随着我国经济发展和社会进步,人们对与乳制品的供应和质量要求越来越重视。乳蛋白的含量是鉴定牛奶质量所必须的指标之一,乳蛋白中的酪蛋白占总量的85%以上,其主要包括α-酪蛋白、β-酪蛋白(CSN2)和κ-酪蛋白(CSN3)[1]。葡萄糖是保证泌乳动物生命体和维持生产必不可少的营养素之一,只有确保乳腺中葡萄糖的充足供给,才可以保证泌乳动物的乳产量和乳成分的产量[2]。在奶牛乳腺上皮细胞(BMECs)中,葡萄糖对蛋白质合成的影响其中最重要的原因是通过促进蛋白质合成过程中所需的能量供应来完成的。前人研究发现,奶牛在泌乳过程中,乳腺组织要消耗大量的葡萄糖来提供能量以保持整个泌乳过程中乳蛋白的合成,采用奶牛静脉注射葡萄糖的方法可以促进乳蛋白的合成[3]。另外,额外提供葡萄糖可以节省生糖氨基酸合成葡萄糖,使这部分的氨基酸进入乳腺组织用来合成乳蛋白。也有研究表明,葡萄糖代谢的中间产物能够合成非必需氨基酸用来合成乳蛋白[4]。与此同时,葡萄糖还能够作为信号物质通过单磷酸腺苷活化蛋白激酶/哺乳动物雷帕霉素靶蛋白(AMPK/mTOR)信号通路调控乳蛋白的转录和翻译过程。已有研究表明,当葡萄糖缺乏时,AMPK会被激活,从而抑制mTOR信号通路阻碍蛋白质翻译[5-6]。体外培养BMECs也发现,AMPK能够通过磷酸化抑制mTOR的活化,从而减少酪蛋白的合成[7]。
泌乳相关激素与乳蛋白的合成存在紧密的联系。武雪会等[8]研究表明,不同乳产量和乳成分的泌乳奶牛,其血清中泌乳相关激素的水平具有差异性。有研究发现,在BMECs培养基中添加催乳素(PRL)、雌激素(E)、胰岛素和氢化可的松等能够提高乳蛋白的合成量[9]。酪氨酸激酶2/信号转导及转录激活因子5(JAK2/STAT5)信号通路具有介导细胞外激素信号转导的作用,泌乳相关激素与各自受体结合后能够激活JAK2信号通路。活化的JAK2能够使其下游的STAT5发生磷酸化。磷酸化后STAT5到细胞核内与其靶基因结合,然后调控酪蛋白基因的转录[10]。mTOR具有mTORC1和mTORC2 2个功能结构不同的复合物[11],mTORC1能够被生长激素、营养物质和细胞能量状态激活[12]。催乳素对调控乳蛋白合成的研究大致分为2个方向:第1个方向是催乳素与催乳素受体(PRLR)结合后,核蛋白体的RNA增加,从而加快酪蛋白mRNA的转录和翻译,最终酪蛋白的量也随之增加[13]。第2个方向是催乳素通过磷脂酰肌醇-3-羟激酶/蛋白激酶B(PI3K/AKT)途径的磷酸化调控酪蛋白的翻译。此外,催乳素还能通过JAK2/STAT5信号通路,促进乳蛋白相关基因的表达[14]。雌激素促进酪蛋白合成的途径有2种:一种是刺激其他激素的分泌,另一种是通过激活雌激素受体表达,刺激乳蛋白合成相关信号通路的激活进而促进酪蛋白的合成[15]。
近年来,体外研究营养素和内分泌激素调控牛乳成分的合成是泌乳生物学的重要研究领域,目前关于乳蛋白前体物以及泌乳相关激素调控乳蛋白合成的研究较多,然而,对于营养素和激素之间的相互作用研究较少且不深入[16]。因此,本研究在体外培养模式下研究了组合添加葡萄糖、雌激素和催乳素对BMECs酪蛋白合成的影响并通过JAK2/STAT5和AMPK/mTOR信号通路探讨其作用机制,旨在为调控乳蛋白合成提供重要的理论依据。
1 材料与方法 1.1 试验材料核糖体p70s6激酶(S6K, 2708)、磷酸化S6K(97596)、单磷酸腺苷活化蛋白激酶α(AMPKα, 5831)、磷酸化AMPKα(2535)和β-肌动蛋白(β-actin, 4970)抗体购自CST公司;mTOR抗体(ab2732)、磷酸化mTOR抗体(ab84400)和酪蛋白抗体(ab166596)购自ABCAM公司;催乳素(cyt-240)购自PROSPEC公司;胰蛋白酶/乙二胺四乙酸(EDTA, 25200054)、胶原酶Ⅱ(17101-015)、雌激素(E2758)、青-链霉素(15140-122)、表皮生长因子(E4127)和氢化可的松(H0135)购自SIGMA公司;反转录PCR试剂盒(Prime ScriptTM RT Reagent Kit)、实时荧光定量PCR(RT-qPCR)试剂盒和总RNA提取试剂盒(RNA Iso-Plus)购自TaKaRa公司;DMEM无糖培养基(A1443001)、葡萄糖(A2494001)和DMEM/F12(12491-015)购自GIBCO公司;BCA试剂盒(PC0020)、细胞裂解液(R0020)和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)制胶试剂盒(P1200-1)购自SOLARBIO公司;胰岛素转铁蛋白硒(41400045)购自CHEMBASE公司;二甲基亚砜(0231)和四甲基偶氮唑盐(MTT, 298-93-1)购自AMRESCO公司;电泳液(P0014B)、转膜液(P0021B)和封闭液(P0228)购自北京碧云天科技有限公司;磷酸盐缓冲液(PBS,SH30256.01)和胎牛血清(FBS,SH30084.03)购自HYCLONE公司;75 cm2细胞培养瓶(430720)购自CORNING公司。
1.2 试验设计本试验采用L9(34)正交设计。使用饥饿培养基(无血清、激素及葡萄糖)饥饿BMECs 16 h,然后更换组合添加了浓度不同的诱导培养基(Ⅰ组为对照组,不添加葡萄糖和泌乳相关激素,Ⅱ组添加14.0 mmol/L葡萄糖+200 ng/mL雌激素,Ⅲ组添加17.5 mmol/L葡萄糖+100 ng/mL雌激素,Ⅳ组添加14.0 mmol/L葡萄糖+100 ng/mL催乳素;Ⅴ组添加17.5 mmol/L葡萄糖+200 ng/mL催乳素,Ⅵ组添加100 ng/mL雌激素+100 ng/mL催乳素,Ⅶ组添加200 ng/mL雌激素+200 ng/mL催乳素,Ⅷ组添加14.0 mmol/L葡萄糖+100 ng/mL雌激素+200 ng/mL催乳素,Ⅸ组添加17.5 mmol/L葡萄糖+200 ng/mL雌激素+100 ng/mL催乳素)继续培养24 h(本研究组合添加葡萄糖和激素的浓度设置参考本课题组[15, 17]以及前人的研究[18]结果),每组设置6个重复。
1.3 试验方法 1.3.1 BMECs的分离与纯化从屠宰场采集健康泌乳的奶牛乳腺组织,分离培养BMECs。用手术刀将最外层的乳腺组织剥离,避开乳导管、血管及结缔组织等部位,剪取适宜大小的组织块放入3×双抗PBS中,转入超净台。将组织块用3×双抗PBS清洗2次,用75%酒精浸泡60 s,最后用1×双抗PBS清洗3次。使用灭菌的眼科手术剪剪取富含腺泡的乳腺样品放入小瓶中,在小瓶中将组织块反复剪碎,直至看不到明显块状为宜,再加3 mL的胶原酶Ⅱ,确保混合完全后放到培养箱中进行消化,计时80 min,每隔20 min取出离心管上下颠倒。待消化结束后,将样品用无菌滤网过滤、离心(1 280×g)8 min后,将细胞悬浮于生长培养基进行37 ℃、5% CO2培养。当细胞长到约为瓶底面积80%时,倒掉培养液,每瓶加入5 mL 0.25%的胰酶-EDTA消化细胞。利用BMECs和成纤维上皮细胞对胰酶敏感性不同对细胞进行纯化。胰酶作用-EDTA消化大约30 s后,成纤维上皮细胞便会脱离下来,弃去混合液,再加入5 mL胰酶-EDTA消化1 min,加入终止培养基终止消化,使用细胞刮刀将BMECs全部刮下,移至离心管中离心(1 280×g,8 min),之后用PBS清洗细胞。最后,收集细胞用生长培养基重悬,转移细胞悬液,置于37 ℃,5% CO2细胞培养箱中培养。1~2次能够纯化完全。
1.3.2 BMECs的鉴定将无菌的细胞爬片放入6 cm的培养皿中接种细胞。当细胞长至80%汇合时,弃去培养液,用PBS清洗3次,使用4%多聚甲醛在室温下固定30 min后,再用0.2% TritonX-100处理细胞10 min,增加细胞通透性。之后用PBS清洗3次,每次5 min。用含1%明胶的PBS室温孵育细胞爬片30 min后加入鼠抗人角蛋白18单一抗抗体(1 ∶ 50稀释)室温振荡孵育1 h,孵育结束后回收一抗,加PBS振荡清洗3次,每次5 min。加入异硫氰酸荧光素(FITC)标记的山羊抗小鼠免疫球蛋白G(IgG)二抗抗体(1 ∶ 50稀释)在摇床上振荡30 min,振荡结束后回收抗体,加入PBS清洗3次,每次5 min。在倒置相差荧光显微镜下观察拍照。如果待鉴定细胞中含有CK-18角蛋白,那么FITC标记的二抗和一抗特异性结合后CK-18会呈现荧光绿色。
1.3.3 BMECs活力的检测将第2代BMECs按照密度为1×104个/孔的细胞接种于96孔板,每孔加入200 μL生长培养基于培养箱中培养,等待细胞生长培养瓶底部80%以上时,饥饿BMECs 16 h,之后更换组合添加了不同浓度的葡萄糖、雌激素和催乳素的诱导培养基继续培养24 h。在细胞培养至20和24 h时分别加入5 mg/mL的MTT溶液20 μL和二甲基亚砜100 μL,置于摇床振荡10 min。使用全自动酶标仪检测每孔在490 nm波长下的吸光度(OD)值。细胞相对增殖率(RGR)计算公式如下:

|
将第2代BMECs以8×105个/瓶的密度接种于培养瓶中于培养箱中培养,等待细胞生长培养瓶底部80%以上时,饥饿BMECs 16 h,更换组合添加了不同浓度葡萄糖、雌激素和催乳素的诱导培养基继续培养24 h。培养结束后收集细胞于1.5 mL EP管中,每管加入400 μL RNA裂解液,提取总RNA并测定其浓度及OD260 nm/OD280 nm,反转录合成cDNA。本试验以泛素表达转录因子(UXT)、β-肌动蛋白和磷酸甘油醛脱氢酶(GAPDH)为内参基因,检测葡萄糖转运载体、激素受体、酪蛋白合成相关基因、AMPK/mTOR信号通路及JAK2/STAT5信号通路相关基因的相对表达量。内参的Ct值为3个内参基因Ct值的平均值,RT-qPCR试验结果采用2-ΔΔCt法进行相对定量数据分析。根据SYBR Premix Dimer EraserTM试剂盒中的说明书对目的基因进行RT-qPCR反应,各基因的扩增条件为:95 ℃,30 s,1个循环;95 ℃,5 s,60 ℃,30 s,35个循环;95 ℃,15 s,60 ℃,30 s,95 ℃,30 s,1个循环。引物序列及参数见表 1。
|
|
表 1 引物序列及参数 Table 1 Primer sequences and parameters |
诱导培养结束后,收集BMECs,加入放射免疫沉淀(RIPA)裂解液(含1%的苯甲基磺酰氟)于冰上裂解30 min,然后离心(8 000×g)5 min,取上清检测蛋白浓度。蛋白样品稀释、变性后采用Western blot法[12]测定α-酪蛋白、mTOR、S6K和AMPK蛋白表达量及其磷酸化水平。结果采用Image StudioVer 5.2软件进行灰度值分析。
1.4 数据与分析试验数据用Excel 2020进行计算和整理,采用SPSS 26.0软件进行ANOVA分析,采用Duncan氏法进行多重比较。以P < 0.05作为差异显著性判断标准。
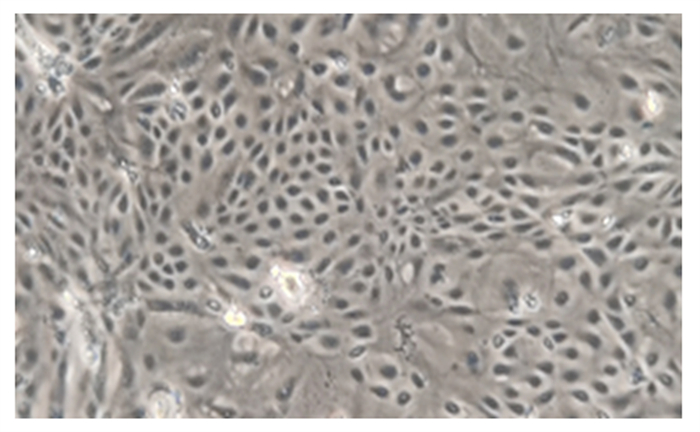
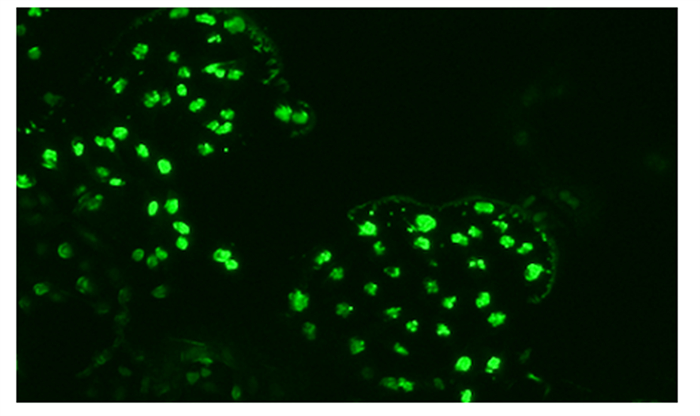
2 结果与分析 2.1 BMECs鉴定由图 1可知,BMECs大多数为卵圆形,细胞之间连成片,呈鹅卵石样单层生长。由图 2可知,采用荧光免疫染色法对BMECs进行鉴定,BMECs骨架蛋白CK-18表达呈阳性,说明本试验分离培养的细胞是BMECs。
|
图 1 纯化后的BMECs Fig. 1 Purified BMECs (100×) |
|
图 2 BMECs免疫荧光鉴定 Fig. 2 Fluorescence identification of BMECs (100×) |
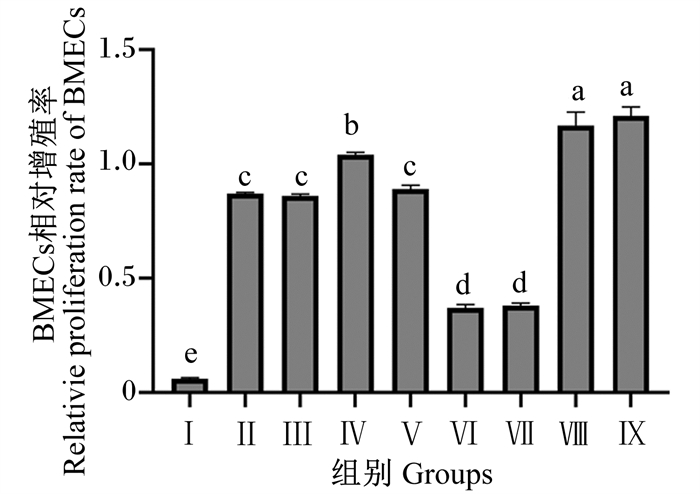
由图 3可知,与对照组相比,Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组显著提高了BMECs的增殖率(P < 0.05);Ⅷ和Ⅸ组BMECs的增殖率显著高于其他各试验组(P < 0.05);Ⅳ组BMECs的增殖率显著高于Ⅱ、Ⅲ、Ⅴ、Ⅵ和Ⅶ组(P < 0.05);Ⅱ、Ⅲ和Ⅴ组BMECs的增殖率显著高于Ⅵ和Ⅶ组(P < 0.05)。
|
数据柱标注相同字母表示差异不显著(P>0.05),不同相同字母表示差异显著(P < 0.05)。下图同。 Value bars with the same letter mean no significant difference (P>0.05), while with different letters mean significant difference (P < 0.05). The same as below. 图 3 组合添加葡萄糖、雌激素和催乳素对BMECs增殖率的影响 Fig. 3 Effects of combined addition of glucose, estrogen and prolactin on proliferation rate in BMECs |
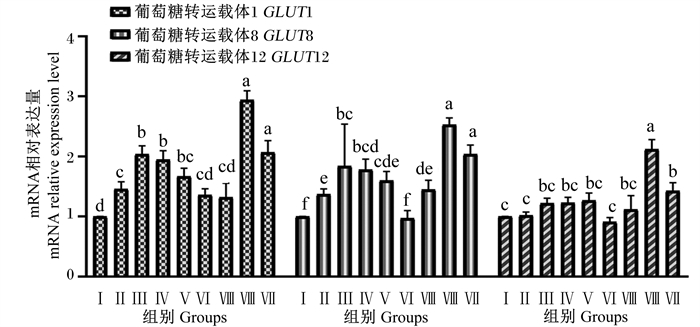
由图 4可知,Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅷ和Ⅸ组BMECs中GLUT1基因相对表达量显著高于对照组和Ⅵ和Ⅶ组(P < 0.05),Ⅱ、Ⅲ、Ⅷ和Ⅸ组BMECs中GLUT8基因相对表达量显著高于对照组和Ⅵ和Ⅶ组(P < 0.05),Ⅵ和Ⅶ组BMECs中GLUT1基因相对表达量与对照组无显著差异(P>0.05),Ⅵ组BMECs中GLUT8基因相对表达量与对照组无显著差异(P>0.05);Ⅷ组BMECs中GLUT1和GLUT8基因相对表达量显著高于除了Ⅸ组外的其他组(P < 0.05),Ⅲ、Ⅳ和Ⅸ组GLUT1基因相对表达量显著高于Ⅱ、Ⅵ和Ⅶ组(P < 0.05),而与Ⅴ组无显著差异(P>0.05)。Ⅷ和Ⅸ组BMECs中GLUT12基因相对表达量显著高于对照组(P < 0.05),其他试验组BMECs中GLUT12基因相对表达量与对照组无显著差异(P>0.05);Ⅷ组BMECs中GLUT12基因相对表达量显著高于Ⅸ组(P < 0.05)。
|
图 4 组合添加葡萄糖、雌激素和催乳素对BMECs葡萄糖转运载体基因表达的影响 Fig. 4 Effects of combined addition of glucose, estrogen and prolactin on expression of glucose transporter gene in BMECs |
由图 5可知,Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅶ、Ⅷ和Ⅸ组BMECs中ER-α基因相对表达量显著高于对照组(P < 0.05),Ⅵ组与对照组无显著差异(P>0.05);Ⅷ和Ⅸ组ER-α的基因相对表达量显著高于其他试验组(P < 0.05)。Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组BMECs中ER-β和PRLR基因相对表达量显著高于对照组(P < 0.05),Ⅱ、Ⅲ组与对照组相比无显著差异(P>0.05);Ⅷ组ER-β基因相对表达量显著高于除Ⅸ组外的其他试验组(P < 0.05),Ⅳ、Ⅶ和Ⅸ组ER-β基因相对表达量显著高于Ⅳ和Ⅵ组(P < 0.05),Ⅷ和Ⅸ组PRLR基因相对表达量显著高于其他试验组(P < 0.05)。Ⅱ、Ⅲ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组BMECs中GPER30基因相对表达量显著高于对照组(P < 0.05),Ⅳ、Ⅴ组与对照组间无显著差异(P>0.05);Ⅷ组BMECs中GPER30基因相对表达量显著高于其他试验组,Ⅶ和Ⅸ组GPER30基因相对表达量显著高于Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ组(P < 0.05)。
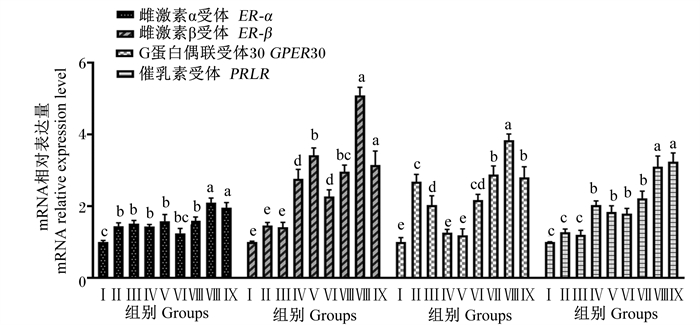
|
图 5 组合添加葡萄糖、雌激素和催乳素对BMECs激素受体基因表达的影响 Fig. 5 Effects of glucose, estrogen and prolactin on expression of hormone receptor gene in BMECs |
由图 6可知,Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组CSN1S1基因相对表达量显著高于对照组和Ⅱ、Ⅲ组(P < 0.05),Ⅱ、Ⅲ组与对照组无显著差异(P>0.05);Ⅷ和Ⅸ组CSN1S1基因相对表达量显著高于其他试验组(P < 0.05)。Ⅸ组CSN2基因相对表达量显著高于对照组和Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ和Ⅶ组(P < 0.05),Ⅷ和Ⅸ组CSN2基因相对表达量无显著差异(P>0.05);Ⅷ组CSN2基因相对表达量显著高于Ⅱ、Ⅳ和Ⅵ组(P < 0.05)。Ⅳ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组CSN3基因相对表达量显著高于对照组和Ⅱ、Ⅲ和Ⅴ组(P< 0.05),Ⅱ、Ⅲ和Ⅴ组与对照组无显著差异(P>0.05);Ⅷ组CSN3基因相对表达量显著高于Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ和Ⅸ组(P < 0.05)。
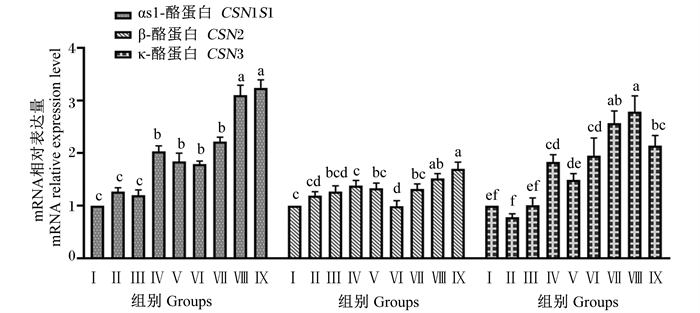
|
图 6 组合添加葡萄糖、雌激素和催乳素对BMECs酪蛋白合成相关基因表达的影响 Fig. 6 Effects of combined addition of glucose, estrogen and prolactin on expression of casein synthesis related genes in BMECs |
由图 7可知,Ⅵ和Ⅶ组AMPK基因相对表达量显著高于对照组及其他试验组(P < 0.05),其他试验组与对照组无显著差异(P>0.05);Ⅲ、Ⅳ和Ⅴ组AMPK基因相对表达量显著高于Ⅷ和Ⅸ组(P < 0.05)。Ⅵ和Ⅶ组PI3K基因相对表达量显著低于对照组和其他试验组(P < 0.05),其他各试验组与对照组无显著差异(P>0.05);Ⅲ组PI3K基因相对表达量显著低于Ⅷ组(P < 0.05)。Ⅵ、Ⅶ、Ⅷ和Ⅸ组AKT基因相对表达量显著高于对照组和其他试验组(P < 0.05),其他试验组与对照组无显著差异(P>0.05);Ⅷ和Ⅸ组AKT基因相对表达量显著高于其他试验组(P < 0.05),Ⅷ组AKT基因相对表达量显著高于Ⅸ组(P < 0.05)。Ⅱ、Ⅲ、Ⅴ、Ⅶ、Ⅷ和Ⅸ组mTOR基因相对表达量显著高于对照组及Ⅳ和Ⅵ组(P < 0.05),Ⅳ和Ⅵ组mTOR基因相对表达量与对照组无显著差异(P>0.05);试验Ⅷ组mTOR基因相对表达量显著高于Ⅱ、Ⅲ、Ⅴ、Ⅶ和Ⅸ组(P < 0.05)。各试验组4EBP1基因相对表达量与对照组无显著差异(P>0.05);Ⅵ和Ⅶ组4EBP1基因相对表达量显著高于Ⅴ和Ⅸ组(P < 0.05),Ⅱ、Ⅲ、Ⅳ和Ⅶ组4EBP1基因相对表达量无显著差异(P>0.05);Ⅲ、Ⅷ和Ⅸ组eIF4E基因相对表达量显著高于对照组和其他试验组(P < 0.05),其他各试验组和对照组无显著差异(P>0.05);Ⅷ组eIF4E基因相对表达量显著高于Ⅲ和Ⅸ组(P < 0.05),Ⅲ、Ⅸ组eIF4E基因相对表达量无显著差异(P>0.05)。Ⅱ、Ⅲ、Ⅳ、Ⅷ和Ⅸ组S6K1基因相对表达量显著高于对照组和Ⅴ、Ⅵ和Ⅶ组(P < 0.05),对照组和Ⅴ、Ⅵ和Ⅶ组S6K1基因相对表达量无显著差异(P>0.05),Ⅱ、Ⅲ、Ⅳ、Ⅷ和Ⅸ组S6K1基因相对表达量无显著差异(P>0.05)。
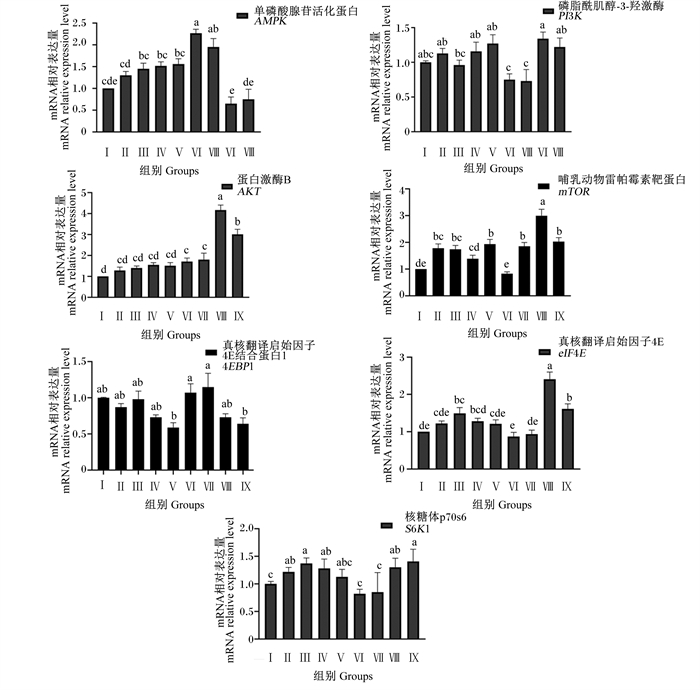
|
图 7 组合添加葡萄糖、雌激素和催乳素对BMECs mTOR信号通路相关基因表达的影响 Fig. 7 Effects of combined addition of glucose, estrogen and prolactin on expression of mTOR signaling pathway related genes in BMECs |
由图 8可知,Ⅳ、Ⅴ、Ⅶ、Ⅷ和Ⅸ组JAK2基因相对表达量显著高于对照组和Ⅱ、Ⅲ和Ⅵ组(P < 0.05),Ⅱ、Ⅲ和Ⅵ组与对照组无显著差异(P>0.05);Ⅷ和Ⅸ组JAK2基因相对表达量显著高于Ⅳ和Ⅴ组(P < 0.05),Ⅷ组JAK2基因相对表达量显著高于Ⅸ组(P < 0.05)。Ⅴ、Ⅷ和Ⅸ组STAT5基因相对表达量显著高于对照组及其他各试验组(P < 0.05),Ⅱ、Ⅲ、Ⅳ、Ⅵ和Ⅶ组与对照组差异不显著(P>0.05),Ⅷ和Ⅸ组STAT5基因相对表达量显著高于Ⅴ组(P < 0.05),Ⅷ组STAT5基因相对表达量显著高于Ⅸ组(P < 0.05)。
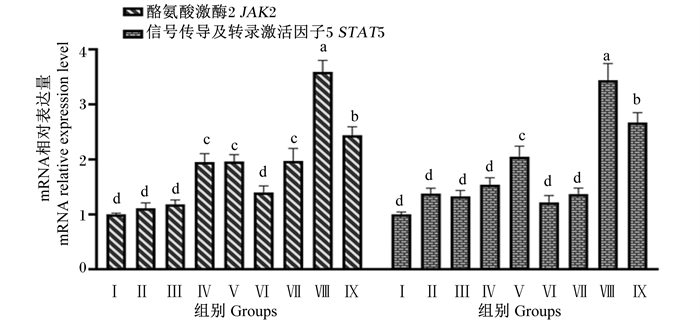
|
图 8 组合添加葡萄糖、雌激素和催乳素对BMECs JAK2/STAT5信号通路相关基因表达的影响 Fig. 8 Effects of combined addition of glucose, estrogen and prolactin on expression of JAK2/STAT5 signaling pathway related genes in BMECs |
由图 9可知,Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅷ和Ⅸ组AMPK磷酸化水平显著低于对照组(P < 0.05),Ⅶ组AMPK磷酸化水平与对照组显著不差异(P>0.05)。试验组间比较,Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅷ和Ⅸ组AMPK磷酸化水平显著低于Ⅵ和Ⅶ组(P < 0.05)。
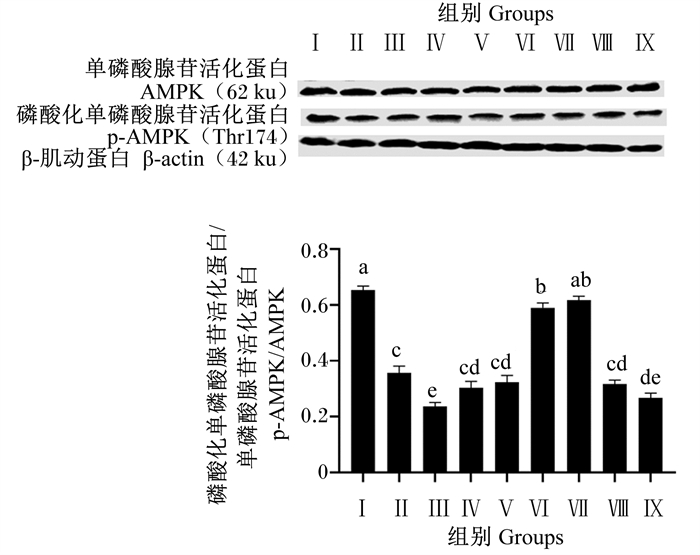
|
图 9 BMECs中AMPK磷酸化水平 Fig. 9 AMPK phosphorylation level in BMECs |
由图 10可知,与对照组相比,各试验组均显著提高了mTOR磷酸化水平(P < 0.05),其中,Ⅴ、Ⅷ和Ⅸ组mTOR磷酸化水平显著高于Ⅱ、Ⅲ、Ⅳ、Ⅵ和Ⅶ组(P < 0.05),Ⅷ组mTOR磷酸化水平显著高于其他试验组(P < 0.05)。
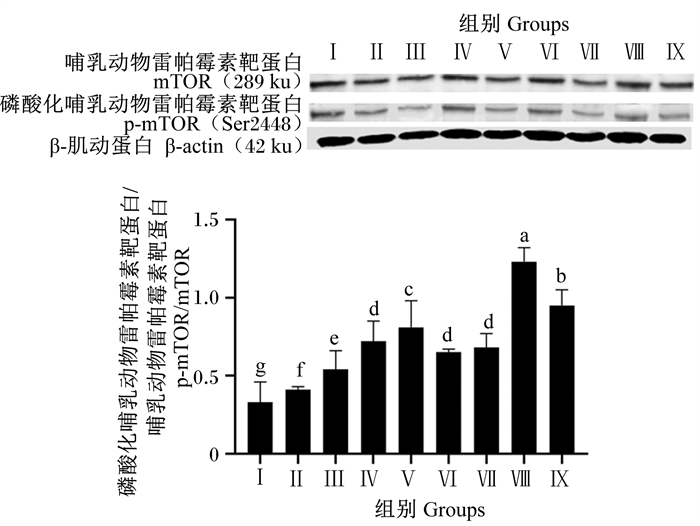
|
图 10 BMECs中mTOR磷酸化水平 Fig. 10 mTOR phosphorylation level in BMECs |
由图 11可知,Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组S6K磷酸化水平显著高于对照组(P < 0.05),Ⅱ组S6K磷酸化水平与对照组相比差异不显著(P>0.05)。试验组间比较,Ⅳ、Ⅴ、Ⅶ、Ⅷ和Ⅸ组S6K磷酸化水平显著高于其他试验组(P < 0.05),Ⅷ组S6K磷酸化水平显著高于Ⅳ、Ⅴ、Ⅶ和Ⅸ组(P < 0.05),Ⅳ、Ⅴ和Ⅸ组S6K磷酸化水平显著高于Ⅶ组(P < 0.05)。
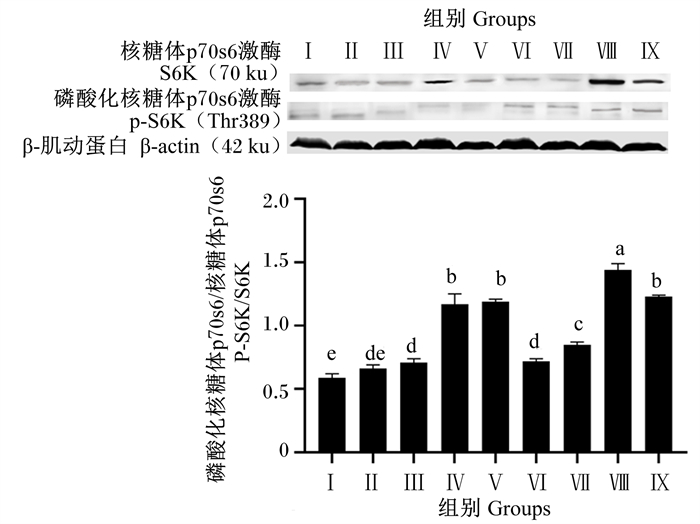
|
图 11 BMECs中S6K磷酸化水平 Fig. 11 S6K phosphorylation level in BMECs |
由图 12可知,与对照组相比,各试验组均显著提高了α-酪蛋白表达量(P < 0.05)。试验组间比较,Ⅷ和Ⅸ组α-酪蛋白表达量显著高于其他试验组(P < 0.05),Ⅷ组α-酪蛋白表达量显著高于Ⅸ组(P < 0.05)。
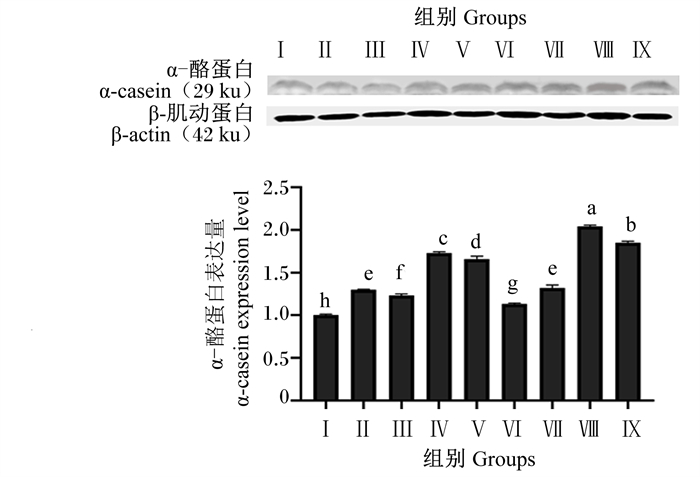
|
图 12 BMECs中α-酪蛋白表达量 Fig. 12 α-casein expression level in BMECs |
BMECs的数量和代谢活力决定乳产量和乳品质,而BMECs的数量主要取决于细胞的增殖和凋亡之间的平衡[19]。前人研究表明,在BMECs培养基中单独添加葡萄糖、催乳素、雌激素和氨基酸均能够促进BMECs的增殖[12, 20-25]。近年来有些研究表明,激素之间具有相互作用,外源添加雌激素和催乳素的协同作用能够提高大鼠和小鼠乳腺上皮细胞的增殖率[26]。切除大鼠卵巢后,使用外源的雌激素和催乳素处理大鼠,5 d后发现大鼠的乳腺上皮细胞增殖率在2种激素单独处理的细胞增殖率之间[27],田青等[28]试验还研究发现,胰岛素、催乳素和氢化可的松组合添加能够提高BMECs的增殖率。金亚亚等[29]试验表明,组合添加100 ng/mL雌激素和200 ng/mL催乳素对BMECs的增殖率促进效果最佳。本试验研究结果表明,葡萄糖、雌激素和催乳素组合添加的Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组显著提高了BMECs的增殖率;葡萄糖和催乳素组合添加量分别为14.0 mmol/L和100 ng/mL时BMECs的增殖率显著高于组合添加量为17.5 mmol/L和200 ng/mL;并且在葡萄糖、雌激素和催乳素的添加量分别为14.0 mmol/L、100 ng/mL和200 ng/mL时促进效果最好,原因可能是PI3K/AKT/mTOR信号通路在哺乳动物体内中主要与细胞生长和增殖有关,组合添加葡萄糖、雌激素和催乳素后,一方面葡萄糖促进细胞能量生成,为细胞生长提供充足的能量供应,另一方面雌激素和催乳素通过与其受体结合,活化了PI3K,并进一步促进AKT的磷酸化,活化的AKT直接磷酸化mTOR,从而促进了细胞增殖。在新近的研究中,人们逐渐认识到一种膜性的雌激素受体,被定义为GPER30,又称HPR30[30-32]。Filardo等[33]发现,GPER30在乳腺中有较强的表达。杨振山[34]研究表明,雌激素通过GPER30基因的表达促进山羊乳腺上皮细胞增殖。本试验研究结果表明,葡萄糖、雌激素和催乳素组合添加的Ⅱ、Ⅲ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组均提高了BMECs中GPER30基因相对表达量,原因可能是雌激素上调了GPER30的表达,并使AKT/mTOR通路活性增加,从而促进BMECs增殖。
前人研究发现,GLUTs的基因相对表达量受到奶牛生理阶段的影响,干奶期的奶牛乳腺组织中GLUT1的基因和蛋白的表达量显著低于泌乳期[35],并且Zhao等[36]研究结果表明,在奶牛产犊前的40 d到产犊后的7 d内,奶牛乳腺组织中GLUTs基因表达量能够增加到上百倍,其原因可能是奶牛在不同生理阶段乳腺组织对葡萄糖的摄取受到泌乳相关激素及机体器官等调控的结果。体外研究证明,泌乳期奶牛乳腺组织对葡萄糖的摄取依靠的是BMECs膜上的GLUTs[37]。本试验与前人研究结果相近,葡萄糖、雌激素和催乳素组合添加的Ⅷ和Ⅸ组提高了BMECs中GLUT1、GLUT8和GLUT12基因相对表达量,且葡萄糖和雌激素组合添加量为17.5 mmol/L和100 ng/mL时BMECs中GLUT1和GLUT8基因相对表达量显著高于组合添加量为14.0 mmol/L和200 ng/mL时;在葡萄糖、雌激素和催乳素的添加量分别为14.0 mmol/L、100 ng/mL和200 ng/mL时促进效果最好,与BMECs增殖率的结果相一致。可能是葡萄糖、雌激素和催乳素组合添加通过增加了GLUT1、GLUT8和GLUT12在BMECs中的基因相对表达量,促进乳腺组织对葡萄糖的摄取,从而提高了BMECs的增殖率。
3.2 组合添加葡萄糖、雌激素和催乳素通过JAK-STAT信号通路影响BMECs酪蛋白的合成JAK是一类酪氨酸激酶家族,JAKs家族中现已发现TYK2、JAK1、JAK2和JAK3 4个成员,其中在乳腺组织中检测到了JAK2的表达。STAT是JAK的作用底物,在泌乳动物乳腺中发现了STAT蛋白,并且STAT5是STATs中首个被认为是乳腺组织中十分重要的信号通路成员,它在BMECs增殖、分化和泌乳方面起到必不可少的作用。有研究表明,催乳素能够激活JAK/STAT通路,与膜上受体结合促进BMECs乳蛋白的合成[38]。Yonekura等[39]研究表明,JAK/STAT通路相关蛋白受到PRLR的调控,通过激活JAK/STAT途径,催乳素与受体结合促进BMECs乳蛋白的合成。
有研究表明,通过给奶牛饲喂大豆黄酮(植物类雌激素)时发现,大豆黄酮可以显著提高乳蛋白的含量[40-43]。武开乐等[42]体内试验研究表明,添加外源性雌激素能够显著提高α-酪蛋白的表达量,且外源性雌激素对β-酪蛋白的表达也有显著的促进效果。本试验与前人研究结果相一致,葡萄糖、雌激素和催乳素组合添加的试验组均提高了BMECs中酪蛋白基因相对表达量和酪蛋白表达量,并且在葡萄糖、雌激素和催乳素的添加量分别为14.0 mmol/L、100 ng/mL和200 ng/mL时酪蛋白基因相对表达量和酪蛋白表达量高于其他试验组,其原因可能是酪蛋白受到雌激素和催乳素的调控[43-44],通过激活JAK/STAT通路,促进BMECs乳蛋白的合成[45]。雌激素有3个受体由不同的基因编码,分别为ER-α、ER-β和GPER30。ER-α的功能是调节乳导管生长和形态的形成,ER-β的功能是保护细胞,抑制细胞不受控的增殖,GPER30的功能是促进BMECs增殖。本试验的结果表明,葡萄糖、雌激素和催乳素组合添加的Ⅶ、Ⅷ和Ⅸ组提高了BMECs中ER-α、ER-β、PRLR和GPER30基因相对表达量、酪蛋白基因表达量和酪蛋白表达量,并且在葡萄糖、雌激素和催乳素的添加量分别为14.0 mmol/L、100 ng/mL和200 ng/mL时提高效果最好, 原因可能是此浓度下葡萄糖、催乳素和雌激素能够很好的互作,一是催乳素增加了雌激素的活性,激活JAK/STAT信号通路,二是当有催乳素时,催乳素会与2个PRLR结合形成复合物,JAK2被激活,从而导致PRLR上的酪氨酸残基磷酸化,之后2个STAT5蛋白通过SH2功能域结合,STAT5的酪氨酸残基被磷酸化后从复合物中脱离,2个STAT5蛋白通过各自磷酸化的酪氨酸和对方的SH2功能域结合,形成STAT5二聚体,最后进入细胞核内与启动子上的荧光素酶报告基因载体(GAS)序列结合,激活酪蛋白基因的转录[46],进而促进乳蛋白的生成。
3.3 组合添加葡萄糖、雌激素和催乳素对BMECs AMPK/mTOR信号通路合成酪蛋白的影响mTOR是非典型的丝氨酸/苏氨酸蛋白激酶,因为其处于调节生长的中心而受到了广大学者们的研究[47]。在BMECs合成乳蛋白的过程中,mTOR的上游主要由磷酸化丝氨酸/苏氨酸蛋白激酶(LKB1)/AMPK/mTOR和PI3K/AKT/mTOR信号通路调控,下游主要由mTOR/4EBP1和mTOR/S6K信号通路的调控。在泌乳动物乳腺细胞中,调控mTOR活性的信号物质主要包括ATP的活化、生长因子和氨基酸,PI3K/AKT/mTOR信号通路与细胞的生长和增殖的关系十分密切。缺陷AMPK的小鼠会出现葡萄糖耐受异常和胰岛素抵抗的现象[48],这表明AMPK的作用主要是作为葡萄糖的感受器。试验研究表明,葡萄糖调节蛋白能够刺激雌激素和催乳素的表达,并通过AMPK/mTOR信号通路在翻译水平上促进酪蛋白的合成[49]。
泌乳动物的乳腺是个耗能多的组织,尤其在乳蛋白合成的过程中要消耗大量的葡萄糖。体内试验研究表明,高产奶牛乳腺组织每天能够消耗掉2 kg的葡萄糖,占奶牛乳腺组织内葡萄糖总量的80%以上[50]。泌乳奶牛瘤胃灌注葡萄糖能够提高乳蛋白产量[43-44, 51],在体外培养BMECs的试验中表明,添加外源葡萄糖能够增加乳蛋白合成率[52]。本试验研究结果与前人相一致,BMECs培养基中添加葡萄糖时,能够增加酪蛋白基因相对表达和酪蛋白表达,原因可能是葡萄糖为酪蛋白合成提供了能量,还作为信号物质通过AMPK/mTOR信号通路调控乳蛋白的转录和翻译过程。
对于2条下游的通路,mTOR/S6K通路中S6K是细胞中蛋白质合成的正调控信号,在胞内蛋白质的转运翻译过程中起关键作用。研究表明,葡萄糖和激素之间存在着协同作用,雌激素对葡萄糖能量代谢系统的调控,能够直接或者间接影响相关蛋白的表达[53],葡萄糖调节蛋白能够促进催乳素和雌激素的表达,通过mTOR信号通路在翻译水平上促进酪蛋白的生成[49]。激素还能够协同调控乳腺的发育以及乳成分的合成,催乳素和糖皮质激素在分娩前后分泌增加从而调节β-酪蛋白的表达[54]。这说明营养素和泌乳相关激素组合添加对乳蛋白合成具有互作效应,并通过mTOR通路调控乳蛋白的合成。本试验研究结果与前人研究结果相一致,Ⅷ组BMECs中CSN1S1和CSN3基因相对表达量高于Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ组,原因可能是催乳素的添加提高了mTOR底物S6K1和4EBP1基因相对表达量及其磷酸化水平,进而刺激乳蛋白的合成;Ⅵ和Ⅶ组的AMPK磷酸化水平显著高于其他试验组,原因可能是当营养不足,能量缺乏时胞内ATP/ADP比值降低,AMPK被激活;Ⅴ、Ⅷ和Ⅸ组的mTOR磷酸化水平显著高于其他试验组;Ⅳ、Ⅴ、Ⅷ和Ⅸ组的酪蛋白表达量显著高于其他试验组;葡萄糖、雌激素和催乳素的添加量分别为14.0 mmol/L、100 ng/mL和200 ng/mL时, CSN1S1、CSN2和CSN3基因相对表达量高于其他试验组;PI3K、AKT、mTOR、eIF4E和S6K1基因相对表达量高于其他试验组;BMECs酪蛋白的蛋白表达以及mTOR磷酸化水平的表达均显著高于对照组和其他试验组;这表明葡萄糖、雌激素和催乳素的添加量分别为14.0 mmol/L、100 ng/mL和200 ng/mL是促进BMEC酪蛋白合成的最佳比例,荷斯坦奶牛体内葡萄糖、雌激素和催乳素正常浓度分别为4 mmol/L、640 pg/mL和27 ng/mL,可能是由于三者在该比例下在分子水平上产生了相互促进的作用,能最大程度地激活mTOR信号通路,进而促进了酪蛋白的基因和蛋白表达。
4 结论各试验组均在不同程度上促进了BMECs的增殖率并且Ⅷ和Ⅸ组BMECs相对增殖率显著高于其他试验组,且Ⅷ组(葡萄糖、雌激素和催乳素的添加量分别为14.0 mmol/L、100 ng/mL和200 ng/mL)的效果最佳;组合添加葡萄糖、雌激素和催乳素的添加量分别为14.0 mmol/L、100 ng/mL和200 ng/mL时对BMECs酪蛋白合成的促进效果最佳;葡萄糖和催乳素组合添加对酪蛋白合成的影响最大。
| [1] |
李楠, 高学军. 雌激素及其受体对动物乳腺上皮细胞泌乳性能的影响[J]. 中国畜牧兽医, 2011, 38(4): 151-153. LI N, GAO X J. Effects of estrogen and its receptor on lactation function of mammary gland epithelial cell in mammal[J]. China Animal Husbandry & Veterinary Medicine, 2011, 38(4): 151-153 (in Chinese). |
| [2] |
卢德勋. 反刍动物葡萄糖营养调控理论体系及其应用[J]. 畜牧与饲料科学, 2010, 31(Z1): 402-409. LU D X. Theoretical system of glucose nutrition regulation in ruminants and its application[J]. Animal Husbandry and Feed Science, 2010, 31(Z1): 402-409 (in Chinese). |
| [3] |
TOERIEN C A, TROUT D R, CANT J P. Nutritional stimulation of milk protein yield of cows is associated with changes in phosphorylation of mammary eukaryotic initiation factor 2 and ribosomal s6 kinase 1[J]. The Journal of Nutrition, 2010, 140(2): 285-292. DOI:10.3945/jn.109.114033 |
| [4] |
周顺伍. 动物生物化学[M]. 3版. 北京: 中国农业出版社, 1999: 119-134. ZHOU S W. Animal biochemistry[M]. 3rd ed. Beijing: China Agricultural Press, 1999: 119-134 (in Chinese). |
| [5] |
BOLSTER D R, CROZIER S J, KIMBALL S R, et al. AMP-activated protein kinase suppresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin (mTOR) signaling[J]. Journal of Biological Chemistry, 2002, 277(27): 23977-23980. DOI:10.1074/jbc.C200171200 |
| [6] |
DUBBELHUIS P F, MEIJER A J. Hepatic amino acid-dependent signaling is under the control of AMP- dependent protein kinase[J]. FEBS Letters, 2002, 521(1/2/3): 39-42. |
| [7] |
BURGOS S A, KIM J J M, DAI M, et al. Energy depletion of bovine mammary epithelial cells activates AMPK and suppresses protein synthesis through inhibition of mTORC1 signaling[J]. Hormone and Metabolic Research, 2013, 45(3): 183-189. |
| [8] |
武雪会, 孙会增, 王迪铭, 等. 不同产奶量和乳蛋白率奶牛的血液生化和激素水平分析[J]. 中国畜牧杂志, 2019, 55(11): 99-104. WU X H, SUN H Z, WANG D M, et al. Research on serum biochemical parameters and hormone profiles in cows with extremely different milk yield or milk protein content[J]. Chinese Journal of Animal Science, 2019, 55(11): 99-104 (in Chinese). |
| [9] |
BURGOS S A, DAI M, CANT J P. Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J]. Journal of Dairy Science, 2010, 93(1): 153-161. DOI:10.3168/jds.2009-2444 |
| [10] |
KELLY P A, BACHELOT A, KEDZIA C, et al. The role of prolactin and growth hormone in mammary gland development[J]. Molecular and Cellular Endocrinology, 2002, 197(1/2): 127-131. |
| [11] |
COUSO I, EVANS B S, LI J, et al. Synergism between inositol polyphosphates and TOR kinase signaling in nutrient sensing, growth control, and lipid metabolism in chlamydomonas[J]. The Plant Cell, 2016, 28(9): 2026-2042. DOI:10.1105/tpc.16.00351 |
| [12] |
EHMANN U K, PETERSON W D Jr, MISFELDT D S. To grow mouse mammary epithelial cells in culture[J]. The Journal of Cell Biology, 1984, 98(3): 1026-1032. DOI:10.1083/jcb.98.3.1026 |
| [13] |
朱河水, 王月影, 王艳玲, 等. 大豆黄酮对奶牛泌乳性能及血浆中激素水平的影响[J]. 中国农学通报, 2006, 22(5): 20-22. ZHU H S, WANG Y Y, WANG Y L, et al. Effect of daidzein on the lactational performance and levels of hormones in plasma of dairy cows[J]. Chinese Agricultural Science Bulletin, 2006, 22(5): 20-22 (in Chinese). DOI:10.3969/j.issn.1000-6850.2006.05.005 |
| [14] |
金亚亚, 李大彪, 孙梅, 等. 催乳素对奶牛乳腺上皮细胞酪蛋白合成的影响[J]. 饲料研究, 2021, 44(14): 77-81. JIN Y Y, LI D B, SUN M, et al. Effect of prolactin on casein synthesis in dairy cow mammary epithelial cells[J]. Feed Research, 2021, 44(14): 77-81. |
| [15] |
金亚亚. 雌激素和催乳素对奶牛乳腺上皮细胞酪蛋白合成的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2021: 24-38. JIN Y Y. Effects of estrogen and prolactin on casein synthesis in bovine mammary epithelial cells[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2021: 24-38. (in Chinese) |
| [16] |
孙振稳. 氨基酸、葡萄糖和胰岛素对奶牛乳腺上皮细胞增殖及乳蛋白合成的影响[D]. 硕士学位论文. 泰安: 山东农业大学, 2018: 13-23. SUN Z W. Effects of essential amino acids, glucose and insulin on proliferation and protein synthesis in bovine mammary epithelial cells[D]. Master's Thesis. Tai'an: Shandong Agricultural University, 2018: 13-23. (in Chinese) |
| [17] |
李子南. 葡萄糖对奶牛乳腺上皮细胞能量代谢和酪蛋白合成的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2020: 15-30. LI Z N. Effect of glucose on energy metabolism and casein synthesis in bovine mammary epithelial cells[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2020: 15-30. (in Chinese) |
| [18] |
邢媛媛. 二、三维培养模式下添加激素对奶牛乳腺上皮细胞乳脂肪和乳蛋白合成的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2017: 24-34. XING Y Y. Effect of hormone supplementation on milk fat and milk protein synthesis in two and three-dimensional cultured bovine mammary epithelial cells[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2017: 24-34. (in Chinese) |
| [19] |
CANT J P, TROUT D R, QIAO F, et al. Milk composition responses to unilateral arterial infusion of complete and histidine-lacking amino acid mixtures to the mammary glands of cows[J]. Journal of Dairy Science, 2001, 84(5): 1192-1200. DOI:10.3168/jds.S0022-0302(01)74580-8 |
| [20] |
IMBERT-FERNANDEZ Y, CLEM B F, O'NEAL J, et al. Estradiol stimulates glucose metabolism via 6-phosphofructo-2-kinase (PFKFB3)[J]. Journal of Biological Chemistry, 2014, 289(13): 9440-9448. DOI:10.1074/jbc.M113.529990 |
| [21] |
王珊珊. 葡萄糖和氨基酸应激对奶牛乳腺上皮细胞β-酪蛋白及信号通路相关蛋白磷酸化表达的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2016: 12-34. WANG S S. Effects of glucose and amino acids stress on β-casein and signaling pathways related protein phosphorylation expression of bovine mammary epithelial cells[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2016: 12-34. (in Chinese) |
| [22] |
王苹, 陈怡君, 吴黎雅, 等. 性激素水平与ER、PR的表达在乳腺增生病辨证分型中的意义[J]. 福建医科大学学报, 2005, 39(3): 291-294. WANG P, CHEN Y J, WU L Y, et al. The importance of the serum sex-hormone level, expression of estrogen receptor and progesterone receptor in syndrome differentiation of mammary hyperplasia[J]. Journal of Fujian Medical University, 2005, 39(3): 291-294 (in Chinese). DOI:10.3969/j.issn.1672-4194.2005.03.013 |
| [23] |
陈静, 王根林, 李莲, 等. 雌激素对奶牛乳腺上皮细胞增殖及抗氧化性的影响[J]. 农业生物技术学报, 2013, 21(2): 216-222. CHEN J, WANG G L, LI L, et al. Effects of estrogen on proliferation and antioxidation in bovine (Bos taurus) mammary epithelial cells[J]. Journal of Agricultural Biotechnology, 2013, 21(2): 216-222 (in Chinese). DOI:10.3969/j.issn.1674-7968.2013.02.012 |
| [24] |
田青, 王洪荣. 胰岛素、催乳素和氢化可的松对奶牛乳腺上皮细胞增殖和凋亡的影响[J]. 中国饲料, 2013(2): 8-12. TIAN Q, WANG H R. Effects of INS, PRL and HYD on proliferation and apoptosis of mammary epithelial cells of dairy cow in vitro[J]. China Feed, 2013(2): 8-12 (in Chinese). DOI:10.3969/j.issn.1004-3314.2013.02.004 |
| [25] |
母晓佳, 李大彪. 激素及细胞因子调控奶牛乳腺上皮细胞增殖和泌乳的研究进展[J]. 中国细胞生物学学报, 2021, 43(5): 1061-1067. MU X J, LI D B. Research progress of hormones and cytokines regulating the proliferation and lactation of cow mammary epithelial cells[J]. Chinese Journal of Cell Biology, 2021, 43(5): 1061-1067 (in Chinese). |
| [26] |
MULDOON T G. Interplay between estradiol and prolactin in the regulation of steroid hormone receptor levels, nature, and functionality in normal mouse mammary tissue[J]. Endocrinology, 1981, 109(5): 1339-1346. DOI:10.1210/endo-109-5-1339 |
| [27] |
HOVEY R C, TROTT J F, GINSBURG E, et al. Transcriptional and spatiotemporal regulation of prolactin receptor mRNA and cooperativity with progesterone receptor function during ductal branch growth in the mammary gland[J]. Developmental Dynamics, 2001, 222(2): 192-205. DOI:10.1002/dvdy.1179 |
| [28] |
田青, 王洪荣. 激素协同作用对奶牛乳腺上皮细胞激素受体基因表达的影响[J]. 中国饲料, 2015(13): 11-14. TIAN Q, WANG H R. Effects of hormones synergy on hormone receptor genes expression in cow mammary epithelial cells[J]. China Feed, 2015(13): 11-14 (in Chinese). |
| [29] |
金亚亚, 李大彪, 孙梅, 等. 组合添加雌激素和催乳素对奶牛乳腺上皮细胞酪蛋白合成的影响[J]. 中国细胞生物学学报, 2021, 43(12): 2316-2325. JIN Y Y, LI D B, SUN M, et al. Effects of estrogen and prolactin on casein synthesis of bovine mammary epithelial cells[J]. Chinese Journal of Cell Biology, 2021, 43(12): 2316-2325 (in Chinese). |
| [30] |
ZHAO Z T, LI L, DU P N, et al. Transcriptional downregulation of miR-4306 serves as a new therapeutic target for triple negative breast cancer[J]. Theranostics, 2019, 9(5): 1401-1416. DOI:10.7150/thno.30701 |
| [31] |
GIULIANELLI S, RIGGIO M, GUILLARDOY T, et al. FGF2 induces breast cancer growth through ligand-independent activation and recruitment of ERα and PRBΔ4 isoform to MYC regulatory sequences[J]. International Journal of Cancer, 2019, 145(7): 1874-1888. |
| [32] |
ROSANO C, PONASSI M, SANTOLLA M F, et al. Macromolecular modelling and docking simulations for the discovery of selective GPER ligands[J]. AAPS Journal, 2016, 18(1): 41-46. DOI:10.1208/s12248-015-9844-3 |
| [33] |
FILARDO E J, GRAEBER C T, QUINN J A, et al. Distribution of GPR30, a seven membrane-spanning estrogen receptor, in primary breast cancer and its association with clinicopathologic determinants of tumor progression[J]. Clinical Cancer Research, 2006, 12(21): 6359-6366. DOI:10.1158/1078-0432.CCR-06-0860 |
| [34] |
杨振山. 雌激素/GPR30信号通路对山羊乳腺上皮细胞增殖与上皮间质转化的影响及其机制研究[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2018: 12-18. YANG Z S. Effect and mechanism of estrogen/GPR30 signaling pathway on proliferation and epithelial-mesenhymal transiton in goat mammary epithlial cells[D]. Master's Thesis. Yangling: Northwest A & F University, 2018: 12-18. (in Chinese) |
| [35] |
KOMATSU T, ITOH F, KUSHIBIKI S, et al. Changes in gene expression of glucose transporters in lactating and nonlactating cows[J]. Journal of Animal Science, 2005, 83(3): 557-564. DOI:10.2527/2005.833557x |
| [36] |
ZHAO F Q, KEATING A F. Expression and regulation of glucose transporters in the bovine mammary gland[J]. Journal of Dairy Science, 2007, 90(Suppl. 1): E76-E86. |
| [37] |
FREEMAN M E, KANYICSKA B, LERANT A, et al. Prolactin: structure, function, and regulation of secretion[J]. Physiological Reviews, 2000, 80(4): 1523-1631. DOI:10.1152/physrev.2000.80.4.1523 |
| [38] |
TAN D Y, JOHNSON D A, WU W, et al. Unmodified prolactin (PRL) and S179D PRL-initiated bioluminescence resonance energy transfer between homo- and hetero-pairs of long and short human PRL receptors in living human cells[J]. Molecular Endocrinology, 2005, 19(5): 1291-1303. DOI:10.1210/me.2004-0304 |
| [39] |
YONEKURA S, SAKAMOTO K, KOMATSU T, et al. Growth hormone and lactogenic hormones can reduce the leptin mRNA expression in bovine mammary epithelial cells[J]. Domestic Animal Endocrinology, 2006, 31(1): 88-96. DOI:10.1016/j.domaniend.2005.09.002 |
| [40] |
杨建英, 张勇法, 王艳玲, 等. 大豆黄酮对奶牛产奶量和乳中常规成分的影响[J]. 饲料研究, 2005(6): 30-31. YANG J Y, ZHANG Y F, WANG Y L, et al. Influence of daidzein on milk production and component in dairy cattle[J]. Feed Research, 2005(6): 30-31 (in Chinese). DOI:10.3969/j.issn.1002-2813.2005.06.010 |
| [41] |
卢志勇, 梁代华, 杨运玲, 等. 大豆异黄酮对奶牛乳腺上皮细胞泌乳性能及抗氧化能力的影响[J]. 饲料与畜牧, 2013(2): 25-28. LU Z Y, LIANG D H, YANG Y L, et al. Influence of isoflavones on the lactation and antioxidation of mammary epithelial cells of dairy cow[J]. Animal Agriculture, 2013(2): 25-28 (in Chinese). |
| [42] |
武开乐, 库西塔别克·买买提依不拉音, 马静, 等. 雌激素对奶牛乳腺上皮细胞中酪蛋白和甘油三酯表达的影响[J]. 饲料工业, 2019, 40(11): 36-42. WU K L, HUXTARBEK.MANBETEBRAYIM, MA J, et al. Effects of estrogen on casein and triglyceride expression in bovine mammary epithelial cells[J]. Effects oFeed Industry, 2019, 40(11): 36-42 (in Chinese). |
| [43] |
SIGL T, MEYER H H D, WIEDEMANN S. Gene expression analysis of protein synthesis pathways in bovine mammary epithelial cells purified from milk during lactation and short-term restricted feeding[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(1): 84-95. DOI:10.1111/jpn.12039 |
| [44] |
TIAN Q, WANG H R, WANG M Z, et al. Lactogenic hormones regulate mammary protein synthesis in bovine mammary epithelial cells via the mTOR and JAK-STAT signal pathways[J]. Animal Production Science, 2015, 56(11): 1803-1809. |
| [45] |
FRASOR J, GIBORI G. Prolactin regulation of estrogen receptor expression[J]. Trends in Endocrinology and Metabolism, 2003, 14(3): 118-123. DOI:10.1016/S1043-2760(03)00030-4 |
| [46] |
贾祥捷, 李秋玲, 王长法, 等. 牛催乳素基因及其单核苷酸多态性与产奶性状关系的研究进展[J]. 中国畜牧兽医, 2010, 37(3): 148-152. JIA X J, LI Q L, WANG C F, et al. Progress of bovine prolactin gene and the relationship of its SNPs and milk production traits[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(3): 148-152 (in Chinese). |
| [47] |
綦松智, 吴登俊, 张中显. mTOR对信号通路调控的研究进展[J]. 中国畜牧杂志, 2010, 46(1): 57-60. QI S Z, WU D J, ZHANG Z X. Advance in the mTOR signaling pathway[J]. Chinese Journal of Animal Science, 2010, 46(1): 57-60 (in Chinese). |
| [48] |
VIOLLET B, ANDREELLI F, JØRGENSEN S B, et al. The AMP-activated protein kinase alpha2 catalytic subunit controls whole-body insulin sensitivity[J]. The Journal of Clinical Investigation, 2003, 111(1): 91-98. DOI:10.1172/JCI16567 |
| [49] |
LIU Y, WANG X M, ZHEN Z, et al. GRP78 regulates milk biosynthesis and the proliferation of bovinemammaryepithelial cells through the mTOR signaling pathway[J]. Cellular & Molecular Biology Letters, 2019, 24: 57. |
| [50] |
BICKERSTAFFE R, ANNISON E F, LINZELL J L. The metabolism of glucose, acetate, lipids and amino acids in lactating dairy cows[J]. The Journal of Agricultural Science, 1974, 82(1): 71-85. DOI:10.1017/S0021859600050243 |
| [51] |
TOERIEN C A, TROUT D R, CANT J P. Nutritional stimulation of milk protein yield of cows is associated with changes in phosphorylation of mammary eukaryotic initiation factor 2 and ribosomal s6 kinase 1[J]. Journal of Nutrition, 2010, 140(2): 285-292. DOI:10.3945/jn.109.114033 |
| [52] |
APPUHAMY J A D R N, NAYANANJALIE W A, ENGLAND E M, et al. Effects of AMP-activated protein kinase (AMPK) signaling and essential amino acids on mammalian target of rapamycin (mTOR) signaling and protein synthesis rates in mammary cells[J]. Journal of Dairy Science, 2014, 97(1): 419-429. DOI:10.3168/jds.2013-7189 |
| [53] |
秦春霞, 李虹, 张帅, 等. 雌激素与葡萄糖能量代谢研究进展[J]. 现代生物医学进展, 2018, 18(17): 3388-3391. QIN C X, LI H, ZHANG S, et al. Research advancement of estrogen and energy metabolism of glucose[J]. Progress in Modern Biomedicine, 2018, 18(17): 3388-3391 (in Chinese). |
| [54] |
ZHOU J Y, JIANG M H, SHI Y, et al. Prolactin regulates LAT1 expression via STAT5 (signal transducer and activator of transcription 5) signaling in mammary epithelial cells of dairy cows[J]. Journal of Dairy Science, 2020, 103(7): 6627-6634. DOI:10.3168/jds.2019-17945 |




