牛磺酸又称牛胆碱、牛胆素,因1827年首先从牛胆汁中分离出来而得名。长期以来,人们普遍认为牛磺酸是动物含硫氨基酸的无毒代谢产物[1],1976年Hayes等[2]发现饲料中缺乏牛磺酸会导致幼猫视觉功能减退甚至失明,使得牛磺酸的营养生理作用开始引起人们的重视并得到广泛研究。牛磺酸虽不参与蛋白质的合成,但在动物体内具有非常广泛的营养生理作用,包括调节细胞渗透压和Ca2+稳态,维持细胞膜的稳定性并增强细胞的抗氧化能力,调节机体内分泌和免疫反应以及保证动物神经系统和视网膜的正常发育等。此外,牛磺酸在动物脂类、碳水化合物和蛋白质代谢中也起着重要作用[1]。近年来,鱼粉资源日趋紧张,用植物蛋白质原料(几乎不含牛磺酸)替代鱼粉来配制饲料在水产饲料研究中逐渐成为热点。由于鱼类特别是肉食性鱼类自身牛磺酸合成能力较弱[3],当饲料中缺乏牛磺酸时普遍表现为生长不良,有的鱼还出现绿肝综合征,而补充牛磺酸后鱼类的生长性能得到改善,绿肝综合征的发生率大为降低[4]。目前普遍认为鱼类正常生长需要牛磺酸,因此,其对鱼类的营养生理功能及其在饲料中的应用研究值得关注。下文就牛磺酸的性质与分布、合成与代谢、营养生理功能、鱼类牛磺酸的需要量及其在鱼类饲料中的应用做一简要概述。
牛磺酸是一种β含硫氨基酸,其分子结构为H2N-CH2-CH2-SO3H,相对分子质量为125.15,常温常压下为无色四周针状结晶,无臭,味微酸,熔点310 ℃,微溶于水(23.5 ℃下溶解度为5~10 g/dL),溶于乙酸,不溶于无水乙醇、乙醚或丙酮,在生理pH条件下以两性离子的形式存在。
牛磺酸广泛存在于动物(原生动物除外)体中,但在植物(海藻除外)和细菌中几乎不含牛磺酸[5]。海藻牛磺酸含量在(1.88~124.90)×10-3 mg/g[6],玉米、小麦和芝麻不含牛磺酸,豆类中牛磺酸含量黑豆为1.15×10-3 mg/g,蚕豆为1.61×10-3 mg/g,嫩豌豆为2.34×10-3 mg/g[7]。水产动物含有丰富的牛磺酸,如牡蛎牛磺酸含量为3.67~4.25 mg/g,鱼粉牛磺酸含量为2.88~3.52 mg/g,虾粉牛磺酸含量为0.70~1.73 mg/g[8],水产动物神经、肌肉组织和腺体中牛磺酸的含量非常高,如五条 (Seriola quinqueradiata)暗红肌肉组织中的牛磺酸含量为10.39 mg/g,虹鳟(Oncorhynchus mykiss)心脏组织中的牛磺酸含量为6.09 mg/g[9]。
牛磺酸生物合成的研究集中在陆生脊椎动物(哺乳动物和禽类)上,并以哺乳动物的研究居多,有关鱼类牛磺酸合成的研究资料则较少。牛磺酸可由半胱氨酸、胱氨酸和蛋氨酸等含硫氨基酸经一系列酶促反应合成,是含硫氨基酸的代谢产物,因此含硫氨基酸的代谢伴随着牛磺酸的生物合成[1]。脊椎动物肝脏、肾脏、脑、肺脏和骨骼肌等组织器官均具牛磺酸合成能力,但各组织器官牛磺酸合成能力不同,其中肝脏牛磺酸合成能力较强,为牛磺酸合成的最主要器官[10]。如图1所示,目前已确定的脊椎动物牛磺酸合成途径有3种:半胱亚磺酸(CSA)途径(途径Ⅰ)、半胱胺途径(途径Ⅱ)和磺基丙氨酸(CA)途径(途径Ⅲ)。这3种途径均以关键酶催化底物的不同来界定。动物体内的半胱氨酸可以分别经途径Ⅰ和途径Ⅱ合成牛磺酸,但半胱氨酸流向这2条途径的比例还不清楚,有研究认为流向途径Ⅰ的半胱氨酸更多[11]。一部分途径Ⅰ的中间产物半胱亚磺酸可氧化为磺基丙氨酸,并经途径Ⅲ合成牛磺酸。大鼠、禽类能将体内的无机硫酸盐转化为3′-磷酸腺苷-5′-磷酰硫酸,并通过途径Ⅲ来合成牛磺酸,但这不是动物合成牛磺酸的主要途径,当途径Ⅰ和途径Ⅱ受阻时,途径Ⅲ或许行使其功能而发挥重要作用[12]。大量研究表明途径Ⅰ是哺乳动物牛磺酸合成的主要途径[13],其过程如下:首先胱硫醚合成酶和胱硫醚酶将蛋氨酸转化为半胱氨酸,半胱氨酸双加氧酶(CDO)将半胱氨酸氧化为CSA,然后半胱亚磺酸脱羧酶(CSAD)催化CSA脱羧生成亚牛磺酸,最后亚牛磺酸被氧化为牛磺酸。
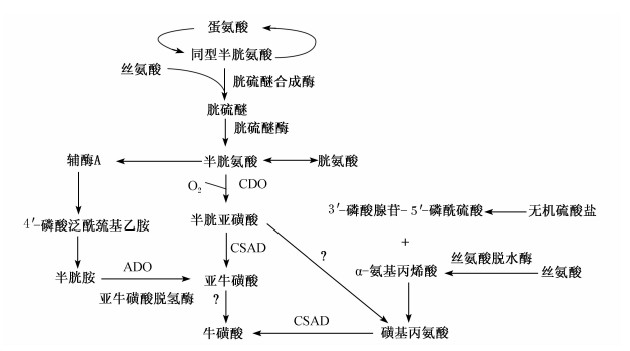 | 图1 脊椎动物牛磺酸的合成途径
Fig.1 Synthesis pathway of taurine in vertebrates[14] |
动物牛磺酸的合成能力主要由牛磺酸合成关键酶的活力决定。途径Ⅲ的关键酶是半胱胺双加氧酶(ADO)。途径Ⅰ和途径Ⅱ的关键酶是CSAD,即CSAD既能催化CSA生成牛磺酸又能催化CA生成牛磺酸。谷氨酸脱羧酶(GAD)也能催化CSA和CA生成牛磺酸。因GAD主要存在于脑组织中,早期研究CSAD特性时误将脑中的GAD认为是另外一种CSAD。在哺乳动物,GAD对CSA和CA的亲和力都很低,而对谷氨酸的亲和力较高,而且谷氨酸只能被GAD催化而不能被CSAD催化,此外,脑内谷氨酸含量又比CSA和CA高很多,因此脑内GAD催化合成牛磺酸的作用极其有限[15]。如表1所示,不同种类的鱼牛磺酸合成关键酶活力差异较大,其牛磺酸合成能力普遍低于哺乳动物,鱼类牛磺酸合成的主要途径与鱼的种类有关;鱼类牛磺酸合成关键酶具有种间差异和组织特异性,说明鱼类牛磺酸合成关键酶可能存在同工酶。以CSAD为例,真鲷(Pagrus major)肝脏CSAD催化CA的能力高于CSA,而大太阳鱼(Lepomismm macrochirus)肝脏CSAD催化CSA的能力高于CA。哺乳动物的情况同鱼类相似,牛脑CSAD对CSA的亲和力高于对CA[16]。大鼠肝脏CSAD对CSA的亲和力高于脑CSAD对CSA的亲和力。以CSA为底物时,测得大鼠肝脏CSAD的Km值为0.045~0.050 mmol/L,大鼠脑CSAD的Km值为0.05~0.10 mmol/L[17]。表1中同种鱼同种酶的活力差异也较大,可能与不同研究者采取的粗酶提取方法、酶催化产物检测方法等不同有关。
| 表1 鱼类肝脏牛磺酸的合成能力Table 1 Taurine synthesis capacity of fish liver nmol/(min·mg prot) |
肝脏是动物最重要的牛磺酸合成器官,鱼类肝脏牛磺酸合成的主要途径可用鱼类肝脏牛磺酸合成关键酶的活力来推测。如表1所示,大太阳鱼肝脏CSAD和ADO活力均较高,推测大太阳鱼肝脏可能同时通过上述3条途径来合成牛磺酸;虹鳟肝脏中以CSA为底物的CSAD活力是以CA为底物的CSAD活力的46.6倍,是ADO活力的25.9倍,推测虹鳟肝脏主要通过途径Ⅰ合成牛磺酸。真鲷肝脏以CA为底物的CSAD酶活力和ADO酶活力均较高,推测真鲷肝脏主要通过途径Ⅱ和途径Ⅲ来合成牛磺酸 。表1中酶活力都是在底物充足的情况下测得的,鱼类生长发育过程中可能会根据其体内底物浓度选择不同的牛磺酸合成途径。哺乳动物不同器官有不同的牛磺酸合成途径,大鼠肾脏和心脏能检出半胱胺,而脑中不能检出半胱胺,说明大鼠脑不能通过途径Ⅱ合成牛磺酸,而途径Ⅰ或许是大鼠脑合成牛磺酸的主导途径或唯一途径[20]。鱼类不同组织器官合成牛磺酸的途径是否存在差异尚不清楚。值得注意的是,虽然牙鲆(Paralichthys olivaceus)和鲤(Cyprinus carpio)体内含有较多的牛磺酸,但其3条途径中的牛磺酸合成酶活力均较低,推测这类鱼体内牛磺酸或许来自于含丰富牛磺酸的食物,或者由其他途径合成[19]。Park等[21]发现,饲料中缺乏牛磺酸时牙鲆的生长受到抑制,即使添加半胱氨酸其生长性能也未见改善,这表明牙鲆不能合成足够的牛磺酸来满足其生长发育的需要,其体内牛磺酸由食物提供。给鲤饲喂酪蛋白饲料(不含牛磺酸)或饲喂给牛磺酸含量(0.06%)很低的饲料时,鲤仍能够正常生长,这表明鲤自身能够通过其他途径合成足够牛磺酸来满足其生长发育的需要[22]。
动物牛磺酸的合成能力受多种因素的影响,如动物种类、饲料成分、生长阶段和性别等。现已明确,猫不具牛磺酸合成能力,大鼠牛磺酸合成能力则较强,并且其这种能力随发育进程而逐渐增强[23]。随着大鼠饲料中酪蛋白含量的增加,其CSAD活力逐渐降低[24]。鱼类牛磺酸合成能力也受上述因素的影响。如表1所示,大太阳鱼牛磺酸的合成能力比牙鲆高出数倍,牙鲆各生长阶段(300~1000 g)CSAD活力差异不大,而体重64 g的圆斑星鲽的CSAD活力是体重13 g个体CSAD活力的3.5倍[18]。
动物体内牛磺酸的合成与代谢处于相对稳定的状态。牛磺酸稳态的调节则是依靠肾脏来实现的,当牛磺酸不足时肾脏通过重吸收来降低牛磺酸的排泄量,以满足机体的需要。当体内的牛磺酸净含量超过一定的水平时,牛磺酸会随尿液排出体外[25]。进入组织器官的牛磺酸或行使各类生理功能或被机体代谢。细菌牛磺酸的代谢能力较强,能够直接将牛磺酸分解,作为其生长所需碳、氮和硫的来源[26]。相比较而言,动物牛磺酸的代谢能力较差,动物体内牛磺酸主要与其他物质反应生成具有生理功能的化合物。牛磺酸在动物体内的代谢可分为以下5个途径。
在鱼类肝脏中,牛磺酸与胆酸、鹅脱氧胆酸等游离胆酸形成牛磺胆酸、牛磺鹅脱氧胆酸等结合胆汁酸[27]。胆汁酸主要以胆汁酸盐的形式随胆汁进入消化道中,不仅能够促进脂肪和脂溶性维生素的消化吸收,而且能够增加胆固醇的溶解与排出[28]。这是牛磺酸最主要的代谢途径。
中性粒细胞和单核细胞髓过氧化物酶的作用下可催化过氧在化氢和氯化物反应产生次氯酸(HClO),HClO再与牛磺酸反应生成稳定且毒性较小的RNHCl,RNHCl在特定氨基酸转运系统的作用下进入肝脏或红细胞中被谷胱甘肽还原为伯胺盐阳离子(RNH+3)而使HClO的氧化性得到清除,使细胞免遭氧化损伤[29, 30]。另外,RNHCl还可以作为信号分子调节巨噬细胞中与炎症反应有关的介质因子的产生,它可以通过减少一氧化氮和肿瘤坏死因子的产生来抑制炎症反应的发生,这已成为牛磺酸生物学功能研究的热点[31]。
哺乳动物通过牛磺酸与精氨酸的脒基转移作用来形成脒基牛磺酸。在无脊椎动物,亚牛磺酸与精氨酸通过脒基转移作用来形成脒基亚牛磺酸,然后被氧化为脒基牛磺酸,脒基牛磺酸可以作为神经递质的调节剂[32]。在很多海洋无脊椎动物中脒基牛磺酸类似于哺乳动物中的肌酸,其磷酸脒基牛磺酸类似于哺乳动物的磷酸肌酸[33],脒基牛磺酸激酶催化磷酸脒基牛磺酸与脒基牛磺酸相互转化并释放三磷酸腺甙(ATP)[34]。
在大鼠和人的尿液中均能测出牛磺脲酸(每100 mL尿液5~10 μg),但不能确定该牛磺脲酸是大鼠和人体内牛磺酸的天然代谢产物还是从外界摄入的化合物。有关牛磺脲酸的研究较少,其生物功能还不清楚[5]。
羟乙基牛磺酸合成路径如下:
牛磺酸+次氯酸RNHCl磺乙醛 羟乙基牛磺酸[35]。羟乙基牛磺酸最初是在乌贼巨轴突里被发现的,它是乌贼巨轴突里最主要的阴离子[36]。Fellman等[37]发现无菌小鼠不能将牛磺酸转化为羟乙基牛磺酸,小鼠和大鼠体外组织均不能将牛磺酸转化为羟乙基牛磺酸,这表明哺乳动物不能合成羟乙基牛磺酸。哺乳动物组织内羟乙基牛磺酸可能是由其肠道内细菌合成,但哺乳动物肠道细菌合成的羟乙基牛磺酸是如何出现在大鼠脑组织中的目前还得不到合理解释[38]。现已证明磺乙醛(sulphoacetaldehyde)是合成羟乙基牛磺酸的中间产物[39],而哺乳动物嗜中性粒细胞能够将牛磺酸经中间产物RNHCl分解为磺乙醛[40],因此哺乳动物自身不能合成羟乙基牛磺酸的原因可能是缺少将磺乙醛转化为羟乙基牛磺酸的酶。
1992年,Liu等[41]从大鼠脑cDNA库中克隆出牛磺酸转运体(TauT),该TauT含590个氨基酸残基,有12个跨膜螺旋区。大鼠脑中牛磺酸的跨膜转运借助脑细胞膜上的TauT来进行。类似哺乳动物,鱼类牛磺酸的跨膜转运也依靠细胞膜上的TauT来进行[42, 43]。TauT与其他神经递质转运体在序列上具有同源性。TauT含有大量丝氨酸残基,是环磷酸腺苷(cAMP)依赖的蛋白激酶A(PKA)和钙离子依赖的蛋白激酶C(PKC)介导的磷酸化位点,PKA和PKC通过影响这些位点的磷酸化来调控TauT的转运活性[44, 45]。牛磺酸的跨膜转运过程依赖Na+和Cl-,牛磺酸随着Na+的协同作用进入细胞,该过程同时受Ca2+、K+和Mg2+的调节。牛磺酸的类似物脒基牛磺酸和β-丙氨酸是牛磺酸跨膜转运的阻滞剂[46]。机体借助细胞膜上的TauT将血液中的牛磺酸运至细胞内来维持机体内牛磺酸的稳态,继而发挥牛磺酸的营养生理功能。
目前已发现牛磺酸具有广泛的生理功能,其主要的生理功能可以归纳如下几个方面。
磷脂酶C能破坏肌浆网的膜结构从而使Ca2+转运能力和跨膜ATP酶活力下降,但在加入牛磺酸后可以减轻这种破坏程度,这表明牛磺酸可以作为生物膜的稳定剂。其机制可能是牛磺酸主要结构与生物膜磷脂的结构很相似,牛磺酸嵌入到磷脂中参与生物膜构象的修饰和生物膜离子对的形成,如牛磺酸的氨基和磺酸基可以与生物膜磷脂的氨基、磷酸或季铵基团结合而产生静电作用引起自由能的改变和阳离子(主要是Ca2+)结合位点的增加[47, 48]。
牛磺酸和甘氨酸能与胆酸和鹅脱氧胆酸等游离胆酸形成结合胆汁酸-牛磺胆酸和甘氨胆酸,结合胆汁酸以胆汁酸盐的形式参与脂肪的消化吸收。哺乳动物中牛磺酸和甘氨酸均能较好与胆酸结合,而鱼类甘氨酸与胆酸的结合率仅为牛磺酸的1%~2%[27, 49]。鱼类形成胆酸的前体物质是胆固醇,因此牛磺胆酸的排泄构成了鱼类胆固醇排出的主要形式。由于牛磺酸还具有促进脂肪酸氧化和减少脂肪合成的作用,因此牛磺酸可以降低脂肪在鱼体内的沉积[50]。
进入胰腺β细胞的牛磺酸能够引起胰岛素的释放,从而使血浆葡萄糖含量降低,其机理如下:牛磺酸能抑制胰腺ATP敏感钾通道的活性,使ATP敏感钾通道关闭,β细胞去极化激活电压依耐性的Ca2+通道增加细胞内Ca2+,从而刺激胰岛素分泌[51]。
当细胞Ca2+内向电流(Ica)减弱时,牛磺酸促进Ca2+内流;当Ca2+内向电流高于正常值时,牛磺酸抑制Ca2+内流,防止Ca2+超负荷[46]。心脏Ca2+超负荷会导致心肌细胞内牛磺酸含量的下降,牛磺酸内流增加可以减少心肌酶漏出,抑制ATP酶活力的降低,增加心肌ATP含量来抑制细胞Ca2+超负荷,从而实现对心肌细胞的保护。牛磺酸通过细胞膜上的Ca2+转运系统(即调节Ca2+在胞内外及细胞器间的转运)来维持细胞Ca2+的稳态,但其作用机制尚未研究清楚。另外,牛磺酸还能通过调节靶组织(如肌钙蛋白、钙调蛋白和ATP酶)对Ca2+的利用及敏感性来维持细胞Ca2+的稳态[1]。
牛磺酸的理化特性使其成为理想的渗透压调节物质。当细胞处于高渗环境时,TauT将牛磺酸转入细胞,牛磺酸内流增加,当细胞处于低渗环境时,细胞膨胀且膜通透性增加,牛磺酸外排作用增强[1]。对于鱼类,牛磺酸是最主要的渗透压调节物质之一,在鱼类渗透压调节中有非常重要的作用[55]。硬骨鱼心脏50%以上的游离氨基酸为牛磺酸,当细胞渗透压变化时,牛磺酸提供40%~50%的渗透压变化[56]。例如,当川鲽(Platichthys flesus)血浆渗透压下降17%时牛磺酸可提供其中40%的渗透压变化,而K+只能提供16%[57]。饲喂缺乏牛磺酸饲料的五条 血浆牛磺酸浓度和血清渗透压显著降低[58]。
牛磺酸及其衍生物能通过清除机体活性氧及其他氧化性有害物或通过增强机体抗氧化系统的抗氧化能力来保护动物免遭氧化伤害。研究表明,牛磺酸能够显著提高大鼠脑和肾脏超氧化物歧化酶和谷胱甘肽过氧化物酶的活力,降低丙二醛的含量[59]。
牛磺酸可以在器官和细胞水平影响动物的免疫功能。猫缺乏牛磺酸时脾脏发生病变,白细胞数量减少,白细胞沉降特性也发生变化[60]。饲料中添加牛磺酸能够显著提高鲤鱼血清和肝胰脏溶菌酶活力[61]。牛磺酸代谢中间产物也能调节动物免疫反应,如RNHCl在炎性反应中具有重要作用,它可以通过下调白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、一氧化氮合酶2(NOS2)、前列腺素E2(PGE2)等促炎因子的产生来发挥消炎作用[31]。
不同种类鱼牛磺酸的合成能力不同,同种鱼处于不同生长阶段其牛磺酸的合成能力也会发生变化,因此不同种类和处于不同生长阶段的鱼牛磺酸的需要量不同,试验也证明不同生长阶段鱼牛磺酸需要量不同。例如,饲料中添加牛磺酸在试验的前3周促进了五条 的生长,但是在后3周则没有这种作用[63]。鱼类牛磺酸的需要量见表2。
动物缺乏牛磺酸时会引起一些牛磺酸缺乏症。大鼠、猫和狐狸牛磺酸不足时出现扩张型心肌病和视网膜变性[72, 73]。此外,猫缺乏牛磺酸时还会出现流产、胎儿被吸收、产死胎或新生胎儿体重偏低等繁殖性能下降的症状[74]。有报道真鲷缺乏牛磺酸会发生绿肝综合征,其机理如下:牛磺酸缺乏引起红细胞渗透脆性增加,导致红细胞破裂,逸出血红蛋白,血红蛋白的降解使胆色素大量生成,不能从肝脏排泄到胆囊,最终导致胆色素淤积[58]。
牛磺酸不仅是鱼类正常生长发育的条件性必需氨基酸,而且对鱼类具有广泛的生理功能。饲料中缺乏牛磺酸会使五条 [58]、虹鳟[69]和军曹鱼[75]等水生动物的生长受到抑制,有的鱼类还出现绿肝综合征等营养性疾病[58, 67]。在生产中,牛磺酸已被作为一种重要的生理活性物质应用于水产养殖。目前已有较多有关牛磺酸在鱼类饲料中应用的报道,具体如下:1)作为诱食剂。牛磺酸通过作用于鱼类的嗅觉器官,可以增加食物的吸引力。牛磺酸可以作为欧洲鳗鱼(Anguilla anguilla)、北极红点鲑(Salvelinus alpinus)、河鳟(Thymallus thymallus)[76]和鲤鱼[77]的诱食剂。2)作为营养强化剂。用牛磺酸强化过的生物饵料(如轮虫和卤虫)饲喂幼鱼可以改善幼鱼的生长发育情况,从而改善幼鱼的存活率[78]。3)提高鱼类的繁殖性能。Matsunari等[67]研究表明,饲喂高牛磺酸饲料的五条 亲鱼跟饲喂低牛磺酸饲料的五条 亲鱼相比,雌鱼卵子的直径、上浮率、受精率等重要参数都要高。4)增强鱼类耐缺氧能力。经牛磺酸溶液浸浴后的麦穗鱼(Pseudorasbora parva)和鲫鱼(Carassius auratus)的耐缺氧能力得到增强[79, 80]。
| 表2 鱼类牛磺酸的需要量 Table 2 Taurine requirement of fish |
饲料中牛磺酸的添加水平需要根据鱼的种类、生长阶段来定,同时还要考虑饲料蛋白质来源和水平、含硫氨基酸的种类和数量。饲料中牛磺酸转运拮抗剂(如脒基牛磺酸和β-丙氨酸)会降低牛磺酸使用效果。
近年来,随着海洋渔业资源逐渐减少,鱼粉价格逐年上升,这已成为制约水产饲料工业发展的瓶颈,因此,开发植物蛋白质替代物替代鱼粉成为鱼类饲料研究的热点,但鱼类特别是肉食性鱼类利用植物蛋白质替代物的效果差,并引发一系列生理病理变化,而植物蛋白质替代物中牛磺酸含量低是影响替代效果的原因之一。尽管牛磺酸在鱼类上的营养生理作用及其应用已经有不少研究,但还不是很充分,相关研究仍需要进一步加强。因此,今后应加强以下几方面的研究:1)牛磺酸防治动物营养性疾病机理的研究,例如牛磺酸在抗心律失常、防治绿肝综合征和改善贫血症等疾病上是如何发挥作用的;2)鱼类不同生长发育阶段和亲鱼繁殖过程中牛磺酸适宜需要量的研究;3)不同种类鱼牛磺酸合成能力、合成过程以及合成能力调控的研究;4)牛磺酸与其他营养物质代谢关系的研究,例如牛磺酸与含硫氨基酸、Ca2+和Zn2+代谢之间的相互关系等。
| [1] | HUXTABLE R J.Physiological action of taurine[J].Physiological Reviews,1992,72:101-163.[本文引用:6] |
| [2] | HAYES K C,CAREY R,SCHMIDT S Y.Retinel degeneration associated with taurine deficiency in the cat [J].Science,1976,188:949-953.[本文引用:1] |
| [3] | GOTO T,TIBA K,SAKURADA Y,et al.Determination of hepatic cysteinesulfinate decarboxylase activity in fish by means of OPA-prelabeling and reverse-phase high performance liquid chromatographic separation[J].Fisheries Science,2001,67:553-555.[本文引用:2] |
| [4] | TAKAGI S,MURATA H,GOTO T,et al.Efficacy of taurine supplementation for preventing green liver syndrome and improving growth performance in yearling red sea bream Pagrus major fed low-fishmeal diet[J].Fisheries Science,2006,72:1191-1199.[本文引用:1] |
| [5] | JACOBSEN J G,SMITH L H.Biochemistry and physiology of taurine and taurine derivatives[J].Physiological Reviews,1968,48:424-511.[本文引用:2] |
| [6] | KATAOKA H,OHNISHI N.Occurrence of taurine in plants[J].Agricultural and Biological Chemistry,1986,50:1887-1888.[本文引用:1] |
| [7] | PASANTES-MORALES H,QUESADA O,ALCOCER L,et al.Taurine content in foods[J].Nutrition Reports International,1989,40:793-801.[本文引用:1] |
| [8] | SPITZE A R,WONG D L,ROGERS Q R,et al.Taurine concentrations in animal feed ingredients;cooking influences taurine content[J].Journal of Animal Physiology and Animal Nutrition,2003,87:251-262.[本文引用:1] |
| [9] | GRAS J,GUDEFIN Y,CHAGNY F,et al.Free amino acids and ninhydrin-positive substance in fish Ⅱ.Cardio-respiratory system:plasma,erythrocytes,heart and gills of the rainbow trout (Salmo gairdnerii Richardson)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1982,73:845-847.[本文引用:1] |
| [10] | STIPANUK M H.Role of the liver in regulation of body cysteine and taurine levels:a brief review[J].Neurochemical Research,2004,29:105-110.[本文引用:1] |
| [11] | STIPANUK M H,DOMINY J E,Jr,LEE J I,et al.Mammalian cysteine metabolism:new insights into regulation of cysteine metabolism[J]. The Journal of Nutrition,2006,136(Suppl.6):1652S-1659S.[本文引用:1] |
| [12] | MARTIN W G,TRUEX C R,TARKA S M,et al.The synthesis of taurine from sulfate.Ⅷ.A constitutive enzyme in mammals[J].Proceedings of the Society for Experimental Biology and Medicine,1974,147:563-565.[本文引用:1] |
| [13] | UEKI I,STIPANUK M H.3T3-L1 adipocytes and rat adipose tissue have a high capacity for taurine synthesis by the cysteine dioxygenase/cysteinesulfinate decarboxylase and cysteamine dioxygenase pathways[J].The Journal of Nutrition,2009,139:207-214.[本文引用:1] |
| [14] | GOTO T,MATSUMOTO T,TAKAGI S.Distribution of the hepatic cysteamine dioxygenase activities in fish[J].Fisheries Science,2001,67:1187-1189.[本文引用:2] |
| [15] | TAPPAZ M,ALMARGHINI K,LEGAY F,et al.Taurine biosynthesis enzyme cysteine sulfinate decarboxylase (CSD) from brain:the long and tricky trail to identification[J].Neurochemical Research,1992,17:849-859.[本文引用:1] |
| [16] | WU J Y.Purification and characterization of cysteic acid and cysteine sulfinic acid decarboxylase and L-glutamate decarboxylase from bovine brain[J].Proceedings of the National Academy of Sciences,1982,79:4270-4274.[本文引用:1] |
| [17] | OERTEL W H,SCHMECHEL D E,WEISE V K,et al.Comparison of cysteine sulphinic acid decarbylase isoenzymes and glutamic acid decarbylase in rat liver and brain[J].Neuroscience,1981,6:2701-2707,2709-2714.[本文引用:1] |
| [18] | YOKOYAMA M,TAKEUCHI T,PARK G S,et al.Hepatic cysteinesulphinate decarboxylase activity in fish[J].Aquaculture Research,2001,32(Suppl.1):216-220.[本文引用:2] |
| [19] | GOTO T,MATSUMOTO T,MURAKAMI S,et al.Conversion of cysteate into taurine in liver of fish[J].Fisheries Science,2003,69:216-218.[本文引用:2] |
| [20] | KURIYAMA K,IDA S,OHKUMA S.Alteration of cerebral taurine biosynthesis in spontaneously hypertensive rats[J].Journal of Neurochemistry,1984,42:1600-1606[本文引用:1] |
| [21] | PARK G S,TAKEUCHI T,YOKOYAMA M,et al.Optimal dietary taurine level for growth of juvenile Japanese fiounder Paralichthys olivaceus[J].Fisheries Science,2002,68:824-829.[本文引用:2] |
| [22] | KIM S K,MATSUNARI H,TAKEUCHI T,et al.Comparison of taurine biosynthesis ability between juveniles of Japanese fiounder and common carp[J].Amino Acids,2008,35:161-168.[本文引用:2] |
| [23] | WORDEN J A,STIPANUK M H.A comparison by species,age and sex of cysteinesulnate decarboxylase activity and taurine concentration in liver and brain of animals[J].Comparative Biochemistry and Physiology,1985,82:233-239.[本文引用:1] |
| [24] | BAGLEY P J,STIPANUK M H.The activities of rat cysteine dioxygenase and cysteinsulfinate decarboxylase are regulated in a reciprocal manner in response to dietary casein level[J].The Journal of Nutition,1994,124:2410-2421.[本文引用:1] |
| [25] | YOKOYAMA M,NAKAZOE J.Accumulation and excretion of taurine in rainbow trout Oncorhynchus mykiss fed diets supplemented with methionine,cystine and taurine[J].Comparative Biochemistry and Physiology,1992,102A:565-568.[本文引用:1] |
| [26] | COOK A M,DENGER K.Metabolism of taurine in microorganisms:a primer in molecular biodiversity?[J].Advances in Experimental Medicine and Biology,2006,583:3-13.[本文引用:1] |
| [27] | VESSEY D A,BENFATTO A M,ZERWECK E,et al.Purification and characterization of the enzymes of bile acid conjugation from fish liver[J].Comparative Biochemistry and Physiology,1990,95:647-652.[本文引用:2] |
| [28] | MIZUSHIMA S,NARA Y,SAWAMURA M,et al.Effects of oral taurine supplementation on lipids and symapathetic nerve tone[J].Advances in Experimental Medicine and Biology,1996,403:615-622.[本文引用:1] |
| [29] | KONTNY E,RUDNICKA W,CHORAY-MASSALSKA M,et al.Taurine chloramine inhibits proliferation of rheumatoid arthritis synoviocytes by triggering a p53-dependent pathway[J].Inflammation Research,2006,55:446-455.[本文引用:1] |
| [30] | KIM K S,PARK E K,JU S M,et al.Taurine chloramine differentially inhibits matrix metalloproteinase 1 and 13 synthesis in interleukin-1β stimulated fibroblast-like synoviocytes[J].Arthritis Research and Therapy,2007,9:R80.[本文引用:1] |
| [31] | MARCINKIEWICZ J,GRABOWSKA A,BERETA J,et al.Taurine chloramines,a product of activated neutrophils,inhibits the generation of nitric oxide and other macrophage inflammatory mediators[J].Journal of Leukocyte Biology,1995,58:667-674.[本文引用:2] |
| [32] | HUXTABLE R J,LIPPINCOTT S E.Comparative metabolism and taurine depletion effects of guanidine ethane sulfonate in cats,mice,and guinea pigs[J].Archives of Biochemistry and Biophysics,1981,210:698-709.[本文引用:1] |
| [33] | ENNOR A H,MORRISON J F.Biochemistry of the phosphagens and related guanidines[J].Physiological Reviews,1985,38:631-674.[本文引用:1] |
| [34] | SURHOLT B.Taurocyamine kinase from the body-wall musculature of the lugworm Arenicola marina[J].European Journal of Biochemistry,1979,93:279-300.[本文引用:1] |
| [35] | MARCINKIEWICZ J,KONTNY E.Taurine,taurine derivatives and the immune system[M]//IDRISSI A E,L’AMOREAUX W.Taurine in health and disase.Trivandrum:Transworld Research Network Press,2012:101-129.[本文引用:1] |
| [36] | KOECHLIN B A.The isolation and identification of the major anion fraction of the axoplasm of squid giant nerve fibers[J].Proceedings of the National Academy of Sciences,1954,40:60-62.[本文引用:1] |
| [37] | FELLMAN J H,ROTH E S,AVEDOVECH N A,et al.The metabolism of taurine to isethionate[J].Archives of Biochemistry and Biophysics,1980,204:560-567.[本文引用:1] |
| [38] | PECK E J,AWAPARA J.Formation of taurine and isethionic acid in rat brain[J].Biochimica et Biophysica Acta,1967,141:499-506.[本文引用:1] |
| [39] | KREJĈÍK Z,HOLLEMEYER K,SMITS T H M,et al.Isethionate formation from taurine in Chromohalobacter salexigens:purification of sulfoacetaldehyde reductase[J]. Microbiology,2010,156:1547-1555.[本文引用:1] |
| [40] | CUNNINGHAM C,TIPTON K F,DIXON H B F.Conversion of taurine into N-chlorotaurine (taurine chloramine) and sulphoacetaldehyde in response to oxidative stress[J].Biochemical Journal,1998,330:939-945.[本文引用:1] |
| [41] | LIU Q R,LÓPEZ-CORCUERA B,NELSON H,et al.Cloning and expression of a cDNA encoding the transporter of taurine and beta-alanine in mouse brain[J].Proceedings of the National Academy of Sciences,1992,89:12145-12149.[本文引用:1] |
| [42] | CHOW S C,CHING L Y,WONG A M F,et al.Cloning and regulation of expression of the Na+-Cl- taurine transporter in gill cells of freshwater Japanese eels[J].Journal of Experimental Biology,2009,212:3205-3210.[本文引用:1] |
| [43] | PINTO W,RØNNESTAD I,JORDAL A E,et al.Cloning,tissue and ontogenetic expression of the taurine transporter in the flatfish Senegalese sole (Solea senegalensis)[J].Amino Acids,2012,42:1317-1327.[本文引用:1] |
| [44] | O'FLAHERTY L,STAPLETON P P,REDMOND H P,et al.Intestinal taurine transport:a review[J].European Journal of Clinical Investigation,1997,27:873-880.[本文引用:1] |
| [45] | LAMBERT I H.Regulation of the cellular content of the organic osmolyte taurine in mammalian cells[J].Neurochemical Research,2004,29:27-63.[本文引用:1] |
| [46] | 宿燕岗,杨英珍,陈溯珠.牛磺酸跨膜转运的意义及机制[J].细胞生物学杂志,1997,19(1):4-9.[本文引用:2] |
| [47] | HUXTABLE R,BRESSLER R.Effect of taurine on a muscle intracellular membrane[J].Biochimica et Biophysica Acta,1973,323:573-583.[本文引用:1] |
| [48] | KUZMINA V V,GAVROVSKAYA L K,RYZHOVA O V.Taurine effect on exotrophia and metabolism in mammals and fish[J].Journal of Evolutionary Biochemistry and Physiology,2010,46:19-27.[本文引用:1] |
| [49] | YOU J S,CHANG K J.Effects of taurine supplementation on lipid peroxidation,blood glucose and blood lipid metabolism in streptozotocin induced diabetic rats[J].Advances in Experimental Medicine and Biology,1998,442:163-169.[本文引用:1] |
| [50] | ESPE M,RUOHONEN K,EL-MOWAFI A,et al.Effect of taurine supplementation on the metabolism and body lipid-to-protein ratio in juvenile Atlantic salmon (Salmo salar)[J].Aquaculture Research,2012,43:349-360.[本文引用:2] |
| [51] | L'AMOREAUX W J,CUTTITTA C,SANTORA A,et al.Taurine regulates insulin release from pancreatic beta cell lines[J].Journal of Biomedical Science,2010,17(Suppl.1):1-8.[本文引用:1] |
| [52] | 邱小琮,赵红雪.牛磺酸对鲤生长及血清T3、T4含量的影响[J].淡水渔业,2006,36(1):22-24.[本文引用:1] |
| [53] | HUANG K H,CHANG C C,HO J D,et al.Role of taurine on acid secretion in the rat stomach[J].Journal of Biomedical Science,2011,18:11-20.[本文引用:1] |
| [54] | 高春生,范光丽,王艳玲.牛磺酸对黄河鲤鱼生长性能和消化酶活性的影响[J].中国农学通报,2007,23(6):645-647.[本文引用:1] |
| [55] | ASSEM H,HANKE W.The significance of the amino acids during osmotic adjustment in teleost fish changes in the euryhaline Sarotherodon mossambicus[J].Comparative Biochemistry and Physiology,1983,74A:531-536.[本文引用:1] |
| [56] | VISLIE T.Cell volume regulation in fish heart ventricles with special reference to taurine[J].Comparative Biochemistry and Physiology,1983,74A:507-514.[本文引用:1] |
| [57] | VISLIE T,FUGELLI K.Cell volume regulation in flounder (Platichthys flesus) heart muscle accompanying an alteration in plasma osmolality[J].Comparative Biochemistry and Physiology,1975,52:415-418.[本文引用:1] |
| [58] | TAKAGI S,MURATA H,GOTO T,et al.Hemolytic suppression roles of taurine in yellowtail Seriola quinqueradiata fed non-fishmeal diet based on soybean protein[J].Fisheries Science,2006,72:546-555.[本文引用:4] |
| [59] | GVRER H,ÖZGVNES H.Antioxidant effect of taurine against lead-induced oxidative stress[J].Archives of Environmental Contamination and Toxicology,2001,41:397-402.[本文引用:1] |
| [60] | SCHULLER-LEVIS G,MEHTA P D,RUDELLI R,et al.Immunologic consequences of taurine deficiency in cats[J].Journal of Leukocyte Biology,1990,47:321-331.[本文引用:1] |
| [61] | 邱小琮,赵红雪,王远吉,等.牛磺酸对鲤非特异性免疫及抗氧化能力的影响[J].上海水产大学学报,2008,14(4):429-434.[本文引用:1] |
| [62] | LIMA L,OBREGON F,CUBILLOS S,et al.Taurine as a micronutrient in development and regeneration of the central nervous system[J].Nutritional Neuroscience,2001,4:439-443[本文引用:1] |
| [63] | MATSUNARI H,TAKEUCHI T,TAKAHASHI M,et al.Effect of dietary taurine supplementation on growth performance of yellowtail juveniles Seriola quinqueradiata[J].Fisheries Science,2005,71:1131-1135.[本文引用:2] |
| [64] | MARTINEZ J B,CHATZIFOTIS S,DIVANACH P,et al.Effect of dietary taurine supplementation on growth performance and feed selection of sea bass Dicentrarchus labrax fry fed with demand-feeders[J].Fisheries Science,2004,70:74-79.[本文引用:1] |
| [65] | MATSUNARI H,YAMAMOTO T,KIM S K,et al.Optimum dietary taurine level in casein-based diet for juvenile red sea bream Pagrus major[J].Fisheries Science,2008,74:347-353.[本文引用:1] |
| [66] | TAKAGI S,MURATA H,GOTO T,et al.Necessity of dietary taurine supplementation for preventing green liver symptom and improving growth performance in yearling red sea bream Pagrus major fed non-fishmeal diets based on soy protein concentrate[J].Fisheries Science,2010,76:119-130.[本文引用:1] |
| [67] | MATSUNARI H,HAMADA K,MUSHIAKE K,et al.Effects of taurine levels in broodstock diet on reproductive performance of yellowtail Seriola quinqueradiata[J].Fisheries Science,2006,72:955-960.[本文引用:3] |
| [68] | QI G S,AI Q H,MAI K S,et al.Effects of dietary taurine supplementation to a casein-based diet on growth performance and taurine distribution in two sizes of juvenile turbot (Scophthalmus maximus L.)[J].Aquaculture,2012,358/359:122-128.[本文引用:1] |
| [69] | GAYLORD T G,BARROWS,F T,TEAGUE A M,et al.Supplementation of taurine and methionine to all-plant protein diets for rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,2007,269:514-524.[本文引用:2] |
| [70] | GONÇALVES G S,RIBEIRO M J P,VIDOTTI R M,et al.Taurine supplementation in diets for Nile tilapia Oreochromis niloticus .World Aquaculture Society,2011.https://www.was.org/WASMeetings/meetings/ShowAbstract.aspx?Id=24516.[本文引用:1] |
| [71] | RHODES M,DAVIS D A.Taurine:critical supplement for marine fish feed .Global Aquaculture Alliance,2011,11/12:34-35.http://pdf.gaalliance.org/pdf/GAA-Rhodes-Nov11.pdf.[本文引用:1] |
| [72] | TAKASHI I,SHOHEI O,MIKA T,et al.Cardiac and skeletal muscle abnormality in taurine transporter-knockout mice[J].Journal of Biomedical Science,2010,17(Suppl.1):1-5.[本文引用:1] |
| [73] | PANSANI M C,AZEVEDO P S,RAFACHO B P M,et al.Atrophic cardiac remodeling induced by taurine deficiency in Wistar rats[J].PLoS One,2012,7:1-6.[本文引用:1] |
| [74] | STURMAN J A.Dietary taurine and feline reproduction and development[J].The Journal of Nutrition,1991,121(Suppl.11):S166-S170.[本文引用:1] |
| [75] | LUNGER A N,MCLEAN E,GAYLORD T G,et al.Taurine supplementation to alternative dietary proteins used in fish meal replacement enhances growth of juvenile cobia (Rachycentron canadum)[J].Aquaculture,2007,271:401-410.[本文引用:1] |
| [76] | DOVING K B,SELSET R,THOMMESEN G.Olfactory sensitivity to bile salts in salmonid fish[J].Acta Physiologica Scandinavica,1980,108:123-131.[本文引用:1] |
| [77] | 邱小琮,赵红雪,魏智清.牛磺酸对鲤鱼诱食活性的初步研究[J].河北渔业,2006(8):10-11.[本文引用:1] |
| [78] | SALZE G,MCLEAN E,CRAIG S R.Dietary taurine enhances growth and digestive enzyme activities in larval cobia[J].Aquaculture,2012,362/363:44-49.[本文引用:1] |
| [79] | 魏智清,于洪川,邱小琮,等.牛磺酸对泥鳅、麦穗鱼抗缺氧能力的影响[J].黑龙江畜牧兽医,2005,10:72-73.[本文引用:1] |
| [80] | 邱小琮,赵红雪,魏智清.牛磺酸对鲫鱼密闭缺氧存活时间和血红蛋白含量的影响[J].信阳师范学院学报,2006,19(2):179-180.[本文引用:1] |




