精氨酸(arginine,Arg)最初是在1886年由德国科学家从植物羽扁豆幼苗中分离提取出来并命名的,1995年,Hedin在哺乳动物的蛋白质中也发现了精氨酸的存在。精氨酸是维持新生哺乳动物最佳生长和氮平衡的必需氨基酸。Geng等[1]研究报道,精氨酸是新生哺乳仔猪的必需氨基酸。家禽体内缺乏合成精氨酸前体物质所必需的甲酰磷酸酶(催化谷氨酰胺与谷氨酸合成瓜氨酸)和二氢吡咯-5-羧酸合成酶(催化脯氨酸与鸟氨酸转化成谷氨酸)等关键酶,不能合成精氨酸,只能由饲粮提供,所以精氨酸也是家禽的必需氨基酸[2],成年哺乳动物在正常情况下能够自身合成精氨酸,但在饥饿、创伤、应激及快速生长等状态下自身合成的精氨酸不足以满足机体需要。因此,精氨酸又被认为是条件性必需氨基酸[3]。精氨酸因其具有广泛的生物学功能而在所有氨基酸中占有很重要的地位,它在机体内参与组织细胞蛋白质、尿素、肌酸、肌酐、一氧化氮(NO)、谷氨酰胺、嘧啶等的合成[4]。近年来发现精氨酸可以通过NO途径参与机体营养免疫调节,因此精氨酸作为一种免疫调节剂而成为动物营养研究的热点。
精氨酸是含有2个碱性基团即氨基和胍基的氨基酸,在生理pH条件下属于碱性氨基酸(pH 10.5~12.5),它是20种蛋白质氨基酸中碱性最强的氨基酸。其分子式为C6H14N4O2,结构式见图1,学名2-氨基-5-胍基戊酸,三字母简称Arg,单字母简称R,相对分子质量为174.20,为白色菱形结晶(含2分子结晶水)或单斜片状结晶(无结晶水),无嗅,味苦,易溶于水,极微溶于乙醇,不溶于乙醚,加热至105 ℃时失去2分子结晶水。精氨酸中由于胍基的存在易与酸反应形成盐。精氨酸在自然界中有2种异构体即D-精氨酸(D-Arg)和L-精氨酸(L-Arg),在动物机体内有营养、代谢及免疫生理功能的是L-精氨酸。
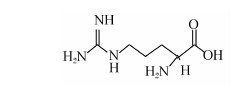 | 图1 精氨酸的结构式
Fig.1 Structural formula of arginine |
动物机体精氨酸主要有3个来源:一是来源于饲粮,饲粮中大约40%的精氨酸在小肠内直接被分解消化,其余进入机体循环(进入其他器官组织),这是精氨酸的最主要来源[5];二是来源于机体蛋白质的周转代谢,当动物禁食时高达80%精氨酸来源于机体蛋白质的分解;三是来源于机体内其他氨基酸如谷氨酸、脯氨酸等的转化(内源合成)。
以往动物生物化学及动物营养教科书上讲述的精氨酸内源合成部位是肝脏,但事实并不然,Li等[6]研究发现,精氨酸在肝脏中的含量为0.03~0.10 mmol/L,远低于其他氨基酸在肝脏中的含量(0.5~10.0 mmol/L)。瓜氨酸在精氨酸琥珀酸合成酶和精氨酸琥珀酸裂解酶的作用下转化为精氨酸,这2种酶在肝脏内的活性始终保持较高水平,但是转化成高浓度的精氨酸会负反馈调节精氨酸的生成,在精氨酸酶的作用下分解为鸟氨酸和尿素,以阻止精氨酸进入机体循环。血浆内的瓜氨酸和线粒体内的鸟氨酸是内源性精氨酸合成的前体物质,瓜氨酸是由肠吸收性上皮细胞分泌的。如图2所示,以猪为研究对象反映哺乳动物中瓜氨酸和精氨酸在各组织器官之间的代谢,与最近报道的精氨酸和瓜氨酸在人体内代谢模式相同[8]。由此可知,通过鸟氨酸循环后肝脏中的精氨酸将不存在净合成,这与Li等[6]研究结果一致。所以对于哺乳动物而言精氨酸的内源合成主要通过小肠-肾代谢轴完成。在成年动物机体内,小肠是瓜氨酸的合成场所,合成的瓜氨酸释放到其他组织中去合成精氨酸。肾脏的生化环境特别是精氨酸酶的低活性有利于精氨酸的合成[9, 10],在肾脏中精氨酸的合成部位是肾脏的皮质而85%精氨酸酶是在肾脏的髓质,所以肾脏是合成精氨酸的另一重要的场所,在成年动物机体内,由小肠分泌的瓜氨酸在肾近端小管内被精氨酸琥珀盐移解酶快速转化成精氨酸。幼年动物合成精氨酸的主要场所是小肠,Blachier等[11]研究发现,仔猪肠上皮细胞具有将瓜氨酸和鸟氨酸转化成精氨酸的能力。
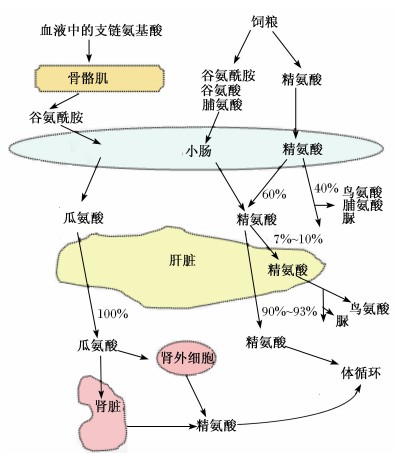 | 图2 瓜氨酸和精氨酸各器官之间的代谢关系
Fig.2 Metabolic relationship between citrulline and arginine in organs[7] |
精氨酸在哺乳动物和家禽机体内的吸收部位是有区别的,家畜主要靠小肠中段吸收,而家禽主要是由小肠前段、后段和胃吸收,且在特定的条件下嗉囊也可以吸收精氨酸[12]。Labelle等[13]研究认为,家禽机体内存在着一条专门吸收碱性氨基酸的途径,不同的碱性氨基酸如精氨酸、赖氨酸等竞争相同的碱性氨基酸载体形成拮抗[14, 15]。
精氨酸在哺乳动物机体内代谢途径如图3所示。精氨酸在动物体内直接代谢途径有2条:一是在精氨酸酶的作用下分解为鸟氨酸和尿素,鸟氨酸是合成多胺类物质的前体,多胺是重要的生物学调控物质,尤其与DNA、RNA以及蛋白质的生物代谢有关,在细胞生长、增殖及分化中起重要的作用[17];二是在一氧化氮酶(nitric oxide syntheses,NOS)的作用下,精氨酸被分解成等分子的瓜氨酸和NO,NO可以作为信号分子参与机体内多种调节包括免疫调节。另外,作为脒基转移反应的脒基供体,精氨酸、甘氨酸和蛋氨酸共同合成胍基乙酸和磷酸肌酸,肌酸能够在机体运动时迅速补充能量。精氨酸在禽类动物机体内的代谢途径是经过鸟氨酸循环生成氨后,再生成嘌呤,然后随嘌呤降解成尿酸而排出体外。小肠是精氨酸降解的主要场所。
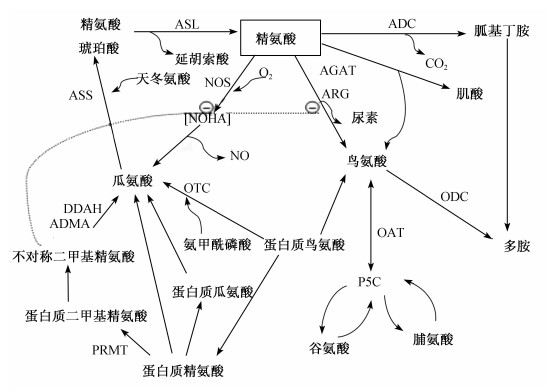 | 图3 哺乳动物机体内精氨酸的代谢途径 Fig.3 Metabolic pathway of arginine in mammals[16] ASL:精氨酸琥珀酸裂解酶argininosuccinate lyase;ADC:精氨酸脱羧酶arginine decarboxylase;AGAT:精-甘脒基转移 酶arginine-glycine amidinotransferase;ARG:精氨酸酶arginase;ASS:精氨酸琥珀酸合成酶argininosuccinate synthetase; DDAH:二甲基精氨酸二甲基水解酶dimethylarginine dimethylaminohydrolase;OAT:鸟氨酸转氨酶ornithine aminotransferase; ODC:鸟氨酸脱羧酶orniththine decarboxylase;OTC:鸟氨酸氨甲酰转移酶ornithine transcarbamylase;P5C:L-△1-吡咯啉- 5-羧酸盐L-△1-pyrroline-5-carboxylate;PRMT:蛋白质-精氨酸甲基转移酶protein-argininemethyltransferase;NOHA:羟 基-L-精氨酸hydroxy-Larginine |
精氨酸参与机体内免疫调节作用主要是通过“精氨酸酶”途径和“NO”途径。参与2条途径的底物均为精氨酸,如图3所示,2条途径之间存在着相互竞争抑制,如NOS可以产生精氨酸酶抑制剂(nor-NOHA),抑制精氨酸酶的活性。Cobert等[18]发现在一些寄生虫疾病如布氏锥虫病中,宿主通过NOS可产生大量的NO,对寄生虫具有明显的杀伤作用,同时寄生虫利用精氨酸酶产生的多胺合成自身的DNA。加入强效的nor-NOHA后,NO生成增加,寄生虫的数量也明显减少,这为解释精氨酸酶与NOS之间相互抑制提供了一个较好的例证。
精氨酸作为一种条件性必需氨基酸,可通过其代谢产物在动物机体内营养代谢调控中发挥重要的生物学功能。
精氨酸是动物机体内携带氮最多的氨基酸。动物代谢产生大量的氨,精氨酸可促进尿素循环,使血氨转换为尿素排除,维持体内氮的平衡。麻名文等[19]研究表明,饲粮中添加2.0%精氨酸能够显著提高断奶至2月龄生长肉兔的增重。Corzo等[20]研究雄性肉鸡精氨酸的需要时发现,饲粮中添加精氨酸能够显著提高42~56日龄雄性肉仔鸡的平均日采食量和平均日增重。刘凤菊等[21]研究饲粮中精氨酸的水平对1~3周龄雌性爱拔益加(AA)肉仔鸡的影响时发现,精氨酸水平极显著地影响1~3周龄肉仔鸡的体重和平均日增重。方勇军[22]研究发现,在低精氨酸饲粮基础上添加精氨酸可显著影响肉鸭的生长性能,提高了肉鸭的平均日采食量和平均日增重,随着添加水平提高,平均日增重上升,添加水平为1.12%时,增重效果最好。朱伟等[23]研究循环高温环境下精氨酸营养对肉鸭生长性能的影响发现,添加0.5%精氨酸可显著降低肉鸭生长全期(1~49日龄)的料重比。姚康等[24]研究表明,在哺乳仔猪基础饲粮中添加0.6%和0.8%精氨酸与对照组相比,7~14日龄的平均日增重分别提高了54.3%和53.3%,14~21日龄0.6%和0.8%精氨酸添加组平均日增重比对照组提高了45.4%和44.9%。Yao等[25]在7日龄仔猪饲粮中添加0.6%的精氨酸,显著提高了平均日增重,促进了肌肉蛋白质的合成。Kim等[26]研究在7~21日龄仔猪饲粮中添加0.2%和0.4%精氨酸,通过人工乳饲喂系统进行喂养,结果发现平均日增重比对照组分别提高了28%和66%。范苗[27]研究得到相似的结果,添加不同水平的精氨酸与对照组相比提高了7~21日龄的平均日增重。杨慧等[28]研究发现,在断奶仔猪基础饲粮中添加1%的精氨酸能够显著提高仔猪的平均日采食量和平均日增重,显著降低料重比。由此可见,动物饲粮中添加适宜的精氨酸能够有效提高平均日采食量和平均日增重,降低料重比,改善动物的生长性能。
饲粮中添加精氨酸能够刺激线粒体的生物合成,同时增加葡萄糖和脂肪的氧化,从而降低动物胴体的脂肪率[29]。Tan等[30]研究在110日龄的公猪饲粮中添加1.00%和2.05%精氨酸,结果发现添加2.05%精氨酸组与添加1.00%精氨酸组相比血液中甘油三脂含量极显著降低了20.0%,胰高血糖素含量显著提高了36.0%,胴体肌肉含量显著提高了5.5%,胴体脂肪含量极显著降低了11.0%。Tan等[31]研究在110日龄猪基础饲粮中添加1.0%精氨酸,试验期60 d,结果显示肌肉组织中脂肪酸合成酶mRNA表达水平极显著提高了467%,脂肪组织中脂蛋白脂肪酶、葡糖糖载体转运蛋白4和乙酰辅酶A羧化酶α mRNA表达水平分别显著降低了49%、51%和38%。所以精氨酸能对肌肉组织和脂肪组织中与脂肪代谢相关的基因进行差异调控,促进肌肉组织中脂肪的沉积及脂肪组织中脂肪的分解,这就可以进一步解释Tan等[31]的研究结果,即精氨酸显著提高胴体肌肉含量和显著降低胴体脂肪含量。吴琛等[32]研究发现,添加精氨酸组与对照组相比,环江香猪瘦肉率显著提高了15.0%,脂肪率及背最长肌中粗脂肪含量分别显著降低了34.6%和35.1%。刘凤菊等[21]研究饲粮中精氨酸的水平对1~3周龄雌性AA肉仔鸡的影响发现,添加精氨酸能够提高胸肌率及降低胸肌内脂肪含量。所以精氨酸能够提高胴体的肌肉率,降低机体内脂肪的含量。
精氨酸是NO、多胺和谷氨酰胺的前体物,在动物机体内可以由NOS催化生成具有生物活性的NO,NO能激活肠道黏膜上的黏着斑激酶(FAK),而黏膜上的踝蛋白、肌动蛋白等蛋白质可被FAK激活,进而参与上皮细胞的迁移,形成新的上皮细胞,促进黏膜修复[33]。Yao等[34]研究在单笼饲养21日龄断乳阉割仔猪的基础饲粮中添加0和1%的精氨酸,试验期7 d,结果显示,添加1%精氨酸组与对照组相比小肠的相对重量显著提高了33%,十二指肠、空肠和回肠的绒毛高度分别显著提高了21%、28%和25%。Wu等[35]研究在21日龄哺乳仔猪基础饲粮中添加0.6%精氨酸,试验期7 d,结果显示,与对照组相比添加0.6%精氨酸组显著提高肠道重量,十二指肠、空肠和回肠的绒毛高度及隐窝深度,显著提高空肠和回肠的杯状细胞的数量。Puiman等[36]研究发现,精氨酸可以诱导新生仔猪肠黏膜生长。孟国权等[37]研究发现,精氨酸可通过降低肠黏膜中内皮质激素-1(ET-1)的含量和降低机体的过氧化水平来缓解脂多糖(LPS)免疫应激导致的肠道黏膜屏障损伤。Liu等[38]研究发现,精氨酸可以通过增加回肠乳糖酶活性、十二指肠和回肠二胺氧化酶活性,改善由LPS免疫应激造成空肠丙二醛含量增加的情况,还可改善由LPS免疫应激造成的回肠超氧化物歧化酶(SOD)活性增强的情况。郭长义等[39]研究泌乳母猪饲粮精氨酸对哺乳仔猪小肠黏膜发育的影响及抗氧化作用机理,结果发现添加精氨酸可以改善肠道黏膜的发育(如黏膜绒毛高度、隐窝深度),同时还可提高黏膜乳糖酶、碱性磷酸酶和谷胱甘肽酶(GSH-Px)的活性,降低了SOD的活性,所以精氨酸可能通过改善肠道的抗氧化能力从而促进哺乳仔猪肠道的发育。谭碧娥等[40]研究在7日龄断乳仔猪基础饲粮中添加0、0.2%、0.4%、0.6%和0.8%精氨酸,结果发现精氨酸能够促进超早断乳仔猪肠道的发育,阻止肠绒毛萎缩,提高肠道白细胞介素-2(IL-2)基因表达水平,增强肠道免疫功能。Tan等[41]等研究发现,精氨酸能够通过雷帕霉素靶蛋白(mTOR)和Toll样受体(TLR)4信号通路机制等来改善受LPS抑制的肠细胞增殖。陈渝等[42]研究精氨酸对免疫应激(24±1)日龄、体重在(7.19±0.63) kg的仔猪的生长性能和肠道组织细胞膜外TLR2、TLR4、TLR5和TLR6基因表达的影响,结果表明,精氨酸能够显著减缓因沙门氏杆菌活疫苗注射引起的断乳仔猪肠道TLR4和TLR5基因的过度表达及血清白细胞介素-6(IL-6)含量升高,从而缓解免疫应激对仔猪的损伤。Liu等[43]研究精氨酸对LPS诱导断奶仔猪的肠道损伤是否具有缓解作用时,结果发现添加0.5%和1.0%精氨酸显著缓解肠道形态(如绒毛高度、隐窝深度等)发育受阻的状况,且添加0.5%精氨酸组显著改善隐窝细胞增殖减少,极显著改善绒毛细胞的凋亡状况;添加0.5%精氨酸组减缓了LPS诱导造成空肠IL-6 mRNA表达水平的增加,显著减缓了空肠和回肠的肿瘤坏死因子-α(TNF-α)mRNA表达水平增的加;添加1.0%精氨酸组减缓了LPS诱导造成空肠IL-6 mRNA表达水平的增加和极显著减缓了空肠TNF-α mRNA表达水平的增加;添加0.5%精氨酸组增加了十二指肠、空肠和回肠的过氧化物酶体增殖物激活受体γ(PPARγ)mRNA表达水平,所以添加精氨酸能够缓解LPS诱导造成的肠道损伤。赵宏丽等[44]研究发现,在细毛断奶羔羊基础饲粮中添加不同水平的瘤胃保护性精氨酸和N-氨甲酰谷氨酸对肠道黏膜蛋白质合成率具有提高作用,其中精氨酸添加1.5 g/d剂量较好。所以添加适宜水平的精氨酸能够从基因水平及肠黏膜酶活性等方面来改善肠道形态的发育。
精氨酸是动物机体内一种十分重要的碱性氨基酸,不仅参与精子的形成,还是精子蛋白质的重要组成成分。另外,精氨酸可调节母畜生殖道内环境的酸碱度,提高其后代的母畜比例。岳斌等[45]用5%精氨酸处理母牛子宫后,奶牛受胎率达到83.5%,高于常规人工受精受胎率(82.0%),由此说明精氨酸不会对母牛受胎率产生不良的影响;产母犊率高达70.66%,比常规人工授精产母犊率(49.40%)高21.36%,所以精氨酸可在不影响受胎率的情况下提高产母犊率。杨慧等[46, 47]研究发现,在妊娠母猪(从配种到分娩)饲粮中添加不同水平精氨酸可以提高窝产活仔数和初生窝重,添加不同水平的精氨酸对妊娠后期母猪血液的生化指标影响明显,饲粮中添加精氨酸可提高泌乳母猪血清中部分氨基酸浓度,改善泌乳母猪的新陈代谢和免疫机能,在提高仔猪生长性能的同时缩短了母猪断奶后的发情间隔。Mateo等[48]在妊娠30 d母猪的玉米-豆粕型基础饲粮中添加1.0%精氨酸盐酸盐,同时对照组添加1.7%丙氨酸做等氮对照,结果发现精氨酸组与对照组相比能够增加22%存活产仔数并增加24%存活仔猪的初生重。Zeng等[49]研究发现,精氨酸能够提高活胚胎数,同时增加足月分娩的产仔数,这对预防早期流产具有重要生产指导意义。Greene等[50]研究发现,精氨酸可以通过增强胎盘中血管内皮生长因子受体2(VEGFR2)基因的转录活性来增强生殖性能。同时,Liu等[51]研究发现,母猪妊娠后期饲粮中添加1%精氨酸能提高了母猪的繁殖性能,可能通过影响母猪脐静脉和胎盘miRNA-15b、miRNA-22的表达,调控其各自靶基因的表达量,从而调节脐静脉和胎盘的血管生成、发育和功能,母体可通过脐静脉和胎盘提供更多的养分给胎儿,保证胎儿的存活、生长和发育。所以精氨酸能够提高种畜的繁殖性能。
精氨酸及其代谢产物在机体免疫调节、免疫防御等方面发挥着重要的作用。精氨酸主要是通过“精氨酸酶”途径和“NO”途径这2条代谢途径及调节内分泌来调节机体免疫。精氨酸在精氨酸酶的作用下,促进机体蛋白质的合成,改善机体内的氮平衡,从而提高机体免疫功能。精氨酸通过NOS催化生成NO,引起组织血管的扩张,维持血流通畅并能调控机体免疫反应[52]。精氨酸还可促进垂体分泌生长激素和催乳素,促进胰腺分泌胰岛素、生长抑素和胰多肽等,来促进蛋白质的合成间接的发挥免疫调节作用。
许多研究报道精氨酸可以促进动物的中枢免疫器官如胸腺和法式囊(禽类)的发育,同时也可以促进动物外周免疫器官如脾脏的发育。Kwak等[53]研究发现,在鸡的基础饲粮中额外添加精氨酸可显著影响鸡的免疫器官如胸腺、脾脏和法氏囊的发育。闫伟等[54]研究发现,在扬州鹅的基础饲粮中添加适宜的精氨酸可增加免疫应激鹅的脾脏和法氏囊指数。麻名文等[19]研究发现,饲粮精氨酸水平显著影响肉兔的胸腺指数,而对脾脏指数影响不显著。师昆景等[55]研究发现,胚蛋注射精氨酸可以一定程度上提高法氏囊和脾脏的重量及指数,但对胸腺的影响不明显。所以精氨酸对不同品种、不同年龄及不同健康状况的动物的免疫器官的影响不同。
许多研究表明精氨酸可以促进淋巴细胞增殖、分化及合成细胞因子。Han等[56]研究发现,精氨酸可以通过提高淋巴细胞的百分比及血清IL-2和干扰素-γ(IFN-γ)的表达水平来缓解环磷酰胺对仔猪造成的免疫应激。Tan等[57]研究发现,在基础饲粮中添加精氨酸可以白细胞、细胞因子和抗体的产生来增强仔猪的细胞免疫和体液免疫,以此提高仔猪的免疫力。谭玲芳等[58]研究发现,饲粮中添加一定量的精氨酸能够显著提高血清中免疫球蛋白M(IgM)的含量。柏美娟等[59]研究发现,饲粮中添加1%的精氨酸可以增加单核细胞数和百分比,增加淋巴细胞的百分比和增殖活性,增加血清免疫球蛋白G(IgG)的含量,增加脾脏IL-2和IFN-γ的表达水平。Li等[60]研究发现,精氨酸可能是通过抑制TLR4信号途径降低肝促炎性细胞因子和自由基的释放来保护肝脏。
随着对精氨酸的营养生理及免疫作用研究的日益深入,精氨酸的生物学功能已经超出了普通氨基酸的功能范畴。随着抗生素的禁用,研究者正在努力的寻找抗生素的替代品,精氨酸作为一种营养免疫剂将会在动物生产中发挥越来越重要的作用。但对于不同品种、不同年龄及不同健康状况的动物而言,精氨酸的需要量及精氨酸的作用机制尚需要大量的研究逐步解决,以使精氨酸发挥最优的营养生理及免疫作用,促进动物生产健康绿色发展。
| [1] | GENG M M, LI T J, KONG X F, et al.Reduced expression of intestinal N-acetylglutamate synthase in sucling piglets:a novel molecular mechanism for arginine as a nutritionally essential amino acid for neonates[J]. Amino Acids, 2011, 40(5):1513-1522. ( 1) 1)
|
| [2] | TAMIR H, RATNER S.Enzymes of arginine metabolism in chicks[J]. Archives of Biochemistry and Biophysics, 1963, 102(2):249-258. ( 1) 1)
|
| [3] | WU G Y, JAEGER L A, BAZER F W, et al.Arginine deficiency in preterm infants:biochemical mechanisms andnutritional implications[J]. The Journal of Nutritional Biochemistry, 2004, 15(8):442-451. ( 1) 1)
|
| [4] | EFRON D, BARBUL A.Role of arginine in immunonutrition[J]. Journal of Gastroenterology, 2000, 35(Suppl.12):20-23. ( 1) 1)
|
| [5] | WANG W W, QIAO S Y, LI D F.Amino acids and gut function[J]. Amino Acids, 2009, 37(1):105-110. ( 1) 1)
|
| [6] | LI P, KIM S W, LI X, et al.Dietary supplementation wit cholesterol and docosahexaenoic acid increases the activity of the arginine-nitric oxide pathway in tissues of young pigs[J]. Nitric Oxide, 2008, 19(3):259-265. ( 2) 2)
|
| [7] | WU G Y, BAZER F W, DAVIS T A, et al.Important roles for the arginine family of amino acids in swine nutrition and production[J]. Livestock Science, 2007, 112(1/2):8-22. ( 1) 1)
|
| [8] | LIGTHART-MELIS G C, VAN DE POLL M C G, BOELENS P G, et al.Glutamine is an important precursor for de novo synthesis of arginine in humans[J]. American Society for Clinical Nutrition, 2008, 87(5):1282-1289. ( 1) 1)
|
| [9] | ROGERS Q R, FREEDLAND R A, SYMMONS R A.In vivo synthesis and utilization of arginine in the rat[J]. American Journal of Physiology, 1972, 223(1):236-240. ( 1) 1)
|
| [10] | SZEPESI B, AVER E H, FREEDLAND R A, et al.Role of kidney in luconeogenesis and amino acid excretion[J]. American Journal of Physiology, 1970, 219:1627-1631. ( 1) 1)
|
| [11] | BLACHIER F, M'RABET-TOUIL H, POSHO L, et al.Intestinal arginine metabolism during development[J]. European Journal of Biochemistry, 1993, 216(1):109-117. ( 1) 1)
|
| [12] | 石现瑞, 王恬.家禽体内精氨酸功能研究进展[J]. 中国饲料, 2003(4):12-14. ( 1) 1)
|
| [13] | LABELLE W C, MILLER D S, LERNER J, et al.Interactions between leucine and arginine transport in chicken small intestine[J]. Biochemical and Biophysical Research Communications, 1971, 45(1):131-137. ( 1) 1)
|
| [14] | CLOSS E I, SIMON A, VÉKONY N, et al.Plasma membrane transporters for arginine[J]. The Journal of Nutrition, 2004, 134(Suppl.10):2752-2759. ( 1) 1)
|
| [15] | BALL R O, URSCHEL K L, PENCHARZ P B.Nutritional consequences of interspecies differences in arginine and lysine metabolism[J]. The Journal of Nutrition, 2007, 137(Suppl.2):1626S-1641S. ( 1) 1)
|
| [16] | MORRIS S M, Jr.Arginine metabolism:boundaries of our knowledge[J]. The Journal of Nutrition, 2007, 137(Suppl.2):1602S-1609S. ( 1) 1)
|
| [17] | NIEVES C Jr, ANGKAMP-HENKEN B.Arginine and immunity:a unique perspective[J]. Biomedicine Pharmacotherrapy, 2002, 56(10):471-482. ( 1) 1)
|
| [18] | GOBERT A P, DAULOUEDE S, LEPOIVRE M, et al.L-aginine availability modulates local nitric oxide production and parasite illing inn experimental trypanosomiasis[J]. Infection and Immunity, 2000, 68(8):4653-4657. ( 1) 1)
|
| [19] | 麻名文, 李福昌.日粮精氨酸水平对断奶-2月龄肉兔生长性能、免疫器官指数及血清指标的影响[J]. 动物营养学报, 2009, 21(3):405-410. ( 2) 2)
|
| [20] | CORZO A, MORAN E T, Jr, HOEHLER D.Arginine need of heavy broiler males applying the ideal protein concept[J]. Poultry Science, 2003, 82(3):402-407. ( 1) 1)
|
| [21] | 刘凤菊, 呙于明, 王磊.1-3周龄雌性肉仔鸡精氨酸需要量[J]. 动物营养学报, 2011, 23(4):571-577. ( 2) 2)
|
| [22] | 方勇军.精氨酸对肉鸭生长性能、免疫机能、胴体品质和血液脂质的影响[D]. 硕士学位论文.武汉:武汉工业学院, 2009:19-21. ( 1) 1)
|
| [23] | 朱伟, 姜威, 李新杰, 等.精氨酸对夏季旱养肉鸭生长性能和免疫器官的影响[J]. 粮食与饲料工业, 2013(1):49-52. ( 1) 1)
|
| [24] | 姚康, 褚武英, 邓敦, 等.不同精氨酸添加水平对哺乳仔猪生长性能的影响[J]. 天然产物研究与开发, 2008, 20(1):121-124. ( 1) 1)
|
| [25] | YAO K, YIN Y L, CHU W Y, et al.Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs[J]. The Journal of Nutrion, 2008, 138(5):867-872. ( 1) 1)
|
| [26] | KIM S W, MCPHERSON R L, WU G Y.Dietary arginine supplementation enhances the growth of milk-fed young pigs[J]. The Journal of Nutrition, 2004, 134(3):625-630. ( 1) 1)
|
| [27] | 范苗.添加不同水平的精氨酸对新生仔猪生长性能、免疫性能及胃肠道发育的影响[D]. 硕士学位论文.保定:河北农业大学, 2011:15. ( 1) 1)
|
| [28] | 杨慧, 林伯全, 张力, 等.L-精氨酸和乳酸菌对早期断奶仔猪生长性能、血液生化指标和小肠黏膜形态的影响[J]. 福建农林大学学报:自然科学版, 2012, 41(4):514-519. ( 1) 1)
|
| [29] | 孔祥峰, 印遇龙, 伍国耀.猪功能性氨基酸营养研究进展[J]. 动物营养学报, 2009, 21(1):1-7. ( 1) 1)
|
| [30] | TAN B E, YIN Y L, LIU Z Q, et al.Dietary L-arginine supplementation increases muscle gain and reduces body fat mass in growing-finishing pigs[J]. Amino Acids, 2009, 37(1):169-175. ( 1) 1)
|
| [31] | TAN B E, YIN Y L, LIU Z Q, et al.Dietary L-arginine supplementation differentially regulates expression of lipid-metabolic genes in porcine adipose tissue and skeletal muscle[J]. The Journal of Nutritional Biochemistry, 2011, 22(5):441-445. ( 2) 2)
|
| [32] | 吴琛, 刘俊锋, 孔祥峰, 等.饲粮精氨酸与丙氨酸对环江香猪肉质、氨基酸组成及抗氧化功能的影响[J]. 动物营养学报, 2012, 24(3):528-533. ( 1) 1)
|
| [33] | TURNER P, DEAR J, SCADDING G, et al.Role of kinins in seasonal allergic rhinitis:icatibant, a bradykinin B2 receptor antagonist, abolishes the hyperresponsiveness and nasal eosinophilia induced by antigen[J]. Journal of Allergy and Clinical Immunology, 2001, 107(1):105-113. ( 1) 1)
|
| [34] | YAO K, GUAN S, LI T J, et al.Dietary L-arginine supplementation enhances intestinal development and expression of vascular endothelial growth factor in weanling piglets[J]. British Journal of Nutrition, 2011, 105(5):703-709. ( 1) 1)
|
| [35] | WU X, RUAN Z, GAO Y L, et al.Dietary supplementation with L-arginine or N-carbamylglutamate enhances intestinal growth and heat shock protein-70 expression in weanling pigs fed a corn-and soybean meal-based diet[J]. Amino Acids, 2010, 39(3):831-839. ( 1) 1)
|
| [36] | PUIMAN P J, STOLL B, VAN GOUDOEVER J B, et al.Enteral arginine does not increase superior mesenteric arterial blood flow but induces mucosal growth in neonatal pigs[J]. The Journal of Nutrition, 2011, 141(1):63-70. ( 1) 1)
|
| [37] | 孟国权, 刘玉兰, 车政权, 等.L-精氨酸对脂多糖诱导的断奶仔猪肠道黏膜屏障损伤的缓解作用[J]. 动物营养学报, 2010, 22(3):647-652. ( 1) 1)
|
| [38] | LIU Y L, HAN J, HUANG J J, et al.Dietary L-arginine supplementation improves intestinal function in weaned pigs after an Escherichia coli lipopolysaccharide challenge[J]. Asian-Australasian Journal of Animal Sciences, 2009, 22(12):1667-1675. ( 1) 1)
|
| [39] | 郭长义, 蒋宗勇, 李职, 等.泌乳母猪饲粮精氨酸水平对哺乳仔猪小肠黏膜发育的影响[J]. 动物营养学报, 2010, 22(4):870-878. ( 1) 1)
|
| [40] | 谭碧娥, 李新国, 孔祥峰, 等.精氨酸对早期断奶仔猪肠道生长、组织形态及IL-2基因表达水平的影响[J]. 中国农业科学, 2008, 41(9):2783-2788. ( 1) 1)
|
| [41] | TAN B, YIN Y L, ONG X F, et al.L-Arginine stimulates proliferation and prevents endotoxin-induced death of intestinal cells[J]. Amino Acids, 2010, 38(4):1227-1235. ( 1) 1)
|
| [42] | 陈渝, 陈代文, 毛湘冰, 等.精氨酸对免疫应激仔猪肠道组织Toll样受体基因表达的影响[J]. 动物营养学报, 2011, 23(9):1527-1535. ( 1) 1)
|
| [43] | LIU Y L, HUANG J J, HOU Y Q, et al.Dietary arginine supplementation alleviates intestinal mucosal disruption induced by Escherichia coli lipopolysaccharide in weaned pigs[J]. British Journal of Nutrition, 2008, 100(3):552-560. ( 1) 1)
|
| [44] | 赵宏丽, 孙海洲, 李金霞, 等.瘤胃保护性精氨酸及N-氨甲酰谷氨酸对细毛羊肠道黏膜蛋白质合成率的影响[J]. 动物营养学报, 2012, 24(11):2141-2147. ( 1) 1)
|
| [45] | 岳斌, 于艺辉.性控胶囊与精氨酸在奶牛性别控制中的应用试验[J]. 中国奶牛, 2012(1):21-22. ( 1) 1)
|
| [46] | 杨慧, 林登峰, 王恬, 等.饲粮中添加不同水平L-精氨酸对妊娠母猪繁殖性能及血液生化指标的影响[J]. 动物营养学报, 2012, 24(10):2013-2020. ( 1) 1)
|
| [47] | 杨慧, 林登峰, 林伯全, 等.饲粮中添加不同水平L-精氨酸对泌乳母猪生产性能、血清氨基酸浓度和免疫生化指标的影响[J]. 动物营养学报, 2012, 24(11):2103-2109. ( 1) 1)
|
| [48] | MATEO R D, WU G Y, BAZER F W, et al.Dietary L-arginine supplementation enhances the reproductive performance of gilts[J]. The Journal of Nutrition, 2007, 137(3):652-656. ( 1) 1)
|
| [49] | ZENG X F, WANG F L, FAN X, et al.Dietary arginine supplementation during early pregnancy enhances embryonic survival in rats[J]. The Journal of Nutrition, 2008, 138(8):1421-1425. ( 1) 1)
|
| [50] | GREENE J M, DUNAWAY C W, BOWERS S D, et al.Dietary L-arginine supplementation during gestation in mice enhances reproductive performance and vegfr2 transcription activity in the fetoplacental unit[J]. The Journal of Nutrition, 2012, 142(3):456-460. ( 1) 1)
|
| [51] | LIU X D, WU X, YIN Y L, et al.Effects of dietary L-arginine or N-carbamylglutamate supplementation during late gestation of sows on the miR-15b/16, miR-221/222, VEGFA and eNOS expression in umbilical vein[J]. Amino Acids, 2012, 42(6):2111-2119. ( 1) 1)
|
| [52] | LUIKING Y C, ENGELEN M P, DEUTZ N E, et al.Regulation of nitric oxide production in health and disease[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2010, 13(1):97-104. ( 1) 1)
|
| [53] | KWAK H, AUSTIC R E, DIETERT R R.Influence of dietary arginine concentration on lymphoid organ growth in chickens[J]. Poultry Science, 1999, 78(11):1536-1541. ( 1) 1)
|
| [54] | 闫伟, 施寿荣, 杨海明, 等.L-精氨酸对脂多糖刺激仔鹅生长发育的影响[J]. 动物营养学报, 2010, 22(4):1071-1075. ( 1) 1)
|
| [55] | 师昆景, 吴灵英, 谭荣炳.胚胎注射L-精氨酸和L-鸟氨酸对肉仔鸡早期生长、免疫器官及血浆激素T3、T4的影响[J]. 中国家禽, 2008, 30(17):25-28. ( 1) 1)
|
| [56] | HAN J, LIU Y L, FAN W, et al.Dietary L-arginine supplementation alleviates immunosuppression induced by cyclophosphamide in weaned pigs[J]. Amino Acids, 2009, 37(4):643-651. ( 1) 1)
|
| [57] | TAN B E, LI X G, KONG X F, et al.Dietary L-arginine supplementation enhances the immune status in early-weaned piglets[J]. Amino Acids, 2009, 37(2):323-331. ( 1) 1)
|
| [58] | 谭玲芳, 王安, 李越, 等.精氨酸对笼养生长期蛋鸭生长性能及免疫功能的影响[J]. 中国饲料, 2013(7):15-18. ( 1) 1)
|
| [59] | 柏美娟, 孔祥峰, 印遇龙, 等.日粮添加精氨酸对肥育猪免疫功能的调节作用[J]. 扬州大学学报:农业与生命科学版, 2009, 30(3):45-49. ( 1) 1)
|
| [60] | LI Q, LIU Y L, CHE Z Q, et al.Dietary L-arginine supplementation alleviates liver injury caused by Escherichia coli LPS in weaned pigs[J]. Innate Immunity, 2012, 18(6):804-814. ( 1) 1)
|




