2. 上海医学生命科学研究中心有限公司, 上海 200032
2. Shanghai Medical Life Science Research Center Co., Ltd., Shanghai 200032, China
脂肪肝综合征(fatty liver syndrome,FLS)是高峰期产蛋鸡常见的一种营养代谢性疾病(发病率>15%),一般发病突然、死亡率高(有时高达30%)。患病蛋鸡较难出现产蛋高峰,因而给蛋鸡养殖业带来较大的经济损失。肝脏是家禽脂质代谢的主要场所,产蛋鸡易发生FLS,这与其脂质代谢旺盛、肝细胞中线粒体数量减少有关。研究表明,脂肪肝在某种程度上就是一种线粒体疾病,线粒体中脂肪酸β氧化减少、氧化应激和炎性细胞因子生成增加等所形成的恶性循环是脂肪肝发生的主要病理过程[1]。临床研究表明,通过药物或饮食缓解线粒体内氧化应激,改善线粒体功能,增加脂肪酸β-氧化等可减轻肝脂变[2]。调节产蛋鸡肝脏线粒体功能能否降低FLS发生,目前尚不清楚。
吡咯喹啉醌(pyrroloquinoline quinine,PQQ)是20世纪60年代发现的一种新型维生素,可改善线粒体功能。研究表明,PQQ能增加线粒体数量,减少其损伤,在治疗心血管疾病[3]、神经退行性疾病[4]、肝损伤[5]等线粒体相关疾病方面有重要作用。PQQ可通过提高抗氧化酶活性或直接中和自由基[6],减少机体氧化损伤[7];线粒体受损时,PQQ能激活线粒体合成通路,促进其快速再生,维持细胞内线粒体动态平衡[8]。本实验室前期研究表明,PQQ能提高蛋鸡体内抗氧化机能,饲粮中添加PQQ能减少高能低蛋白质饲粮引起的蛋鸡脂肪肝。因此,本试验旨在研究饲粮添加不同剂量PQQ对人工诱导(高能低蛋白质饲粮)FLS产蛋鸡的肝脂质代谢和抗氧化作用、肝脏线粒体数量和功能及肝脏组织病理变化的影响,确定其改善肝脏脂质代谢和抗氧化作用是否与肝脏线粒体功能有关,从而探讨PQQ在预防蛋鸡脂肪肝发生过程中可能作用机制。
PQQ由微生物发酵制成,纯度>99.9%,由上海医学生命科学研究中心有限公司提供。
选择产蛋率、体重相近的29周龄海兰褐蛋鸡288只,随机分成4个组(Ⅰ、Ⅱ、Ⅲ、Ⅳ组),每个组6个重复,每个重复12只鸡。预试期1周,正试期4周。Ⅰ组为对照组,饲喂玉米-豆粕型基础饲粮;Ⅱ组为病理模型组,饲喂高能低蛋白质饲粮;Ⅲ和Ⅳ组为PQQ预防组,分别在Ⅱ组的高能低蛋白质饲粮基础上添加0.08和0.16 mg/kg的PQQ。
对照组饲粮参照NRC(1994)和《鸡的饲养标准》(NY/T 33—2004),结合海兰褐蛋鸡饲养手册,配制玉米-豆粕型粉状饲粮;试验组饲粮除能量、粗蛋白质含量不参照上述标准外其他均以此为标准配制而成(表1)。
| 表1 饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) % |
采用半开放式鸡舍3层立体笼养,人工补光加自然光照,人工补光的光照强度20 lx,总光照时间16 h/d;相对湿度50%~90%,自然通风与横向负压通风结合。每天布料2次,匀料4次,自由采食和饮水。每日捡蛋2次,清粪2次,每周消毒1次。常规防疫和管理。
试验结束时,每重复随机选取体重相近的蛋鸡1只,屠宰,采血,通过3 000 r/min离心10 min制备血浆,-30 ℃冻存;取5~8 cm肝组织块,置10%福尔马林溶液中固定,用于肝组织病理检查;另取相同部位肝脏5 g,锡箔纸包装,液氮速冻,-80 ℃保存。
采用黄嘌呤氧化酶法测定肝脏总超氧化物歧化酶(T-SOD)的活性,硫代巴比妥酸(TBA)法测定肝脏丙二醛(MDA)含量;比色法测定血浆谷丙转氨酶(ALT)、谷草转氨酶(AST)活性,二喹啉甲酸(BCA)法测定肝匀浆中总蛋白含量,试剂盒均购自南京建成生物工程研究所。制备肝匀浆:取-80 ℃冻肝0.5 g,按重量体积比1∶ 9加入磷酸盐缓冲液,用IKA T10高速组织匀浆机匀浆,3 500 r/min离心10 min,取上清待测。
采用磷酸甘油氧化酶(GPO-PAP)法测定肝脏中TG和TC含量,试剂盒购自北京北化康泰临床试剂有限公司。制备肝匀浆液:参照Folch等[9]法并略有改动。取0.1 g冻肝样,加入20倍体积的氯仿-甲醇(2∶ 1,V/V)混合液,匀浆并过滤。向滤液中加入0.2倍体积的0.37% KCl溶液,弃上层溶液,用氯仿-甲醇-水(3∶ 48∶ 47,V/V/V)混合液洗涤2次。取肝匀浆用上述试剂盒测定。
用实时荧光定量PCR(RT-PCR)方法测定肝脏线粒体相对含量:切取肝组织块,按照试剂盒(QIAamp DNA Mini Kit,Qiagen)说明,提取DNA(包括线粒体DNA和核DNA)。分别测定β-肌动蛋白(β-actin)和线粒体ATP合酶亚基8(ATP synthase subunit 8,ATP 8)基因。核DNA和线粒体ATP 8定量,分别用10和0.1 ng DNA做模板。
根据基因库(GenBank)发表的ATP 8和β-actin基因序列,通过美国国家生物技术信息中心(NCBI)的Primer-BLAST软件设计引物(表2),由北京天一辉远生物科技有限公司合成。
| 表2 目的基因及内参基因RT-PCR引物 Table 2 RT-PCR primes of target gene and reference gene |
在CFX96实时荧光定量PCR检测仪(CFX96 RT-PCR Detection System,Bio-Rad Laboratories,Hercules,CA,USA)进行RT-PCR反应。反应条件:循环1为94 ℃ 30 s;循环2分3步,即94 ℃ 5 s,57 ℃ 15 s,72 ℃ 10 s,重复40次;从65 ℃逐步升温到95 ℃采集熔解曲线。线粒体相对含量的计算方法采用2-ΔΔCt线粒体/核,其中:ΔΔCt线粒体/核=ΔCt线粒体/核(校准样)-ΔCt线粒体/核(测样),ΔCt线粒体/核=Ct线粒体-Ct核。
线粒体分离试剂盒分离线粒体,用双抗体夹心法测定肝细胞线粒体中柠檬酸合酶(CS)和细胞色素C氧化酶(CCO)活性,用购自南京建成生物工程研究所的试剂盒测定。肝匀浆制备方法同前。
将固定于10%福尔马林溶液中的肝脏组织块切取适宜大小,常规石蜡包埋,苏木精-伊红(HE)染色,光镜观察,对肝组织病理变化进行评分。切片由北京集思卓扬生物科技公司操作。
所有数据首先经Excel 2003处理,采用SPSS 16.0的one-way ANONA程序统计分析,Duncan氏法进行多重比较,P<0.05为差异显著。
由图 1可知,Ⅰ组蛋鸡肝细胞、肝小叶结构正常,肝细胞大小均匀,未见炎性病灶和肝细胞脂肪变性。Ⅱ组蛋鸡肝小叶结构尚存,部分肝细胞索结构消失,肝细胞排列紊乱;局部汇管区、中央静脉周围可见大量炎性细胞浸润;小血管瘀血明显,局部肝窦隙中可见少量红细胞;局部肝细胞中空泡样变性和气球样变性。PQQ添加组(Ⅲ、Ⅳ组)均表现出不同程度减轻,肝小叶结构基本正常,部分肝索排列紊乱,未见炎症病灶,有轻微的脂肪滴存在。
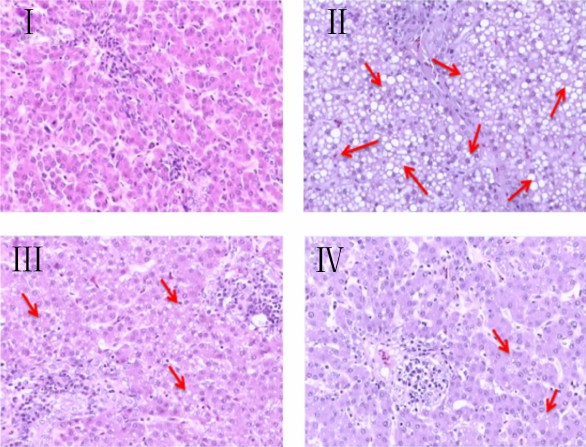 | 图 1 各组肝脏组织病理学观察 Fig.1 Liver histopathological observation in all groups |
由表3可知,对于肝脂质代谢指标,与Ⅰ组相 比,Ⅱ组肝脏TG和TC含量显著升高63.07%和137.13%(P<0.05),Ⅲ、Ⅳ组肝脏TG、TC含量与Ⅰ组差异不显著(P>0.05);与Ⅱ组相比,Ⅲ组肝脏TG和TC含量显著降低(P<0.05),Ⅳ组肝脏TG含量显著降低(P<0.05),TC含量虽有降低,但统计学上差异不显著(P>0.05);Ⅲ与Ⅳ组之间肝脏中TG、TC含量差异不显著(P>0.05)。
| 表3 饲粮PQQ对脂肪肝蛋鸡肝脂质代谢和肝功能的影响 Table 3 Effects of dietary PQQ on liver lipid profiles and liver function of fatty liver laying hens |
对于肝功能指标,与Ⅰ组相比,Ⅱ组血浆中AST和ALT活性未发生显著变化(P>0.05),Ⅲ和Ⅳ组的ALT活性显著低于Ⅰ、Ⅱ组(P<0.05);Ⅲ、Ⅳ组之间没有显著差异(P>0.05)。
可见,高能低蛋白质饲粮引起的肝脏中TG、TC含量变化,在添加PQQ(Ⅲ、Ⅳ组)后得到显著改善,添加PQQ为0.08或0.16 mg/kg时没有显著差异。高能低蛋白质饲粮并未引起血浆AST和ALT活性的显著升高。
由表4可知,与Ⅰ组相比,Ⅱ组肝脏中MDA含量显著升高了62.50%(P<0.05),肝脏中T-SOD活性显著降低了24.84%(P<0.05);与Ⅱ组相比,Ⅲ、Ⅳ组肝脏中MDA含量显著降低(P<0.05),肝脏中T-SOD活性显著升高(P<0.05);Ⅲ、Ⅳ组之间肝脏中T-SOD活性没有显著差异(P>0.05)。
| 表4 饲粮PQQ对脂肪肝蛋鸡抗氧化能力和肝细胞线粒体功能的影响 Table 4 Effects of dietary PQQ on anti-oxidative capacity and hepatic mitochondrial function of fatty liver laying hens |
由表4可知,与Ⅰ组相比,Ⅱ组肝细胞线粒体内CS和CCO活性分别显著降低了28.35%和34.97%(P<0.05),Ⅲ、Ⅳ组与Ⅰ组差异不显著(P>0.05);与Ⅱ组相比,Ⅲ组的CS和CCO活性分别显著升高了42.38%和50.66%(P<0.05),Ⅳ组CS活性升高了23.71%,但差异不显著(P>0.05),CCO活性显著升高了47.75%(P<0.05),Ⅲ、Ⅳ组之间CS和CCO活性差异不显著(P>0.05)。可见,饲粮添加PQQ可抑制高能低蛋白质饲粮引起的CS和CCO活性降低。
由图 2可知,与Ⅰ组相比,Ⅱ、Ⅲ组线粒体相对含量显著降低(P<0.05),Ⅳ组线粒体相对含量差异不显著(P>0.05),其中Ⅱ组线粒体相对含量降低了70.22%,Ⅲ组降低了33.14%。与Ⅱ组相比,Ⅲ组线粒体相对含量显著升高了44.01%(P<0.05),Ⅳ组线粒体相对含量显著升高了124.79%(P<0.05)。
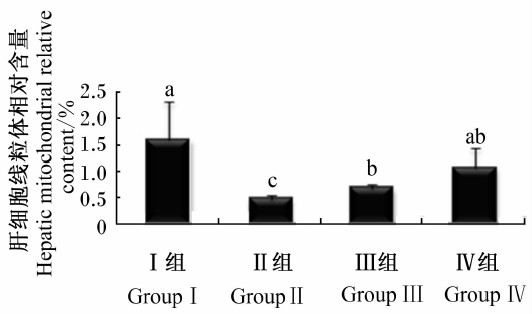 | 图 2 饲粮PQQ对脂肪肝蛋鸡肝细胞线粒体相对含量的影响 Fig. 2 Effects of dietary PQQ on hepatic mitochondrial relative content of fatty liver laying hens |
脂肪肝能引起蛋鸡肝脏脂质代谢紊乱、脂质代谢指标升高、肝功能降低等情况[10 ,11],以TG含量升高为主要特征。组织学上定义每单位面积有1/3以上肝细胞发生脂肪变性,即可判定为脂肪肝。本试验中Ⅱ组蛋鸡肝脏组织切片中肝细胞脂肪变性程度超过1/3,有的视野中仅见脂肪空泡;且肝脏中TG、TC和LDL-C含量显著升高,与前人文献报道[12]一致。在临床肝酶学检测上,血浆ALT和AST活性是反映肝损伤的常见指标,大部分ALT存在肝细胞浆内,AST存在于细胞浆和线粒体内。肝脏发生脂肪病变时,TG在肝细胞内过度积聚,占据大量空间,迫使肝细胞肿大破损,转氨酶大量外溢,故血浆ALT活性是肝细胞损伤的敏感指标。本试验中高能低蛋白质饲粮引起的血浆ALT活性显著升高,添加PQQ后基本恢复到正常值,表明饲粮PQQ能保护肝脏细胞免受损伤。PQQ能提高肝细胞内脂肪酸β-氧化速率,改善体内脂质代谢水平,促进对肝组织中TG的摄取,减少肝内脂质堆积,降低肝细胞功能损伤[13,14],因此PQQ可能通过上述途径改善肝脏内脂质代谢异常。
蛋鸡采食高能低蛋白质饲粮后,可引起线粒体内β-氧化增加、电子生成增多、线粒体呼吸链中电子泄漏增加、活性氧(ROS)生成增多。同时,动物长期采食高能低蛋白质饲粮导致脂肪代谢障碍,大量TG在肝细胞内积聚,ROS攻击细胞内不饱和脂肪酸和膜双分子层中磷脂,加剧细胞内氧化,导致肝细胞损伤[15]。本研究表明,添加PQQ可显著抑制饲喂高能低蛋白质饲粮引起的蛋鸡肝脏内MDA含量显著升高和T-SOD活性显著降低。PQQ作为有效的活性氧清除剂,一方面可直接进入细胞线粒体内,与氧自由基反应,清除过氧化物、减少细胞内氧化损伤;另一方面还能提高抗氧化相关基因的表达,增加蛋鸡体内抗氧化酶活性,从而减少氧化损伤[16]。
线粒体是细胞内的能量工厂,是肝脏脂肪酸β-氧化、ATP及ROS形成的主要部位,其在脂肪肝形成中具有重要作用,蛋鸡脂肪肝形成可能与过多自由基生成有关[16,17]。蛋鸡FLS中,线粒体的功能性变化为呼吸链紊乱、体内ATP水平降低[18]。本试验中,Ⅱ组蛋鸡肝细胞线粒体相对含量比正常组减少了77.02%,而PQQ组(Ⅲ、Ⅳ组)明显增加。饲喂缺乏PQQ饲粮的小鼠肝细胞线粒体相对含量比PQQ添加组减少了20%~30%[19];用电子显微镜观察,PQQ添加组小鼠细胞内线粒体数量明显增加,PQQ缺乏组小鼠肝细胞内较难获得足够的线粒体用于测定线粒体呼吸控制率(RCR)[8],与本试验研究结果相似。肝细胞中线粒体数量的减少,表明肝脏的能量代谢发生障碍。
CS存在于线粒体基质中,是催化三羧酸循环的限速酶及代谢变化的标志酶,参与细胞内脂肪酸氧化解毒过程;CCO位于线粒体内膜上,是线粒体呼吸链中电子传递的终端酶,与ATP的合成直接有关,其功能异常通常与某些能量代谢疾病的发生有关。线粒体CS和CCO活性变化通常用来反映线粒体功能变化。本试验中高能低蛋白质饲粮引起CS和CCO活性的降低,在PQQ组(Ⅲ、Ⅳ组)均得到了显著改善,与Chowanadisai等[14]报道的用10~30 μmol PQQ处理小鼠Hepal-6细胞24~48 h后线粒体内CS和CCO活性明显增加的结果一致。
对于高能低蛋白质饲粮引起的线粒体相对含量的减少和线粒体功能损伤,PQQ可能通过以下3个方面发挥调控作用。第一,作为电子传递体,PQQ在线粒体呼吸链中可直接将电子传递到细胞色素C上,形成1个产能较少的呼吸链,从而加速脂肪酸β-氧化,减少呼吸链中电子的泄漏和氧自由基生成[20]。第二,提高细胞内与线粒体相关的转录因子和转录蛋白质的表达,进而提高线粒体内酶的活性,刺激线粒体合成。环磷酸腺苷(cAMP)反应元件结合蛋白(CREB)是过氧化物增殖激活受体协同激活子-1α(PGC-1α)活化的重要调节因子。当细胞内线粒体受损时,PQQ能激活调控线粒体合成的CREB-PGC-1α通路促进线粒体快速合成[13,14]。PQQ能刺激CREB 133位丝氨酸发生磷酸化,活化PGC-1α启动子,增加PGC-1α mRNA和蛋白质的表达,进一步促进核呼吸因子1/2(NRF-1、NRF-2)活化,刺激线粒体合成。PQQ也可直接促进含NRF-1和NRF-2反应元件的线粒体转录因子A、B1和B2(TFAM、TFB1M、TFB2M)mRNA表达的增加,从而刺激线粒体合成[14]。第三,作为ROS的清除剂,PQQ可直接与线粒体内ROS反应,维持线粒体内ROS生成和清除的动态平衡,减少氧化应激引起的线粒体内脂质过氧化和呼吸链的失活[6, 21],保障线粒体功能的正常发挥。目前关于PQQ对线粒体作用的研究主要集中在小鼠上,其在蛋鸡肝脏内的具体作用机制与上述1条或几条有关,尚有待进一步研究。
饲粮中添加适量PQQ可通过调节产蛋鸡脂质代谢和抗氧化功能维持线粒体动态平衡,增加线粒体功能,预防高能低蛋白质饲粮诱发的FLS,且本试验中当饲粮PQQ添加量为0.16 mg/kg时效果较优。
| [1] | PESSAYRE D.Role of mitochondria in non-alcoholic fatty liver disease[J]. Journal of Gastroenterology and Hepatology, 2007, 22(1):S20-S27. ( 1) 1)
|
| [2] | BEGRICHE K, IGOUDJIL A, PESSAYRE D, et al.Mitochondrial dysfunction in NASH:Causes, consequences and possible means to prevent it[J]. Mitochondrion, 2006, 6(1):1-28. ( 1) 1)
|
| [3] | ZHU B Q, ZHU H Z, TEERLINK J R, et al.Pyrroloquinoline quinone (PQQ) decreases myocardial infarct size and improves cardiac function in rat models of ischemia and ischemia/reperfusion[J]. Cardiovascular Drugs and Therapy, 2004, 18(6):421-431. ( 1) 1)
|
| [4] | HIRAKAWA A, SHIMIZU K, FUKUMITSU H, et al.Pyrroloquinoline quinone attenuates inos gene expression in the injured spinal cord[J]. Biochemical Biophysical Research Communications, 2009, 378(2):308-312. ( 1) 1)
|
| [5] | 闵向荣, 赵永芳.PQQ对四氯化碳和乙醇引起大鼠肝损伤的保护作用[J]. 武汉大学学报, 2001(6):757-760. ( 1) 1)
|
| [6] | 徐磊, 张海军, 武书庚, 等.吡咯喹啉醌对蛋鸡生产性能、蛋品质及抗氧化功能的影响[J]. 动物营养学报, 2011, 23(8):1370-1377. ( 2) 2)
|
| [7] | TAO R, KARLINER J S, SIMONIS U, et al.Pyrroloquinoline quinone preserves mitochondrial function and prevents oxidative injury in adult rat cardiac myocytes[J]. Biochemical and Biophys ical Research Communications, 2007, 363(2):257-262. ( 1) 1)
|
| [8] | STITES T E, STORMS D, BAUERLY K, et al.Pyrroloquinoline quinone modulates mitochondrial quantity and function in mice[J]. The Journal of Nutrition, 2006, 136(2):390-396. ( 2) 2)
|
| [9] | FOLCH J, LEES M, SLOANE G H.A simple method for the isolation and purification of total lipides from animal tissues[J]. The Journal of Biological Chemistry, 1957, 226(1):497-509. ( 1) 1)
|
| [10] | 郭小权, 曹华斌, 胡国良, 等.高能量低蛋白质日粮中添加生物素对蛋鸡脂类代谢的影响[J]. 中国兽医学报, 2012, 32(5):754-758. ( 1) 1)
|
| [11] | YOUSEFI M, SHIVAZAD M, SOHRABI H I.Effect of dietary factors on induction of fatty liver-hemorrhagic syndrome and its diagnosis methods with use of serum and liver parameters in laying hens[J]. International Journal of Poultry Science, 2005, 4(8):568-572. ( 1) 1)
|
| [12] | STEINBERG F M, GERSHWIN M E, BUCKER R B, et al.Dietary Pyrroloquinoline quinone:growth and immune response in BALB/c mice[J]. The Journal of Nutrition, 1994, 124(5):744-753. ( 1) 1)
|
| [13] | BAUERLY K, HARRIS C, CHOWANADISAI W, et al.Altering pyrroloquinoline quinone nutritional status modulates mitochondrial, lipid, and energy metabolism in rats[J]. PLoS One, 2011, 6(7):e21779. ( 2) 2)
|
| [14] | CHOWANADISAI W, BAUERLY K A, TCHAPARIAN E, et al.Pyrroloquinoline quinone stimulates mitochondrial biogenesis through cAMP response element-binding protein phosphorylation and increased PGC-1α expression[J]. The Journal of Biological Chemistry, 2010, 285(1):142-152. ( 4) 4)
|
| [15] | WEI Y Z, RECTOR R S, THYFAULT J P, et al.Nonalcoholic fatty liver disease and mitochondrial dysfunction[J]. World Journal of Gastroenterology, 2008, 14(2):193-199. ( 1) 1)
|
| [16] | 徐磊.日粮中添加吡咯喹啉醌对产蛋鸡生产性能和抗氧化机能的影响[D]. 硕士学位论文.北京:中国农业科学院, 2011:27-29. ( 2) 2)
|
| [17] | 郭小权, 胡国良, 曹华斌, 等.高能低蛋白日粮致脂肪肝出血综合征鸡抗氧化能力和肝损伤的研究[J]. 中国兽医学报, 2010, 30(6):829-832. ( 1) 1)
|
| [18] | OLIVEIRA C P M S, COELHO A M M, BARBEIRO H V, et al.Liver mitochondrial dysfunction and oxidative stress in the pathogenesis of experimental nonalcoholic fatty liver disease[J]. Brazilian Journal of Medical and Biological Research, 2006, 39(2):189-194. ( 1) 1)
|
| [19] | BAUERLY K A, STORMS D H, HARRIS C B, et al.Pyrroloquinoline quinone nutritional status alters lysine metabolism and modulates mitochondrial DNA content in the mouse and rat[J]. Biochimica et Biophysica Acta General Subjects, 2006, 1760(11):1741-1748. ( 1) 1)
|
| [20] | SMITH R A, HARTLEY R C, COCHEME H M, et al.Mitochondrial pharmacology[J]. Trends in Pharmacological Sciences, 2012, 33(6):341-352. ( 1) 1)
|
| [21] | GONG D, GENG C, JIANG L, et al.Effect of pyrroloquinoline quinone on neuropathic pain following chronic constriction injury of the sciatic nerve in rats[J]. European Journal of Pharmacology, 2012, 697(1/2/3):53-58. ( 1) 1)
|




