近年来,由于全球气候的持续性升温,不仅是我国南方地区,北方地区的奶牛也频频遭受热应激(heat stress,HS)的影响,严重制约了奶牛业生产的健康发展,给乳品企业和养殖户造成了巨大的经济损失。瘤胃是反刍动物消化代谢和营养物质吸收最重要的场所,瘤胃黏膜屏障功能的完整性决定了营养物质是否能被高效吸收。正常情况下,瘤胃黏膜上皮细胞只允许离子、氨基酸等营养物质通过,而不允许毒性大分子及微生物通过,但在病理情况下,瘤胃黏膜上皮细胞的通透性就会增强,瘤胃内产生的病原微生物及其异常代谢产物就会通过破损的瘤胃黏膜屏障侵入机体循环系统,引发机体感染。因此,维持正常的瘤胃黏膜屏障功能对保证动物营养物质消化吸收和生产性能具有重要意义。本课题组前期就热应激对奶牛和奶山羊生产性能的影响做了大量的研究,发现热应激可通过显著提高奶牛和奶山羊直肠温度、体表温度以及呼吸频率,显著降低奶牛和奶山羊采食量和饲粮营养物质消化率,而严重影响奶牛和奶山羊生产性能的正常发挥;通过显著影响奶牛和奶山羊瘤胃发酵参数,而使瘤胃菌群结构发生显著变化,并导致瘤胃功能出现异常[1,2]。一些应激如心理应激[3]、长时间体力消耗所产生的生理应激[4,5]以及热应激[6,7,8]等都可破坏胃肠道黏膜上皮细胞紧密连接的完整性,引发胃肠道黏膜屏障功能障碍,增加其通透性。马燕芬等[2]在研究热应激对奶山羊生产性能和瘤胃黏膜形态结构的影响时发现,热应激通过显著降低奶山羊的直肠温度、呼吸频率、饲粮营养物质消化率、瘤胃发酵参数等,进而显著降低其饲粮干物质采食量、乳的质量及生产性能;热应激通过破坏瘤胃黏膜结构,致使瘤胃黏膜绒毛大面积萎缩、脱落,甚至坏死,进而导致瘤胃黏膜屏障通透性增加。同时也有研究发现,瘤胃内产生的脂多糖(LPS)及其异常代谢产物通过破损的瘤胃黏膜屏障侵入机体循环系统,发生细菌移位,且瘤胃通透性增高维持至45 d时尚未得以恢复[9]。然而,有关热应激在导致瘤胃黏膜形态结构发生变化及增加屏障通透性的相关分子机制目前还不清楚,国内外文献也未见相关的报道。因此,在已有研究基础上,研究热应激对瘤胃黏膜屏障通透性影响的分子机制,对维持奶山羊或奶牛在炎热环境中正常的瘤胃功能和生产性能具有重要意义。本试验以泌乳中后期奶山羊为动物模型,系统探讨热应激对瘤胃黏膜紧密连接蛋白[闭合蛋白(claudin)和闭锁小带蛋白1(ZO-1)]蛋白的结构分布、基因mRNA表达量和蛋白表达量的影响,旨在为揭示瘤胃黏膜通透性增加的相关分子机制,以及在炎热环境中维持动物正常生理机能提供试验依据。
试验于2012年6月至2012年9月在内蒙古农牧业科学院动物试验基地进行。
试验采用单因子试验设计,将8只体况良好,体重为(30.0±2.3)~(35.0±1.8) kg,年龄2~3岁,产奶量为(1.02±0.30)~(1.25±0.50) kg/d,胎次相近,处于泌乳中后期且安装有瘤胃瘘管的奶山羊随机分为对照组和热应激组,每组4只羊。
饲养环境采取人工控温控湿。热应激组奶山羊饲养于高温高湿环境(温度25~36 ℃,相对湿度60%~75%)。对照组奶山羊的饲养温度和相对湿度条件以奶山羊的适中区(温度<22 ℃,相对湿度<45%)来设定。
试验动物单栏笼饲养,每日07:00和19:00分2次等量饲喂,自由采食,自由饮水,日挤奶2次。试验期为45 d。当连续7 d的温湿指数(temperature-humidity index,THI)[10]>72时,动物热应激模型成功建立[11,12]。
参照NRC(1981)[13]奶山羊饲养标准,并结合金公亮[14]推荐的我国奶山羊饲养标准配制基础饲粮,其组成及营养水平见表1。主要以玉米、豆粕、麦麸、青干草为原料,精粗比为51∶ 49。
| 表1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) % |
试验期间根据中国移动公司短信服务,记录气象资料。同时在试验羊舍内的中央和两端以及羊体上方等高处(距地面约1.5 m)挂温湿度表,记录每天07:00、14:00及22:00的温度和相对湿度。
根据Drackley等[15]的公式计算羊舍环境THI。
THI=td-(0.55-0.55RH)×(td-58)。式中:td为华氏温度(℉),RH为相对湿度(%)。
THI<72时无热应激,72≤THI≤79时为轻度热应激,79
于奶山羊热应激模型建立后,于试验30和45 d时,对照组和热应激组各选取2只羊,禁食12 h后屠宰,采集瘤胃背囊和腹囊组织待测。对照组在试验30和45 d时采集的2次样本为组内重复,热应激组试验30和45 d采集的样本分别为试验组(30 d)和试验组(45 d)的组内重复。
claudin和ZO-1蛋白的结构分布采用免疫组化法测定。
claudin、ZO-1基因mRNA表达量采用实时定量PCR法测定。取液氮冻存的奶山羊瘤胃背囊和腹囊组织放入研钵中,加入液氮研磨成粉末,将粉末转移到1.5 mL离心管中。参照Trizol Reagent使用说明书提取总RNA,并用紫外光分光光度计测定总RNA的纯度和浓度。提取的总RNA置于-70 ℃保存。以1~4 μg总RNA为模版,进行反转录。反转录条件:37 ℃水浴60 min,95 ℃水浴5 min,结束反应。将反转录产物于-20 ℃保存备用。
根据GenBank已登录的claudin、ZO-1和甘油醛-3-磷酸脱氢酶(GAPDH)基因序列设计引物(由上海英俊生物技术有限公司合成)。claudin基因的引物序列为:上游5′-TGGAAGGTTTACTCCTATG-3′,下游5′-CACAAAGATGGCTATTAGTC-3′;ZO-1基因的引物序列为:上游5′-CACGCCAGCATACAATCG-3′,下游5′-CACGCCACTGTCAAACTC-3′;GAPDH基因引物序列为:上游5′-CATCATCCCTGCTTCTACTG-3′,下游5′-TGCTTCACCACCTTCTTG-3′。
实时定量PCR扩增体系如下:SYBRGreen Mix 32.5 μL,上、下游引物各0.5 μL,双蒸水14.5 μL,cDNA模板2.0 μL,总体积为50.0 μL。
扩增条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火45 s,40个循环;反应结束后4 ℃保存。取10 μL产物于10 g/L琼脂糖凝胶电泳检测,观测扩增结果。实时定量PCR产物经电泳后,采用凝胶电泳显像仪(Immage Master VDS)进行成像和定量分析。
claudin、ZO-1蛋白表达量采用蛋白质免疫印迹(West-blotting)法测定。
试验数据采用SPSS 16.0统计软件的one-way ANOVA程序进行单因素方差分析,差异显著者采用Duncan氏法进行多重比较,结果以平均值±标准差表示。
从图 1和图 2可以看出,claudin、ZO-1蛋白主要沿瘤胃黏膜上皮细胞膜的顶端分布,呈表达很强的蓝色线状信号,在各组中均能清晰地看到。在对照组背囊和腹囊的比较中,claudin(图 1-A和图 1-D)、ZO-1(图 2-A和图 2-D)蛋白的分布几乎无差异。与对照组相比,随着热应激时间的延长,热应激组(30 d)claudin(图 1-B和图 1-E)、ZO-1蛋白(图 2-B和图 2-E)的信号强度有所下降,而热应激组(45 d)claudin(图 1-C和图 1-F)、ZO-1蛋白(图 2-C和图 2-F)的信号强度下降更为严重。
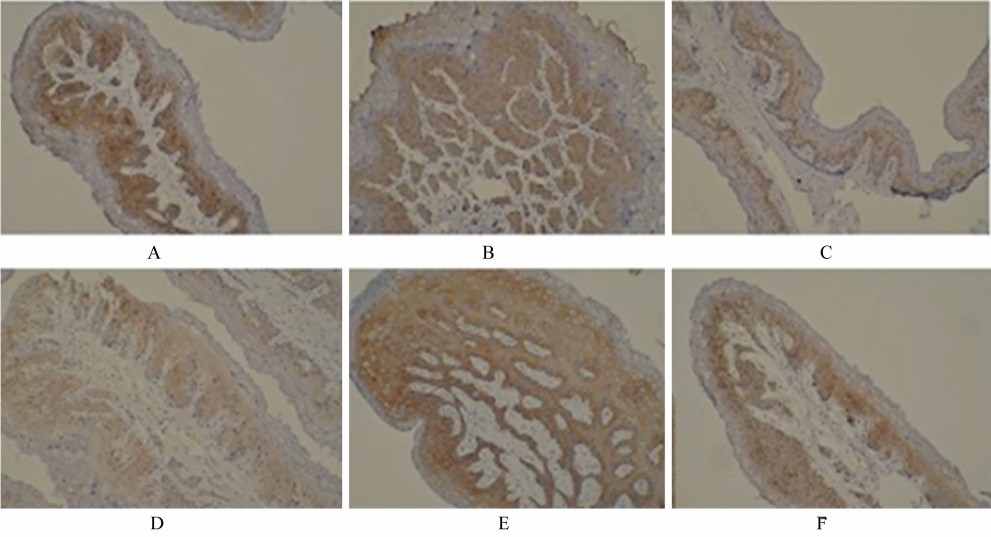 | 图 1 热应激对奶山羊瘤胃黏膜claudin蛋白的结构分布的影响 Fig.1 Effects of heat stress on structural distribution of claudin protein in ruminal mucosa of dairy goats |
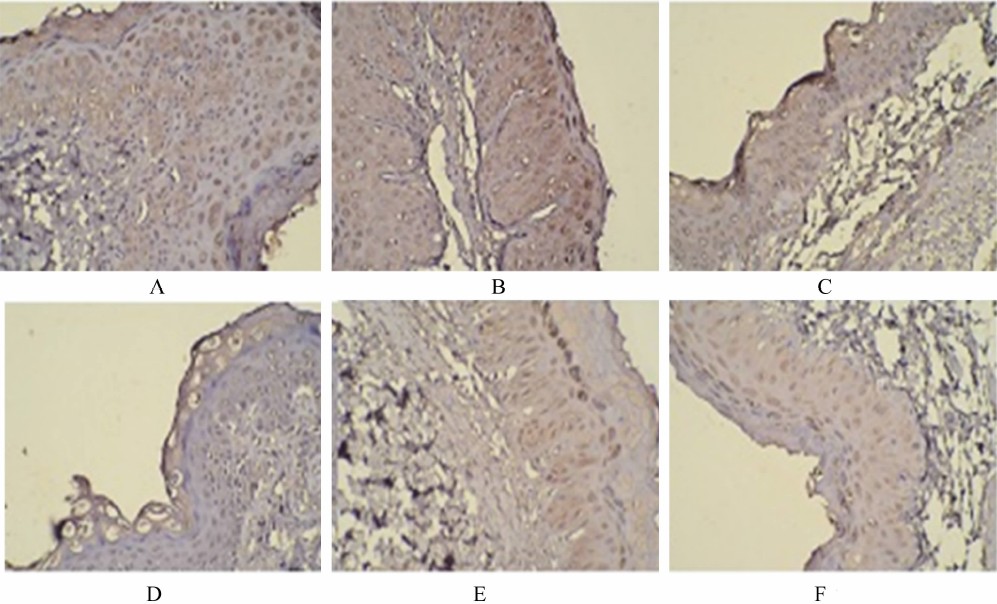 | 图 2 热应激对奶山羊瘤胃黏膜ZO-1蛋白的结构分布的影响 Fig. 2 Effects of heat stress on structural distribution of ZO-1 protein in ruminal mucosa of dairy goats |
从图 3可以看出,claudin和ZO-1基因扩增曲线有明显的扩增期和平台期,并且claudin、ZO-1基因扩增曲线的起峰约分别发生在25和22个循环时,且claudin、ZO-1基因整条曲线均走形光滑,显示扩增结果都很理想。
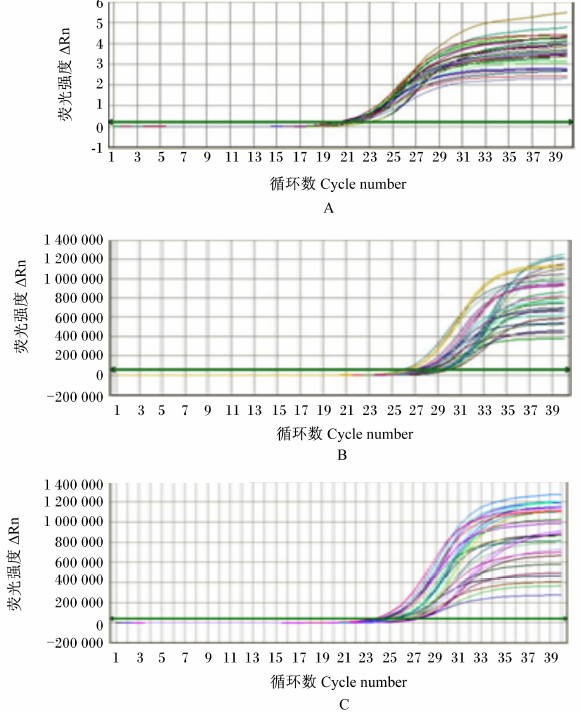 | 图 3 GAPDH、claudin和ZO-1基因的实时定量PCR扩增曲线 Fig. 3 RT-qPCR amplification curves of GAPDH, claudin and ZO-1 genes |
从表2可以看出,对照组、热应激组(30 d)和热应激组(45 d)瘤胃腹囊中claudin基因mRNA表达量均显著低于瘤胃背囊(P<0.05),ZO-1基因mRNA表达量均高于瘤胃背囊,但差异不显著(P>0.05)。
| 表2 热应激对奶山羊瘤胃黏膜claudin和ZO-1基因mRNA表达量的影响 Table 2 Effects of heat stress on mRNA expression levels of claudin and ZO-1 genes in ruminal mucosa of dairy goats |
与对照组相比,热应激组瘤胃背囊和腹囊中claudin、ZO-1基因mRNA表达量均显著下降(P<0.05),且随着热应激时间的延长,瘤胃背囊和腹囊中claudin、ZO-1基因mRNA表达量下降更为严重,即热应激组(45 d)中瘤胃背囊和腹囊中claudin、ZO-1基因mRNA表达量显著低于热应激组(30 d)(P<0.05)。
从图 4可以看出,将背囊与腹囊相比,对照组和热应激组背囊中claudin、ZO-1蛋白表达量均低于腹囊。与对照组相比,随着热应激时间的延长,热应激组(30 d)背囊和腹囊中claudin、ZO-1蛋白的表达量均有所下降,而热应激组(45 d)下降更为严重。
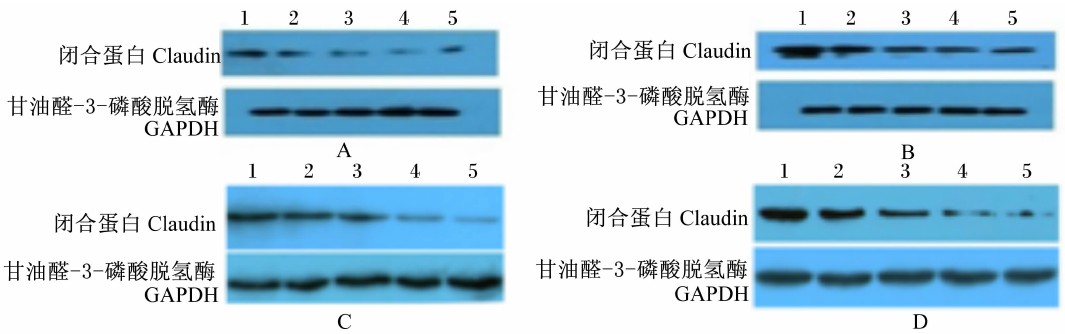 | 图 4 热应激对奶山羊瘤胃黏膜claudin和ZO-1蛋白表达量的影响 Fig. 4 Effects of heat stress on expression levels of claudin and ZO-1 proteins in ruminal mucosa of dairy goats |
应激通常指当动物体内平衡受到威胁时所发生的非特异性生物学反应。众所周知,高温热应激或高温中暑时,人会出现腹泻、频繁呕吐甚或腹泻引起的脱水、电解质紊乱等症状,在动物中同样也会出现以上症状,这与高温应激导致的胃肠道黏膜屏障功能下降密切相关。研究发现,当体内发生各种应激时,胃肠道最早发生缺血缺氧,并且是最迟得到恢复的,易较早受损或衰竭。胃肠道又是作为机体重要的免疫器官,应激状态使胃肠黏膜损伤、萎缩,屏障功能下降。当胃肠道黏膜屏障功能下降或者遭到破坏时,LPS的移位比细菌的移位更容易发生,移位后的LPS反过来会加重胃肠道黏膜屏障的损害,形成恶性循环[16]。
瘤胃是反刍动物消化代谢和营养物质吸收最重要的场所,而营养物质是否能被高效吸收主要取决于瘤胃黏膜屏障功能的完整性。本课题组前期研究结果表明,奶山羊在热应激30 d时,血浆中D-乳酸、二胺氧化酶(DAO)浓度、内毒素及其异常代谢产物如肿瘤坏死因子α(TNF-α)和肿瘤坏死因子γ(TNF-γ)、白细胞介素1α(IL-1α)、白细胞介素6(IL-6)和白细胞介素1β(IL-1β)以及干扰素-γ(INF-γ)等炎性细胞因子浓度显著高于对照组,且其浓度与热应激时间呈正相关,这种情况说明热应激增加了奶山羊瘤胃黏膜的通透性,并在此基础上使瘤胃黏膜屏障产生了更为严重的损伤,从而使内毒素及其异常代谢产物通过破损的瘤胃黏膜屏障侵入机体循环系统[9]。
胃肠道黏膜上皮细胞之间的紧密连接和肠上皮细胞(intestinal epithelial cell,IEC)两者共同构成肠道的选择性屏障,调控着水和溶质的跨上皮转运,且紧密连接与肠道营养物质吸收、微生物黏附关系更为密切。紧密连接在胃肠道中所起的作用主要是通过连续地存在于细胞与细胞之间的紧密连接蛋白发挥重要作用,来维持紧密连接的结构和功能。紧密连接蛋白有闭锁蛋白(occludin)、claudin、连接黏附分子(jinctional adhesion molecule,JAM)、闭锁小带蛋白(ZO,包括ZO-1、ZO-2、ZO-3)、AF6、7H6等,而紧密连接的破坏常常伴随着紧密连接蛋白表达和结构分布的改变,还会进一步加重肠黏膜屏障的损伤。目前认为occludin、claudin、ZO-1是紧密连接的主要功能调节蛋白,对于屏障功能的维持和紧密连接的完整性具有重要作用。这些结构就决定了胃肠道的选择性屏障,只允许离子及小分子等可溶性物质通过,而不允许毒性大分子及微生物通过。且缺乏occludin、claudin、ZO-1的成纤维细胞不能形成典型的紧密连接结构。
本课题组前期试验观察到电镜下热应激奶山羊瘤胃黏膜上皮细胞间紧密连接出现断裂,这是否与胃肠道黏膜occludin、claudin、ZO-1蛋白表达有关?本课题组前期研究结果表明,与对照组相比,热应激组瘤胃黏膜occludin蛋白信号强度、基因mRNA表达量和蛋白表达量呈下降趋势,且热应激组(45 d)较热应激组(30 d)进一步下降。本试验中,与对照组相比,热应激组瘤胃黏膜claudin、ZO-1蛋白的信号强度、基因mRNA表达量和蛋白表达量呈下降趋势,且热应激组(45 d)较热应激组(30 d)进一步下降,这表明热应激组能通过下调claudin、ZO-1基因mRNA的表达,从而下调claudin、ZO-1蛋白的表达,进而达到破坏瘤胃黏膜紧密连接结构和功能的作用,并使瘤胃黏膜上皮细胞间紧密连接呈现出断裂状态。
本试验中,将背囊与腹囊相比,对照组和热应激组背囊中claudin、ZO-1蛋白表达量均低于腹囊。造成这种结果的原因或许与试验所取的黏膜部位、试验操作过程以及样品的保存方式等有关,而热应激到底对背囊claudin、ZO-1蛋白表达的影响大还是对腹囊的影响大还需做进一步的研究。
热应激对瘤胃黏膜的结构和完整性的破坏与瘤胃黏膜紧密连接蛋白表达量下降有关。
| [1] | 温雅俐.热应激对奶牛生产性能及生理机能的影响[D]. 硕士学位论文.呼和浩特:内蒙古农业大学, 2011. ( 1) 1)
|
| [2] | 马燕芬, 杜瑞平, 高民.热应激对奶山羊生产性能及瘤胃上皮细胞形态结构的影响[J]. 中国农业科学, 2013, 46(21):4486-4495. ( 2) 2)
|
| [3] | SDERHOLM J D, PERDUE M H.Stress and gastrointestinal tract Ⅱ.Stress and intestinal barrier function[J]. Liver Physiology, 2001, 280(1):G7-G13. ( 1) 1)
|
| [4] | PALS K L, CHANG R T, RYAN A J, et al.Effect of running intensity on intestinal permeability[J]. Journal of Applied Physiology, 1997, 82(2):571-576. ( 1) 1)
|
| [5] | LAMBERT G P, MURRAY R, EDDY D, et al.Intestinal permeability following the 1998 Ironman triathlon[J]. Medicine & Science in Sports & Exercise, 1999, 31(5):S318. ( 1) 1)
|
| [6] | LAMBERT G P, GISOLFI C V, BERG D J, et al.Selected contribution:hyperthermia-induced intestinal permeability and the role of oxidative and nitrosative stress[J]. Journal of Applied Physiology, 2002, 92:1750-1761. ( 1) 1)
|
| [7] | PROSSER C, STELWAGEN K, RCUMMINS R, et al.Reduction in heat-induced gastrointestinal hyperpermeability in rats by bovine colostrum and goat milk powders[J]. Journal of Applied Physiology, 2004, 96:650-654. ( 1) 1)
|
| [8] | SINGLETON K D, WISCHMEYER P E.Oral glutamine enhances heat shock protein expression and improves survival following hyperthermia[J]. Shock, 2006, 25(3):295-299. ( 1) 1)
|
| [9] | 马燕芬, 陈琦, 杜瑞平, 等.热应激对奶山羊瘤胃上皮细胞屏障通透性的影响[J]. 中国农业科学, 2013, 46(21):4478-4485. ( 2) 2)
|
| [10] | BOHMANOVA J, MISZTAL I, COLE J B.Temperature-humidity indice as indicators of milk production losses due to heat stress[J]. Journal of Dairy Science, 2007, 90(4):1947-1956. ( 1) 1)
|
| [11] | WEST J W.Interaction of energy and bovine somatotropin with heat stresses[J]. Journal of Dairy Science, 1993, 77(7):2091-2102. ( 1) 1)
|
| [12] | ARMSTRONG D V.Heat stress interaction with shade and cooling[J]. Journal of Dairy Science, 1994, 77(7):2044-2050. ( 1) 1)
|
| [13] | NRC.Nutrient requirements of goats:Angora, dairy and meat goats in temperate and tropical countries[S]. Washington, D.C.:National Academy Press, 1981. ( 1) 1)
|
| [14] | 金公亮.奶山羊饲养标准[J]. 畜牧兽医杂志, 1989(2):7-12. ( 1) 1)
|
| [15] | DRACKLEY J K, CICELA T M, LACOUNT D W.Responses of primiparous and multiparous Holstein cows to additional energy from fat or concentrate during summer[J]. Journal of Dairy Science, 2003, 86(4):1306-1314. ( 1) 1)
|
| [16] | DEITEH E A, BERG R D.Endotoxin but not malnutrition promotes bacterial translocation of the gut flora in burned mice[J]. The Journal of Trauma:Injury, Infection, and Critical Care, 1987, 27(2):161-166. ( 1) 1)
|




