苜蓿由于其较高的营养价值,常作为奶牛的优质粗饲料进行饲喂[1]。苜蓿叶中富含蛋白质且纤维素含量低,在瘤胃中易降解,但由于苜蓿茎中细胞壁多糖和木质素含量较高,这在一定程度上限制了其在反刍动物中的高效利用。同时,茎杆在牧草总产量中比例高达50%~70%[2],因此,深入研究苜蓿茎在奶牛瘤胃中的降解规律对高效利用和改善纤维素消化具有重要意义。显微镜观察表明,微生物可快速吸附并定植于牧草纤维结构中,然后迅速繁殖形成菌落,且产琥珀酸丝状杆菌、黄色瘤胃球菌和白色瘤胃球菌是降解纤维结构的优势菌[3]。Jung等[4]还发现苜蓿茎的表皮、厚角组织、绿色组织、形成层、初生木质部薄壁组织可快速被瘤胃微生物降解,而木质化组织(次生木质部纤维和髓腔薄壁组织)在发酵96 h后仅少部分降解,初生和次生木质部导管几乎完全不降解。此外,苜蓿茎的木质化程度和节间长度也会影响苜蓿茎的降解率[5]。叶肉细胞和韧皮部要比外周维管束鞘和表皮组织优先降解,纤维结构中吸附的微生物数量与组织类型密切相关,黄色瘤胃球菌不易附着在叶肉组织和导管中[6]。然而,前人多集中利用体外法以及对叶片降解进行组织形态学观察,有关苜蓿茎在奶牛瘤胃内的降解规律及超微结构变化的研究相对较少。本研究旨在通过尼龙袋法并借助扫描电镜(scanning electron microscope,SEM)和透射电镜(transmission electron microscope,TEM),研究苜蓿茎在奶牛瘤胃中的降解特性及超微结构的变化,为深入了解苜蓿茎的降解规律和提高苜蓿降解率的研究思路提供一定的理论指导。
选取3头安装有永久性瘤胃瘘管的荷斯坦奶牛[(600±15) kg],饲喂主要由玉米青贮、秸秆和精料补充料组成的全混合日粮(TMR),栓系式饲养,日喂2次,自由饮水。
本试验选用扬州大学试验农牧场种植的牧歌401紫花苜蓿[粗蛋白质(crude protein,CP)23.21%,中性洗涤纤维(neutral detergent fiber,NDF)40.58%]。采集初花期苜蓿并剥离出苜蓿茎作为本试验材料,一份在65 ℃下烘干,粉碎过2 mm筛,装样品瓶,用于干物质(dry matter,DM)和NDF的降解率动态变化的测定;另一份于4 ℃保存,用于电镜观察样品的制备。
准确称取3.0 g粉碎样品放入预先烘干并称重的尼龙袋(8 cm×12 cm,孔径300目)中,每个时间点同一瘘管牛设2个重复。于晨饲前放入瘤胃中,分别在放入2、6、12、24、36、48和72 h后快速取出尼龙袋,放冰水中终止发酵,然后用冷水冲洗直到水澄清为止,65 ℃下烘至恒重,过1 mm筛,测定DM和NDF含量,通过下列公式计算DM和NDF在各时间点的瘤胃降解率。
瘤胃降解率(%)=100×(降解前样品中的含量-降解后样品中的含量)/降解前样品中的含量。采用∅rskov等[7]的降解模型估算苜蓿茎DM和NDF的瘤胃降解参数。
dp=a+b(1-e-c×t); ED=a+(b×c)/(c+k)。式中:dp为降解时间为t(h)时样品中某成分的瘤胃降解率(%);ED为样品中该成分的有效降解率(%);a为样品中该成分的快速降解部分(%);b为样品中该成分的慢速降解部分(%);c为慢速降解部分的降解速率(%/h);k为瘤胃外流速率常数(%/h),本文k取0.025%/h[8]。
选取整株苜蓿茎杆,在第2节上缘节下2 cm处截取3 cm长片段,纵切为6份,分别放入特制尼龙袋(4 cm×7 cm,孔径300目)中,1个尼龙袋只放1段茎。然后将尼龙袋用塑料软管悬于瘤胃内,塑料软管固定于瘘管口处。分别在放入6、12、24、48和72 h后取出尼龙袋。取出后的尼龙袋放在自来水中轻柔冲洗15 min左右,至流出的水澄清为止,然后按电子显微镜观测要求制备样品。未放入瘤胃降解的苜蓿茎放入37 ℃水中浸泡72 h作为对照样。
在制备扫描电镜样品时,先切除样品2端1 mm左右片段,以消除边缘效应,然后截取2个1 mm的片段,放入2.5%的戊二醛溶液中固定24 h,次日倒掉戊二醛溶液,用磷酸盐缓冲液冲洗3次,各级乙醇脱水,在1∶ 1的醋酸异戊酯与乙醇混合液中处理30 min,再用纯的醋酸异戊酯处理1 h,经临界点干燥,最后放样品台喷金,用扫描电镜(Phillips XL-30 SEM,荷兰)观察,照相。
在制备扫描电镜样品的同时,截取2 mm左右的样品片段用于透射电镜的观察。截取后的样品立即放入2.5%戊二醛溶液中固定24 h。次日倒掉戊二醛固定液,然后用磷酸盐缓冲液冲洗3次,2%锇酸固定3 h,磷酸盐缓冲液再洗3次,经各级乙醇脱水,进行常规树脂包埋,在超薄切片机上用钻石刀切片,再经醋酸铀和枸椽酸铅双重染色,在透射电镜(Phillips Tecnai-12 TEM,荷兰)下观察,照相。
试验数据用Excel 2007整理,统计分析采用SPSS 17.0进行方差分析,并用Duncan氏法进行多重比较,应用非线性回归(nonlinear regression)程序确定瘤胃降解参数,结果以“平均值±标准差”表示,以P<0.05作为差异显著性判断标准。
由表1可见,在48 h之前,DM和NDF的瘤胃降解率均随时间的延长显著提高(P<0.05),但48 h后无显著变化(P<0.05)。苜蓿茎DM的降解主要集中在24 h内,在24 h时可达到52.39%。瘤胃微生物对NDF的降解在6 h内较低(降解率低于10%),降解过程处于一个明显的延滞期,降解主要集中在6~24 h,NDF的瘤胃降解率在24 h时达到33.38%,之后则只有很少部分能降解。DM和NDF的有效降解率分别为48.05%和27.88%。
| 表1 苜蓿茎DM和NDF瘤胃降解率和降解参数 Table 1 Ruminal degradation rates and parameters of DM and NDF of alfalfa stem |
图 1显示了扫描电镜下苜蓿茎在奶牛瘤胃内降解0~72 h的超微结构的变化。苜蓿茎(未降解)由表皮、厚角组织、绿色组织、初生韧皮部、形成层、次生木质部纤维及导管、初生木质部薄壁组织和髓构成;表皮由单层细胞组成,绿色组织和初生韧皮部出现了皱缩现象(图 1-A)。苜蓿茎降解6 h时,髓出现降解,并在髓腔中形成一个大的凹陷;此外,表皮、厚角组织、绿色组织、形成层、初生韧皮部和初生木质部薄壁组织均已部分降解,且因降解出现了孔洞(图 1-B)。12 h时可清晰地看见髓腔基本上已完全降解,且在中间形成一个大空腔(图 1-C)。到24 h时,苜蓿茎完整的方形结构出现了断裂(图 1-D)。也就是说,在12~24 h,苜蓿茎表皮、厚角组织、绿色组织、初生韧皮部和形成层已完全降解,仅剩下次生木质部纤维及导管以及少量的初生木质部薄壁组织。到72 h时,只有次生木质部纤维及导管仍保持完整,几乎未被降解。
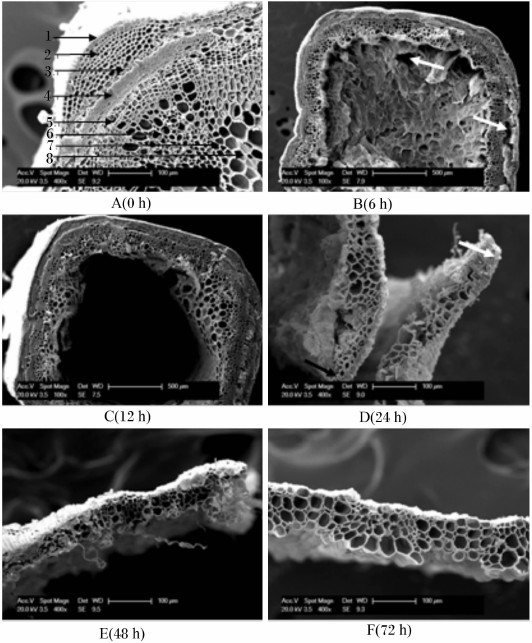 |
1:表皮epidermis , 2:厚角组织collencyma , 3:绿色组织chlorenchyma , 4:初生韧皮部primary phloem , 5:形成层cambi-
um,6:次生木质部纤维及导管secondary xylem fiber and vessels , 7:初生木质部薄壁组织primary xylem parenchyma, 8:髓
pith.
图 1 扫描电镜下苜蓿茎超微结构的变化
Fig.1 The change of ultrastructure of alfalfa stem observed under scanning electron microscope |
图 2显示了透射电镜下苜蓿茎在奶牛瘤胃内降解0~72 h的超微结构的变化。对照组苜蓿茎在水中浸泡72 h后的组织结构仍保持完整,且叶绿体等结构清晰可见(图 2-A)。将苜蓿茎放入瘤胃后,茎组织结构很快被微生物破坏,降解过程中起主要作用的是球菌和不规则形状菌,它们可在6 h内快速聚集于细胞腔内,其中某些紧密吸附于细胞壁表面,而有些菌仅是靠近细胞壁,未形成紧密吸附(图 2-B和图 2-C)。有大量球菌是通过荚膜状物质吸附于细胞壁表面,且与细胞壁紧密吸附的球菌的荚膜宽度比未紧密吸附的球菌更宽,这说明胞外纤维状物质在降解过程中存在延伸现象(图 2-D和图 2-E)。杆菌通常附着在已降解破损后的组织结构上,它能嵌入细胞壁内部进行深层次降解,但杆菌一般无荚膜状结构,同时它在降解过程中形态多样,会随组织降解后的结构调整自身形状(图 2-F和图 2-G)。
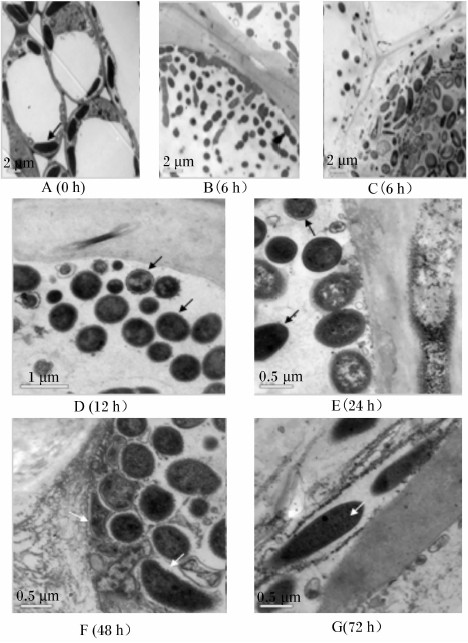 | 图 2 透射电镜下苜蓿茎超微结构的变化
Fig. 2 The change of ultrastructure of alfalfa stem observed under transmission electron microscope |
苜蓿茎各组织在微生物作用下逐渐降解,髓降解最快,6 h时几乎完全被降解(图 3-A)。而12 h时大量微生物聚集于厚角组织细胞腔内,初生木质部薄壁组织结构已大量被降解,微生物继续对次生木质部纤维及导管和果胶层进行进一步降解(图 3-B)。24 h时,初生木质部薄壁组织正在被微生物降解(图 3-C),其降解规律与上述扫描电镜结果(图 1-D)相一致。然而,次生木质部纤维和导管在降解72 h后仍然保持结构完整,基本上未被降解(图 3-D),这与扫描电镜结果(图 1-F)相吻合。
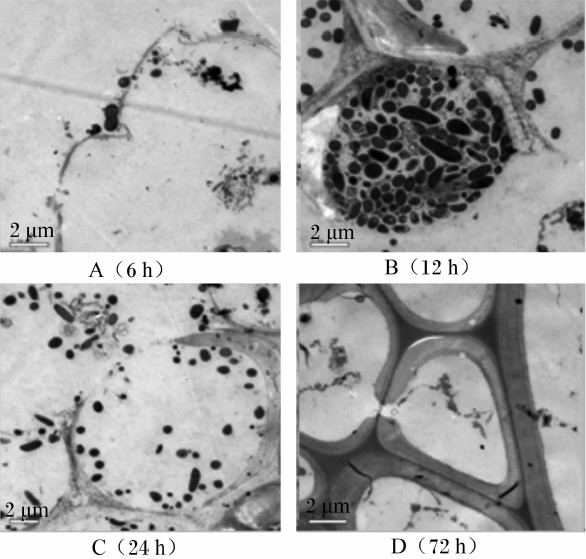 | 图 3 透射电镜下不同组织结构的降解特性 Fig. 3 Degradation characteristics of different tissues observed under transmission electron microscope |
Engels等[9]根据苜蓿茎细胞壁的形成过程将其分为以下4类:1)含薄的、非木质化细胞壁的绿色组织,形成层,次生韧皮部和初生木质部薄壁组织;2)髓,一般不被木质化,但在茎停止伸长后,有时会发生细胞壁的加厚和木质化;3)细胞壁会加厚,但有不发生木质化的厚角组织,表皮和初生韧皮部;4)细胞壁加厚且高度木质化的次生木质部纤维。本研究中发现,无论细胞壁厚薄,非木质化的细胞壁均可在瘤胃微生物的作用下完全降解。相反,木质化的组织结构降解形式不一,且降解程度及速率依赖于木质素在组织中的含量和分布情况。苜蓿茎DM瘤胃降解率呈现由高到低的规律,这是因为易降解的蛋白质、果胶和非木质化组织结构在瘤胃微生物的作用下可以快速降解。苜蓿茎中NDF主要包括纤维素、半纤维素和难降解的木质素,而纤维素和半纤维素在前6小时的降解相对缓慢,它们的降解主要发生在6~24 h,扫描电镜结果(图 1)印证了这一现象,前6小时木质化低的组织结构只降解一小部分(髓),但24 h后几乎仅剩下难降解的次生木质部纤维和导管部分,可见随着苜蓿茎中NDF的降解,其结构也跟着发生相应的改变。
对于茎中不同组织的降解规律,Jung等[4]发现苜蓿茎中部分组织(表皮、厚角组织、绿色组织、形成层以及初生木质部薄壁组织)通常在8 h内完全降解,而初生和次生木质部导管即使96 h也基本不被降解。在细胞壁的不同层中,初生韧皮部和次生木质部纤维的降解率存在很大差异。初生韧皮部的次生细胞壁在24 h内基本上可完全被降解,但与之对应的是初生韧皮部的初生细胞壁只能部分被降解。在光学显微镜下发现,木质部纤维的初生和次生细胞壁基本上不能被微生物降解。在某些牧草茎中的髓可在8 h内完全降解,但另外一些牧草茎在瘤胃内降解96 h后结构仍保持完整,这可能与细胞壁的木质化和牧草来源有关。Engels等[5]还发现非木质化的苜蓿茎组织(绿色组织、厚角组织、形成层和初生木质部薄壁组织)可降解到更深部位(3 700~8 200 μm),但木质化组织(韧皮部和木质部纤维)降解程度则较低(150~1 360 μm)。本试验中,木质化程度低的表皮、厚角组织、绿色组织、韧皮部和薄壁组织等均可完全降解,最后只剩下高度木质化的维管束组织,且结构仍保持完整,苜蓿茎的降解是通过表面和内部同时受微生物入侵的双向模式。
细菌与底物的吸附能力是影响底物消化率的重要因子[10],它也是植物细胞壁多糖降解的前提条件[11]。本文苜蓿茎透射电镜结果显示,紧密吸附于纤维细胞中的微生物主要是有荚膜的球菌和不规则形状菌,且不规则形状菌对纤维底物的吸附更加紧密(图 2-C和图 2-G),它们可能是因为不能分泌胞外酶故采取紧密吸附的方式来降解纤维组织。这与Akin[12]研究结果相一致,他还发现有荚膜的球菌更喜欢吸附于百慕大干草的厚角组织中,但荚膜球菌并不喜欢吸附于羊茅草的厚角组织中。本研究中球菌也更倾向吸附于厚角组织中,因而微生物对植物组织的吸附方式并非完全一致,这也许就是造成不同牧草降解率不同的原因。要深入了解纤维降解规律就必须进一步对嵌在细胞壁内部的瘤胃微生物做更深层次的探究。
苜蓿茎降解受细胞壁含量和组分的影响,通常认为植物细胞壁中木质素含量是限制降解率的主要因素[13]。苜蓿茎由多种不同的组织构成,某些组织在生长和发育过程中从不发生木质化,但是有些组织在细胞停止生长后立即发生木质化[9]。此外,木质素还会影响组织中细胞壁多糖的含量,在所有初生细胞壁中均含有少量果胶,且厚角组织中加厚的初生细胞壁还会出现果胶的累积现象。苜蓿茎组织中细胞壁组成的多样性使得未木质化的组织在瘤胃内的降解率远远高于木质化的组织[4]。这与本试验透射电镜得到的结论相一致,非木质化的组织结构可在微生物作用下快速并完全降解,而高度木质化的组织难以降解甚至几乎不降解。这主要是因为苜蓿茎组织在生长发育过程中不发生木质化的部分可在瘤胃微生物的作用下快速降解,而高度木质化的维管组织难以被微生物入侵[4]。
苜蓿茎在瘤胃微生物作用下可快速降解,但降解速率及程度受其组织结构及组分的影响,而高度木质化的结构在瘤胃中难以降解,提示了降低高度木质化组分含量是提高苜蓿茎降解率的有效途径。
| [1] | HOLT M, EUN J S, THACKER C, et al.Effects of feeding brown midrib corn silage with a high dietary concentration of alfalfa hay on lactational performance of Holstein dairy cows for the first 180 days of lactation[J]. Journal of Dairy Science, 2012, 96(1):515-523. ( 1) 1)
|
| [2] | MOWAT D, FULKERSON R, TOSSELL W, et al.The in vitro digestibility and protein content of leaf and stem portions of forages[J]. Canadian Journal of Plant Science, 1965, 45(4):321-331. ( 1) 1)
|
| [3] | MOSONI P, FONTY G, GOUET P.Competition between ruminal cellulolytic bacteria for adhesion to cellulose[J]. Current Microbiology, 1997, 35(1):44-47. ( 1) 1)
|
| [4] | JUNG H, ENGELS F.Alfalfa stem tissues:rate and extent of cell wall thinning during ruminal degradation[J]. NJAS-Wageningen Journal of Life Sciences, 2001, 49(1):3-13. ( 4) 4)
|
| [5] | ENGELS F M, JUNG H J G.Alfalfa stem tissues:impact of lignification and cell length on ruminal degradation of large particles[J]. Animal Feed Science and Technology, 2005, 120(3):309-321. ( 2) 2)
|
| [6] | AKIN D E, AMOS H E.Rumen bacterial degradation of forage cell walls investigated by electron microscopy[J]. Applied Microbiology, 1975, 29(5):692-701. ( 1) 1)
|
| [7] | ØRSKOV E R, MCDONALD I.The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. The Journal of Agricultural Science, 1979, 92(2):499-503. ( 1) 1)
|
| [8] | 冯仰廉, 莫放.反刍动物蛋白质营养的新体系[M]. 动物营养研究进展, 1994, 65-83. ( 1) 1)
|
| [9] | ENGELS F, JUNG H.Alfalfa stem tissues: cell wall development and lignification[J]. Annals of Botany, 1998, 82(5):561-568. ( 2) 2)
|
| [10] | FERNANDO W M, FLINT S, BRENNAN C S, et al.The influence of environmental factors on the adhesion of combinations of probiotics to rice fibre fractions[J]. World Journal of Microbiology and Biotechnology, 2012, 28(6):2293-2302. ( 1) 1)
|
| [11] | LYND L R, WEIMER P J, VAN ZYL W H, et al.Microbial cellulose utilization:fundamentals and biotechnology[J]. Microbiology and Molecular Biology Reviews, 2002, 66(3):506-577. ( 1) 1)
|
| [12] | AKIN D E.Evaluation by electron microscopy and anaerobic culture of types of rumen bacteria associated with digestion of forage cell walls[J].Applied and Environmental Microbiology, 1980, 39(1):242-252. ( 1) 1)
|
| [13] | JUNG H J, SAMAC D A, SARATH G.Modifying crops to increase cell wall digestibility[J]. Plant Science, 2012, 185:65-77. ( 1) 1)
|




