2. 农业食品与生物科学研究所, 希尔斯伯勒BT26 6DR
2. Agri-Food and Biosciences Institute, Hillsborough BT26 6DR, UK
自2008年三聚氰胺事件以来,传统的牛奶及奶制品检测手段的弊端逐渐显现出来。常用的检测手段如凯氏定氮法不能对牛奶中非蛋白质类含氮物质(尿素氮、游离氨氮、无机氨盐等)进行有效鉴定[1]。其他的如考马斯亮蓝法和分光光度计法虽然可以进行定量分析,但与上述方法一样,分析测定过程中对仪器设备要求较高,分析步骤较为耗时和繁琐,无法满足实验室之外的快速准确测定。牛奶及奶制品中脂肪的测定方法既有传统的索氏抽提法、哥特里-罗紫法、盖勃氏法和巴布科克法,也有气相色谱法、高效液相色谱法、气相色谱-质谱联法等[2]。但这些方法或准确度较低或由于分析过程复杂耗时,都往往局限于实验室样品的小规模分析,而未能在生产实践中得到广泛使用。近年来,越来越多的研究表明,使用中红外光谱(mid-infrared spectrometry,MIRS)分析技术能够对牛奶中各种营养成分如蛋白质、脂肪酸、矿物质及潜在的有害物质进行实时、快速和准确地定量分析[3, 4, 5, 6]。与传统的化学分析方法相比,MIRS分析方法对样品处理的要求不高,无需化学试剂,能够快速无损的检测样品中各成分的含量。除此之外,通过使用MIRS技术对牛奶中特定物质建立预测模型,能够快速准确地分析和鉴定奶牛的营养(如饲料转化率、能量利用效率和甲烷排放)、健康[如乳房炎和代谢性疾病(酮病等)]和生殖生理与繁殖状况。
近年来,国际上越来越多的国家和组织通过收集和共享大量的奶牛试验及实际生产数据,采用MIRS分析技术来考察不同品种及遗传能力、饲养水平和管理环境下牛奶中各营养物质成分,进而来实现对奶牛营养、健康和生殖状况的预测和鉴定[7, 8, 9]。欧盟RobustMilk项目(2008—2012年)通过采用MIRS分析技术来定量分析牛奶中脂肪酸、蛋白质和糖类的含量,并结合基因组分析技术来改善牛奶中特定营养成分的含量,从而提高牛奶及其制品的附加值[7]。作为欧盟区域性发展项目的一部分,欧洲6个国家(比利时、英国、爱尔兰、德国、法国和卢森堡)的3个研究中心和11所牛奶测定组织于2011年联合采用MIRS技术对牛奶中脂肪酸、蛋白质、尿素含量以及体细胞数进行定量分析,通过建立牛奶中特定成分的预测模型来对奶牛怀孕情况、健康状况以及能量利用情况进行快速检测和筛选,提高奶牛生产过程中的管理和盈利能力[8]。在法国,由农户、育种公司、牛奶记录组织和政府科研部门组成的PhenoFinlait项目也通过对大规模牛奶样品进行MIRS分析,建立起牛奶中各营养物质的预测模型,为奶牛的营养调控和基因繁育提供依据[9]。目前,国内采用MIRS分析技术对牛奶中各营养物质含量进行定量分析的研究尤为鲜见,通过MIRS分析技术来实现对奶牛自身营养、健康、生育等情况的检测和分析还未见报道。本文将首先对MIRS分析技术的基本原理和测定方法进行介绍。其次对近年来使用此技术建立牛奶中各营养物质的预测模型以及在鉴定和筛选奶牛营养、健康、生育等方面的最新进展进行综述,旨在为深入认识MIRS技术在科学研究及生产实践中的有效应用奠定基础。
1 MIRS分析技术的基本原理和数据处理 1.1 基本原理红外光谱处于可见光区和微波光区之间,根据其波长通常可以将红外光谱分为3个区:近红外光区(0.75~2.50 μm)、中红外光区(2.50~25.00 μm)和远红外光区(25.00~1 000.00 μm)。中红外区的波数范围在400~4 000 cm-1之间,是绝大多数有机物和无机离子的基频吸收带。由于基频振动是红外光谱中吸收能力最强的振动,所以中红外区也被认为是最适于进行红外光谱定性和定量分析的区域。因此,借助现代化学计量学方法和计算机技术,MIRS分析技术能够对待测样品中有机分子的组成和含量进行快速、准确、无损地分析,在科学研究和生产实践中都有广泛的应用。
MIRS分析技术能够通过考察和分析被测物质在中红外区域内特定的吸收特征来进行定性或定量分析。定性分析一般是将样品的中红外谱图与标准的谱图进行对照,通过分析吸收峰的位置、形状以及相对强度来判定是否为该标准物;定量分析则是根据朗伯-比耳定律,通过对试样特征吸收谱带强度的测定来测定组分的含量,其流程如图1所示。其分析方法的主要步骤如下:1)收集和选择有代表性的样本做校正集,测定其MIRS数据;2)采用标准或者广泛认可的参考方法测定校正集样本的化学分析值;3)利用校正集光谱及其化学分析数据,采用合理的化学计量学方法建立校正模型;4)利用验证集样本光谱和参考方法得到的数据来验证校正模型的准确度,选择最优校正模型;5)模型确立后,通过样品的光谱数据来预测其组成和含量。在使用MIRS分析技术建立样品中特定成分最佳预测模型过程中,有很多的因素会影响最终的预测准确度。例如,从不同地区、品种、饲喂管理方式收集到的牛奶样品中,脂肪酸和蛋白质含量会有所不同。不同的光谱分析仪器会在图谱数据收集过程中产生误差,而校正集的化学分析数据容易受到不同测定方法的影响。其中,图谱数据预处理方法的选择是影响预测模型准确度的重要因素。
1.2 数据预处理在MIRS定量分析过程中,结果的可靠性首先取决于光谱数据及化学测定值的准确性。通过判别和剔除MIRS和化学分析中的异常值能够排除非有效值的干扰,提高预测模型的准确度。但此时的图谱数据中除了包含样品自身的有效信息之外,还存在光谱随机噪声、基线漂移、干扰组分背景光谱与测定环境背景等其他干扰信息,这些都难以通过剔除异常值这种方法来对干扰数据进行排除。因此,在使用化学计量学建立预测模型之前,通过对全图谱数据进行适当处理或变换,减弱以至于消除各种非目标因素对光谱的影响,可以简化后续建模处理运算过程,显著提高预测准确度[6]。导数运算如一阶导数和二阶导数可以降低光谱峰偏移和漂移,提高图谱分辨率。多元散射校正可以消除多重光谱偏差,减小试验过程中样品颗粒尺寸、均匀性等因素对红外光谱的影响。其他的处理方式如标准正则变换技术可以有效降低不需要的光谱干扰以利于分析信号的解析;归一化可以同时消除绝对强度及光散射的影响。
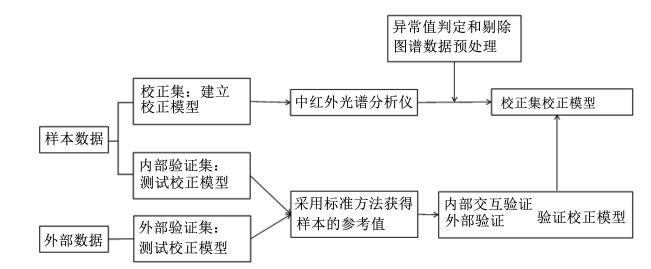 | 图1 利用MIRS技术进行定量分析的基本流程 Fig. 1 The basis process of MIRS quantitative analysis |
De Marchi等[10]利用气相色谱法和MIRS分析技术对267份瑞士棕牛牛奶样品中的脂肪酸组成和含量进行了测定,在采用偏最小二乘法建立预测模型之前,除了采用未经处理的图谱数据之外,也比较了另外4种不同的图谱处理方法:一阶导数、二阶导数、归一化和多重散射矫正加一阶导数。试验证明,图谱数据经过一阶导数和多重散射矫正加一阶导数处理之后,建立的预测模型具有最好的预测准确度。其中经过一阶导数预处理之后预测模型对C12 ∶ 0和C14 ∶ 0的交互验证相关系数分别为0.75和0.77。采用多重散射矫正加一阶导数处理的预测模型对C8 ∶ 0和长链脂肪酸的交互验证相关系数分别为0.74和0.76。Bonfatti等[11]对西门塔尔奶牛样品中的总蛋白、酪蛋白、乳清蛋白及其他各组成成分和含量进行MIRS分析时,比较了一阶导数和二阶导数图谱预处理方法对预测准确度的影响。试验结果与De Marchi等[6]的发现类似,MIRS谱图经一阶导数预处理之后,由改进的偏最小二乘回归法建立的预测模型的准确度能够得到显著提高。 Soyeurt等[12]对比利时、爱尔兰和英国3个国家共1 609个牛奶样品中脂肪酸的组成和含量进行了MIRS分析。与未经处理的图谱数据得到的预测模型相比,采用一阶导数处理图谱数据能够得到更好的预测模型和更高的准确度,也具有最高的交互验证相关系数。Soyeurt等[13] 采用更大量的数据(2 499个)来考察6种不同图谱预处理方法对建立牛奶中乳铁蛋白预测模型准确度的影响。与Soyeurt等[12]的结果类似,图谱数据经过导数处理之后能够得到最好的预测模型,其中交互验证相关系数能够达到0.72。
2 牛奶中脂肪酸的分析牛奶中含有丰富的饱和脂肪酸(70%)、单不饱和脂肪酸(25%)和多不饱和脂肪酸(5%)[14]。这些脂肪酸的含量和组成受到奶牛品种、遗传性能和饲养管理模式的影响[15, 16]。因此,实时快速地获取牛奶中脂肪酸的组成和含量信息能够为奶牛的有效养殖和管理提供依据,提高奶牛养殖行业的盈利能力。传统上采用的气相色谱法虽能够得到牛奶中脂肪及脂肪酸组成和含量较为准确的结果[17],但由于其分析所需材料较多,分析步骤较为耗时和繁琐,往往局限于实验室分析,而不能满足大规模样品的测定和数据采集。近年来,越来越多的研究表明,牛奶中脂肪酸的组成和含量能够采用MIRS分析技术来进行快速、准确和无损分析。在建立牛奶中脂肪酸的预测模型时,其准确度容易受到待测物质含量、表示单位以及选用的化学计量学模型的影响[3, 18, 19]。
Soyeurt等[3]采用MIRS技术对比利时6个不同品种275头奶牛牛奶样品中的脂肪酸进行定量分析,并在红外光谱的1 736~1 805 cm-1和2 823~3 016 cm-1波数区建立预测模型,结果显示该预测模型具有较高的预测准确度,且预测模型的准确度与待测成分在牛奶样品中的含量呈正比。例如,对于单独的脂肪酸,分别由MIRS分析技术和气相色谱法获得的数据之间的相关系数最高可达0.95,其中牛奶中含量较高的C12 ∶ 0、C14 ∶ 0、C16 ∶ 0和C18 ∶ 1的相关系数均大于0.90,而含量较低的C10 ∶ 1cis-9和C14 ∶ 1cis-9的相关系数较低,分别为0.05和0.12;对于脂肪酸组成,饱和脂肪酸和单不饱和脂肪酸的相关系数最高,分别为0.98和0.89,而含量较低的多不饱和脂肪酸的相关系数则为0.43。Soyeurt等[12]还收集了比利时、爱尔兰和英国1 060个MIRS数据,分别采用6种不同的图谱预处理方式建立牛奶中脂肪酸含量(g/dL)的预测模型,发现牛奶中含量较高的C4 ∶ 0、C6 ∶ 0、C8 ∶ 0、C10:0和C12:0的交互验证相关系数在0.88~0.95之间,外部验证相关系数为0.82~0.90。饱和脂肪酸和不饱和脂肪酸的交互验证相关系数分别为0.99和0.97,外部验证相关系数分别为0.98和0.96,具有较高的预测准确度,能够在对牛奶的特异性选择过程中发挥重要作用。随后,Rutten等[18]采用荷兰3 622个牛奶样品进行MIRS和气相色谱法分析时,对牛奶中16种单独脂肪酸和4类脂肪酸组建立预测模型。结果显示,预测模型的准确度与待测物质的表示单位有关。当以单位体积牛奶中含量(g/dL)为表示单位时,C4 ∶ 0、C6 ∶ 0 C8 ∶ 0和C10 ∶ 0的相关系数分别为0.91、0.96、0.94和0.92;脂肪酸组预测模型的相关系数在0.91~0.97之间,预测准确度显著高于以占总脂肪的含量(%)为表示单位的预测能力。De Marchi等[10]结合MIRS技术和气相色谱法对1 200头瑞士棕牛牛奶中的脂肪酸进行定量分析,比较了不同表示单位的单独脂肪酸和脂肪酸组预测模型的准确度。结果表明,以单位质量牛奶中含量为表示单位(g/kg)的模型具有较高的预测精度,其中C18 ∶ 0、C10 ∶ 0和 C12 ∶ 0的交互验证相关系数分别为0.74、0.73和0.74;脂肪酸组的交互验证相关系数在0.63~0.76之间。在此试验中,预测模型的准确度略低,原因可能是动物品种和样品来源较为单一,原始数据缺乏多样性,限制了预测模型的预测范围。Ferrand等[19]从4个不同品种的奶牛中收集了317个牛奶样品,通过使用MIRS技术来比较2种不同化学计量学模型(偏最小二乘法与遗传算法加偏最小二乘法)对脂肪酸预测模型准确度的影响,发现采用偏最小二乘法能够快速建立预测模型,其对C4 ∶ 0、C6 ∶ 0、C8 ∶ 0、C10 ∶ 0和C12 ∶ 0的外部验证相关系数在0.82~0.95之间,饱和脂肪酸和不饱和脂肪酸的外部验证相关系数分别为0.97和0.89;采用基因算法加偏最小二乘法获得的预测模型能够略微提高预测准确度,如饱和脂肪酸和不饱和脂肪酸的外部验证相关系数分别为0.98和0.91。但由于基因算法计算步骤较为繁琐,耗时较长,在实践生产中采用MIRS分析技术时常用偏最小二乘法来建立预测模型。另外,Maurice-Van Eijndhoven等[20]从24 445头奶牛中收集41 404个牛奶样品来建立脂肪酸(g/dL)的MIRS预测模型,结果发现预测模型能够得到较高的预测准确度,但不同品种奶牛牛奶中脂肪酸含量存在差异。因此,采用MIRS分析技术对牛奶中脂肪酸进行测定时,无论是单独的脂肪酸还是脂肪酸组(饱和脂肪酸、单不饱和脂肪酸以及多不饱和脂肪酸),其预测模型的准确度与待测物质在牛奶中的含量呈正比,且显著高于传统的气相色谱分析方法。同时,当脂肪酸以单位质量牛奶含量为表示单位时,其预测模型的相关系数显著高于以单位体积牛奶含量为表示单位的相关系数。另外,化学计量学模型、脂肪酸测定的样本量等因素也都会对预测模型的准确度产生影响。
3 牛奶中蛋白质的分析牛奶具有较高的营养价值,其中酪蛋白(κ-酪蛋白、αs1-酪蛋白、αs2-酪蛋白和β-酪蛋白)和乳清蛋白(α-乳白蛋白和β-乳球蛋白)分别约占牛奶蛋白质总量的80%和20%。传统的牛奶蛋白质成分检测以化学分析方法为主,如液相色谱法、毛细管电泳法和毛细管等电聚焦电泳。但近年来的研究证明MIRS分析技术不仅能够无损地对样品进行测定,而且还能缩短测定时间,提高测定准确度[21, 22, 23, 24, 25]。
Etzion等[21]通过确定牛奶中蛋白质在MIRS中的特定吸收区域(1 500~1 700 cm-1和1 060~1 100 cm-1)来建立预测模型,结果证明该模型的预测误差较低,能够满足对牛奶中蛋白质含量进行快速准确测定的要求。De Marchi等[22]使用反向液相色谱和MIRS分析技术研究西门塔尔奶牛1 336个牛奶样品中蛋白质组分和含量,通过偏最小二乘法建立定量预测模型,结果表明,预测模型中总蛋白和酪蛋白含量的预测值与化学分析值的相关系数为0.58,交互验证均方根误差分别为3.11和2.76 g/L;乳清蛋白、αS1-酪蛋白和β-乳球蛋白的相关系数在0.50~0.58之间,交互验证均方根误差分别为0.51、1.07和0.43 g/L,具有较高的预测准确度。但是由于α-乳白蛋白在牛奶中的总含量较低,其相关系数仅为0.29,模型的预测准确度较低。这个结果与Soyeurt等[3]和Rutten等[18]在利用MIRS技术定量预测牛奶中脂肪酸含量的结果类似,研究都发现预测模型的预测精度与待测物质在牛奶样品中的含量呈线性相关关系。Bonfatti等[11]采用MIRS技术得到西门塔尔牛牛奶样品中13种蛋白质成分的光谱图并建立定量预测模型,发现总蛋白、酪蛋白、乳清蛋白、αS1-酪蛋白和β-乳球蛋白的相关系数分别为0.80、0.79、0.65、0.69和0.67,预测准确度高于De Marchi等[22]的结果。另外,此研究发现在对样品中含量较低的α-乳白蛋白建立预测模型之前,对原始光谱进行预处理(一阶导数或二阶导数)能够有效提高预测精度,其相关系数(0.39)较De Marchi等[22]的结果(0.29)得到了显著提高。与采用MIRS分析技术对牛奶中脂肪酸进行预测分析时类似,牛奶中蛋白质的MIRS预测模型准确度同样的会受到待测物质表示单位的影响。Rutten等[23]分别采用毛细管区带电泳法和MIRS法对荷斯坦奶牛5 545个牛奶样品中10项指标进行化学和图谱分析,首次尝试采用以占总蛋白含量(%)为表示单位来建立牛奶中各蛋白质成分的定量预测模型,结果显示预测模型对酪蛋白、乳清蛋白和β-乳球蛋白的预测准确度较低,相关系数分别为0.25、0.53和0.56。而以往的试验多采用以单位体积牛奶含量(g/dL)为表示单位来获得较高的相关系数(>0.90)和预测准确度[22, 24]。
牛奶中乳铁蛋白可增强铁的传递和吸收,具有光谱的抑菌性等许多独特的生理调节作用。在采用免疫酶联吸附法测定牛奶中乳铁蛋白含量时,样品需要预处理且操作步骤较为繁琐;高效液相色谱法对待测样品的纯度有较高的要求,设备也较昂贵[26]。Soyeurt等[25]尝试采用MIRS分析技术对475头奶牛的1 609个牛奶样品进行定量分析,结果发现牛奶中乳铁蛋白预测模型的相关系数为0.83,交互验证相关系数为0.75,较传统的免疫酶联吸附法具有更高的测定精度。Soyeurt等[13]使用中MIRS技术和免疫酶联吸附法对爱尔兰、苏格兰和比利时3个地区共2 499个牛奶样品进行分析,采用6种不同图谱预处理方法之后利用内部交互验证集和外部验证集来考察预测模型的准确度。试验证明,预测模型中牛奶中乳铁蛋白具有较高的相关系数(0.69~0.74)。此外,由于实际生产中常用体细胞数量作为评判奶牛乳房炎以及免疫情况的指标,而牛奶中乳铁蛋白也有奶牛免疫系统有关[27]。因此,作者还发现将得到的乳铁蛋白预测模型与牛奶中体细胞数量的测定方程相结合,也能够对奶牛乳房炎发病情况进行快速准确地鉴定和筛选。一般来说,采用MIRS分析技术对牛奶中蛋白质建立预测模型进行定量分析时,其预测模型的准确度与待测蛋白质成分在牛奶中的含量呈正比。与此同时,与采用MIRS分析技术定量测定牛奶中脂肪酸含量相同,待测成分采用不同的表示单位能够影响其预测准确度。因此,与传统的液相色谱和免疫酶联吸附法相比,MIRS分析技术能够显著提高预测精度及测定效率。同时,将MIRS定量分析模型与其他测定方程相结合,能够实现对奶牛整体健康状况等方面的鉴定和筛选,有效改善奶牛养殖管理模式,提升奶牛养殖企业的盈利能力,从而实现整个养殖行业的健康可持续发展。
4 牛奶中矿物质及其他潜在有害物质的分析牛奶中除了含有优质的蛋白质和脂肪酸之外,还有非常丰富的矿物质元素、微量元素和维生素等。在对牛奶中这些物质检测时,MIRS分析技术凭借其快速、无损的特性迅速成为近年来研究的热点。Soyeurt等[4]以6个不同品种奶牛的1 543个牛奶为样品,用原子吸收法和MIRS对牛奶中钙、钠、磷、钾和镁的含量进行定量分析,结果表明,MIRS对钙、钠和磷具有较高的预测能力,其相关系数分别为0.96、0.83和0.99,结果与Toffanin等[28]结果类似;对钾和镁的预测模型的准确度略低,交互验证相关系数分别为0.76和0.85。Stocco等[29]采用MIRS对5个种群共173头水牛奶中的钙、磷、镁和钾元素含量进行定量分析,结果发现预测模型的预测值和分析值的相关系数分别为0.71、0.70、0.72和0.55,进一步表明MIRS能够对不同奶源中的矿物质元素进行较为准确地定量分析。此外,Wu等[30]比较了近红外光谱(near-infrared spectroscopy,NIRS)和MIRS技术对奶粉中钙含量预测模型的准确度。结果发现,样品在MIRS(671~3 698 cm-1)光谱区具有较好的吸收能力,相关系数为0.94,显著高于由NIRS建立的预测模型(相关系数为0.64)。
在实际生产中,除了需要对牛奶中营养物质进行定量检测之外,还需要对乳品掺假、药物残留等方面进行实时鉴定和分析。但基于色谱、质谱、免疫、微生物等方法建立起来的检测手段过程繁琐复杂、鉴定成本高,难以达到快速有效准确地判定。近年来越来越多的研究表明MIRS技术对掺假牛奶进行定量分析的准确度更高,能够达到实时快速的鉴定和分析[31, 32, 33]。Sivakesava等[31]使用NIRS和MIRS技术对牛奶中四环素的含量进行测定,采用偏最小二乘法建立预测模型。结果显示MIRS技术对预测牛奶中四环素含量的预测准确度更高,预测值和化学分析值的相关系数最大值为0.93,且相关系数会随着样本中四环素含量的增加而提高。Santos等[32]采用MIRS分析技术对牛奶中不同残杂物(水、乳清、过氧化氢、尿素、合成奶和合成尿)进行定量分析。结果发现MIRS对各类掺杂物建立预测模型的相关系数在0.90~0.98之间,标准误差在0.014~2.33之间,具有较高的预测、鉴定能力。另外,Santos等[33]比较了NIRS和MIRS分析技术对上述6种混有掺杂物的牛奶定量分析时的预测准确度。结果发现,6种掺杂物在MIRS光谱区具有更为明显的吸收峰,能够建立更为准确的定量预测模型。因此,采用MIRS分析技术除了能够对牛奶中脂肪酸和蛋白质进行准确地定量分析之外,牛奶中矿物质元素以及其他潜在的有害物质也能够通过MIRS建立预测模型来进行准确测定、鉴别和分析。这种方法操作简单、定量分析准确度高,而且能够实现实时快速的定量分析,能够有效替代传统的基于色谱、质谱、免疫、微生物等方法建立起来的检测方法。
5 奶牛营养、健康与生殖状况预测和评估采用MIRS除了能够对牛奶中常规的营养物质成分进行快速准确地分析之外,通过筛选合适的待测物质来建立MIRS预测模型能够实现对奶牛自身营养、健康、生殖状况的有效预测、筛选和管理。例如,围产期高产奶牛处于能量负平衡时,血液和牛奶中β-羟丁酸、丙酮和乙酰乙酸含量会随之升高,最终导致酮病、脂肪肝等能量代谢障碍性疾病的发生。Heuer等[34]采用MIRS分析技术和气相色谱法测定牛奶中丙酮的含量,结果发现,在1 239~1 370 cm-1波数范围内丙酮有较高的吸收峰,其MIRS预测值与化学分析值之间的相关系数为0.66,预测均方根误差为0.21 mmol,预测模型的准确度显著高于气象色谱法,能够采用MIRS来对奶牛是否患有酮病进行有效鉴定和区分。Hansen[35]发现在964~1 581 cm-1、1 697~1 812 cm-1和2 699~2 969 cm-1这3个MIRS波数范围内丙酮都有较高的吸收峰,经偏最小二乘法建立的预测模型的相关系数为0.81,预测均方根误差为0.27 mmol。Van Knegsel等[36]和Van Der Drift等[37]比较了MIRS分析技术和试剂盒法测定血液和牛奶样品中丙酮和β-羟丁酸的含量,试验结果也表明经MIRS分析技术获得的预测值较传统的试剂盒法更为准确和快捷,能够实现对高血酮病奶牛的有效筛选。
当高产奶牛长期处于能量负平衡时,动物整体的生产性能、抗病能力和繁殖性能都会受到较大的损害。以往的研究一般采用以下3种方法来预测奶牛的能量平衡情况:一是通过测定奶牛日常能量摄入和产出来计算能量平衡值;二是考察奶牛体重和体况评分的变化来预测奶牛能量平衡[38];三是利用血液或牛奶中特定物质(酮体、胰岛素、脂肪、蛋白质和糖类等)的含量变化来预测能量利用情况[39]。由于前2种考察方法步骤繁琐、工作量大,结果准确度低等问题,近年来越来越多的研究采用MIRS来对奶牛能量状况进行预测和分析[40, 41, 42]。McParland等[40]使用MIRS分析技术对苏格兰地区1 145个牛奶样品中的脂肪和蛋白质含量,产奶量,干物质采食量,体重以及体况评分进行分析,建立对奶牛能量平衡、体组织能量含量和有效能量采食量的定量预测模型。试验结果发现,预测模型对这3项指标的预测相关系数分别为0.78,0.64和0.88,具有较高的准确度,能够在规模化奶牛养殖过程中作为评价奶牛能量状况的有效手段。McParland等[41]从英国和爱尔兰分别收集了1 218和1 586头荷斯坦奶牛的生产数据及其牛奶样品,通过MIRS分析技术来建立奶牛能量状况的预测模型。结果表明奶牛的有效能量采食量、能量平衡和体组织的预测相关系数分别为0.88、0.75和0.62,与McParland等[40]结果类似,经MIRS分析技术建立的预测模型能够实现对奶牛能量状况的有效预测和分析。此外,由于奶牛的剩余采食量和能量平衡之间存在显著的相关关系(相关系数为0.85),也有研究发现能够通过预测剩余采食量来鉴定和分析奶牛的能量利用情况[42]。McParland等[5]通过采用MIRS分析技术对牛奶中的营养物质(蛋白质、脂肪和糖类含量)进行定量分析,并结合奶牛的生长状况指标(体重和体况评分)来预测奶牛的剩余采食量。结果表明,经MIRS分析技术建立的剩余采食量预测模型的相关系数为0.70,表明MIRS分析技术能够对奶牛剩余采食量进行准确预测,从而实现对奶牛能量利用情况的准确判别。因此,在采用MIRS分析技术对牛奶中营养物质和其他潜在的有害物质进行准确地定量分析之外,利用MIRS分析技术建立的预测模型结合奶牛自身特点,能够实现对奶牛自身营养、健康、生殖状况的有效预测、筛选和管理。
6 小结与展望MIRS分析技术能够对大规模牛奶样品中各营养成分和其他潜在的有害物质进行快速准确地定量分析,并通过建立预测模型来实现对牛奶营养、健康和生殖生理与繁殖状况的鉴定和分析,在提高牛奶及奶制品附加值和奶牛养殖行业盈利性的同时,有助于实现畜牧业高效、健康和绿色生产。
尽管采用MIRS分析技术建立预测模型需要较大量的数据样品、较为详细的数据处理过程以及较为细致的模型验证模型,但随着计算技术的发展和数学模型的优化,采用MIRS分析技术在实际生产中将发挥举足轻重的作用。另外,采用MIRS技术还能够对牛奶中其他营养物质成分进行定量分析和预测。例如,牛奶中含有丰富的维生素A、B、C以及瘤胃内甲烷的排放量进行较为准确地分析和预测。通过收集不同饲养和管理条件下不同遗传特性和品种的奶牛数据来扩大样本的代表性和多样性,从而提高预测模型的准确度,将是MIRS技术的扩展研究。毫无疑问地将MIRS分析技术与反刍动物饲料利用效率、遗传特性选择等方面的内容进行集成,对推动我国畜牧行业的高效、低碳和可持续性发展具有实际意义。
| [1] | 中华人民共和国卫生部.GB 5009.5-2010食品安全国家标准食品中蛋白质的测定[S]. 北京:中国标准出版社,2010. ( 1) 1)
|
| [2] | 阳丽芝,陈志伟.牛奶中脂肪检测技术研究进展[J]. 食品科学,2011,32(1):270-273. ( 1) 1)
|
| [3] | SOYEURT H,DARDENNE P,DEHARENG F,et al.Estimating fatty acid content in cow milk using mid-infrared spectrometry[J]. Journal of Dairy Science,2006,89(9):3690-3695. ( 3) 3)
|
| [4] | SOYEURT H,BRUWIER D,ROMNEE J M,et al.Potential estimation of major mineral contents in cow milk using mid-infrared spectrometry[J]. Journal of Dairy Science,2009,92(6):2444-2454. ( 2) 2)
|
| [5] | MCPARLAND S,LEWIS E,KENNEDY E,et al.Mid-infrared spectrometry of milk as a predictor of energy intake and efficiency in lactating dairy cows[J]. Journal of Dairy Science,2014,97(9):5863-5871. ( 2) 2)
|
| [6] | DE MARCHI M,TOFFANIN V,CASSANDRO M P.Mid-infrared spectroscopy as phenotyping tool for milk traits[J]. Journal of Dairy Science,2014,97(3):1171-1186. ( 3) 3)
|
| [7] | RobustMilk.Innovative and practical breeding tools for improved dairy products from more robust dairy cattle[EB/OL].[2015-05-15] .http://www.robustmilk.eu. ( 2) 2)
|
| [8] | OptiMIR.New tools for a more sustainable dairy sector[EB/OL].[2015-05-15] . http://www.optimir.eu/en/index.php. ( 2) 2)
|
| [9] | PhénoFinLait.PHENOtypage FIN du LAIT[EB/OL].[2015-05-15] . http://www.phenofinlait.fr/spip.php. ( 2) 2)
|
| [10] | DE MARCHI M,PENASA M,CECCHINATO A,et al.Effectiveness of mid-infrared spectroscopy to predict fatty acid composition of Brown Swiss bovine milk[J]. Animal,2011,5(10):1653-1658. ( 2) 2)
|
| [11] | BONFATTI V,DI MARTINO G,CARNIER P.Effectiveness of mid-infrared spectroscopy for the prediction of detailed protein composition and contents of protein genetic variants of individual milk of Simmental cows[J]. Journal of Dairy Science,2011,94(12):5776-5785. ( 2) 2)
|
| [12] | SOYEURT H,DEHARENG F,GENGLER N,et al.Mid-infrared prediction of bovine milk fatty acids across multiple breeds,production systems,and countries[J]. Journal of Dairy Science,2011,94(4):1657-1667. ( 3) 3)
|
| [13] | SOYEURT H,BASTIN C,COLINET F G,et al.Mid-infrared prediction of lactoferrin content in bovine milk:potential indicator of mastitis[J]. Animal,2012,6(11):1830-1838. ( 2) 2)
|
| [14] | GRUMMER R R.Effect of feed on the composition of milk fat[J]. Journal of Dairy Science,1991,74(9):3244-3257. ( 1) 1)
|
| [15] | ARNOULD V M R,SOYEURT H.Genetic variability of milk fatty acids[J]. Journal of Applied Genetics,2009,50(1):29-39. ( 1) 1)
|
| [16] | CHILLIARD Y,FERLAY A.Dietary lipids and forages interactions on cow and goat milk fatty acid composition and sensory properties[J]. Reproduction,Nutrition, Development,2004,44(5):467-492. ( 1) 1)
|
| [17] | DEPETERS E J,MEDRANO J F,REED B A.Fatty acid composition of milk fat from three breeds of dairy cattle[J]. Canadian Journal of Animal Science,1995,75(2):267-269. ( 1) 1)
|
| [18] | RUTTEN M J M,BOVENHUIS H,HETTINGA K A,et al.Predicting bovine milk fat composition using infrared spectroscopy based on milk samples collected in winter and summer[J]. Journal of Dairy Science,2009,92(12):6202-6209. ( 3) 3)
|
| [19] | FERRAND M,HUQUET B,BARBEY S,et al.Determination of fatty acid profile in cow's milk using mid-infrared spectrometry:interest of applying a variable selection by genetic algorithms before a PLS regression[J]. Chemometrics and Intelligent Laboratory Systems,2011,106(2):183-189. ( 2) 2)
|
| [20] | MAURICE-VAN EIJNDHOVEN M H T,BOVENHUIS H,SOYEURT H,et al.Differences in milk fat composition predicted by mid-infrared spectrometry among dairy cattle breeds in the Netherlands[J]. Journal of Dairy Science,2013,96(4):2570-2582. ( 1) 1)
|
| [21] | ETZION Y,LINKER R,COGAN U,et al.Determination of protein concentration in raw milk by Mid-infrared fourier transform infrared/Attenuated total reflectance spectroscopy[J]. Journal of Dairy Science,2004,87(9):2779-2788. ( 1) 1)
|
| [22] | DE MARCHI M,BONFATTI V,CECCHINATO A,et al.Prediction of protein composition of individual cow milk using mid-infrared spectroscopy[J]. Italian Journal of Animal Science,2009,8(S2):399-401. ( 5) 5)
|
| [23] | RUTTEN M J M,BOVENHUIS H,HECK J M L,et al.Predicting bovine milk protein composition based on Fourier transform infrared spectra[J]. Journal of Dairy Science,2011,94(11):5683-5690. ( 2) 2)
|
| [24] | SØRENSEN L K,LUND M,JUUL B.Accuracy of Fourier transform infrared spectrometry in determination of casein in dairy cows' milk[J]. Journal of Dairy Research,2003,70(4):445-452. ( 2) 2)
|
| [25] | SOYEURT H,COLINET F G,ARNOULD V M R,et al.Genetic variability of lactoferrin content estimated by mid-infrared spectrometry in bovine milk[J]. Journal of Dairy Science,2007,90(9):4443-4450. ( 2) 2)
|
| [26] | 卢蓉蓉,许时婴,王璋.乳铁蛋白测定方法的比较[J]. 中国乳品工业,2002,30(5):123-125. ( 1) 1)
|
| [27] | HAGIWARA S I,KAWAI K,ANRI A,et al.Lactoferrin concentrations in milk from normal and subclinical mastitic cows[J]. Journal of Veterinary Medical Science,2003,65(3):319-323. ( 1) 1)
|
| [28] | TOFFANIN V,DE MARCHI M.Prediction of calcium,phosphorus and titratable acidity,and relationships with coagulation traits and chemical composition of bovine milk[J]. Italy Journal of Animal Science,2013,12:37. ( 1) 1)
|
| [29] | STOCCO G,CIPOLAT-GOTET C,BITTANTE G,et al.Variation of major mineral contents in Mediterranean buffalo milk and application of Fourier transform infrared spectroscopy for their indirect prediction[J]. Acta Agraria Kaposváriensis,2014,18(S1):96-102. ( 1) 1)
|
| [30] | WU D,NIE P C,HE Y,et al.Determination of calcium content in powdered milk using near and mid-infrared spectroscopy with variable selection and chemometrics[J]. Food and Bioprocess Technoogy,2012,5(4):1402-1410. ( 1) 1)
|
| [31] | SIVAKESAVA S,IRUDAYARAJ J.Rapid determination of tetracycline in milk by FT-MIR and FT-NIR spectroscopy[J]. Journal of Dairy Science,2002,85(3):487-493. ( 1) 1)
|
| [32] | SANTOS P M,PEREIRA-FILHO E R,RODRIGUEZ-SAONA L E.Rapid detection and quantification of milk adulteration using infrared microspectroscopy and chemometrics analysis[J]. Food Chemistry,2013,138(1):19-24. ( 2) 2)
|
| [33] | SANTOS P M,PEREIRA-FILHO E R,RODRIGUEZ-SAONA L E.Application of hand-held and portable infrared spectrometers in bovine milk analysis[J]. Journal of Agricultural and Food Chemistry,2013,61(6):1205-1211. ( 2) 2)
|
| [34] | HEUER C,LUINGE H J,LUTZ E T G,et al.Determination of acetone in cow milk by Fourier transform infrared spectroscopy for the detection of subclinical ketosis[J]. Journal of Dairy Science,2001,84(4):575-582. ( 1) 1)
|
| [35] | HANSEN P W.Screening of dairy cows for ketosis by use of infrared spectroscopy and multivariate calibration[J]. Journal of Dairy Science,1999,82(9):2005-2010. ( 1) 1)
|
| [36] | VAN KNEGSEL A T M,VAN DER DRIFT S G A,HORNEMAN M,et al.Short communication:ketone body concentration in milk determined by Fourier transform infrared spectroscopy:value for the detection of hyperketonemia in dairy cows[J]. Journal of Dairy Science,2010,93(7):3065-3069. ( 1) 1)
|
| [37] | VAN DER DRIFT S G A,JORRITSMA R,SCHONEWILLE J T,et al.Routine detection of hyperketonemia in dairy cows using Fourier transform infrared spectroscopy analysis of β-hydroxybutyrate and acetone in milk combination with test-day information[J]. Journal of Dairy Science,2012,95(9):4886-4898. ( 1) 1)
|
| [38] | FRIGGENS N C,RIDDER C,LØVENDAHL P.On the use of milk composition measures to predict the energy balance of dairy cows[J]. Journal of Dairy Science,2007,90(12):5453-5467. ( 1) 1)
|
| [39] | GRIEVE D G,KORVER S,RIJPKEMA Y S,et al.Relationship between milk composition and some nutritional parameters in early lactation[J]. Livestock Production Science,1986,14(3):239-254. ( 1) 1)
|
| [40] | MCPARLAND S,BANOS G,WALL E,et al.The use of mid-infrared spectrometry to predict body energy status of Holstein cows[J]. Journal of Dairy Science,2011,94(7):3651-3661. ( 2) 2)
|
| [41] | MCPARLAND S,BANOS G,MCCARTHY B,et al.Validation of mid-infrared spectrometry in milk for predicting body energy status in Holstein-Friesian cows[J]. Journal of Dairy Science,2012,95(12):7225-7235. ( 2) 2)
|
| [42] | SAVIETTO D,BERRY D P,FRIGGENS N C.Towards an improved estimation of the biological components of residual feed intake in growing cattle[J]. Journal of Animal Science,2014,92(2):467-476. ( 2) 2)
|




