乳腺营养物质代谢一直是奶牛营养研究的热点。乳蛋白是乳中最为重要的营养物质,是衡量乳品质的重要指标之一。氨基酸作为合成乳蛋白的基本单位,在乳腺内代谢活跃,与泌乳密切相关。乳腺从血液中摄取的游离氨基酸绝大部分用于乳蛋白合成,另外也具有重要的代谢调控作用。关于奶牛乳腺氨基酸代谢,体内外已展开大量研究,但氨基酸代谢的分子机制仍不清楚。信号通路研究可从细胞分子水平阐述奶牛营养调控机理,为改善奶牛乳腺机能进而进行营养调控以提高乳品质以及产乳量提供理论依据。
1 乳腺代谢乳腺是乳汁合成的重要场所,其功能特性也是奶牛经济价值的根本体现。哺乳动物乳腺是较为特殊的器官,在整个生命过程中,伴随妊娠进行着周期性发育,并且在不同泌乳阶段具有不同的代谢特征。乳汁在乳腺中的合成与分泌过程复杂,并且其代谢状况影响乳腺对营养物质的摄取吸收[1]。在代谢旺盛的泌乳期,奶牛乳腺合成的蛋白质占全身蛋白质合成量的43%,其中90%为乳蛋白[2]。蛋白质在乳腺内的代谢既有氨基酸组装合成,也存在降解过程,是一动态平衡过程。氨基酸作为乳蛋白合成的前体物,一直是乳蛋白合成代谢研究的重点。深入研究乳腺对氨基酸的利用及氨基酸对乳蛋白合成的调控机制显得尤为必要。
2 乳腺内氨基酸代谢乳腺主要摄取血液中游离的氨基酸。氨基酸通过转运载体进入乳腺上皮细胞,进行蛋白质合成与降解过程。乳腺内氨基酸代谢复杂,各种氨基酸代谢过程及代谢效率需要进一步揭示。乳腺通过增加对必需氨基酸的摄取,以及对非必需氨基酸的选择性摄取平衡配比,以增加乳蛋白的产量,提高可代谢蛋白质的利用率,并使吸收的氨基酸较少地进行分解代谢[3]。激素影响氨基酸的代谢,如生长因子影响多种氨基酸的转运[4],生乳激素可促进氨基酸氧化酶的表达[5]。通过体内灌注同位素标记氨基酸手段研究氨基酸代谢,对氨基酸在机体及乳腺内代谢具有指示性作用,但其具体机制仍有待揭示。由于氨基酸种类繁多,代谢受诸多因素影响,在不同生理状态下代谢不同,大大增加研究难度。只有深入了解反刍动物乳腺组织对氨基酸的摄取代谢模式,才能合理得出各种氨基酸的需求量并对其调控,从而达到提高乳产量、改善乳品质的目的。
2.1 蛋氨酸含硫氨基酸蛋氨酸和半胱氨酸在哺乳动物蛋白质代谢中具有重要作用。蛋氨酸是奶牛在玉米基础饲粮条件下的第一限制性氨基酸,在乳腺中摄取量低于乳分泌量。除与蛋白质合成密切相关,蛋氨酸也以组织特异性的方式进行多种代谢,如生成磷脂、肉毒碱、多胺[6]。同时,蛋氨酸也是一种甲基供体,在一系列转甲基反应,如调控DNA活性、致癌基因活性过程中起到重要作用,并且为半胱氨酸的合成提供硫。单独添加蛋氨酸或同时添加赖氨酸时,可显著提高以玉米为基础饲粮奶牛的乳蛋白合成[7]。在培养的奶牛乳腺上皮细胞中研究发现,蛋氨酸可促进β-酪蛋白基因的表达,其中60s核糖体蛋白的一种亚基(60s核糖体蛋白L35)在蛋氨酸调控β-酪蛋白基因翻译延长和分泌过程中起到重要作用[8]。自然界中L型氨基酸可以构成蛋白质,Lapierre等[9]研究发现D型蛋氨酸虽然不被乳腺摄取利用,但在机体其他部位可转化生成L型蛋氨酸,用于乳蛋白合成。在乳腺中,蛋氨酸和半胱氨酸除了用于合成乳蛋白,是否存在其他作用,且蛋氨酸和半胱氨酸在其他组织中发现的分解代谢途径在乳腺中是否存在均有待于进一步确定。
2.2 赖氨酸乳腺对赖氨酸的摄取量高于乳中分泌量。尽管乳腺对其过度摄取,但赖氨酸仍是奶牛营养限制性氨基酸,这不仅由于赖氨酸可直接用于合成乳蛋白,也与其在乳腺内的代谢密切相关。添加过瘤胃保护性赖氨酸和蛋氨酸可增加乳蛋白产量[10],而相关体外研究进一步发现赖氨酸与蛋氨酸合成乳蛋白的最适比例为3 ∶ 1[11]。Lapierre等[12]对赖氨酸代谢进行了一系列研究,发现赖氨酸在乳腺内发生分解代谢,并为非必需氨基酸合成提供氮,即使在赖氨酸受限制时该过程仍有发生;而当赖氨酸过量时,乳腺摄取量增加并且氧化反应增强。过度摄取的赖氨酸究竟如何代谢,以及赖氨酸如何限制乳蛋白生成等问题均有待阐明。了解赖氨酸的代谢机制,在不同营养条件下可以对其需求量做出预判,从而达到调控乳合成的目的。
2.3 精氨酸精氨酸是一种功能性必需氨基酸,在生长、繁殖、泌乳等生命过程中起重要作用,其乳腺摄取量高于乳分泌量。在泌乳奶牛乳腺中,精氨酸在精氨酸酶催化下转化为氨和鸟氨酸,鸟氨酸在鸟氨酸脱羧酶作用下转化为多胺,具有调控乳生成的作用。精氨酸代谢生成的一氧化氮(NO)可作为血管舒张剂,有利于维持血管通透性,保证组织氨基酸的正常血供。精氨酸也可转化生成非必需氨基酸,如脯氨酸。当乳腺其他必需氨基酸供应充足时,缺乏精氨酸会使乳腺对于精氨酸的吸收减少,但并不降低乳蛋白及乳产量[13],精氨酸与其他氨基酸之间也存在着某些代谢转化。乳腺中精氨酸的代谢在众多氨基酸研究中相对较多,但具体代谢机制仍不清晰,需要进一步确认,也为后续其他氨基酸代谢提供参考思路。
2.4 支链氨基酸亮氨酸、异亮氨酸、缬氨酸是奶牛营养代谢所需的必需氨基酸。尤以亮氨酸为首,有较多代谢相关研究。研究发现挤奶次数可影响亮氨酸在奶山羊乳腺内的代谢[14],而生糖营养物质也可调控亮氨酸的代谢[15]。亮氨酸被乳腺大量吸收,并且摄取量超过乳蛋白分泌量。体外试验表明,由支链氨基酸生成的酮酸不会氧化生成二氧化碳,反而释放到细胞外[16]。酮酸脱氢酶的活性在磷酸化作用下受支链氨基酸和胰岛素调控,当血浆中支链氨基酸浓度降低或胰岛素浓度升高时,酶活性受到抑制。支链氨基酸相应的酮酸氧化可导致乙酰辅酶A和琥珀酰辅酶A生成,进而从根本上引发从头合成非必需氨基酸、脂肪酸和碳骨架。缬氨酸在乳腺中可能除了合成蛋白质还参与包括氧化在内的代谢过程[17]。支链氨基酸的氧化改变可能与乳产量相关,但支链氨基酸氧化的量是否足以影响乳生成仍不得而知。
乳腺内氨基酸代谢为奶牛泌乳提供基础,深入了解各氨基酸的代谢可指示机体整体状况,或可指征疾病。代谢组学方法也为奶牛乳腺内氨基酸代谢研究提供便利,宏观了解各氨基酸的代谢,从而为揭示各代谢通路提供依据[18]。
3 奶牛乳腺氨基酸代谢相关信号通路具有泌乳功能的基因既受自身表达调控,又受外部环境因素,如营养素、激素、温度调节[19]。在奶牛乳腺内氨基酸的代谢涉及诸多信号通路,氨基酸应答(amino acid response,AAR)信号通路可感知氨基酸的平衡;两面神激酶(Janus kinases,JAK)-信号转导子与转录激活子(signal transducers and activators of transcription,STAT)信号通路主要调控乳蛋白的合成;AMP激活蛋白酶(AMP-activated protein kinase,AMPK)信号通路掌控能量平衡;雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路在氨基酸代谢、合成,糖脂代谢等方面均有重要作用,并且与诸多通路密切关联。各信号通路如图1所示。
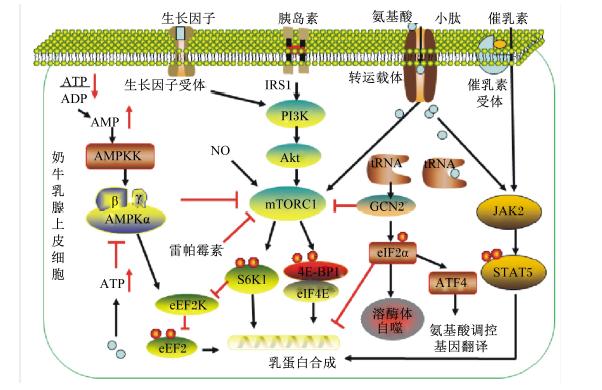 | AMPK:AMP激活蛋白酶 AMP-activated protein kinase;AMPKK:AMPK激酶 AMP-activated protein kinase kinase;eEF2:真核延长因子2 eukaryotic elongation factor 2;eEF2k:真核延长因子2激酶 eukaryotic elongation factor 2 kinase;NO:一氧化氮 nitric oxide;IRS1:胰岛素受体底物1 insulin receptor substrate 1;PI3K:磷脂酰肌醇3激酶 phosphatidylinositol-3-kinase;Akt:蛋白激酶B protein kinase B;mTORC1:雷帕霉素靶蛋白复合物1 mammalian target of rapamycin complex 1;S6K1:核糖体S6蛋白激酶1 translational regulators S6 kinase 1;eIF2α:真核细胞翻译启动因子 eukaryotic translation initiation factor 2α;4E-BP1:真核细胞翻译启动因子4E结合蛋白1 eukaryotic translation initiation factor 4E binding protein;tRNA:转运RNA transfer1 RNA;GCN2:通用控制蛋白2 general control nonderepressible 2;ATF4:转录活化因子4 activating transcription factor 4;JAK2:两面神激酶2 Janus kinase 2;STAT5:信号转导子与转录激活因子5 signal transducer and activator of transcription 5。 图1 奶牛乳腺上皮细胞氨基酸代谢重要信号通路 Fig. 1 Pathways of amino acids metabolism in bovine mammary epithelial cells[20, 21, 22, 23] |
3.1 通用控制蛋白2(general control nonderepressible 2,GCN2)信号通路
细胞通过感知胞内外氨基酸进而对其分配利用,维持其动态平衡状态。GCN2是感知氨基酸缺乏的信号通路,当任何一种氨基酸缺乏时,AAR启动,胞内氨基酸被分配循环利用,在营养限制条件下合成所需的蛋白质。GCN2与空载转运RNA(tRNA)具有高亲和性,当氨基酸充足时,氨基酸被连接到相应的tRNA上;当氨基酸缺乏时,GCN2则与空载tRNA相连引发构象改变,激活真核细胞翻译启动因子(eukaryotic translation initiation factor,eIF)2α[21],抑制大多数蛋白质的合成,也特异性激活转录活化因子4(activating transcription factor 4,ATF4),促进一些氨基酸代谢调控基因翻译,如氨基酸转运载体、氨基酸代谢酶、能量调节因子,调控细胞内氨基酸缺失应答。氨基酸的不平衡也会对糖脂代谢造成影响[24]。添加组氨酸和支链氨基酸可减少Mac-T细胞eIF2α磷酸化;尽管能够使培养的乳腺组织中乳蛋白合成率改变,但并不影响组织块中eIF2α的磷酸化[25]。体内试验研究表明,支链氨基酸以及赖氨酸的缺乏会导致eIF2α表达上调。尽管在亮氨酸和赖氨酸缺乏条件下,eIF2α表达量得以维持,但乳蛋白产量下降说明存在其他因素调控赖氨酸和亮氨酸的代谢[26]。稳态的维持是氨基酸代谢的重要过程,了解其机制有利于透彻认知氨基酸代谢。GCN2信号通路的研究目前常见于人类疾病如癌症中,奶牛营养研究或可从营养缺乏角度提供研究思路。
3.2 AMPK信号通路AMPK信号通路在不同种类细胞中具有功能性调节细胞代谢以及协调几种代谢应答的作用,可在细胞水平,甚至机体整体水平调控代谢能量平衡。泌乳期乳腺需要大量能量供应,AMPK信号通路起到关键作用,并调控奶牛脂肪代谢,在奶牛肝脏中也起到重要作用。Mahmoudi等[27]利用基因组学方法发现AMPKγ1基因上影响乳蛋白及乳产量的突变位点。AMPK通过真核延长因子(eukaryotic elongation factor 2,eEF2)激酶与mTOR抑制蛋白质合成。活化的AMPK可抑制mTOR及其效应器的活性[28],并激活eEF2激酶,使eEF2磷酸化失活,从而抑制蛋白质的合成,减少ATP的损耗。其调控机制是AMPK的激活多发生在应激条件下,AMP/ATP,瘦素、脂联素等激素以及AMPK激酶(AMPKK)对AMPK的激活均有调节作用[29]。在培养的奶牛乳腺上皮细胞中添加必需氨基酸可增加ATP浓度,抑制AMPK的磷酸化,影响乳蛋白合成[23]。此外,葡萄糖、乙酸等能量物质可通过AMPK-mTOR信号通路调控乳蛋白的生成[30]。能量可以作为衡量代谢程度的指标,通过AMPK信号通路研究有利于从能量水平揭示氨基酸代谢过程,为氨基酸代谢研究提供新思路。
3.3 JAK-STAT信号通路JAK-STAT信号通路参与生物体凋亡、生长、增殖及炎症反应等多种生命活动。JAK与STAT包括多种激酶,在奶牛乳腺组织中的研究主要集中在JAK2-STAT5信号通路[11]。该通路是酪蛋白合成转录的重要通路,催乳素结合受体激活JAK2,JAK2使STAT5磷酸化,继而引发酪蛋白合成转录。在多种动物细胞中已发现催乳素、生长激素、表皮生长因子、促红细胞生成素等30种以上细胞因子能够激活STAT蛋白[31],但其激素激活机制仍待研究。氨基酸通过JAK2-STAT5信号通路调控乳生成,主要通过STAT5a基因调节乳蛋白的表达[32]。研究证实,蛋氨酸、亮氨酸以及赖氨酸在奶牛乳腺上皮细胞泌乳过程中起重要调节作用,能够调节乳蛋白合成信号通路中的关键蛋白表达,从而提高奶牛乳腺上皮细胞的增殖能力以及乳糖、乳脂和乳蛋白合成[33, 34]。最新研究表明,蛋氨酸-蛋氨酸二肽通过JAK-STAT信号通路影响乳蛋白的合成[35]。JAK-STAT信号通路对免疫应答也有着重要调控作用,对于该信号通路有待更多的探索。
3.4 mTOR信号通路mTOR信号通路是奶牛乳腺氨基酸代谢的重要通路,不仅调控乳蛋白合成也感知氨基酸丰度,同时还关联其他代谢通路。mTOR复合物1(mTORC1)对雷帕霉素敏感,主要控制蛋白质合成、脂肪合成、能量代谢和自噬等多种细胞生命活动,是乳腺氨基酸代谢通路中的关键调控点。其活性受生长因子、激素、能量以及氨基酸调控,生长因子、激素的调控机制已经得到确定,均通过磷脂酰肌醇3激酶(PI3K)-蛋白激酶B(Akt)-mTOR通路刺激乳蛋白生成[36],而氨基酸调控机制仍有待进一步确定。
3.4.1 氨基酸感知及调控mTORC1对各种氨基酸敏感度不同,对亮氨酸最为敏感。不同于GCN2信号通路可以感知任何一种氨基酸的缺乏,mTOR只感受几种特定氨基酸的存在,即在氨基酸充足时通路才会被激活。研究发现,亮氨酸、精氨酸以及组氨酸对酪蛋白基因翻译调控以及mTOR通路上相关基因的表达都起到重要作用[37, 38]。并且不同氨基酸激活mTOR通路的同时也存在互作。在培养的奶牛乳腺组织中添加异亮氨酸和苏氨酸均可影响mTOR的磷酸化,但两者的作用却是相抵抗的,异亮氨酸增加核糖体蛋白S6的磷酸化,而苏氨酸则可抑制该效果[39]。虽然已有诸多关于氨基酸调控mTOR的研究,但氨基酸感知及调控mTORC1的分子机制至今仍不明确。mTORC1虽对于氨基酸水平的改变高度敏感,但却不是氨基酸受体。SLC38A9作为一种氨基酸转运受体,不仅具有转运氨基酸进出细胞以及溶酶体等细胞器的功能,还可感知氨基酸,可以使mTORC1感知精氨酸[40]。而谷氨酰胺刺激mTORC1激活则依赖于溶酶体和空泡H+-ATP酶(V-ATPase)的活性,这与感知亮氨酸的方式不同[41],可见mTOR感受氨基酸的机制较为复杂。氨基酸增强乳蛋白的合成与mTOR及其下游信号真核细胞翻译启动因子4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein,4E-BP1)和核糖体S6蛋白激酶(translational regulators S6 kinase 1,S6K1)的磷酸化相关。Appuhamy等[42]发现,必需氨基酸增强mTOR通路上mTOR、S6K1、4EBP1以及胰岛素受体底物(insulin receptor substrate 1,IRS1)的磷酸化,并且对于调控蛋白质合成翻译起始和延长过程中各控制点的作用强于胰岛素。相关体内试验也表明,调控蛋白质合成的细胞信号分子对于营养性刺激的应答是不同的[43]。
3.4.2 小肽调控除氨基酸外,小肽也可通过mTOR信号通路调控乳蛋白合成。Yang等[44]在培养的奶牛乳腺组织中添加蛋氨酸-蛋氨酸二肽替换蛋氨酸发现,αs1酪蛋白基因表达量可显著升高,并且mTOR通路上的关键基因表达量也显著增加。小肽逐渐成为近年研究热点,在奶牛营养研究中功能性作用日趋被发现,该试验研究也为乳蛋白合成研究提供理论基础。但目前对于小肽调控mTOR通路的机制仍有许多未知,需更进一步研究。
4 小 结乳腺内氨基酸代谢极其复杂,在不同生理状况、不同环境影响等条件下,GCN2、AMPK、JAK-STATE、mTOR等信号通路通过对氨基酸进行相应的感知反馈,在乳腺氨基酸代谢利用中均发挥重要作用。此外,环单磷酸鸟苷依赖性激酶(cGMP-dependent kinase)、环一磷酸腺苷依赖性激酶(cAMP-dependent kinase)等信号通路以及一些气体分子如硫化氢也可能调控奶牛乳腺代谢。对奶牛乳腺氨基酸代谢信号通路分子机理的揭示,将有助于阐明奶牛乳腺中乳蛋白代谢机制,为提高奶牛及其他家畜的生产效率,提供最优化营养调控策略提供依据,并将对奶牛生产产生深远影响。
| [1] | NICHOLS J R,SCHINGOETHE D J,MAIGA H A,et al.Evaluation of corn distillers grains and ruminally protected lysine and methionine for lactating dairy cows[J]. Journal of Dairy Science,1998,81(2):482-491. ( 1) 1)
|
| [2] | THIVIERGE M C,PETITCLERC D,BERNIER J F,et al.Variations in mammary protein metabolism during the natural filling of the udder with milk over a 12-h period between two milkings:leucine kinetics[J]. Journal of Dairy Science,2002,85(11):2974-2985. ( 1) 1)
|
| [3] | HAQUE M N,GUINARD-FLAMENT J,LAMBERTON P,et al.Changes in mammary metabolism in response to the provision of an ideal amino acid profile at 2 levels of metabolizable protein supply in dairy cows:consequences on efficiency[J]. Journal of Dairy Science,2015,98(6):3951-3968. ( 1) 1)
|
| [4] | SCIASCIA Q L,PACHECO D,MCCOARD S A.Administration of exogenous growth hormone is associated with changes in plasma and intracellular mammary amino acid profiles and abundance of the mammary gland amino acid transporter SLC3A2 in mid-lactation dairy cows[J]. PLoS One,2015,10(7):e0134323. ( 1) 1)
|
| [5] | FUJII K,ZHANG H L,USUDA K,et al.Lactogenic hormone stimulation and epigenetic control of L-amino acid oxidase expression in lactating mammary glands[J]. Journal of Cellular Physiology,2015,230(11):2755-2762. ( 1) 1)
|
| [6] | MANJARIN R,BEQUETTE B J,WU G Y,et al.Linking our understanding of mammary gland metabolism to amino acid nutrition[J]. Amino Acids,2014,46(11):2447-2462. ( 1) 1)
|
| [7] | WEEKES T L,LUIMES P H,CANT J P.Responses to amino acid imbalances and deficiencies in lactating dairy cows[J]. Journal of Dairy Science,2006,89(6):2177-2187. ( 1) 1)
|
| [8] | JIANG N,HU L J,LIU C N,et al.60S ribosomal protein L35 regulates β-casein translational elongation and secretion in bovine mammary epithelial cells[J]. Archives of Biochemistry and Biophysics,2015,583:130-139. ( 1) 1)
|
| [9] | LAPIERRE H,HOLTROP G,CALDER A G,et al.Is D-methionine bioavailable to the dairy cow?[J]. Journal of Dairy Science,2012,95(1):353-362. ( 1) 1)
|
| [10] | LEE C,Hristov A N,CASSIDY T W,et al.Rumen-protected lysine,methionine,and histidine increase milk protein yield in dairy cows fed a metabolizable protein-deficient diet[J]. Journal of Dairy Science,2012,95(10):6042-6056. ( 1) 1)
|
| [11] | NAN X M,BU D P,LI X Y,et al.Ratio of lysine to methionine alters expression of genes involved in milk protein transcription and translation and mTOR phosphorylation in bovine mammary cells[J]. Physiological Genomics,2014,46(7):268-275. ( 2) 2)
|
| [12] | LAPIERRE H,DOEPEL L,MILNE E,et al.Responses in mammary and splanchnic metabolism to altered lysine supply in dairy cows[J]. Animal,2009,3(3):360-371. ( 1) 1)
|
| [13] | DOEPEL L,LAPIERRE H.Deletion of arginine from an abomasal infusion of amino acids does not decrease milk protein yield in Holstein cows[J]. Journal of Dairy Science,2011,94(2):864-873. ( 1) 1)
|
| [14] | BEQUETTE B J,DOUGLASS L W.The frequency of unilateral milking alters leucine metabolism and amino acid removal by the mammary gland of lactating goats[J]. Journal of Dairy Science,2010,93(1):162-169. ( 1) 1)
|
| [15] | CANTALAPIEDRA-HIJAR G,ORTIGUES-MARTY I,LEMOSQUET S.Diets rich in starch improve the efficiency of amino acids use by the mammary gland in lactating Jersey cows[J]. Journal of Dairy Science,2015,98(10):6939-6953. ( 1) 1)
|
| [16] | LEI J,FENG D Y,ZHANG Y L,et al.Nutritional and regulatory role of branched-chain amino acids in lactation[J]. Frontiers in Bioscience:Landmark Edition,2012,17:2725-2739. ( 1) 1)
|
| [17] | GUAN X,BEQUETTE B J,CALDER G,et al.Amino acid availability affects amino acid flux and protein metabolism in the porcine mammary gland[J]. The Journal of Nutrition,2002,132(6):1224-1234. ( 1) 1)
|
| [18] | SUN H Z,WANG D M,WANG B,et al.Metabolomics of four biofluids from dairy cows:potential biomarkers for milk production and quality[J]. Journal of Proteome Research,2015,14(2):1287-1298. ( 1) 1)
|
| [19] | WU G Y.Amino acids:metabolism,functions,and nutrition[J]. Amino Acids,2009,37(1):1-17. ( 1) 1)
|
| [20] | BIONAZ M,LOOR J J.Gene networks driving bovine mammary protein synthesis during the lactation cycle[J]. Bioinformatics and Biology Insights,2011,5:83-98. ( 1) 1)
|
| [21] | TSALIKIS J,CROITORU D O,PHILPOTT D J,et al.Nutrient sensing and metabolic stress pathways in innate immunity[J]. Cellular Microbiology,2013,15(10):1632-1641. ( 2) 2)
|
| [22] | APELO S I A,KNAPP J R,HANIGAN M D.Invited review:current representation and future trends of predicting amino acid utilization in the lactating dairy cow[J]. Journal of Dairy Science,2014,97(7):4000-4017. ( 1) 1)
|
| [23] | APPUHAMY J A D R N,NAYANANJALIE W A,ENGLAND E M,et al.Effects of AMP-activated protein kinase (AMPK) signaling and essential amino acids on mammalian target of rapamycin (mTOR) signaling and protein synthesis rates in mammary cells[J]. Journal of Dairy Science,2014,97(1):419-429. ( 2) 2)
|
| [24] | GUO F F,CAVENER D R.The GCN2 eIF2α kinase regulates fatty-acid homeostasis in the liver during deprivation of an essential amino acid[J]. Cell Metabolism,2007,5(2):103-114. ( 1) 1)
|
| [25] | APELO S I A,NAYANANJALIE W A D,APPUHAMY J A D R N,et al.mTOR independent model of protein synthesis regulation by essential amino acids in mammary epithelial cells[M]//CROVETTO M G.Energy and protein metabolism and nutrition.Wageningen,the Netherlands:Wageningen Academic Publishers,2010:247. ( 1) 1)
|
| [26] | DOELMAN J,KIM J J,CARSON M,et al.Branched-chain amino acid and lysine deficiencies exert different effects on mammary translational regulation[J]. Journal of Dairy Science,2015,98(11):7846-7855. ( 1) 1)
|
| [27] | MAHMOUDI A,ZARGARAN A,AMINI H R,et al.A SNP in the 3'-untranslated region of AMPKγ1 may associate with serum ketone body and milk production of Holstein dairy cows[J]. Gene,2015,574(1):48-52. ( 1) 1)
|
| [28] | PARK S H,GAMMON S R,KNIPPERS J D,et al.Phosphorylation-activity relationships of AMPK and acetyl-CoA carboxylase in muscle[J]. Journal of Applied Physiology,2002,92(6):2475-2482. ( 1) 1)
|
| [29] | HARDIE D G,ROSS F A,HAWLEY S A.AMPK:a nutrient and energy sensor that maintains energy homeostasis[J]. Nature Reviews Molecular Cell Biology,2012,13(4):251-262. ( 1) 1)
|
| [30] | BURGOS S A,DAI M,CANT J P.Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J]. Journal of Dairy Science,2010,93(1):153-161. ( 1) 1)
|
| [31] | CHAUDHARI N,ROPER S D.The cell biology of taste[J]. The Journal of Cell Biology,2010,190(3),285-296. ( 1) 1)
|
| [32] | LIU X F,LI M,LI Q Z,et al.Stat5a increases lactation of dairy cow mammary gland epithelial cells cultured in vitro[J]. In Vitro Cellular & Developmental Biology:Animal,2012,48(9):554-561. ( 1) 1)
|
| [33] | WANG L N,LIN Y,BIAN Y J,et al.Leucyl-tRNA synthetase regulates lactation and cell proliferation via mTOR signaling in dairy cow mammary epithelial cells[J]. International Journal of Molecular Sciences,2014,15(4):5952-5969. ( 1) 1)
|
| [34] | LU L M,LI Q Z,HUANG J G,et al.Proteomic and functional analyses reveal MAPK1 regulates milk protein synthesis[J]. Molecules,2013,18(1):263-275. ( 1) 1)
|
| [35] | 杨建香.奶牛乳腺蛋氨酸二肽的摄取及其影响乳蛋白合成的机制研究[D]. 硕士学位论文.杭州:浙江大学,2014:125-133. ( 1) 1)
|
| [36] | HAY N,SONENBERG N.Upstream and downstream of mTOR[J]. Genes & Development,2004,18(16):1926-1945. ( 1) 1)
|
| [37] | WANG M Z,XU B L,WANG H R,et al.Effects of arginine concentration on the in vitro expression of casein and mTOR pathway related genes in mammary epithelial cells from dairy cattle[J]. PLoS One,2014,9(5):e95985. ( 1) 1)
|
| [38] | GAO H N,HU H,ZHENG N,et al.Leucine and histidine independently regulate milk protein synthesis in bovine mammary epithelial cells via mTOR signaling pathway[J]. Journal of Zhejiang University Science B,2015,16(6):560-572. ( 1) 1)
|
| [39] | ARRIOLA A S I,SINGER L M,LIN X Y,et al.Isoleucine,leucine,methionine,and threonine effects on mammalian target of rapamycin signaling in mammary tissue[J]. Journal of Dairy Science,2014,97(2):1047-1056. ( 1) 1)
|
| [40] | REBSAMEN M,POCHINI L,STASYK T,et al.SLC38A9 is a component of the lysosomal amino acid sensing machinery that controls mTORC1[J]. Nature,2015,519(7544):477-481. ( 1) 1)
|
| [41] | JEWELL J L,KIM Y C,RUSSELL R C,et al.Differential regulation of mTORC1 by leucine and glutamine[J]. Science,2015,347(6218):194-198. ( 1) 1)
|
| [42] | APPUHAMY J A D R N,Bell A L,NAYANANJALIE W A D,et al.Essential amino acids regulate both initiation and elongation of mRNA translation independent of insulin in MAC-T cells and bovine mammary tissue slices[J]. The Journal of Nutrition,2011,141(6):1209-1215. ( 1) 1)
|
| [43] | RIUS A G,APPUHAMY J A D R N,CYRIAC J,et al.Regulation of protein synthesis in mammary glands of lactating dairy cows by starch and amino acids[J]. Journal of Dairy Science,2010,93(7):3114-3127. ( 1) 1)
|
| [44] | YANG J X,WANG C H,XU Q B,et al.Methionyl-methionine promotes α-s1 casein synthesis in bovine mammary gland explants by enhancing intracellular substrate availability and activating JAK2-STAT5 and mTOR-mediated signaling pathways[J]. The Journal of Nutrition,2015,145(8):1748-1753. ( 1) 1)
|




