2. 中国科学院亚热带农业生态研究所, 中国科学院亚热带农业生态过程重点实验室, 湖南省畜禽健康养殖工程技术中心, 长沙 410125
2. Key Laboratory of Agro-Ecological Processes in Subtropical Region, Hunan Provincial Engineering Research Center of Healthy Livestock, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China
色氨酸(tryptophan,Trp)是一种必需氨基酸,也是畜禽饲粮的限制性氨基酸之一。多年来的研究发现,色氨酸在机体内主要有以下生理作用:1)作为底物合成蛋白质;2)增加畜禽采食量;3)减轻动物的应激反应;4)提高动物生长性能;5)降低肝脏脂肪含量;6)生成激素类物质;7)提高饲料利用率[1, 2]。近年来还发现,色氨酸在调节畜禽免疫功能方面也发挥着重要作用。饲粮中色氨酸不足会降低动物机体的营养水平和免疫功能,同时动物对疾病的易感性、发病率和死亡率大幅度增加[3]。色氨酸作为与免疫相关蛋白的限制性氨基酸,直接调节动物的体液免疫。大量动物试验证明,色氨酸对巨噬细胞的吞噬能力和脾脏淋巴细胞的增殖能力有一定影响,而且色氨酸能抑制T淋巴细胞的增殖和分化,对肿瘤细胞免疫逃逸可能有一定作用[4, 5];此外,饲粮中色氨酸含量升高会促进动物血清中免疫球蛋白的合成,增强机体的免疫力[6]。色氨酸主要通过其代谢产物在机体不同器官和组织中发挥免疫调控作用。本文对色氨酸的代谢途径、代谢物的作用途径及这些物质在畜禽中的免疫调节作用进行综述,旨在总结前人的相关研究,为今后色氨酸在免疫调控方面的深入研究和应用提供指导。
1 色氨酸的代谢途径动物摄入体内的色氨酸一方面用于合成蛋白质,另一方面主要在肝脏中进行分解代谢。色氨酸的分解代谢主要包括2条途径:一是沿5-羟色胺(5-hydroxytryptamine,5-HT)的代谢途径;二是沿犬尿氨酸(kynurenine)的代谢途径[7]。仅有5%的色氨酸通过色氨酸羟化酶生成5-羟色氨酸,并在氨基酸脱羧酶作用下生成5-HT,最终经N-乙酰转移酶生成褪黑激素(melatonin)。而95%的色氨酸主要在色氨酸2,3-双加氧酶(tryptophan 2,3-dioxygenase,TDO)和吲哚2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)这2种限速酶的作用下沿犬尿氨酸途径进行代谢,生成的犬尿氨酸大部分被犬尿氨酸羟化酶分解成3-羟犬尿氨酸,再由3-羟犬尿氨酶催化水解为3-羟邻氨苯甲酸,最后经多级酶促反应生成喹啉酸(quinolinic acid,QA)、吡啶羧酸类及尼克酰胺腺嘌呤二核苷酸(如烟酸)等活性分子;仅有一小部分是在犬尿氨酸氨基转移酶作用下生成犬尿喹啉酸[8]。色氨酸代谢过程中产生的一系列活性物质,如犬尿氨酸、喹啉酸、5-HT和褪黑激素等,都具有调节机体免疫功能的作用。色氨酸代谢途径如图1所示。
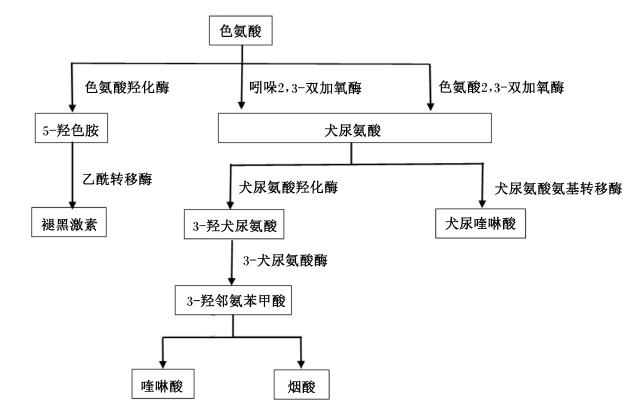 | 图1 色氨酸代谢途径 Fig. 1 The metabolic pathways of tryptophan[8] |
IDO是色氨酸/犬尿氨酸途径的限速酶,广泛存在于哺乳动物肝脏以外的组织细胞内,在色氨酸发挥免疫功能过程中起重要作用[9]。IDO可以被前炎症因子及其他免疫调节因子所诱导,而干扰素-γ是最强的诱导剂,在机体发生炎症时,干扰素-γ正反馈调节色氨酸发挥免疫功能[10]。研究发现,感染炎症后野生小鼠IDO基因表达量升高,而将干扰素基因敲除后,野生小鼠在受到相同细菌感染后IDO基因表达量不变[11]。色氨酸能够抑制T细胞的增殖,促进其凋亡,也是通过IDO来发挥作用。一方面,IDO会使局部色氨酸耗竭,使T细胞停滞于G1期,抑制T细胞增殖;另一方面,通过机体自身的免疫调节机制,IDO催化色氨酸代谢产生犬尿素,引起胞内氧化剂和抗氧化剂改变而诱导T细胞凋亡[12, 13, 14]。IDO表达型(IDO+)细胞可能通过激活T细胞表面的蛋白激酶来抑制T细胞的增殖和活动。IDO是一种胞内酶,会使细胞内环境形成一种“色氨酸耗竭”状态,同时激活一般阻遏蛋白激酶2(general control nondepressing2,GCN2)来抑制淋巴细胞增殖分化,起到抗炎作用[15]。而色氨酸经犬尿氨酸途径的代谢产物可以作为芳香烃受体(aryl hydrocarbon receptor,AHR)的配体,与其结合后发挥免疫抑制功能[16]。
近年来还发现,IDO还可以诱导线粒体产生活性氧(reactive oxygen species,ROS)[17]。ROS可以抑制淋巴细胞功能并促进其凋亡,自然杀伤性(NK)细胞对ROS的敏感性较其他淋巴细胞高。随着IDO代谢产物含量升高,胞内的氧化氢酶和谷胱甘肽等抗氧化剂的活性或含量下降,ROS含量相对升高,从而使NK细胞功能受到的抑制作用更显著。总之,IDO可通过降解局部组织中的色氨酸来影响淋巴细胞功能,在自身免疫疾病、慢性感染、母胎耐受和肿瘤逃逸等代谢性免疫调节中发挥着重要作用[18]。
2.2 犬尿氨酸研究发现,犬尿氨酸不仅具有负向调节免疫应答的作用,还能抑制T细胞和NK细胞的增殖功能。此外,犬尿氨酸也可以通过负向调节树突状细胞的免疫原性,从而促使初始T细胞向调节性T细胞分化,阻止其向辅助性T17(Th17)细胞分化。在犬尿氨酸酶作用下,3-羟基犬尿酸可以生成羟基邻氨基苯甲酸、喹啉酸等具有免疫活性的物质。研究表明,在免疫调节中,一定量的犬尿氨酸及其产物可以抑制促炎细胞因子白细胞介素-17(IL-17)的生成,进而抑制Th17细胞的成熟分化,促进CD4+T细转化为CD4+和CD25+Foxp3+调节性T细胞,减轻机体炎症反应[19]。Bauer等[20]通过体外对小鼠异型基因移植,发现犬尿氨酸能抑制同种异型基因T细胞的增殖,诱导T细胞凋亡。进一步的研究表明,低剂量的犬尿氨酸可诱导T细胞的凋亡[21]。
2.3 喹啉酸喹啉酸是一种内源性神经毒素,在富含T细胞的树突细胞和巨噬细胞中含量较高,而在非淋巴细胞中检测到其含量基本为零。炎症状态下,色氨酸降解加速生成大量的喹啉酸,直至炎症消失。研究发现,喹啉酸主要在免疫细胞中合成,且肝脏内不能储存;当免疫细胞被干扰素及其他免疫刺激因子诱导时,喹啉酸含量升高[22]。3-羟犬尿氨酸原和喹啉酸可诱导辅助性T1(Th1)细胞凋亡而不影响辅助性T2(Th2)细胞,若同时给药,一些胸腺细胞会出现使用环磷酰胺时的萎缩现象[21]。
2.4 5-HT和褪黑激素5-HT是一种神经递质。研究表明,5-HT作为免疫调节因子在机体神经免疫调节过程中发挥着重要作用[23]。5-HT可以通过结合不同的受体发挥相应的免疫功能,对嗜酸性粒细胞、肥大细胞和树突状细胞都有趋化作用。5-HT还可以增加成熟树突状细胞中能促进体液免疫反应的细胞因子白细胞介素-6(IL-6)和白细胞介素-10(IL-10)的产生,从而调节适应性免疫应答[24]。除此之外,5-HT还可以提高NK细胞杀伤力,但具体作用机制还不清楚[25]。
褪黑激素是一种松果体激素,可以促进胸腺和脾脏等免疫器官的增大,进而使脾细胞和淋巴细胞体积增生[26]。褪黑激素通过诱导巨噬细胞产生白细胞介素和干扰素,促进免疫细胞释放免疫因子,进一步调节免疫平衡[27]。给哺乳动物注射褪黑激素后,产生大量NK细胞,骨髓内单核细胞活力增强[28]。Esteban等[13]研究表明,褪黑激素可促进肿瘤细胞凋亡,可能对乳腺癌、结肠癌和前列腺癌等多种肿瘤疾病具有一定的抑制作用。
3 色氨酸发挥免疫功能时的拮抗作用色氨酸及其主要代谢产物5-HT、褪黑激素等对畜禽免疫都有一定的调节作用。然而,机体内部分氨基酸之间存在一定的相互作用,尤其是在吸收途径相同的情况产生的拮抗作用。色氨酸的转运与一些大分子中性氨基酸(包括亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸和酪氨酸)进入血脑屏障的途径相同。研究发现,色氨酸和周边的支链氨基酸跨越血脑屏障进入脑需要共同的L型氨基酸转运载体1(L-type amino acid transporter-1,LAT1)和白蛋白结合位点,血清中色氨酸与支链氨基酸的比值直接影响脑中色氨酸含量[29, 30]。当饲粮中支链氨基酸含量增加时,通过血脑屏障的色氨酸分子就会减少,脑中5-HT含量随之降低[31]。5-HT作用于下丘脑的采食中枢,对动物采食量发挥调节作用。当机体中色氨酸与支链氨基酸的比值失衡时,动物的采食量会有所下降,同时免疫功能也会受到一定程度的影响[32]。在应用色氨酸调控机体免疫功能时,要注意调整饲粮中支链氨基酸的含量。
4 色氨酸对畜禽免疫功能的影响色氨酸作为功能性氨基酸,在不同种类和生理阶段的畜禽机体内发挥着不同程度的免疫调控作用。当机体发生炎症或应激反应时,色氨酸加速分解,促进淋巴细胞、免疫球蛋白等生成,进而提高体液免疫。色氨酸主要通过其代谢产物在畜禽不同器官和组织中发挥免疫调节作用。
4.1 胎猪妊娠是猪生长发育过程中的一个特殊阶段,胎猪的生长发育、营养程序以及产后仔猪健康都取决于母体胎盘营养供给。胎盘是母胎物质交换的场所,胎盘养分的转化能力直接决定胎猪对养分的摄取。研究发现,胎盘滋养细胞、蜕膜细胞及蜕膜间质细胞等都可以表达IDO,从而调节母猪妊娠期的免疫耐受、胚胎的生长发育,使胎儿免受母体T细胞攻击,避免流产[33]。Mosnier等[34]发现,给妊娠母猪饲粮中添加等量色氨酸,不敏感猪的血浆色氨酸含量低于敏感反应猪,妊娠期间的低反应更利于仔猪的出生。Kudo等[17]发现,在人早孕绒毛和足月胎盘组织体外细胞中添加色氨酸至生理浓度且无干扰素-γ时,仅色氨酸和苏氨酸被代谢利用,色氨酸含量显著降低。色氨酸对调节妊娠期免疫耐受有一定影响,但对其在胎盘的营养和代谢过程的作用机理有待进一步探讨。
4.2 仔猪仔猪获得免疫保护主要来自2个方面:一是通过母乳获得大量免疫蛋白;二是自身免疫系统的发育。仔猪在断奶阶段承受了巨大的应激,再加上其免疫系统发育尚不完善,抵抗力弱,因此肠道易遭受大肠杆菌的感染。而色氨酸可促进骨髓T细胞分化为成熟T细胞,提高血液中免疫球蛋白含量。Trevisi等[35]通过给21日龄的断奶仔猪口服大肠杆菌,又喂给含充足色氨酸的饲粮,发现饲喂含充足色氨酸饲粮的仔猪日增重显著高于对照组,血液免疫球蛋白A(IgA)的含量也显著增加。Le Floc’H等[36]发现,猪感染肺炎后肺中IDO活性和相关的淋巴结数量增加。当给仔猪饲喂含色氨酸较少的饲粮时,其血浆中急性期蛋白结合蛋白(炎症标志物)的含量较饲喂色氨酸足量饲粮的仔猪增高。这些研究结果显示,当机体发生免疫反应时,色氨酸的犬尿氨酸代谢途径加快,饲粮中的色氨酸会减轻炎症对仔猪的不良影响。仔猪处于炎症状态或产生免疫应激时(多发生在断奶或哺乳期)对色氨酸的需求可能会增加。Willemen等[37]发现色氨酸的代谢产物5-HT可以提高低胎龄仔猪和正常仔猪的肠道免疫,从而减少围产期的死亡率。
4.3 母猪母猪的营养状况与胎儿及新生仔猪的生长和健康息息相关。子宫内色氨酸对内环境稳态相当重要,可以起到改善繁殖性能的作用。色氨酸主要通过平衡Th1与Th2细胞的比例来调节母猪的免疫反应,而Th1与Th2细胞的比例平衡对提高母猪受孕率和减少流产率具有决定性作用。研究发现,母猪在妊娠期一旦感染疾病,Th1型促炎症细胞因子就会增加,导致Th1与Th2细胞的比例平衡被破坏,使妊娠无法正常进行[38]。母猪饲粮中添加一定量的色氨酸对提高繁殖力也有一定作用[16]。另外,对于妊娠母猪,子宫免疫耐受器官中色氨酸作为IDO的最适底物,诱导大量IDO的产生,促进色氨酸降解产物生成,进而参与细胞免疫调节,使胎儿免受母体排斥,降低流产率[39]。邱时秀[40]发现,色氨酸可以促进感染伪狂犬病毒(PRV)鼠体内抗病毒蛋白的合成,增强机体免疫力。Poletto等[41]发现,在混群期母猪的饲粮中添加高剂量的色氨酸可以减少其攻击行为,使其抗应激能力增强。因此,色氨酸对提高母猪免疫力、繁殖能力和减少攻击行为都有重要调节作用。
4.4 生长猪色氨酸是动物体内唯一与血清白蛋白结合的氨基酸,在机体免疫过程中发挥重要作用。Melchior等[42]研究发现,猪经诱导产生肺炎后,其血浆色氨酸的含量相对健康猪要低,色氨酸是唯一会引起该效应的氨基酸,说明动物在患炎症或疾病时色氨酸的利用率提高。色氨酸的分解代谢对免疫细胞(如巨噬细胞和淋巴细胞)维持其免疫功能至关重要。Platten等[43]研究发现,色氨酸-IDO代谢途径是其发挥免疫功能的关键途径,代谢产物邻氨基苯甲酸通过抑制促炎细胞因子生成,避免自身免疫神经炎症的产生。色氨酸代谢产物影响T细胞的分化和B细胞的成熟,进而影响B细胞分泌免疫球蛋白G(IgG)的能力[44]。王军等[45]在接种呼吸综合征(PRRS)弱毒苗的生长猪的饲粮中添加不同水平的色氨酸和苏氨酸,发现血清中免疫球蛋白含量升高,表明色氨酸可能通过促进炎症细胞因子生成来强化免疫功能。这与Xu等[46]的研究结果一致,后者通过研究色氨酸和苏氨酸含量不同的饲粮对PRRS诱导的生长猪免疫性能的影响,发现血清中免疫性抗体、干扰素以及IL-10和白细胞介素-1β(IL-1β)的含量都显著增加,说明色氨酸在炎症反应调节中起一定作用。
4.5 禽类色氨酸在动物体液免疫调节中发挥着重要作用。免疫器官是机体执行免疫功能的组织结构,也是淋巴细胞和其他免疫细胞增殖、分化以及免疫应答的重要场所。研究表明,色氨酸可以促进脾脏发育,进而提高机体免疫力。魏宗友等[47]通过给扬州鹅饲喂色氨酸含量不同的饲粮,发现饲粮中适量的色氨酸可提高扬州鹅脾脏指数和血液中IgG及免疫球蛋白M(IgM)的含量,表明色氨酸有利于脾脏的生长发育,从而提高机体免疫力。刘肖挺等[48]也发现,添加不同水平的色氨酸可显著提高蛋雏鸭免疫器官(脾脏、胸腺、法氏囊)的生长发育,增强机体免疫功能。色氨酸可以稳定核多糖,进而利于合成球蛋白,一旦缺乏会导致血液中IgM和IgG含量下降[9]。Emadi等[49]研究发现,给不同时期感染法氏囊病毒(IBD)的肉鸡饲喂色氨酸,其血清中干扰素-α、干扰素-β和IgG含量在饲喂30 d左右显著增加,这些结果表明色氨酸对法氏囊病有一定抵御作用。Emadi等[50]研究发现,在感染IBD的不同日龄肉仔鸡的饲粮中添加适量的色氨酸后血清中干扰素-α、干扰素-γ和IgG含量显著升高,表明色氨酸对IBD的保护性免疫应答起重要作用。
4.6 反刍动物无论是单胃动物还是反刍动物,当机体发生炎症反应或免疫系统活化时,氨基酸代谢大多会激活。作为幼龄羊的第三限制性氨基酸,色氨酸缺乏会导致幼龄羊出现生长迟缓、采食减少、抗病力差等不良症状[51]。高剂量的色氨酸会导致组织异常白细胞的聚集,表明色氨酸在免疫系统中代谢活跃。预防乳房炎是乳牛生产过程中亟待解决的难题,色氨酸可以作用于胸腺淋巴系统,促进T细胞增殖分化,诱导产生大量的淋巴因子,对降低乳牛隐形乳房炎有一定作用[52]。色氨酸作为一种瘤胃保护剂,能够调节瘤胃内微生物活动所处的适宜pH,避免瘤胃酸中毒以及由此引发的蹄叶炎[53]。除此之外,色氨酸的代谢终产物烟酸可以减轻奶牛泌乳早期的能量应激,调节脂肪代谢,预防酮病的发生[54]。
5 小 结综上所述,色氨酸及其代谢产物在调节畜禽免疫机制尤其是体液免疫中发挥着重要作用。其主要作用途径是调节免疫球蛋白和淋巴细胞的生成,进而提高机体免疫力。但目前关于色氨酸增强免疫力的机制的研究还存在很多不足,对色氨酸的代谢产物(如犬尿氨酸)及IDO在组织中的定位及对免疫细胞的增殖及趋化作用途径了解甚少,尚需进一步研究。
| [1] | DOURMAD J Y,NOBLET J,ETIENNE M.Effect of protein and lysine supply on performance,nitrogen balance,and body composition changes of sows during lactation[J]. Journal of Animal Science,1998,76(2):542-550. ( 1) 1)
|
| [2] | 周斌,李慧,邹晓庭,等.色氨酸对产蛋鸡脂肪代谢的影响[J]. 中国畜牧杂志,2011,47(7):50-53. ( 1) 1)
|
| [3] | WU G Y.Amino acids:metabolism,functions,and nutrition[J]. Amino Acids,2009,37(1):1-17. ( 1) 1)
|
| [4] | WEINLICH G,MURR C,RICHARDSEN L,et al.Decreased serum tryptophan concentration predicts poor prognosis in malignant melanoma patients[J]. Dermatology,2007,214(1):8-14. ( 1) 1)
|
| [5] | WINDER B,LEBLHUBER F,WALLI J,et al.Tryptophan degradation and immune activation in Alzheimer's disease[J]. Journal of Neural Transmission,2000,107(3):343-353. ( 1) 1)
|
| [6] | ZHU B T.Development of selective immune tolerance towards the allogeneic fetus during pregnancy:role of tryptophan catabolites (review)[J]. International Journal of Molecular Medicine,2010,25(6):831-835. ( 1) 1)
|
| [7] | YAO K,FANG J,YIN Y L,et al.Tryptophan metabolism in animals:important roles in nutrition and health[J]. Frontiers in Bioscience,2011,3:286-297. ( 1) 1)
|
| [8] | MOFFETT J R,NAMBOODIRI M A.Tryptophan and the immune response[J]. Immunology and Cell Biology,2003,81(4):247-265. ( 2) 2)
|
| [9] | SIKALIDIS A K.Amino acids and immune response:a role for cysteine,glutamine,phenylalanine,tryptophan and arginine in T-cell function and cancer?[J]. Pathology & Oncology Research,2015,21(1):9-17. ( 2) 2)
|
| [10] | BHUTIA Y D,BABU E,GANAPATHY V.Interferon-γ induces a tryptophan-selective amino acid transporter in human colonic epithelial cells and mouse dendritic cells[J]. Biochimica et Biophysica Acta:Biomembranes,1848,1848(2):453-462. ( 1) 1)
|
| [11] | XU J,YAO N,LI Y D.T-cell proliferation is inhibited by the induction of indoleamine 2,3-dioxygenase in spleen-derived dendritic cells in rat[J]. Chinese Medical Journal,2011,124(19):3154-3158. ( 1) 1)
|
| [12] | LE FLOC'H N,SEVE B.Biological roles of tryptophan and its metabolism:potential implications for pig feeding[J]. Livestock Science,2007,112(1/2):23-32. ( 1) 1)
|
| [13] | ESTEBAN S,NICOLAUS C,GARMUND A,et al.Effect of orally administered L-tryptophan on serotonin,melatonin,and the innate immune response in the rat[J]. Molecular and Cellular Biochemistry,2004,267(1/2):39-46. ( 2) 2)
|
| [14] | POORMASJEDI-MEIBOD M S,JALILI R B,HOSSEINI-TABATABAEI A,et al.Immuno-regulatory function of indoleamine 2,3 dioxygenase through modulation of innate immune responses[J]. PLoS One,2013,8(8):e71044. ( 1) 1)
|
| [15] | JALILI R B,FOROUZANDEH F,MOEENREZAKHANLOU A,et al.Mouse pancreatic islets are resistant to indoleamine 2,3 dioxygenase-induced general control nonderepressible-2 kinase stress pathway and maintain normal viability and function[J]. The American Journal of Pathology,2009,174(1):196-205. ( 1) 1)
|
| [16] | MEZRICH J D,FECHNER J H,ZHANG X J,et al.An interaction between kynurenine and the aryl hydrocarbon receptor can generate regulatory T cells[J]. The Journal of Immunology,2010,185(6):3190-3198. ( 2) 2)
|
| [17] | KUDO Y,BOYD C A,SARGENT I L,et al.Tryptophan degradation by human placental indoleamine 2,3-dioxygenase regulates lymphocyte proliferation[J]. The Journal of Physiology,2001,535(Pt 1):207-215. ( 2) 2)
|
| [18] | PRENDERGAST G C,SMIITH C,THOMAS S,et al.Indoleamine 2,3-dioxygenase pathways of pathogenic inflammation and immune escape in cancer[J]. Cancer Immunology,Immunotherapy,2014,63(7):721-735. ( 1) 1)
|
| [19] | KOLODZIEJ L.Systemic metabolism of tryptophan and its catabolites,kynurenine and 3-HAA,in mice with inflammatory arthritis[J]. Gene,2013,512(1):23-27. ( 1) 1)
|
| [20] | BAUER T M,JIGA L P,CHUANG J J,et al.Studying the immunosuppressive role of indoleamine 2,3-dioxygenase:tryptophan metabolites suppress rat allogeneic T-cell responses in vitro and in vivo[J]. Transplant International,2005,18(1):95-100. ( 1) 1)
|
| [21] | FALLARINO F,GROHMANN U,VACCA C,et al.T cell apoptosis by tryptophan catabolism[J]. Cell Death & Differentiation,2002,9(10):1069-1077. ( 2) 2)
|
| [22] | CHIARUGI A,CALVANI M,MELI E,et al.Synthesis and release of neurotoxic kynurenine metabolites by human monocyte-derived macrophages[J]. Journal of Neuroimmunology,2001,120(1/2):190-198. ( 1) 1)
|
| [23] | AHERN G P.5-HT and the immune system[J]. Current Opinion in Pharmacology,2011,11(1):29-33. ( 1) 1)
|
| [24] | LI N, GHIA J E, WANG H, et al.Serotonin activates dendritic cell function in the context of gut inflammation[J]. The American Journal of Pathology,2011,178(2):662-671. ( 1) 1)
|
| [25] | MACGILLIVRAY L,REYNOLDS K B,SICKAND M, et al.Inhibition of the serotonin transporter induces microglial activation and downregulation of dopaminergic neurons in the substantia nigra[J]. Synapse,2011,65(11):1166-1172. ( 1) 1)
|
| [26] | MAESTRONI G J M.The immunoneuroendocrine role of melatonin[J]. Journal of Pineal Research,1993,14(1):1-10. ( 1) 1)
|
| [27] | REITER R J.Oxidative damage in the central nervous system:protection by melatonin[J]. Progress in Neurobiology,1998,56(3):359-384. ( 1) 1)
|
| [28] | LECHNER O, DIETRICH H, DOS SANTOS A O, et al.Altered circadian rhythms of the stress hormone and melatonin response in lupus-prone MRL/MP-fasIpr mice[J]. Journal of Autoimmunity,2000,14(4):325-333. ( 1) 1)
|
| [29] | HAWKINS R A,O'KANE R L,SIMPSON I A,et al.Structure of the blood-brain barrier and its role in the transport of amino acids[J]. The Journal of Nutrition,2006,136(1):218S-226S. ( 1) 1)
|
| [30] | YAMAMOTO T,NEWSHOLME E A.Diminished central fatigue by inhibition of the L-system transporter for the uptake of tryptophan[J]. Brain Research Bulletin,2000,52(1):35-38. ( 1) 1)
|
| [31] | ASOR E,STEMPLER S,AVITAL A,et al.The role of branched chain amino acid and tryptophan metabolism in rat's behavioral diversity:intertwined peripheral and brain effects[J]. European Neuropsychopharmacology,2015,25(10):1695-1705. ( 1) 1)
|
| [32] | HENRY Y,SÈVE B,COLLÉAUX Y,et al.Interactive effects of dietary levels of tryptophan and protein on voluntary feed intake and growth performance in pigs,in relation to plasma free amino acids and hypothalamic serotonin[J]. Journal of Animal Science,1992,70(6):1873-1887. ( 1) 1)
|
| [33] | BADAWY A A B.The tryptophan utilization concept in pregnancy[J]. Obstetrics & Gynecology Science,2014,57(4):249-259. ( 1) 1)
|
| [34] | MOSNIER E,DOURMAD J Y,ETIENNE M,et al.Feed intake in the multiparous lactating sow:its relationship with reactivity during gestation and tryptophan status[J]. Journal of Animal Science,2009,87(4):1282-1291. ( 1) 1)
|
| [35] | TREVISI P,MELCHIOR D,MAZZONI M,et al.A tryptophan-enriched diet improves feed intake and growth performance of susceptible weanling pigs orally challenged with Escherichia coli K88[J]. Journal of Animal Science,2009,87(1):148-156. ( 1) 1)
|
| [36] | LE FLOC'H N,MELCHIOR D,SÈVE B.Chronic lung inflammation affects plasma amino acid concentrations in pigs[J]. Journal of Animal Science,2004,82(4):1091-1099. ( 1) 1)
|
| [37] | WILLEMEN S A,CHE L,DEWILDE S,et al.Enteric and serological distribution of serotonin and its precursor tryptophan in perinatal low and normal weight piglets[J]. Animal,2014,8(5):792-799. ( 1) 1)
|
| [38] | ROBERTSON S A,CARE A S,SKINNER R J.Interleukin 10 regulates inflammatory cytokine synthesis to protect against lipopolysaccharide-induced abortion and fetal growth restriction in mice[J]. Biology of Reproduction,2007,76(5):738-748. ( 1) 1)
|
| [39] | KUDO Y.The role of placental indoleamine 2,3-dioxygenase in human pregnancy[J]. Obstetrics & Gynecology Science,2013,56(4):209-216. ( 1) 1)
|
| [40] | 邱时秀.日粮色氨酸水平对感染伪狂犬病毒妊娠雌鼠繁殖性能和免疫功能的影响[D]. 硕士学位论文.雅安:四川农业大学,2009. ( 1) 1)
|
| [41] | POLETTO R,KRETZER F C,HÖTZEL M J.Minimizing aggression during mixing of gestating sows with supplementation of a tryptophan-enriched diet[J]. Physiology & Behavior,2014,132:36-43. ( 1) 1)
|
| [42] | MELCHIOR D,LE MELCHIOR N,S VE B.Effects of chronic lung inflammation on tryptophan metabolism in piglets[M]//ALLEGRI G,COSTA C V L,RAGAZZI E,et al.Developments in tryptophan and serotonin metabolism.New York:Springer-Verlag,2003,527:359-362. ( 1) 1)
|
| [43] | PLATTEN M,HO P P,YOUSSEF S,et al.Treatment of autoimmune neuroinflammation with a synthetic tryptophan metabolite[J]. Science,2005,310(5749):850-855. ( 1) 1)
|
| [44] | FALLARINO F,GROHMANN U,YOU S,et al.The combined effects of tryptophan starvation and tryptophan catabolites down-regulate T cell receptor ζ-chain and induce a regulatory phenotype in naive T cells[J]. The Journal of Immunology,2006,176(11):6752-6761. ( 1) 1)
|
| [45] | 王军,赵迎飞,方正锋,等.饲粮中添加苏氨酸和色氨酸对接种猪繁殖与呼吸综合征弱毒苗生长猪免疫反应的影响[J]. 动物营养学报,2013,25(6):1189-1198. ( 1) 1)
|
| [46] | XU S Y,SHEN J,FANG Z F,et al.Effects of dietary threonine and tryptophan supplementation on growing pigs induced by porcine respiratory and reproductive syndrome vaccination[J]. Archives of Animal Nutrition,2014,68(5):385-397. ( 1) 1)
|
| [47] | 魏宗友,王洪荣,潘晓花,等.饲喂方式和饲粮色氨酸水平对扬州鹅免疫功能及抗氧化指标的影响[J]. 动物营养学报,2012,24(12):2356-2365. ( 1) 1)
|
| [48] | 刘肖挺,王安,杨小然,等.色氨酸对蛋雏鸭生长性能、抗氧化功能及免疫器官发育的影响[J]. 饲料工业,2012,33(10):5-8. ( 1) 1)
|
| [49] | EMADI M,JAHANSHIRI F,Kaveh K,et al.Nutrition and immunity:the effects of the combination of arginine and tryptophan on growth performance,serum parameters and immune response in broiler chickens challenged with infectious bursal disease vaccine[J]. Avian Pathology,2011,40(1):63-72. ( 1) 1)
|
| [50] | EMADI M,JAHANSHIRI F,KAVEH K,et al.Tryptophan stimulates immune response in broiler chickens challenged with infectious bursal disease vaccine[J]. Journal of Animal and Veterinary Advances,2010,9(3):610-616. ( 1) 1)
|
| [51] | VAN E NOLTE J,LÖEST C A,FERREIRA A V,et al.Limiting amino acids for growing lambs fed a diet low in ruminally undegradable protein[J]. Journal of Animal Science,2008,86(10):2627-2641. ( 1) 1)
|
| [52] | MELZER N,WITTENBURG D,HARTWIG S,et al.Investigating associations between milk metabolite profiles and milk traits of Holstein cows[J]. Journal of Dairy Science,2013,96(3):1521-1534. ( 1) 1)
|
| [53] | HERNÁNDEZ J,BENEDITO J L,ABUELO A,et al.Ruminal acidosis in feedlot:from aetiology to prevention[J]. The Scientific World Journal,2014,2014:1-8. ( 1) 1)
|
| [54] | RUNGRUANG S,COLLIER J L,RHOADS R P,et al.A dose-response evaluation of rumen-protected niacin in thermoneutral or heat-stressed lactating Holstein cows[J]. Journal of Dairy Science,2014,97(8):5023-5034. ( 1) 1)
|




