2. 中国科学院亚热带农业生态研究所, 长沙 410125
2. Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China
糖皮质激素(glucocorticoid,GC),又名“肾上腺糖皮质激素”,因其发现之初对血液葡萄糖水平的调节而得名。GC的分泌主要受下丘脑-垂体-肾上腺轴(HPA)经由相关神经递质受体调控,并存在自身负反馈调节作用,其水平高低对内环境稳态的维持具有决定意义。GC的分泌具有典型的节律性变化特点,表现为昼夜节律升高和滑落,每日08:00至10:00为分泌的高峰,随后逐渐下降,24:00时分泌最少。研究表明,GC的这种节律性变化效应主要是在外源授时因子的刺激下,肾上腺生物钟相关基因的分子调控实现的;反过来GC亦能减缓由食物因子引起的外周生物钟时相的移动,导致生物钟的节律发生诱导性改变,最终二者表现出明显的反馈式互作调节特性[1]。可见,肾上腺GC的分泌和生物节律存在着密切联系,在其相互联系的过程中,外源受控因素(食物和光照等)对肾上腺GC的分泌和生物节律性调控扮演着重要角色,为畜禽生产提供理论依据。
1 GC的主要生物学特性GC通过血液到达靶组织细胞,首先与细胞膜上的受体蛋白结合,诱导性提高了邻近的腺苷酸环化酶(AC)活性,在镁离子(Mg2+)的作用下,AC使三磷酸腺苷(ATP)变为第二信使环腺苷酸(cAMP)。进入细胞后,GC与细胞质中的糖皮质激素受体(GR)α结合,形成GC-GRα复合物,进而与染色体上的糖皮质激素反应原件(glucocorticoid response element,GRE)结合,启动或抑制其下游的基因表达,合成各种蛋白质。研究证实,GC的生物学作用是通过直接和间接2条途径实现的,其中,直接途径是指GC形成的GC-cGR复合物可直接调控一些细胞因子mRNA转录,如肿瘤坏死因子-α(tumorneerossiafctora,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-2(interleukin-2,IL-2);间接途径则是通过GC与其他核转录因子的相互作用,发挥抗炎和免疫抑制作用的过程[2, 3, 4]。
GC在维持机体稳态和调节物质代谢等方面具有广泛的生理作用。研究表明,GC可有效促进糖原异生和糖原合成,抑制糖的有氧氧化和无氧酵解;在促进蛋白质分解和抑制其合成方面,GC可提高蛋白质分解酶的活性,造成多种组织(淋巴、肌肉、皮肤、骨骼、结缔组织等)中蛋白质降解,导致负氮平衡。此外,研究发现,GC的作用受其剂量水平影响较大,表现出明显的量效关系,高水平时主要体现在抗炎、抗休克和抗毒等方面[5, 6]。
2 肾上腺GC的节律性分泌在自然界中,为了适应外界环境,生物的生命活动均按照一定的规律运行的,具有明显节律性活动的现象,称为生物钟(生物节律)。生物钟的自主运行周期一般约为24 h,因此称为近日生物钟[7]。在哺乳动物中,生物钟节律是受下丘脑的视交叉上核(suprachiasmatic nucleus,SCN)和外围振荡器共同调控[8],其中生物节律的分子基础是由一组特异的、保守的核心元件组成,主钟生物钟基因编码的核心基因包括生物钟循环输出蛋白(circadian locomotor output cycles kaput,Clock)、大脑和肌肉芳香烃受体核转运样蛋白1(brain and muscle Arnt-like protein-1,Bmal1)、Period(Per)1、Per2、Per3、隐花色素(cryptochrome,Cry)1和Cry2以及反红细胞增多病毒α(reverse erythroblastosis virus α,Rev-erbα)基因及其蛋白质产物等。其中Clock和Bmal1等蛋白因子共同启动生物钟基因,Cry和Per等产生负反馈调控来阻断或减弱[1, 9, 10]生物钟基因的表达等活动。生物钟的主要调控机制是通过正、负2个方面,在此调控过程中GC的调控也与此相偶联如图1所示。Clock和Bmal1通过组成碱性螺旋-环-螺旋蛋白二聚体结合到钟基因启动子的E-box上从而激活Per、Cry 和Rev-erba基因转录,随着Per蛋白水平的增加,Cry蛋白和CKIE/丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)磷酸化的复合。由于分化的胚软骨表达蛋白(differentiated embryo-chondrocyte expressed gene,DEC)和Clock-Bmal1异二聚体相互竞争E-box就会抑制Clock-Bmal1异二聚体。肾上腺束状带细胞核内的一些细胞在胞浆中启动主钟后,通过反馈基因的反馈是表达产物在核内进行相关激素的转录产生,而当在日节律性的转录后,反馈基因Per和Cry又将抑制主钟的调控,进而抑制肾上腺相关激素的产生。如果核心生物钟和外周生物钟偶联关系遭到破坏,机体内部的生物钟系统将会重新调节来达到新的平衡。而在此过程中,生物钟将影响下游的基因表达、激素分泌、代谢反应、能量平衡,以及生物体的行为活动也随之发生相应变化[11, 12]。
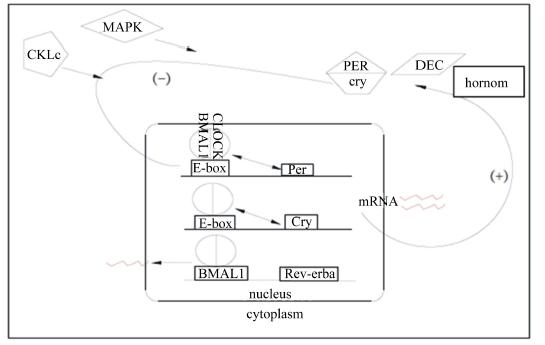 | hormone:激素;nucleus:核;cytoplasm:细胞质。 图1 哺乳动物生物钟基因、肾上腺束状带钟基因的核心调控 Fig. 1 The core of the control about mammalian circadian clock genes and adrenal zona fasciculata clock gene[1, 9, 10] |
GC的分泌有昼夜节律性,午夜时水平最低,清晨时水平最高。机体在应激状态下,内源性GC的分泌量会激增到平时的10倍左右。GC在分泌或到达各细胞发挥作用时,都依赖于有节奏性的释放促肾上腺皮质激素(adrenocorticotropic hormone,ACTH),它们都是通过SCN来控制[13]。在姜黄素对慢性应激大鼠肾上腺、血清ACTH和免疫功能的影响的研究中表明:慢性应激大鼠与正常对照组比较肾上腺皮质增厚,髓质萎缩,外周血白细胞数量明显减少(包括淋巴细胞、单核细胞和中性粒细胞百分比下降)[14]。这一结果初步表明当机体在受到某种应激时,SCN就会调控HPA对ACTH分泌的控制,从而实现对GC的一系列分泌活动节律性调控。不仅如此,GC还能有效影响外周组织中生物钟基因以及钟控基因的表达[15, 16]。有试验表明,在Per2/Cry1双突变体的小鼠实验中,HPA的调控是有缺陷的[17],最终导致小鼠产生一些代谢疾病。由此可见,当机体稳态被打破,SCN就会控制肾上腺GC节律性分泌,使机体重新达到一个新的平衡,最终使得机体的生命活动有序进行。
另外,GC分泌的节律性与生物钟基因的表达调控也密切相关。生物钟基因的表达调控在GC日节律的发生和维持中起到了关键性作用。在内分泌信号中,GC是外围振荡器最重要的定时信号,他们通过肾上腺时钟峰值的出现来实现有节律地分泌代谢激素[13],如皮质激素分泌的日节律性就是通过SCN有节律分泌ACTH来实现的[15, 18, 19]。这样,在钟控基因的表达调控下进行有序的GC分泌调控。由此可见,GC的分泌是节律性的,这也依赖于主钟和肾上腺的外围生物钟的共同调控。
3 肾上腺GC节律分泌的主要受控因素和应用光和食物是生物节律重要的授时因子。其中,光是母钟主要的授时因子。在哺乳动物中,视网膜细胞接受光信号,并将之转化成神经信号传递到SCN,从而使生物钟与环境保持同步。Cry是一类在高等真核生物中广泛存在的、对蓝光和近紫外光敏感的黄素类蛋白,也称紫外光-A/蓝光受体(UV-A/blue-light receptor)[20],它们参与GC节律性分泌的调控。GC在发挥作用时必须与GR结合,有最新研究发现Cry可与GR相互作用,参与调控机体糖代谢。在通过对小鼠光照刺激后,小鼠血液中的GC水平在光照刺激后最先开始的30 min内几乎没有改变,但是60~120 min内显著上升,在180 min后GC又恢复到原来的基础水平[21]。此研究表明:在光照刺激下,GC分泌会产生节律性的波动,生命活动也呈现不同层次的变化。生命体在太阳光的刺激下,GC的分泌就会产生昼夜节律性,以此来适应外环境(睡眠与觉醒)的变化。而遗传丢失Cry1和Cry2基因的动物,可导致葡萄糖的不耐受性和皮质醇的高水平[22]。由此可以看出,在2种情况下,GC水平的上升是受不同机制调控,其中光照引起的GC分泌量增加可能是受生物钟系统调控的。反过来,GC的波动就会引起外围振荡器相位移动,又反馈到主钟。而基因缺失引起的GC分泌的改变,可能是由母钟和肾上腺外周振荡器共同来调控的。此外,在摄食或饥饿状态下,动物体内GC的分泌量也会受到不同程度的影响,GC分泌与哺乳动物的生物钟调控的主位一致,都是由SCN通过HPA和其他路径控制的[23]。其中,食物也是重要的刺激因子,GC能够抑制由食物诱发的外围昼夜节律振荡器,研究人员通过在白天和晚上分别饲喂小鼠发现:在白天饲喂时,皮质酮的水平非常高,这对于白天进食时降低血糖有非常重要的意义[23]。有科学家认为,机体在摄食时,外围昼夜振荡器占主导地位。GC也能够抑制由食物诱发的外围昼夜节律振荡器的移相[24]。
GC节律性分泌时的主要作用是维持机体内能量平衡。许多葡萄糖的体内平衡通路试验中,发现葡萄糖会产生一定的副作用,比如一些代谢疾病[25],这些疾病与GC的分泌密切相关。同样,在对畜禽生产中,可以通过动态调节(不同生理阶段或不同的采食阶段)动物摄入能量的多少去适应体内激素的节律性分泌,以此来达到饲料的节约或合理使用。同样,生物钟控制GC分泌的日节律性,同时受主钟和存在于肾上腺的时钟——皮质激素生理节奏门控机制[26]。肾上腺有自己的主钟和在外围时钟紧密联系在一起,并且外围振荡器通过控制GC的生理节奏,有节奏的产生类固醇。在一些试验中,敲除Bmal1基因的小鼠,肾上腺生物钟能够产生皮质酮;在几个外围生物钟中的敲除试验中,小鼠的行为却受到很大的影响,同时Per1的表达发生改变,但Per2没有受到影响。研究者认为,肾上腺的外围生物钟在哺乳动物生理协调中扮演着重要的角色,外围生物钟是通过有节奏的分泌GC来调控的[20, 27, 28, 29, 30, 31]。由此可以看出,GC的节律性分泌在授时因子、主钟和外围振荡器的共同调控下产生的,它们之间的关系如图2。因此,在生产上,我们可以通过控制光与食物来对畜禽生产进行调控。
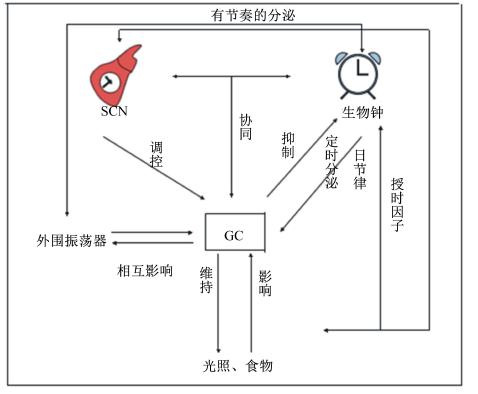 | 图2 糖皮质激素、生物钟和SCN之间的关系
Fig. 2 The relationship of corticosteroids,clock and SCN |
综合以上的研究可以发现,GC的节律性分泌,一方面受到肾上腺等外围振荡器的调控,另一方面受到光、食物等外界授时因子的影响。GC的分泌主要是受SCN和生物钟的同步控制,反过来GC峰值的出现又抑制生物钟的调控,最终使得GC节律性分泌。此外,GC在调控机体内代谢稳态等方面发挥着的重要生理功能。生物钟和GC的调控主位一致(都是由SCN控制),它们共同调控着代谢的稳态。GC的分泌受主钟的调控,反过来外围生物钟在接受肾上腺的信号时又影响主钟的调控,这一规律可以用来指导我们对实际生产的应用,比如在动物GC节律性分泌的高峰期饲喂某种促生长剂,来提高动物生产效益;动物营养效应与GC节律性分泌的正、负关系,如某一营养素对动物的血液生化效应的GC节律性分泌是在什么通路下来调控的等。近期的研究表明,不同时间段饲喂不同的粗蛋白质饲粮,可以有效改善猪的生长性能、血液生化指标等[32]。但是,在对营养物质代谢调控GC分泌节律性的规律以及GC分泌的节律性与动物营养需要的关系还有待进一步研究。
| [1] | 倪银华,吴涛,王露,等.肾上腺糖皮质激素与生物钟基因表达调控的相关研究进展[J]. 遗传,2008,30(2):135-141. ( 3) 3)
|
| [2] | 王德杰,刘兴国,张东.糖皮质激素受体的研究进展[J]. 现代生物医学进展,2010,10(8):1592-1594. ( 1) 1)
|
| [3] | 徐磊,谢骏,刘波,等.应激状态下鱼类糖皮质激素代谢及作用机理的研究进展[J]. 江西农业学报,2010,22(8):132-137. ( 1) 1)
|
| [4] | 陈晓红.糖皮质激素作用的分子机理及减轻其副作用的研究进展[J]. 国外医学:内分泌学分册,1997,17(1):37-40. ( 1) 1)
|
| [5] | 黄樾.内源性肾上腺糖皮质激素对血管炎症反应抑制作用的研究[D]. 硕士学位论文.广州:广州医学院,2009. ( 1) 1)
|
| [6] | 马占俊.糖皮质激素的临床应用[J]. 中国当代医药,2011,18(14):18-19. ( 1) 1)
|
| [7] | 郭金虎,徐璎,张二荃,等.生物钟研究进展及重要前沿科学问题.中国科学基金,2014(3):179-186. ( 1) 1)
|
| [8] | SCHIBLER U,RIPPERGER J,BROWN S A.Peripheral circadian oscillators in mammals:time and food[J]. Journal of Biological Rhythms,2003,18(3):250-260. ( 1) 1)
|
| [9] | FROY O.The circadian clock and metabolism[J]. Clinical Science,2011,120(2):65-72. ( 2) 2)
|
| [10] | 王培培,李明春.昼夜节律与肿瘤时辰化疗作用机制的研究进展[J]. 中国医院药学杂志,2014,34(6):499-503. ( 2) 2)
|
| [11] | HIROTA T,FUKADA Y.Resetting mechanism of central and peripheral circadian clocks in mammals[J]. Zoological Science,2004,21(4):359-368. ( 1) 1)
|
| [12] | SAKKOU M,WIEDMER P,ANLAG K,et al.A role for brain-specific homeobox factor Bsx in the control of hyperphagia and locomotory behavior[J]. Cell Metabolism,2007,5(6):450-463. ( 1) 1)
|
| [13] | MOORE R Y,EICHLER V B.Loss of a circadian adrenal corticosterone rhythm following suprachiasmatic lesions in the rat[J]. Brain Research,1972,42(1):201-206. ( 2) 2)
|
| [14] | 陈亮,吕平,潘建春,等.姜黄素对慢性应激大鼠肾上腺、血清ACTH和免疫功能的影响[J]. 温州医学院学报,2008,38(1):22-24. ( 1) 1)
|
| [15] | BALSALOBRE A,BROWN S A,MARCACCI L,et al.Resetting of circadian time in peripheral tissues by glucocorticoid signaling[J]. Science,2000,289(5488):2344-2347. ( 2) 2)
|
| [16] | REDDY A B,MAYWOOD E S,KARP N A,et al.Glucocorticoid signaling synchronizes the liver circadian transcriptome[J]. Hepatology,2007,45(6):1478-1488. ( 1) 1)
|
| [17] | OSTER H, DAMEROW S,KIESSLING S,et al.The circadian rhythm of glucocorticoids is regulated by a gating mechanism residing in the adrenal cortical clock[J]. Cell Metabolism,2006,4(2):163-173. ( 1) 1)
|
| [18] | NADER N,CHROUSOS G P,KINO T.Interactions of the circadian CLOCK system and the HPA axis[J]. Trends in Endocrinology & Metabolism,2010,21(5):277-286. ( 1) 1)
|
| [19] | PEZVK P,MOHAWK J A,WANG L A,et al.Glucocorticoids as entraining signals for peripheral circadian oscillators[J]. Endocrinology,2012,153(10):4775-4783. ( 1) 1)
|
| [20] | VAN DER HORST G T J,MUIJTJENS M,KOBAYASHI K,et al.Mammalian Cry1 and Cry2 are essential for maintenance of circadian rhythms[J]. Nature,1999,398(6728):627-630. ( 2) 2)
|
| [21] | ISHIDA A,MUTOH T,UEYAMA T,et al.Light activates the adrenal gland:timing of gene expression and glucocorticoid release[J]. Cell Metabolism,2005,2(5):297-307. ( 1) 1)
|
| [22] | ZHANG E E,LIU Y,DENTIN R,et al.Cryptochrome mediates circadian regulation of cAMP signaling and hepatic gluconeogenesis[J]. Nature Medicine,2010,16(10):1152-1156. ( 1) 1)
|
| [23] | LE MINH N,DAMIOLA F,TRONCHE F,et al.Glucocorticoid hormones inhibit food-induced phase-shifting of peripheral circadian oscillators[J]. The EMBO Journal,2001,20(24):7128-7136. ( 2) 2)
|
| [24] | SON G H,CHUNG S,CHOE H K,et al.Adrenal peripheral clock controls the autonomous circadian rhythm of glucocorticoid by causing rhythmic steroid production[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(52):20970-20975. ( 1) 1)
|
| [25] | SO A Y L,BERNAL T U,PILLSBURY M L,et al.Glucocorticoid regulation of the circadian clock modulates glucose homeostasis[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(41):17582-17587. ( 1) 1)
|
| [26] | BAE K,JIN X W,MAYWOOD E S,et al.Differential functions of mPer1,mPer2,and mPer3 in the SCN circadian clock[J]. Neuron,2001,30(2):525-536. ( 1) 1)
|
| [27] | ZHENG B H,ALBRECHT U,KAASIK K,et al.Nonredundant roles of the mPer1 and mPer2 genes in the mammalian circadian clock[J]. Cell,2001,105(5):683-694. ( 1) 1)
|
| [28] | ZHENG B H,LARKIN D W,ALBRECHT U,et al.The mPer2 gene encodes a functional component of the mammalian circadian clock[J]. Nature,1999,400(6740):169-173. ( 1) 1)
|
| [29] | DICKMEIS T.Glucocorticoids and the circadian clock[J]. Journal of Endocrinology,2009,200(1):3-22. ( 1) 1)
|
| [30] | LAMIA K A,PAPP S J,YU R T,et al.Cryptochromes mediate rhythmic repression of the glucocorticoid receptor[J]. Nature,2011,480(7378):552-556. ( 1) 1)
|
| [31] | LAMIA K A,STORCH K F,WEITZ C J.Physiological significance of a peripheral tissue circadian clock[J]. Proceeding of the National Academy of Sciences of the United States of America,2008,105(39):15172-15177. ( 1) 1)
|
| [32] | 谢春艳,黎俊,吴信,等.饲粮粗蛋白质水平日变化对生长猪生长性能和血液生理生化指标的影响[J]. 动物营养学报,2014,26(7):1753-1759. ( 1) 1)
|




