磷脂酰肌醇信号通路(phosphatidylinositol signal pathway)是指胞外信号通过膜受体与其相应的第一信使分子结合后,激活膜上的Gq蛋白偶联受体(G protein-coupled receptors,GqPCRs),细胞膜上的GqPCRs激活的Gq蛋白的α亚基与β、γ亚基分离,细胞质膜上的磷脂酶C(phospholipase C,PLC)被三磷酸鸟苷(GTP)水解释放的能量激活,继而水解磷脂酰肌醇-4,5-二磷酸(PIP2)生成的三磷酸肌醇(IP3)和二酰甘油(DAG)2个第二信使的过程,因此磷脂酰肌醇信号通路又称为“双信使系统”。作为细胞中重要的信号分子,IP3调节钙离子的释放,而DAG调节蛋白激酶K(protein kinase C,PKC)的活性,进而调控细胞的增殖、分化、收缩、分泌和代谢等功能[1]。大量研究表明,绝大多数肽类激素均通过此通路发挥作用。
1 磷脂酰肌醇信号通路的结构磷脂酰肌醇信号通路主要包括接受刺激的G蛋白偶联受体、转换刺激的G蛋白、细胞质膜上的PLC、被水解的PIP2及“双信使”IP3与DAG等。本综述对结构的介绍主要为通路的起始——G蛋白偶联受体与通路发挥作用的主要体现者——“双信使”,其他部分不做详述。
1.1 G蛋白偶联受体G蛋白偶联受体是一个统称,包含一大类膜蛋白受体。示意图如图 1所示。气味、信息素、荷尔蒙、神经递质、趋化因子等均可作为配体与G蛋白偶联受体结合。G蛋白偶联受体与配体结合后,构象发生变动,从而显示出鸟苷酸交换因子(guanine nucleotide exchange factor,GEF)的特征,通过将G蛋白上原来的二磷酸鸟苷(GDP)交换为GTP从而使G蛋白的α亚基与β、γ亚基分离,从而达到将G蛋白激活参与以下生理过程的目的。磷脂酰肌醇信号通路中接受外界刺激的是Gq蛋白偶联受体。Gq偶联蛋白受体形式多样,GPR120就是其中的一种。Gq蛋白偶联受体存在于各种动物与人身体的各个部位中,例如α2肾上腺素受体等。Gq蛋白偶联受体引导的信号通路较多,其中就包含磷脂酰肌醇信号通路,即磷脂酰肌醇信号通路也存在与各种动物中,包括大中小型动物。大量研究表明,G蛋白偶联受体以及下游通路产生的多个第二信使都对T型钙通道起到一定的调节作用[3, 4, 5, 6]。而T型钙通道又能通过调节钙来调节采食,其原理会在下面详述。同时,GqPCRs也可以通过各类形式的受体激活整个通路,从而调节糖降解作用及肝糖原代谢[7]。
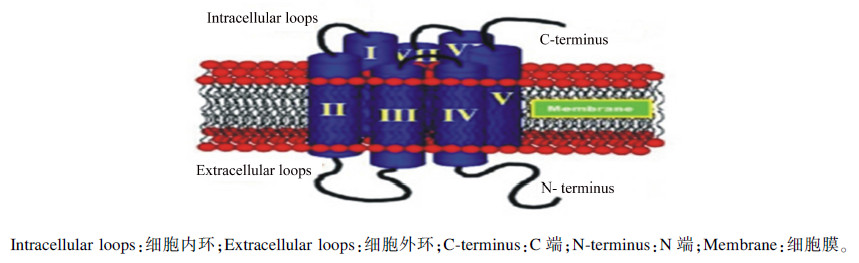 | 图1 G蛋白偶联受体结构示意图 Fig.1 The structure diagram of GPCRs[2] |
IP3通过酶解产生酶解物,其酶解物可诱导钙离子(Ca2+)从细胞中的钙储存仓库中释放出来,从而达到短时间内增长细胞液中Ca2+浓度的目的。IP3的结构如图 2所示。IP3溶于水,生成后即可扩散到整个细胞。IP3可与IP3配体门钙通道结合,从而将钙通道启动,使细胞中的Ca2+浓度升高。从而激活各中可依靠钙离子的蛋白。IP3信 号的停止是通过去磷酸化形成二磷酸肌醇(IP2),或被磷酸化形成四磷酸肌醇(IP4)。而细胞液中的Ca2+则可通过细胞质膜上的钙泵或者钠(Na)-Ca2+交换通道排出细胞,或者可通过内质网上的钙泵被吸入内质网。有研究表明,Ca2+可通过IP3通路调节脂肪的合成代谢[8]。Chen等[9]的试验结果显示,Ca2+的减少影响胰岛素的分泌。
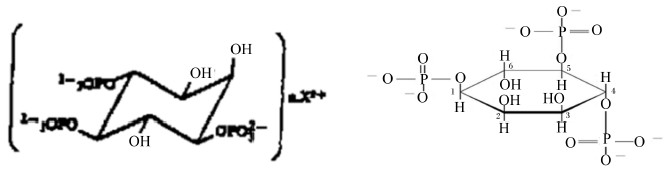 | 图2 三磷酸肌醇的结构图 Fig.2 The structure diagram of IP3[10] |
DAG由1个甘油分子的3个羟基中的2个羟基和2个脂肪酸缩合失去2分子水形成的酯。DAG结合于质膜上,可活化与质膜结合的PKC。PKC位于细胞溶质中,平时以非活化性形式存在。当细胞上的G偶联蛋白受体接受刺激最终产生IP3,Ca2+浓度升高,PKC便会转移到质膜内表面被DAG活化。PKC可以与蛋白质的丝氨酸/苏氨酸残基反应,使其磷酸化,从而使具有差异的细胞产生不相同的反应,如细胞分泌、分化和肌肉收缩等。Montell等[11]的研究表明,DAG的累积可麻痹肌肉中的胰岛素刺激葡萄糖摄入的过程。
2 磷脂酰肌醇信号通路对动物采食的影响及作用机制磷脂酰肌醇信号通路的示意图如图 3所示。
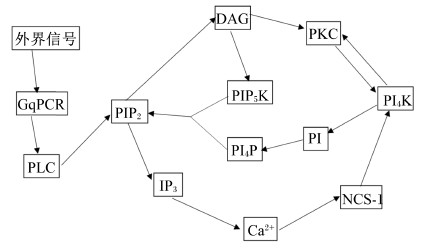 | 图3 磷脂酰肌醇信号通路的作用机制 Fig.3 Mechanism of the action of phosphatidylinositol signal pathway[12] |
采食量是评判一个动物是否健康成长、能否产出优良的产品的重要指标,是影响动物生产效率的重要原因。早期研究报道,动物采食行为调控与胃肠道功能状态(胃肠的蠕动与排空)调节[13]、下丘脑的神经体液调节以及外周体液信号(胃肠道激素、细胞因子、细胞激素等)调节等[14, 15]相关。对动物摄食行为的调节可分为外周调控和中枢机制调控,外周调控主要由胃和肠道产生的激素到达各处发挥作用,如胰岛素(insulin)等。中枢调节机制则由神经元与神经递质共同发挥作用。位于下丘脑弓状核的促采食神经元和抑采食神经元是调节采食的重要部位。诸多营养素都可通过激活磷脂酰肌醇信号通路完成对采食的调控,例如胰岛素的释放就是通过磷脂酰肌醇信号通路使游离Ca2+浓度增加,从而调节胰高血糖素样肽1的产生,调控胰岛素的释放,而长链脂肪酸也是通过磷脂酰肌醇信号通路诱导胆囊收缩素分泌的。下面选择其中3种机制,叙述其对动物采食的影响及作用机制。
2.1 钙通过磷脂酰肌醇信号通路对动物采食的影响及作用机制钙作为矿物元素具有诸多作用,青少年缺钙易导致偏食。钙可作为矿物元素添加来激活磷脂酰肌醇信号通路从而完成对采食的调控。吕彬等[8]用高脂饲粮饲喂小鼠30 d以建立肥胖模型,将肥胖小鼠分为对照组、去甲肾上腺素(NE)组、肝素组、钙组、钙+NE组和钙+肝素组,且除对照组和钙组外的各药物组小鼠分别给予相应的药物处理,腹腔注射质量浓度0.1 mg/mL的NE或1.5 mg/mL的肝素0.2 mL/(只·d);对照组和钙组以相同的方法给予等体积的生理盐水,检测甘油三酯(TG)、总胆固醇(TC)和高密度脂蛋白胆固醇(HDL-C)的浓度,并取脂肪组织,测定其附睾脂肪和肾周脂肪组织质量,分析附睾脂肪、肾周脂肪和肝脏的钙含量。通过RT-PCR法分析与脂肪生成密切相关的转录因子过氧化物酶体增殖物激活受体γ(PPARγ)、CCAAT增强子结合蛋白α(C/EBPα)和生脂基因脂肪酸合成酶(FAS)及脂解基因激素敏感性脂肪酶(HSL)mRNA的表达水平,以研究钙信号通过IP3通路对肥胖小鼠脂肪合成代谢的影响。结果表明,钙通过摄食的增加可抑制三磷酸肌醇受体(IP3R)mRNA的表达,进而影响采食量。即如图 3磷脂酰肌醇信号通路作用机制示意图所示,钙通过抑制IP3 mRNA的表达来减少IP3的量,IP3含量的减少导致细胞中Ca2+浓度减少,继而影响细胞内Ca2+信号系统,从而影响由Ca2+相关酶活性的不同来调控的一系列生理过程。同时Ca2+浓度的减少可以抑制Ca2+敏感的重组人神经元钙传感蛋白(NCS-1)对神经元中磷脂酰肌醇-4-激酶(PI4K)的激活,抑制PI4K将细胞中的磷脂酰肌醇磷酸化成为磷脂酰肌醇-4-磷酸(PI4P),影响PIP2的重新生成,进而抑制整个磷脂酰肌醇信号通路的进行,从而导致细胞中游离Ca2+浓度降低,继而可消弱PPARγ及生脂基因FAS mRNA的基因表达程度,同时可增强脂解基因HSL mRNA的表达程度,从而造成脂肪蓄积减少。脂肪蓄积的减少则会影响采食调节中枢,为了保持能量储备,采食调节中枢通过调节胰岛素的合成分泌或者调节瘦素的浓度来调节采食量。即钙可通过磷脂酰肌醇信号通路来调节采食量。
上述吕彬等[8]的试验可以表明,钙对动物采食量的调控主要分为3个部分,钙对磷脂酰肌醇信号通路的调节及磷脂酰肌醇信号通路通过Ca2+浓度对脂肪代谢的调节,最终脂肪代谢影响采食量。以上试验的试验对象是啮齿类动物,对于哺乳动物,魏星灿[16]以新美系大白猪为研究对象进行研究,试验结果表明,促进猪脂肪分解通路中有磷脂酰肌醇信号通路的参与,这种参与与一类来源于嗜铬粒蛋白A的肽有关,但在大白猪饲粮中添加钙是否会通过磷脂酰肌醇信号通路影响采食还待进一步试验证明。
2.2 食欲增食因子(orexin)通过磷脂酰肌醇信号通路对动物采食的影响及作用机制食欲增食因子是一种可参与调节能量代谢、摄食、睡觉与觉醒的下丘脑神经肽[17, 18, 19, 20]。食欲增食因子有2个Gq偶联蛋白受体:OX1R和OX2R。食欲增食因子的神经元胞体主要位于下丘脑外侧区和穹窿周围核,相关研究表明,下丘脑第四脑室很可能是其作用的靶点之一[21],其主要作用是增加采食量和控制能量损耗,与脂肪的累积相关。食欲增食因子及其受体在不同种动物中的分布也不同,相关研究表明,食欲增食因子在猪、新生狗和马的胃肠道神经系统均有分布,而在反刍动物体内肠道黏膜下层和肌层发现有OX1R的分布。Dyer等[22]按3 mg/kg体重给断奶仔猪肌肉注射人工合成的猪食欲增食因子,12 h后试验猪采食了额外的食物;12~24 h间,试验猪累计采食量显著增加;24 h后累计采食量比对照组提高18%,表明食欲增食因子能够上调猪的采食量。而对于反刍动物,Kuhla等[23]研究指出,食欲素A(OXA)是存在于分娩前起到食欲调节的一种物质,并且在进食条件下的表达量显著增加。Kuhla等[23]还指出,在禁食过程中PPARγ和OXA的表达量同步增加,并且与自由采食时相比差异显著。以上可以表明,食欲增食因子对各种动物均有调节采食的作用。
食欲增食因子可通过多种途径参与对动物摄食的调节,其中包括通过磷脂酰肌醇信号通路的调节参与摄食。Gorojankina等[24]在研究OXA对Wistar大鼠Odora细胞作用途径时发现,用OXA处理后,显著地增加了IP3、Ca2+的浓度。此试验表明在食欲增食因子调节采食的过程中存在磷脂酰肌醇信号通路。OXA可引起Ca2+浓度升高,此功能大概是由于钙离子通道被开启而引发的。食欲增食因子的增食作用可被PKC特异性阻断剂完全阻断,也可表明食欲增食因子的作用可能是通过与Gq偶联蛋白受体结合激活磷脂酰肌醇信号通路,从而激活PKC,使Ca2+通道开启,从而增加Ca2+内流,如图 3所示。即食欲增食因子是通过磷脂酰肌醇信号通路完成对采食的调控[25]。
2.3 饥饿素(ghrelin)通过磷脂酰肌醇信号通路对动物采食的影响及作用机制饥饿素是人类的胃和胰腺的基底部P/D1细胞产生的一种刺激食欲的激素,是生长激素促分泌激素受体1A(growth hormone secretagogue receptor-1A,GHSR-1A)的一种内源性配体。饥饿素分布较广,中枢神经与外周均有分布。较多研究已证实,人类和动物注射饥饿素可以刺激食欲,增加采食。给断奶仔猪静脉注射外源饥饿素,5 d后发现与注射生理盐水组的仔猪相比,摄食次数增加,体重也明显增大。然而对于禽类,当给雏鸡脑室内注射饥饿素后,雏鸡的采食量明显下降,血浆中皮质醇和肾上腺皮质激素的浓度增加,鸡产生厌食症,且这种食欲抑制随着添加量的增加呈现相关依赖性。给日本鹌鹑脑室内注射饥饿素后效果与鸡相似。这些结果说明,饥饿素在调节动物摄食方面具有种属差异。但饥饿素确实可调节各种动物的采食。
饥饿素对摄食的调节也可通过多种途径实现,其中饥饿素促进成长激素分泌的作用是由GHSR-1A介导的,研究证明,GHSR-1A是一种Gq蛋白偶联受体,它被激活后通过PLC或者腺苷酸环化酶(AC)发挥生物学效应。饥饿素与GHSR-1A结合后,激活PLC,水解PIP2生产IP3和DAG,IP3促进Ca2+的释放,如图 3所示。而Darko等[26]的研究发现,饥饿素对食欲的控制是通过激活磷脂酰肌醇信号通路后Ca2+浓度的增加启动雷帕霉素靶蛋白复合物1(mTORC1)/核糖体S6激酶1(S6K1)通路实现的。即细胞浆内钙离子水平升高产生钙离子流,钙离子流可激活腺苷酸活化蛋白激酶(AMPK),AMPK的激活不消耗能量[27, 28]。AMPK的磷酸化能增强沉默调节蛋白1(SIRT1)及其下游叉头框蛋白O1(FOXO1)活性、消弱雷帕霉素靶蛋白(mTOR)活性,进而激活促食神经元神经肽Y(NPY)/刺鼠相关蛋白(AgRP)或抑制抑食神经元前阿黑皮质素原(POMC)/可卡因安非他明调节转录肽(CART)而促进动物采食[29, 30]。而DAG作用于PKC,激活腺垂体细胞的Ca2+通道,刺激生长激素的分泌,增加胃排空的速率,从而促进动物的采食量[31, 32]。给大鼠静脉注射饥饿素(0.8~2.0 μg/kg)可引起剂量依赖性的胃酸分泌增多、胃收缩频率和幅度增强、胃排空加快。
3 小 结动物采食量是动物获得较好生产性能的重要因素,直接影响生产效率。综上所述,磷脂酰肌醇信号通路通过介导各类物质对各种动物采食的调节发挥作用,且这些物质在绝大多数哺乳动物中均存在,即磷脂酰肌醇信号通路在各类动物中均可发挥作用,包括啮齿动物、大小型哺乳动物。磷脂酰肌醇信号通路对采食量调节的关键在与Gq偶联蛋白受体的激活。而磷脂酰肌醇信号通路在各个方面对采食的作用则主要依赖于Ca2+浓度的增加及PKC等产物的调节。营养素对动物采食的调节则主要是通过激活整个通路达到目的。磷脂酰肌醇信号通路对动物多个生理过程尤其是采食具有较大的作用,但我们对于磷脂酰肌醇信号通路的认识还存在不足。国内外对于磷脂酰肌醇信号通路的研究多集中于啮齿类动物,而对于哺乳类动物的研究较少,且多数对于磷脂酰肌醇信号通路的研究存在医学领域。本综述通过对磷脂酰肌醇信号通路的介绍,旨在希望为之后的相关研究提供一些参考。近年来,随着Lefkowitz和Kobilka 2位科学家因G蛋白偶联受体的研究获得诺贝尔奖,G蛋白偶联受体的研究也正在受到越来越多的关注,相信在不久的将来,磷脂酰肌醇信号通路可以受到更多关注,哺乳动物上的研究也能取得较好的成果!
| [1] | VINESCM.Phospholipase C[J].Advances in Experimental Medicine and Biology,2012,740:235-254.( 1) 1) |
| [2] | PALCZEWSKI K,KUMASAKA T,HORI T,et al.Crystal structure of rhodopsin:a Gprotein-coupled receptor[J].Science,2000,289(5480):739-745.( 1) 1) |
| [3] | HUC S,MONTEIL A,BIDAUD I,et al.Regulation of T-type calcium channels:signalling pathways and functional implications[J].Biochimica et BiophysicaActa(BBA)-Molecular Cell Research,2009,1793(6):947-952.( 1) 1) |
| [4] | IFTINCA M C,ZAMPONI G W.Regulation of neuronal T-type calcium channels[J].Trends in Pharmacological Sciences,2009,30(1):32-40.( 1) 1) |
| [5] | PEREZ-REYES E.G protein-mediated inhibition of Cav3.2 T-type channels revisited[J].Molecular Pharmacology,2010,77(2):136-138.( 1) 1) |
| [6] | RANGEL A,SÁNCHEZ-ARMASS S,MEZA U.Protein kinase C-mediated inhibition of recombinant T-type Cav3.2 channels by neurokinin 1 receptors[J].Molecular Pharmacology,2010,77(2):202-210.( 1) 1) |
| [7] | XU Y Z,XIE X.Glucagon receptor mediates calcium signaling by coupling to Gαq/11 and Gαi/o in HEK293 cells[J].Journal of Receptors and Signal Transduction,2009,29(6):318-325.( 1) 1) |
| [8] | 吕彬,王勇,解芸菲,等.钙信号通过IP3通路对肥胖小鼠脂肪合成代谢的影响[J].西北农林科技大学学报:自然科学版,2011,39(9):41-47.( 3) 3) |
| [9] | CHEN F X,ZHENG D,XU Y M,et al.Down-regulation of Kir6.2 affects calcium influx and insulin secretion in HIT-T15 cells[J].Journal of Pediatric Endocrinology and Metabolism,2010,23(7):709-718.( 1) 1) |
| [10] | 余以刚,曾庆孝,姚惠源.三磷酸肌醇的研究进展[J].中国粮油学报,2001,16(6):34-36.( 1) 1) |
| [11] | MONTELL E,TURINI M,MAROTTA M,et al.DAG accumulation from saturated fatty acids desensitizes insulin stimulation of glucose uptake in muscle cells[J].American Journal of Physiology-Endocrinology and Metabolism,2001,280(2):E229-E237.( 1) 1) |
| [12] | 徐佳曦.G蛋白耦联受体激动剂调节细胞膜PIP2代谢及生理学意义的研究[D].博士学位论文.石家庄:河北医科大学,2014.( 1) 1) |
| [13] | DELZENNE N,BLUNDELL J,BROUNS F,et al.Gastrointestinal targets of appetite regulation in humans[J].Obesity Reviews,2010,11(3):234-250.( 1) 1) |
| [14] | FANTINOM.Role of lipids in the control of food intake[J].Current Opinion in Clinical Nutrition andMetabolic Care,2011,14(2):138-144.( 1) 1) |
| [15] | AHIMA R S,LAZAR M A.Adipokines and the peripheral and neural control of energy balance[J].Molecular Endocrinology,2008,22(5):1023-1031.( 1) 1) |
| [16] | 魏星灿.猪脂肪分解通路中主要基因的网络构建[D].硕士学位论文.保定:河北农业大学,2014.( 1) 1) |
| [17] | NIXON J P,MAVANJI V,BUTTERICK T A,et al.Sleepdisorders,obesity,andaging:the role of orexin[J].Ageing Research Reviews,2015,20:63-73.( 1) 1) |
| [18] | SUGITA T,SAKURABA S,KAKU Y,et al.Orexin induces excitation of respiratory neuronal network in isolated brainstem spinal cord of neonatal rat[J].Respiratory Physiology & Neurobiology,2014,200:105-109.( 1) 1) |
| [19] | QUARTA D,SMOLDERS I.Rewarding,reinforcing and incentive salient events involve orexigenic hypothalamic neuropeptides regulating mesolimbic dopaminergic neurotransmission[J].European Journal of Pharmaceutical Sciences,2014,57:2-10.( 1) 1) |
| [20] | BADONNEL K,LACROIX M C,DURIEUX D,et al.Rat strains with different metabolic statuses differ in food olfactory-driven behavior[J].Behavioural Brain Research,2014,270:228-239.( 1) 1) |
| [21] | 彭晓燕,郭菲菲,孙向荣,等.第四脑室注射orexin-A及OX1R拮抗剂对大鼠摄食及自由活动的影响[J].生理学报,2015,67(4):379-385.( 1) 1) |
| [22] | DYER C J,TOUCHETTE K J,CARROLL J A,et al.Cloning of porcine prepro-orexincDNAand effects of an intramuscular injection of synthetic porcine orexin-B on feedintake in young pigs[J].Domestic Animal Endocrinology,1999,16(3):145-148.( 1) 1) |
| [23] | KOBASHI M,FURUDONO Y,MATSUO R,et al.Centralorexin facilitates gastricrelaxation and contractility in rats[J].NeuroscienceLetters,2002,332(3):171-174.( 1) 1) |
| [24] | GOROJANKINA T,GRÉBERT D,SALESSE R,et al.Study of orexins signal transductionpathways in rat olfactory mucosa and in olfactory sensory neurons-derived cellline Odora:multipleorexinsignalling pathways[J].Regulatory Peptides,2007,141(1/2/3):73-85.( 1) 1) |
| [25] | LUND P E,SHARIATMADARI R,UUSTARE A,et al.Theorexin OX1 receptor activates a novel Ca2+ influx pathway necessary for coupling to phospholipase C[J].Journal of Biological Chemistry,2000,275(40):30806-30812.( 1) 1) |
| [26] | STEVANOVIC D,TRAJKOVIC V,MVLLER-LVHLHOFF S,et al.Ghrelin-induced food intake and adiposity depend on central mTORC1/S6K1 signaling[J].Molecular and Cellular Endocrinology,2013,381(1/2):280-290.( 1) 1) |
| [27] | KLIPA.The many ways to regulate glucose transporter4[J].Applied Physiology,Nutrition,and Metabolism,2009,34(3):481-487.( 1) 1) |
| [28] | SUNY,BILAN P J,LIU Z,et al.Rab8A and Rab13 are activated by insulin and regulate GLUT4 translocation in muscle cells[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(46):19909-19914.( 1) 1) |
| [29] | FIJAŁKOWSKI F,JARZYNA R.Role of hypothalamic AMP-activated protein kinase in the control of food intake[J].Postepy Higieny I Medycyny Doswiadczalnej,2010,64:231-243.( 1) 1) |
| [30] | WICZER B M,THOMAS G.The role of the mTOR pathway in regulating food intake[J].Current Opinionin Drug Discovery & Development,2010,13(5):604-612.( 1) 1) |
| [31] | WANG G Y,LEE H M,ENGLANGDER E,et al.Ghrelin-not just another stomach hormone[J].Regulatory Peptides,2002,105(2):75-81.( 1) 1) |
| [32] | KELLEY A E,BALDO B A,PRATT W E,et al.Corticostriatal-hypothalamic circuitry and food motivation:integration of energy,action and reward[J].Physiology & Behavior,2005,86(5):773-795.( 1) 1) |




