2. 吉林大学动物医学学院, 长春 130062
2. College of Veterinary Medicine, Jilin University, Changchun 130062, China
奶牛酮病是围产期奶牛常见的营养代谢性疾病,多见于泌乳初期能量负平衡的奶牛[1, 2],常引起食欲不振、精神沉郁等症状,严重的可引起神经功能紊乱,常诱发脂肪肝、皱胃变位、胎衣不下和生产瘫痪等代谢性疾病[3],给奶牛业带来巨大的经济损失。当奶牛发生能量负平衡时,脂肪大量动员,导致肝脏脂代谢紊乱[1, 4]。当机体发生氧化应激、低血糖等代谢紊乱时,腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)被磷酸化激活,蛋白质、脂肪和糖原合成代谢通路受到抑制,葡萄糖转运、脂肪酸氧化及糖酵解等代谢通路得到增强[5, 6]。
1 AMPK信号转导通路肝脏是动物机体脂代谢的枢纽,肝脏脂代谢紊乱是造成酮病、脂肪肝和胰岛素(insulin,INS)抵抗等能量代谢性疾病的重要原因之一[7]。AMPK是一个进化保守的丝氨酸/苏氨酸蛋白激酶,由催化亚基α、调节亚基β和γ组成,参与细胞中的多条代谢通路来适应能量的变化,在调节细胞和机体能量稳态上有重要作用,被认为是细胞的能量感受器[8]。它广泛存在于骨骼肌、肝脏、胰腺和脂肪组织中,可通过对靶蛋白的磷酸化调节代谢通路,影响脂代谢[9]。AMPK在肝脏脂代谢中起着核心作用[9]。对大鼠的研究表明,AMPK活化后,导致大鼠体内β-羟-β-甲基戊二酰辅酶A(β-hydroxy-β-methyl glutaryl coenzyme A,HMG-CoA)合成酶、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)和甘油-3-磷酸酰基转移酶活性降低甚至丧失,从而抑制胆固醇、脂肪酸和甘油三酯(triglyceride,TG)的合成,提高脂肪酸的氧化速度[10]。AMPK通过甾醇调节元件结合蛋白Ⅰc(sterol regulatory element-binding protein-Ⅰc,SREBP-Ⅰc)、磷酸化碳水化合物应答元件结合蛋白(carbohydrate responsive element-binding protein,ChREBP)和过氧化物酶体增殖激活受体(peroxisome proliferators-activated receptor,PPAR)α参与脂代谢的调节[5, 11, 12]。SREBP-Ⅰc是一种主要高表达于肝脏的转录因子,通过调控脂肪酸、TG合成和转运相关酶的表达来促进脂合成和转运作用[5]。肝脏高表达SREBP-Ⅰc基因的小鼠,可导致TG的聚集,且脂肪酸的合成速率和相关酶类表达升高[5]。ChREBP同样是调控肝脏脂代谢的主要转录因子,与SREBP-Ⅰc相互协作,共同完成肝脏的脂代谢调节[13]。在正常饮食情况下,ChREBP基因敲除小鼠的肝脏中,三磷酸腺苷(adenosine triphosphate,ATP)-柠檬酸裂解酶、ACCⅠ和脂肪酸合成酶的mRNA水平较对照组小鼠均显著下降,最终导致其肝脏脂肪酸合成减少[13]。PPARα是PPAR的一种亚型,主要高表达于具有丰富线粒体和β氧化活性的组织,如肝、心脏[11]。动物研究表明,PPARα能与配体结合而活化,从而增强与脂质代谢有关的酶和基因的转录,如肉碱脂酰基转移酶Ⅰ、肉碱脂酰基转移酶Ⅱ、酰基辅酶A氧化酶3-羟基-3-甲基戊二酰辅酶A合成酶,使肝脏氧化脂肪酸能力加强[11]。
2 胰高血糖素(glucagon,GLN)与奶牛酮病及AMPK信号转导通路 2.1 GLN与奶牛酮病当发生酮病时,奶牛参与能量调节的内分泌激素发生显著变化,主要是INS和GLN[7]。酮病奶牛血液中INS含量降低,GLN的含量显著升高[7]。其中,GLN是由胰岛α细胞分泌的一种多肽激素,由29个氨基酸残基组成,主要作用于肝脏,促进肝糖原分解,抑制肝糖原合成,促进葡萄糖异生、分解和脂肪分解[12]。因此,GLN对于反刍动物的能量代谢至关重要。近年来对GLN在脂代谢方面的研究逐年增加。Bobe等[14]研究表明,中度脂肪肝奶牛产犊后2~3周注射GLN(15 mg/d),可以缓解由脂肪肝导致的体温升高,以及减低患乳房炎的风险。他们还指出,环境低于35 ℃时,皮下注射GLN,效果更明显,且无副作用。
2.2 GLN与AMPK信号转导通路GLN和环腺苷酸(cAMP)的增加可导致HMG-CoA还原酶以及ACC的失活,而这2种酶正是AMPK的作用靶点[15, 16]。使用GLN刺激鼠的肝细胞,可以导致ACC磷酸化而失活,最初的研究认为这是由cAMP依赖蛋白激酶直接抑制所致,而进一步的研究却发现这是AMPK的作用结果[16]。因此,增加GLN的含量或者由条件改变引起GLN的增加,均可导致肝脏AMPK的活化[17]。GLN与AMPK信号转导通路相互关系如图 1所示。
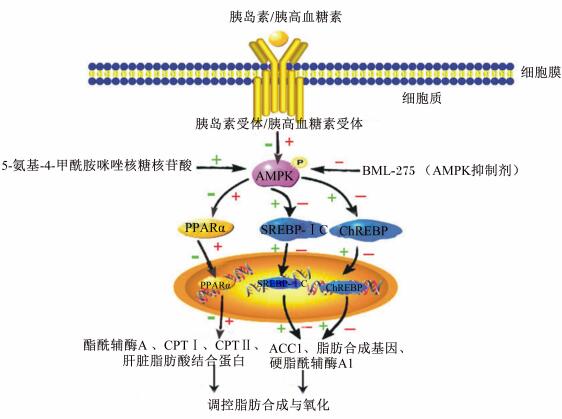 | 图1 GLN和INS与AMPK信号转导通路调控的相互关系 Fig. 1 The correlation between GLN and INS,and AMPK signal transduction pathways |
为了更清楚地了解GLN的生理作用,必须要知道GLN由胰腺分泌到门静脉,而门静脉是肝脏最主要的供血血管[18]。这是GLN对肝脏起作用的有效通道,但也是试验困难的所在。因为,大部分的GLN在肝脏被利用,检测系统血液并不能反映门静脉血液中GLN的含量[18]。GLN增加肝脏葡萄糖的输出、脂肪酸氧化和氨基酸代谢以及尿素生成[7]。近期研究表明,体内GLN的升高可以增加单磷酸腺苷(AMP)/ATP,同时活化AMPK,而且,饥饿和锻炼时,GLN受体信号是AMPK活化必不可少的[19]。
在氧气吸收和脂肪氧化增加时,GLN增加,AMPK活化[20]。三羧酸循环(tricarboxylic acid cycle,TCA)和糖异生的关系与ATP生成、消耗的关系是相对应的。TCA和糖异生的增加会引起肝脏ATP的消耗,这与锻炼和饥饿时引起AMP/ATP的增加是相似的[21]。活化脂肪酸的氧化和氨基酸的糖异生也需要消耗ATP。研究表明,氨基酸和脂肪酸糖异生,每生产1 mol葡萄糖分别消耗6和4 mol的ATP;乳酸、丙氨酸、丙酮酸以及油酸转移入TCA,AMP也会增加[22]。也就是说,GLN信号可通过增加肝脏AMP含量,进而活化AMPK。
AMP的增加可以使AMPK磷酸化增加,被认为是肝激酶BⅠ(liver kinase BⅠ,LKBⅠ)作用的结果[23]。GLN也可以增加细胞质内钙离子(Ca2+)的含量,从而活化钙调蛋白依赖性蛋白激酶激酶α/β,最终使AMPK磷酸化[24]。Berglund等[21]研究表明,野生型小鼠在饥饿处理18 h或运动到精疲力竭时,分别可以导致AMP/ATP增加5和10倍,而在GLN受体缺陷的小鼠模型中,则不会出现上述变化。同时,使用高胰高血糖素-正葡萄糖钳夹技术,可以提高循环血中GLN却不会造成高血糖和高INS血症。
饥饿时,肝脏AMPK活化,使ACC失活,这一现象在肝脏呈带状分布[25]。门静脉附近组织的糖异生、尿素生成和β-氧化以及酮体生成能力较强,这种现象同激素与肝脏底物的含量相对应[26]。饥饿的情况下,AMPK活化主要集中在门静脉附近,这与GLN在门静脉附近浓度较高一致[27]。长时间剧烈运动也会导致ACC的失活,降低丙二酰辅酶A含量,增加β-羟基丁酸(beta-hydroxybutyrate,BHBA)的含量,并活化AMPK[28]。GLN介导的AMPK活化可快速抑制肝脏脂肪的从头合成并促进脂肪酸的氧化,通过抑制ACC调节丙二酰辅酶A的能力,减少脂肪生成碳底物,并消除对肉碱棕榈酰转移酶-Ⅰ(carnitine palmitoyl transterase-Ⅰ,CPTⅠ)的抑制作用[29]。相同地,GLN抑制SREBP-Ⅰc的表达,SREBP-Ⅰ是肝脏脂肪生成的控制器[30]。Li等[5]的研究表明,AMPK磷酸化可以降低SREBP-Ⅰc的活性,缺乏AMPKβⅠ的肝细胞TG合成能力提升,脂肪酸氧化能力减弱。因此可以推断GLN通过AMPK抑制了SREBP-Ⅰc的活性。
通过对肝脏AMPKαⅡ缺乏或过表达小鼠的研究表明,AMPK活化抑制脂肪生成,促进脂肪氧化[31]。对肝脏缺乏AMPKαⅡ的小鼠进行5 h的饥饿处理,可导致其血浆游离脂肪酸(free fatty acids,FFAs)、TG的升高和BHBA减少。GLN受体基因敲除小鼠模型在饥饿处理16 h后,其血脂状态与上述AMPKαⅡ缺乏小鼠相似,TG和FFAs升高[32]。相反地,腺病毒介导的肝脏AMPKαⅡ过表达,可降低血浆TG含量,增加BHBA含量[31]。
长时间自主和强迫运动,可导致GLN作用增强,AMPK活化,这与改善高脂饮食造成小鼠脂肪肝相一致[19]。剧烈和长时间运动可以使肝脏AMP/ATP升高,AMPK活化,这依赖GLN受体信号以及磷酸烯醇丙酮酸羧激酶的含量[21]。AMP/ATP的提高、AMPK活化以及PPARα和成纤维细胞生长因子(fibroblast growth factor XXI,FGFXXI)的转录和翻译伴随着脂肪肝的改善[19]。在脂肪细胞中,FGFXXI可增加AMPK活化、烟酰腺嘌呤二核苷酸/还原型烟酰胺腺嘌呤二核苷酸和氧气消耗;在线粒体中,FGFXXI发挥作用则主要依赖过氧化物酶体增生物激活受体辅助活化因子Ⅰα、LKBⅠ、AMPK和沉默信息调节因子[33]。在肝脏中,FGFXXI介导GLN发挥着长期的作用。完整的GLN-AMPK信号网络对肝脏疾病的恢复可能是至关重要的。因此可以推测,奶牛酮病肝脂代谢紊乱可能与高GLN状态引起的肝脏AMPK信号通路变化有关。
3 INS与奶牛酮病及AMPK信号转导通路当奶牛发生酮病时,另一能量代谢激素INS水平降低[13]。INS是由胰岛β细胞分泌的一种蛋白质激素,是机体内唯一降低血糖的激素,主要作用于肝脏,可促进糖原、脂肪和蛋白质合成。
INS和AMPK信号通路通过在关键信号位点进行重叠,来共同维持器官的稳态[34]。在很多病理状态下,可以检测到INS和AMPK信号通路的失衡,例如糖尿病、肥胖、营养缺乏[5]。已有研究证明,INS可降低肝脏AMPK的活性。经INS前期处理,丝氨酸/苏氨酸蛋白激酶/蛋白激酶B可以使AMPKαⅠ第485位丝氨酸(Ser485)和AMPKαⅡ第491位丝氨酸(Ser491)磷酸化,而AMPKα第172位苏氨酸(Thr172)磷酸化减少[35]。前面提到,AMPK可抑制脂肪合成,促进脂肪氧化,可通过增加cAMP,GLN和肾上腺素来活化AMPK,从而迅速使ACC失活。与此相反,INS降低AMPK的活性,同时增加ACC的活性[36]。INS介导的ACC活化的具体机制仍未明确,可能是共价以及变构修饰的结果[37]。
GLN和AMPK共同降低SREBP-Ⅰc的表达与活化,GLN间歇地刺激活化AMPK,例如,定期的运动能调节氧化应激、肝脏抗脂肪生成区域,活化PPARα,抑制雷帕霉素靶蛋白复合物Ⅰ和SREBP-Ⅰc[30]。相反,INS增强SREBP-Ⅰc的编码和转录以及靶基因的表达[38]。机体在正常或者存在INS抵抗的状况下,INS通过对SREBP-Ⅰc的控制,介导肝脏中脂肪的合成[39]。AMPK对机体的调节并不是单一的,而是与许多代谢通路和调节信号组成的复杂网络而发挥作用。GLN和INS与AMPK信号转导通路调控的相互关系如图 1所示。
4 奶牛酮病与AMPK信号转导通路奶牛酮病的特点是高非酯化脂肪酸、高BHBA和低血糖,存在能量负平衡,体内代谢紊乱。而AMPK信号转导通路在调节糖酵解、葡萄糖转换、脂类代谢过程中发挥着重要的作用。已有研究通过培养牛肝细胞,添加BHBA和AMPK抑制剂(Compound C,Cpd C)来检测BHBA在AMPK信号转导通路中发挥的作用。结果表明,当BHBA含量达到1.2 mmol/L时,AMPK信号通路被激活,SREBP-Ⅰc及其目的基因的表达下降。没有添加Cpd C组中,PPARα、ChREBP及其目的基因的表达显著升高。这说明BHBA可以激活AMPK信号转导通路,调控AMPK脂代谢相关基 因[40]。Mahmoudi等[41]研究表明,通过调控AMPKγⅠ 3′非编码区基因的突变,血清中BHBA含量明显升高,说明AMPKγⅠ基因在酮体生成过程中发挥着重要的作用。
5 小结与展望
奶牛酮病的发生,是一个十分复杂的过程,尽管在过去的一段时间内,有关奶牛酮病的研究报道已经很多,但主要集中在奶牛酮病的防治上,其发生的分子机制目前为止还不清楚。近年来,AMPK信号通路已经逐渐成为生命科学研究的热点。但是,多数有关这方面的报道主要集中在小鼠和人,有关反刍动物,尤其是奶牛,这方面文献报道的资料还知之甚少。因此,研究奶牛酮病发生过程中,GLN和INS如何调控AMPK信号转导通路中关键酶、基因,非编码RNA的表达,将具有十分重要的意义。
| [1] | 张辉,王哲.围产期奶牛能量代谢障碍性疾病概述[J]. 中国兽医杂志,2007,43(4):72-74. ( 2) 2)
|
| [2] | 黄克和.奶牛酮病和脂肪肝综合症研究进展[J]. 中国乳业,2008(6):62-66. ( 1) 1)
|
| [3] | VAN KNEGSEL A T M,VAN DEN BRANDA H,DIJKSTRA J,et al.Effect of dietary energy source on energy balance,production,metabolic disorders and reproduction in lactating dairy cattle[J]. Reproduction Nutrition Development,2005,45(6):665-688. ( 1) 1)
|
| [4] | 孙玉成.围产期奶牛肝VLDL组装与分泌主要相关蛋白基因表达的调控[D]. 博士学位论文.长春:吉林大学,2006. ( 1) 1)
|
| [5] | LI Y,XU S Q,MIHAYLOVA M M,et al.AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice[J]. Cell Metabolism,2011,13(4):376-388. ( 5) 5)
|
| [6] | 陈雷.AMP激活蛋白质激酶(AMPK)调控机制的研究[D]. 博士学位论文.北京:清华大学,2010. ( 1) 1)
|
| [7] | 李鹏.酮病奶牛肝脏脂肪酸氧化代谢特征及其调控[D]. 博士学位论文.长春:吉林大学,2012. ( 3) 3)
|
| [8] | HARDIE D G,HAWLEY S A.AMP-activated protein kinase:the energy charge hypothesis revisited[J]. BioEssays,2001,23(12):1112-1119. ( 1) 1)
|
| [9] | FORETZ M,VIOLLET B.Regulation of hepatic metabolism by AMPK[J]. Journal of Hepatology,2011,54(4):827-829. ( 1) 1)
|
| [10] | BROWNING J D,HORTON J D.Molecular mediators of hepatic steatosis and liver injury[J]. The Journal of Clinical Investigation,2004,114(2):147-152. ( 1) 1)
|
| [11] | UYEDA K,YAMASHITA H,KAWAGUCHI T.Carbohydrate responsive element-binding protein(ChREBP):a key regulator of glucose metabolism and fat storage[J]. Biochemical Pharmacology,2002,63(12):2075-2080. ( 3) 3)
|
| [12] | 张永宏,高妍,孙玉成,等.神经内分泌因子、代谢产物对体外培养新生犊牛肝细胞胰高血糖素受体mRNA丰度的影响[J]. 中国草食动物,2007,27(6):3-6. ( 2) 2)
|
| [13] | BARRETO-TORRES G,PARODI-RULLÁN R,JAVADOV S.The role of PPARα in metformin-induced attenuation of mitochondrial dysfunction in Acute Cardiac Ischemia/reperfusion in rats[J]. International Journal of Molecular Sciences,2012,13(6):7694-7709. ( 3) 3)
|
| [14] | BOBE G,AMETAJ B N,YOUNG J W,et al.Effects of exogenous glucagon on lipids in lipoproteins and liver of lactating dairy cows[J]. Journal of Dairy Science,2003,86(9):2895-2903. ( 1) 1)
|
| [15] | HOLLAND R,WITTERS L A,HARDIE D G.Glucagon inhibits fatty acid synthesis in isolated hepatocytes via phosphorylation of acetyl-CoA carboxylase by cyclic-AMP-dependent protein kinase[J]. European Journal of Biochemistry,1984,140(2):325-333. ( 1) 1)
|
| [16] | SIM A T R,HARDIE D G.The low activity of acetyl-CoA carboxylase in basal and glucagon-stimulated hepatocytes is due to phosphorylation by the AMP-activated protein kinase and not cyclic AMP-dependent protein kinase[J]. FEBS Letters,1988,233(2):294-298. ( 2) 2)
|
| [17] | BERGLUND E D,KANG L,LEE-YOUNG R S,et al.Glucagon and lipid interactions in the regulation of hepatic AMPK signaling and expression of PPARα and FGF21 transcripts in vivo[J]. American Journal of Physiology:Endocrinology and Metabolism,2010,299(4):E607-E614. ( 1) 1)
|
| [18] | WASSERMAN D H,LACY D B,BRACY D P.Relationship between arterial and portal vein immunoreactive glucagon during exercise[J]. Journal of Applied Physiology,1993,75(2):724-729. ( 2) 2)
|
| [19] | BERGLUND E D,LUSTIG D G,BAHEZA R A,et al.Hepatic glucagon action is essential for exercise-induced reversal of mouse fatty liver[J]. Diabetes,2011,60(11):2720-2729. ( 3) 3)
|
| [20] | KIMMIG R,MAUCH T J,KERZL W,et al.Actions of glucagon on flux rates in perfused rat liver[J]. The FEBS Journal,1983,136(3):609-616. ( 1) 1)
|
| [21] | BERGLUND E D,LEE-YOUNG R S,LUSTIG D G,et al.Hepatic energy state is regulated by glucagon receptor signaling in mice[J]. The Journal of Clinical Investigation,2009,119(8):2412-2422. ( 3) 3)
|
| [22] | HEMS R,ROSS B D,BERRY M N,et al.Gluconeogenesis in the perfused rat liver[J]. Biochemical Journal,1966,101(2):284-292. ( 1) 1)
|
| [23] | HAWLEY S A,BOUDEAU J,REID J L,et al.Complexes between the LKB1 tumor suppressor,STRADα/β and MO25α/β are upstream kinases in the AMP-activated protein kinase cascade[J]. Journal of Biology,2003,2(4):28. ( 1) 1)
|
| [24] | CHAREST R,BLACKMORE P F,BERTHON B,et al.Changes in free cytosolic Ca2+ in hepatocytes following α1-adrenergic stimulation.Studies on Quin-2-loaded hepatocytes[J]. The Journal of Biological Chemistry,1983,258(14):8769-8773. ( 1) 1)
|
| [25] | MUNDAY M R,MILIC M R,TAKHAR S,et al.The short-term regulation of hepatic acetyl-CoA carboxylase during starvation and re-feeding in the rat[J]. Biochemical Journal,1991,280(3):733-737. ( 1) 1)
|
| [26] | JUNGERMANN K,KEITZMANN T.Zonation of parenchymal and nonparenchymal metabolism in liver[J]. Annual Review of Nutrition,1996,16(1):179-203. ( 1) 1)
|
| [27] | WITTERS L A,GAO G,KEMP B E,et al.Hepatic 5'-AMP-activated protein kinase:zonal distribution and relationship to acetyl-CoA carboxylase activity in varying nutritional states[J]. Archives of Biochemistry and Biophysics,1994,308(2):413-419. ( 1) 1)
|
| [28] | CARLSON C L,WINDER W W.Liver AMP-activated protein kinase and acetyl-CoA carboxylase during and after exercise[J]. Journal of Applied Physiology,1999,86(2):669-674. ( 1) 1)
|
| [29] | HALLOWS K R.Emerging role of AMP-activated protein kinase in coupling membrane transport to cellular metabolism[J]. Current Opinion in Nephrology & Hypertension,2005,14(5):464-471. ( 1) 1)
|
| [30] | FORETZ M,PACOT C,DUGAIL I,et al.ADD1/SREBP-1c is required in the activation of hepatic lipogenic gene expression by glucose[J]. Molecular and Cellular Biology,1999,19(5):3760-3768. ( 2) 2)
|
| [31] | FORETZ M,ANCELLIN N,ANDREELLI F,et al.Short-term overexpression of a constitutively active form of AMP-activated protein kinase in the liver leads to mild hypoglycemia and fatty liver[J]. Diabetes,2005,54(5):1331-1339. ( 2) 2)
|
| [32] | LONGUET C,SINCLAIR E M,MAIDA A,et al.The glucagon receptor is required for the adaptive metabolic response to fasting[J]. Cell Metabolism,2008,8(5):359-371. ( 1) 1)
|
| [33] | CHAU M D L,GAO J P,YANG Q,et al.Fibroblast growth factor 21 regulates energy metabolism by activating the AMPK-SⅡRT1-PGC-1α pathway[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(28):12553-12558. ( 1) 1)
|
| [34] | HASENOUR C M,BERGLUND E D,WASSERMAN D H.Emerging role of AMP-activated protein kinase in endocrine control of metabolism in the liver[J]. Molecular and Cellular Endocrinology,2013,366(2):152-162. ( 1) 1)
|
| [35] | MORALES-ALAMO D,PONCE-GONZÁLEZ J G,GUADALUPE-GRAU A,et al.Increased oxidative stress and anaerobic energy release,but blunted Thr172-AMPKα phosphorylation,in response to sprint exercise in severe acute hypoxia in humans[J]. Journal of Applied Physiology,2012,113(6):917-928. ( 1) 1)
|
| [36] | WITTERS L A,KEMP B E.Insulin activation of acetyl-CoA carboxylase accompanied by inhibition of the 5'-AMP-activated protein kinase[J]. The Journal of Biological Chemistry,1992,267(5):2864-2867. ( 1) 1)
|
| [37] | BROWNSEY R W,BOONE A N,ELLIOTT J E,et al.Regulation of acetyl-CoA carboxylase[J]. Biochemical Society Transactions,2006,34:223-227. ( 1) 1)
|
| [38] | LI S,BROWN M S,GOLDSTEIN J L.Bifurcation of insulin signaling pathway in rat liver:mTORC1 required for stimulation of lipogenesis,but not inhibition of gluconeogenesis[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(8):3441-3446. ( 1) 1)
|
| [39] | BROWN M S,GOLDSTEIN J L.Selective versus total insulin resistance:a pathogenic paradox[J]. Cell Metabolism,2008,7(2):95-96. ( 1) 1)
|
| [40] | DENG Q H,LIU G W,LIU L,et al.BHBA influences bovine hepatic lipid metabolism via AMPK signaling pathway[J]. Journal of Cellular Biochemistry,2015,116(6):1070-1079. ( 1) 1)
|
| [41] | MAHMOUDI A,ZARGARAN A,AMINI H R,et al.A SNP in the 3'-untranslated region of AMPKγ1 may associate with serum ketone body and milk production of Holstein dairy cows[J]. Gene,2015,574(1):48-52. ( 1) 1)
|




