2. 平度市畜牧兽医局, 青岛 266700
2. Bureau of Animal Husbandry and Veterinary Medicine of Pingdu, Qingdao 266700, China
近年来,随着奶牛养殖业集约化、规模化程度不断提高,有效缓解了奶牛市场供求矛盾,但同时也产生了大量奶牛粪污,对周边环境造成了严重污染,其中,氮对环境的影响尤为严重。尽管对奶牛粪污进行固液分离、厌氧发酵、污水净化等无害化处理可以减轻氮污染,但终因其成本高昂等缺点,目前很难在中小型奶牛养殖场得到全面推广,而营养调控技术不仅成本较小且还可产生经济效益,更容易为广大中小型奶牛养殖场所接受。如何在实际生产中采取营养调控技术,在提高奶牛生产性能的同时,提高氮利用率,减少氮的排泄,将成为解决奶牛养殖过程中氮污染和加快奶牛养殖业发展的一个重要途径。小肽(small peptide,SP)通常是指有2~3个氨基酸构成的寡肽,是饲料蛋白质在消化酶作用下降解为氨基酸过程中的重要产物,这些产物能以完整的形式被吸收进入循环系统,且比单一氨基酸更易被组织吸收利用[1]。王恬等[2]研究发现,添加肽营养素可以显著提高奶牛的产奶量、乳蛋白率和乳脂率,提高奶牛产奶性能。王文娟等[3]的瘤胃灌注试验表明,大豆SP能提高肉牛饲粮营养成分的消化率,增加氮沉积。目前,SP在奶牛生产上的研究主要集中在产奶量上,对饲粮中添加SP是否能够增加微生物蛋白(MCP)产量、降低氮排泄的相关研究鲜见报道。本试验拟通过向奶牛饲粮中添加不同水平SP,探讨SP对奶牛瘤胃MCP产量、产奶性能及氮排泄的影响,以期提高奶牛产奶性能、节省蛋白质饲料资源和降低奶牛氮排泄,为实现奶牛业的健康可持续发展提供参考依据。
1 材料与方法 1.1 SPSP购自哈尔滨某公司,为棕色粉末状物质,其主要原料为大豆,粗蛋白质(CP)≥50%,肽≥40%,水分≤8%,粗灰分≤8%(干物质基础)。载体用精料为犊牛料,由青岛奥特奶牛原种场提供。
1.2 试验设计用单因素随机区组设计,选用青岛奥特奶牛原种场体况良好,年龄、体重、产奶量、乳成分和泌乳期[(45±15)d]相近的荷斯坦奶牛40头,分为4组,每组10头。对照组和试验1组、2组、3组分别补饲0、50、100和150 g/(d·头)SP。方法为将SP加入0.25 kg载体犊牛料中混匀后,将其均分为2份,每日2次随全混合日粮(TMR)饲喂。TMR组成及其营养水平见表 1。
| 表1 TMR组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the TMR (DM basis) |
整个试验期为75 d,其中预试期15 d,正试期60 d。试验牛舍饲,采用利拉伐挤奶设备日挤奶2次(03:30、15:30),日饲喂TMR 2次(04:00、16:00),确保奶牛每天必须有20 h以上可以接触到TMR。奶牛采食后在运动场自由运动和饮水,按常规光照、驱虫及管理。
1.3 试样采集及处理 1.3.1 饲料样按四分法收集TMR样和载体犊牛料样,65 ℃烘箱中烘干,制成风干样,粉碎后备用。
1.3.2 粪样预试期第1~3天,正试期第28~30天,正试期第58~60天时采集3次粪样,采用全收粪法,每组收集10头试验牛的粪样,连续3 d进行24 h全收粪,粪收集时将牛床冲刷干净,及时将试牛粪便收集入粪桶,混合每天所收集的粪样称重,称重时采用四分法收集当天粪样,按每100 g粪样加10%硫酸25 mL进行固氮处理后放入冰箱-20 ℃冷冻保存,采样期的最后1天按样重比例混匀3 d所留粪样,放入烘箱中65 ℃烘干,制成风干样,用于氮含量测定。
1.3.3 尿样预试期第1~3天,正试期第28~30天,正试期第58~60天时采样,参考朱雯[6]点收尿法收集,采取人工接尿结合膀胱取尿的方式,即每次采样时,将牛用颈夹固定后,把导尿管插到膀胱里采取膀胱取尿的方式依次采集每头牛的尿样,若采集过程中牛出现自主排尿的姿势,由专人负责接尿,每组收集10头试验牛的尿样,连续收集3 d,每天收集2次,每隔12 h收集1次,每天在前1天的基础上延后4 h收集,按一定比例加98%浓H2SO4以调整尿液pH低于3,-20 ℃保存。
1.3.4 乳样预试期开始当天、正试期每隔15 d采集1次乳样,均按早、晚产奶量的比例共收集65 mL乳样,其中50 mL乳样加入重铬酸钾防腐剂(0.6 mg/mL)混合均匀,4 ℃冷藏用于乳成分含量检测。剩余15 mL经1 500×g离心10 min,取4 mL离心乳样,加入等体积的三氯乙酸(TCA)(25%),静置5 min后于3 500×g下离心20 min去蛋白质,取1.5 mL处理好的乳样-20 ℃冷冻用于乳尿素氮排泄量的测定。
1.4 测定指标与方法 1.4.1 采食量预试期内每隔2 d称量1次剩料,并记录投料量(TMR车停稳状态下电子显示投料量),每次饲喂前收集剩料并称重,根据投料量和剩料量计算每头奶牛的平均采食量,共记录6次,预试期结束时根据6次的记录数据,计算得出预试期每头奶牛的平均采食量。按照同样的方法,正试期内每隔10 d记录和计算1次采食量,共6次。正试期结束时根据6次的记录数据,计算得出正试期每头奶牛的平均采食量。每次根据上次测定的采食量调整下一阶段的TMR投料量。根据平均采食量和TMR营养物质含量计算养分采食量。
1.4.2 瘤胃MCP产量尿中排出的嘌呤衍生物(PD)主要来自瘤胃微生物嘌呤,因此可以通过PD估测经瘤胃排出的MCP产量。采用比色法分别测定尿中尿酸和尿囊素含量,尿酸与尿囊素含量之和即为尿PD含量[7]。
小肠吸收外源性嘌呤的量(X,mmol/d)的计算公式为:
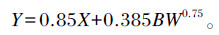
式中:Y为尿中PD的排出量(mmol/d);0.85为牛肠道中吸收的嘌呤转化为尿中PD的回收率;0.385为当吸收嘌呤的量为0时,尿中排出内源PD的量;BW0.75为是动物的代谢体重(kg)。
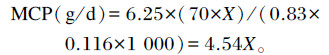
式中:X为小肠吸收外源性嘌呤的量(mmol/d);70为每摩尔嘌呤含氮量(mg/mol);0.83为微生物核酸嘌呤的消化率;0.116为瘤胃微生物总氮中嘌呤氮的比例;6.25为氮换算为蛋白质的平均系数。
正试期第30天和正试期结束时MCP产量的平均值为正试期瘤胃MCP产量。
1.4.3 产奶量及乳成分含量产奶量用利拉伐鱼骨式挤奶机测定,电子显示奶量。预试期、正试期每隔5 d记录1次奶量,每次连记3 d,取平均值。
采用山东省农业科学院奶牛研究中心生产性能测定实验室的乳成分和体细胞自动分析仪(CombiFoss FT+,丹麦Foss公司)测定乳蛋白率、乳脂率、乳糖率及乳体细胞数,采用加权平均法计算正试期各乳成分含量。
1.4.4 氮代谢指标尿氮含量采用凯氏定氮法分析[5],尿素氮含量采用脲酶法测定[8],尿肌酐含量采用苦味酸比色法测定[9],试剂盒均购自南京建成生物工程研究所。参照Valadares等[9]的方法,以尿肌酐(每头牛每天1 kg体重排出约29 mg)标记测定奶牛的排尿量。参照张丽英[5]主编的《饲料分析及饲料质量检测技术》中的方法测定饲粮及粪中CP含量。
氮代谢指标计算公式:

试验数据用Excel 2010软件进行数据的基本处理。采用SPSS 17.0软件进行单因素方差分析,Duncan氏法多重比较进行组间差异显著性检验,以P<0.01和P<0.05分别表示差异极显著和显著,结果以平均值±标准误表示。
2 结果与分析 2.1 SP添加水平对奶牛主要养分采食量的影响由表 2可知,饲粮中加入SP后对干物质和其他养分的采食量影响较小。
| 表2 SP添加水平对奶牛主要养分采食量的影响 Table 2 SP添加水平对奶牛主要养分采食量的影响 Effects of supplemental level of SP on main nutrient intakes of dairy cows |
由表 3可知,各试验组尿酸、尿囊素、PD排出量及MCP产量均显著高于对照组(P<0.05),其中试验2组显著高于试验3组(P<0.05),而试验2组和1组间无显著差异(P>0.05),试验3组与1组间差异不显著(P>0.05);试验1组、2组、3组MCP产量分别比对照组提高17.38%、22.94%、12.22%。
| 表3 SP添加水平对奶牛瘤胃微生物蛋白产量的影响 Table 3 Effects of supplemental level of SP on ruminal MCP production of dairy cows |
由表 4可知,试验1组、2组、3组的产奶量均显著高于对照组(P<0.05),分别比对照组提高9.93%、12.64%、7.53%,试验1组和3组之间无显著差异著(P>0.05)。试验1组和2组乳脂率显著高于对照组(P<0.05),而试验1组与2组之间差异不显著(P>0.05),试验3组与对照组间无显著差异(P>0.05);各试验组乳蛋白率均显著高于对照组(P<0.05),其中试验1组和2组显著高于试验3组(P<0.05),试验1组与2组之间无显著差异(P>0.05);各试验组乳体细胞数均显著低于对照组(P<0.05),其中,试验1组和2组显著低于试验3组(P<0.05),而试验1组和2组间无显著差异(P>0.05)。
| 表4 SP添加水平对奶牛产奶量及乳成分的影响 Table 4 Effects of supplemental level of SP on milk yield and milk composition of dairy cows |
由表 5可知,从粪氮排泄量来看,各试验组均显著低于对照组(P<0.05),试验1组和2组显著低于试验3组(P<0.05),而试验1组与2组之间无显著差异(P>0.05);在尿氮排泄量方面,各试验组均显著低于对照组(P<0.05),其中试验2组显著低于试验3组(P<0.05),试验2组与1组之间差异不显著(P>0.05),试验3组与1组间无显著差异(P>0.05);各试验组的乳尿素氮排泄量均显著低于对照组(P<0.05);试验1组、2组、3组氮总排泄量分别比对照组减少13.31%、15.01%、9.43%,各试验组显著低于对照组(P<0.05),试验1组和2组显著低于试验3组(P<0.05),而试验1组与2组间差异不显著(P>0.05)。从可消化氮来看,试验1组和2组显著高于对照组(P<0.05),而试验1组与2组之间差异不显著(P>0.05),试验3组与对照组间无显著差异(P>0.05);各试验组的氮表观消化率均显著高于对照组(P<0.05)。由此表明,饲粮中添加SP可以显著提高氮的消化利用率,减少氮排放量。
| 表5 SP添加水平对奶牛氮表观消化率及氮排泄的影响 Table 5 Effects of supplemental level of SP on excretion and apparent digestibility of nitrogen of dairy cows |
周萌[10]研究表明,植物SP对泌乳母猪、育肥猪的平均采食量影响差异不显著。陈宇光[11]研究发现饲喂SP和灌注SP均不能显著影响山羊主要养分采食量。本试验结果表明,添喂SP后不能显著提高奶牛采食量。王文娟等[3]的瘤胃灌注大豆SP的试验结果表明,大豆SP能够显著提高养分消化率和氮的表观消化率,增加氮沉积。饲粮中添加SP后氮表观消化率的提高可能与SP可以调控瘤胃发酵,使得某些蛋白质分解菌的活性降低,增加了蛋白质的过瘤胃利用率,刺激肠道消化酶活性,延长食糜在肠道内的潴留时间,增强消化道蠕动和消化酶的分泌有关。
3.2 SP添加水平对奶牛瘤胃MCP产量的影响MCP是反刍动物最主要的氮源供应,反刍动物蛋白质需要量的60%~70%来自瘤胃MCP,其产量反映了微生物对氮源的利用率,其产量还间接反映瘤胃中微生物菌群的数量。Griswold等[12]利用体外试验发现,肽提供氨基氮能显著提高MCP的产量。王梦芝等[13]利用体外试验研究表明低聚肽对MCP的合成量显著高于培养液为氯化铵时MCP合成量。本试验得出通过饲喂添加SP的饲粮显著提高了奶牛瘤胃MCP产量,与上述研究结果相符。MCP产量主要取决于碳水化合物和氮源的降解数量和速度是否相匹配,即能氮是否平衡的问题,王文娟等[14]研究表明,灌注SP可使得瘤胃液总挥发性脂肪酸(TVFA)浓度增加,另外,挥发性脂肪酸(VFA)是瘤胃微生物发酵碳水化合物的代谢产物,是反刍动物主要的能量来源。Hoover[15]研究表明,牛瘤胃中的乳酸杆菌、大肠杆菌、粪链球菌等微生物可直接利用瘤胃内的一些SP增强其活力,微生物活力的增强更有利于增强氮代谢,而脲酶活性的抑制,使氮源的降解速度降低,能氮更加平衡,更有利于MCP的生成,从而使MCP合成量增加。
3.3 SP添加水平对奶牛产奶量及乳成分的影响马惠茹等[16]研究表明,奶牛饲粮中添加大豆蛋白肽可显著提高产奶量,与本试验结果相一致。Kung等[17]报道,降低饲料蛋白质在瘤胃内的分解速度,以增加供给到小肠的氨基酸数量,是提高奶牛产奶量的常见做法。Taylor等[18]研究表明,提高奶牛饲粮中蛋白质的过瘤胃率,可提高奶牛产奶量,提高乳脂率和乳糖率。姜宁等[19]研究发现,奶牛饲粮中添加SP会使较多的过瘤胃蛋白质在小肠内消化、吸收,使血清中的氨基酸数量增多,吸收入血的氨基酸数量增多,使胰岛素(INS)浓度上升,INS对胰岛素样生长因子-Ⅰ(IGF-Ⅰ)含量的提高具有促进作用,IGF-Ⅰ通过对乳腺发育和乳腺细胞增殖发挥促进作用,间接调控奶牛泌乳功能,促进奶牛泌乳。另外,就蛋白质而言,一定浓度的肽或游离氨基酸能够显著降低某些细菌的蛋白质分解活性,进而降低过瘤胃微生物对蛋白质的降解速度,增加蛋白质的过瘤胃利用率,增加反刍动物小肠中可消化蛋白质和氨基酸数量,为奶牛泌乳提供更多的小肠可消化蛋白质,对产奶量的提高起到了积极作用。王恬等[2]在奶牛饲粮中添加SP后发现产奶量得到显著提高,乳脂率和乳蛋白率变化不显著。黄建国等[20]研究表明,给泌乳奶牛饲粮添加SP营养素,能显著提高奶牛的产奶量,乳脂率、乳蛋白质率以及乳糖率均有显著提高。大量的研究表明,SP对乳品质的影响结果不尽相同。本试验结果表明,奶牛饲粮中添加SP后,能提高奶牛的乳脂率、乳蛋白率以及乳糖率,降低乳体细胞数。郭冬生等[21]研究发现,乳腺组织是一个合成乳蛋白十分活跃的场所,牛奶中90%以上的乳蛋白是在乳腺组织中通过吸收的氨基酸合成的,在饲粮中添加SP,可以提高瘤胃MCP产量,增加反刍动物小肠中可消化蛋白质和氨基酸数量,增加用于乳蛋白合成的可利用氨基酸数量,因此,添加SP可以提高乳蛋白率。另外,葡萄糖作为动物代谢活动中的主要营养物质,是最有效的供能物质,也是唯一能通过血浆和细胞在全身循环的一种碳水化合物,奶牛体内血液葡萄糖含量的升高能为乳糖的合成提供更多的前体,并为乳脂的生成提供必要的原料。刘辉等[22]的十二指肠大豆SP梯度灌注试验表明,随着大豆SP灌注量的增加血清中生长激素(GH)和INS浓度表现出增加的趋势。Molento等[23]研究发现,GH和INS交互作用可显著提高泌乳早期奶牛乳腺泌乳量和乳蛋白产量。Chaiyabutr等[24]研究表明GH能显著增加早、中期泌乳奶牛的乳脂率,且在泌乳末期也有增加趋势。Staples等[25]和Johnson等[26]发现,应用牛重组GH后可以通过提高GH浓度显著提高奶中的乳脂率,GH可以增加乙酰辅酶A羧化酶、脂肪酸合成酶和脂蛋白酶的合成,其中乙酰辅酶A羧化酶是脂肪酸合成的限速酶。SP能提高血清GH浓度促进各种酶的合成从而提高乳脂率。INS的增加诱导IGF-Ⅰ分泌增强,使得血清中IGF-Ⅰ含量升高,IGF-Ⅰ通过促进乳腺细胞的增殖,促进乳腺细胞对循环系统中营养物质的摄取利用,促进乳蛋白、乳糖和乳脂的合成,刺激动物泌乳反射,促进产奶量提高。牛奶中乳体细胞数是反映乳房是否健康的指标,它关系到奶牛的产奶量、乳品质及乳品质的存放时间,乳体细胞数越高,牛乳房健康程度越差,牛乳房炎发病率越高。本试验中饲喂SP后乳体细胞数显著降低,表明奶牛乳腺得到良好的发育,乳房健康程度得到提高。
3.4 SP添加水平对奶牛氮表观消化率及氮排泄的影响SP可以通过减轻由于游离氨基酸相互竞争共同吸收位点而产生的拮抗作用,促进氨基酸吸收,加快蛋白质的合成,SP也可以通过加快细菌的繁殖速度、缩短细胞分裂周期,促进瘤胃细菌生长,促进动物体对氮的利用率,使得氮沉积增加,进而减少动物体氮排泄。殷云浩等[27]研究表明,饲粮中添加二肽能够促进碳水化合物的发酵,提高VFA和MCP产量,降低氨态氮浓度,提高能量利用率。李丽立等[28]通过对山羊十二指肠灌注SP和氨基酸的试验发现,灌注SP组与其他组相比,氮留存显著提高。姜宁等[19]研究发现,奶牛饲粮中添加SP可使较多的过瘤胃蛋白质在小肠内消化、吸收,小肠对蛋白质的吸收能力增强。本试验中,随着饲粮中SP添加量的增加,试验组粪氮、尿氮、乳尿素氮排泄量均显著低于对照组,均以试验2组最低,且SP的添加显著提高了氮的消化利用率,提高了动物体的氮沉积效率。氮排泄的降低、氮体内沉积效率的提高、氮消化利用率的提高,一方面与饲料中的蛋白质在瘤胃内被降解为氨的速度受到限制有关,一定浓度的SP能够显著降低某些细菌的蛋白质分解活性,进而降低过瘤胃微生物对蛋白质的降解速度,增加蛋白质的过瘤胃利用率,降低了瘤胃内因蛋白质分解造成氨的释放速度大于微生物利用效率而造成的氮损失,提高了瘤胃氮利用率;另一方面,SP能刺激十二指肠食糜乳糖酶、淀粉酶和胰蛋白酶的活性,肠道消化酶活性的增高可以更有效利用过瘤胃蛋白质和瘤胃MCP,提高了小肠中蛋白质的消化利用程度,提高了小肠中的氮利用率;另外,SP还可以通过提高IGF-Ⅰ浓度提高氮的利用率,IGF-Ⅰ能通过IGF-Ⅰ受体作用于靶细胞,刺激细胞摄取葡萄糖和氨基酸,促进蛋白质的合成,抑制蛋白质的分解;此外,INS可促进氨基酸进入细胞内,促使细胞内可利用氨基酸增多,同时对合成氨基酸相关的RNA聚合酶活性有促进作用,从而促进氨基酸的合成,为蛋白质的合成提供充足的前体。
4 结论奶牛饲粮中添加SP可以显著提高MCP产量、减少氮排泄、提高奶牛生产性能,综合考虑上述指标,在本试验条件下,100 g/(d·头)SP效果最佳。
| [1] | BOZA J J,MOËNNOZ D,VUICHOUD A,et al.Protein hydrolysate vs free amino acid-based diets on the nutritional recovery of the starved rat[J].European Journal of Nutrition,2000,39(6):237-243.( 1) 1) |
| [2] | 王恬,贝水荣,傅永明,等.小肽营养素对奶牛泌乳性能的影响[J].中国奶牛,2004(2):12-14.( 2) 2) |
| [3] | 王文娟,杨维仁,宋恩亮,等.瘤胃灌注大豆小肽对鲁西黄牛营养物质消化代谢的影响[J].中国畜牧杂志,2011,47(17):22-26.( 2) 2) |
| [4] | 冯仰廉,陆治年.奶牛营养需要和饲料成分[M].3版.北京:中国农业出版社,2007:2.( 2) 2) |
| [5] | 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007:49-74.( 4) 4) |
| [6] | 朱雯.粗料来源对奶牛乳蛋白前体物生成与生产性能的影响与机制研究[D].博士学位论文.杭州:浙江大学,2013:39-69.( 1) 1) |
| [7] | CHEN X B,MATUSZEWSKI W,KOWALCZYK J.Determination of allantoin in biological,cosmetic,and pharmaceutical samples[J].Journal of AOAC International,1996,79(3):628-635.( 1) 1) |
| [8] | KOHN R A,FRENCH K R,RUSSEK-COHEN E.A comparison of instruments and laboratories used to measure milk urea nitrogen in bulk-tank samples[J].Journal of Dairy Science,2004,87(6):1848-1853.( 1) 1) |
| [9] | VALADARES R F D,BRODERICK G A,FILHO S C V,et al.Effect of replacing alfalfa silage with high moisture corn on ruminal protein synthesis estimated from excretion of total purine derivatives[J].Journal of Dairy Science,1999,82(12):2686-2696.( 1) 1) |
| [10] | 周萌.植物小肽对泌乳母猪、育肥猪生产性能和免疫性能的影响[D].硕士学位论文.泰安:山东农业大学,2009.( 1) 1) |
| [11] | 陈宇光.小肽对山羊氮存留、营养物质的消化率以及门静脉血糖、血氨和血浆总氨基酸浓度的影响[D].硕士学位论文.长沙:湖南农业大学,2002.( 1) 1) |
| [12] | GRISWOLD K E,HOOVER W H,MILLER T K,et al.Effect of form of nitrogen on growth of ruminal microbes in continuous culture[J].Journal of Animal Science,1996,74(2):483-491.( 1) 1) |
| [13] | 王梦芝,喻礼怀,王洪荣,等.不同分子形式氮源对瘤胃微生物发酵及蛋白合成的影响[J].中国畜牧杂志,2010,46(5):20-24.( 1) 1) |
| [14] | 王文娟,万发春,杨维仁,等.瘤胃灌注大豆小肽对肉牛瘤胃发酵的影响[J].动物营养学报,2011,23(8):1324-1331.( 1) 1) |
| [15] | HOOVER W H.Chemical factors involved in ruminal digestion[J].Journal of Animal Science,1991,69:2755-2766.( 1) 1) |
| [16] | 马惠茹,陈艳君.小肽营养对奶牛产奶性能的影响[J].饲料博览,2008(10):22-24.( 1) 1) |
| [17] | KUNG L,Jr.,HUBER J T.Performance of high producing cows in early lactation fed protein of varying amounts,sources,and degradability[J].Journal of Dairy Science,1983,66(2):227-234.( 1) 1) |
| [18] | TAYLOR R B,HUBER J T,GOMEZ-ALARCON R A,et al.Influence of protein degradability and evaporative cooling on performance of dairy cows during hot environmental temperatures[J].Journal of Dairy Science,1991,74(1):243-249.( 1) 1) |
| [19] | 姜宁,张爱忠,苗树君,等.补充蛋氨酸和小肽及过瘤胃保护处理对奶牛血液生化指标和氨基酸浓度的影响[J].中国畜牧杂志,2005,41(5):31-34.( 2) 2) |
| [20] | 黄建国,高学军,佟慧丽,等.蛋白饲料源小肽对奶牛产奶量和乳品质的影响[J].中国乳品工业,2009,37(9):20-21,29.( 1) 1) |
| [21] | 郭冬生,彭小兰,任慧波,等.小肽制剂和过瘤胃产品对奶牛产奶性能及奶品质的影响[J].江苏农业科学,2007(6):202-203.( 1) 1) |
| [22] | 刘辉,王玲,李胜利,等.十二指肠大豆小肽梯度灌注对泌乳奶山羊血液指标、乳成分及肽转运载体在小肠中表达丰度的影响[J].动物营养学报,2009,21(3):319-325.( 1) 1) |
| [23] | MOLENTO C F M,BLOCK E,CUE R I,et al.Effects of insulin,recombinant bovine somatotropin and their interaction on insulin-like growth factor-Ⅰ secretion and milk protein production in dairy cows[J].Journal of Dairy Science,2002,85(4):738-747.( 1) 1) |
| [24] | CHAIYABUTR N,BOONSANIT D,CHANPONGSANG S.Effects of cooling and exogenous bovine somatotropin on hematological and biochemical parameters at different stages of lactation of crossbred Holstein friesian cow in the tropics[J].Asian-Australasian Journal of Animal Sciences,2011,24(2):230-238.( 1) 1) |
| [25] | STAPLES C R,HEAD H H,DARDEN D E.Short-term administration of bovine somatotropin to lactating dairy cows in a subtropical environment[J].Journal of Dairy Science,1988,71(12):3274-3282.( 1) 1) |
| [26] | JOHNSON H D,LI R,MANALU W,et al.Effects of somatotropin on milk yield and physiological responses during summer farm and hot laboratory conditions[J].Journal of Dairy Science,1991,74(4):1250-1262( 1) 1) |
| [27] | 殷云浩,薛白,阎天海,等.不同氨基酸组成的二肽对羊体外瘤胃发酵特性的影响[J].动物营养学报,2012,24(6):1173-1180.( 1) 1) |
| [28] | 李丽立,陈宇光,谭支良,等.小肽对山羊氮平衡和营养物质消化率的影响[J].草业学报,2004,13(2):73-78.( 1) 1) |




