2. 扬州市扬大康源乳业有限公司, 扬州 225004
2. Yangzhou city Yangda Kangyuan Dairy Co., Ltd., Yangzhou 225004, China
作为目前人类重要而优质的营养源和功能食品之一[1],牛乳不仅能提供给机体多种必需的氨基酸和脂肪酸而具有营养功能,而且牛乳蛋白质中含量最高的酪蛋白(80%以上)还因具有多种生物学功能而具有一定的保健作用。如酪蛋白不仅可与矿物元素结合,特别是钙离子结合,形成可溶性复合物促进机体对钙等矿质元素的吸收[2],还含有多种功能性小肽。同时,酪蛋白为乳腺组织所特有合成的蛋白质[3]。因此,研究奶牛乳腺酪蛋白合成的调控机理与技术是提高乳蛋白率以及乳品质的重要渠道之一。前人的研究表明,精氨酸对上皮细胞的增殖及蛋白质合成有一定的促进作用。培养液中添加0.3 mmol/L的精氨酸有利于小肠上皮细胞的增殖及蛋白质转化,并可缓解其因内毒素诱发的凋亡[4];培养液中添加556.00 mg/L的精氨酸可促进奶牛乳腺上皮细胞的增殖,并可通过哺乳动物雷帕霉素靶蛋白(mTOR)通径调控机制促进酪蛋白基因的表达[5],进而促进酪蛋白的合成[6]。而给予Wistar大鼠2倍精氨酸需要量,促进了乳腺腺泡发育和提高了乳腺酪蛋白的合成[7]。以上研究表明,精氨酸可以用于促进体外培养乳腺上皮细胞和模式动物Wistar大鼠乳腺酪蛋白的合成。奶牛上的试验也发现,真胃灌注精氨酸组相对于对照组(无精氨酸)能够提高乳蛋白的产量。但该研究中只测定了乳蛋白产量,并没有分析其中酪蛋白的变化情况[8]。所以,迄今尚不能完全阐明精氨酸对乳蛋白(酪蛋白)合成影响的规律和机理。为此,本研究拟采用颈静脉灌注方式,给泌乳中期奶牛提供体外培养条件下促进酪蛋白合成适宜的精氨酸量,并测定其泌乳性能、乳品质、酪蛋白含量的动态变化,以及乳腺酪蛋白基因表达情况,以探讨精氨酸影响奶牛乳腺酪蛋白合成的规律及其机制,为牛乳品质调控技术和机理的研究提供一些基础资料。
1 材料与方法 1.1 试验动物与试验设计在扬州大学实验农牧场选择6头体重、胎次(4胎)、泌乳期[(80±2) d]、泌乳量[(21.0±1.0) kg]、体况(3.0分)等基本一致的荷斯坦奶牛作为试验动物。参照NRC(2001)[9]奶牛营养需要配制试验用基础饲粮(由扬州大学实验农牧场提供),试验期持续饲喂试验用基础饲粮。基础饲粮组成及营养水平见表 1,其中,除羊草单独喂给外,其他饲料以全混合形式喂给。基础饲粮的养分含量测定参考张丽英[10]的方法,预试期统计各试验牛15 d内的平均采食量,依此数据计算投料量。试验牛在同舍分单圈饲养,每天早晚2次等量饲喂(羊草先饲、混合料后饲),收集剩料,计算各组干物质采食量(分别为20.21、18.85、19.12 kg/d),组间无显著差异(P>0.05)[11]。每日挤奶3次,自由饮水,饲养管理皆保持一致。在试验牛左侧颈部静脉安装滞留针,安装后每天用无菌肝素钠生理盐水(750 IU/mL)疏通2次。
| 表1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
将试验牛随机分为3组,分别为酪蛋白模式灌注组(对照组,在测定了试验牛阴外动脉血流量和其中氨基酸本底值的基础上,灌注补足为酪蛋白模式的氨基酸混合物)、以对照组为基础的2倍精氨酸灌注组(精氨酸灌注组,本研究选择体外细胞培养试验促进酪蛋白表达最优的2倍精氨酸量进行灌注,灌注量为37.66 g/d,相当于氮12.10 g/d)、丙氨酸等氮灌注组(丙氨酸等氮组,与精氨酸灌注组等氮,灌注量为77.24 g/d,相当于氮12.13 g/d)。采用3×3复拉丁方试验设计,每期22 d,包括灌注期7 d,间隔期15 d。每天经由颈静脉滞留针匀速灌注8 h,灌注总量皆为4 L。灌注液由江苏省南京市剑桥生物科技有限公司配制。
1.2 奶样的采集与指标的检测奶样采集:灌注期每天记录每头牛早(07:00)、中(15:00)、晚(23:00)挤奶量,并各采集1管奶样,全天3管充分混匀待测。
乳品质分析:采用扬大康源乳业的丹麦福斯120乳品检测仪(红外线)检测乳脂率、乳中非脂固形物含量、乳蛋白率、牛乳密度。
酪蛋白含量测定:采用R&D公司的α-酪蛋白(CK-E94191B)、β-酪蛋白(CK-E94192B)、κ-酪蛋白(CK-E94193B)ELISA检测试剂盒,检测α-酪蛋白、β-酪蛋白、κ-酪蛋白的含量。具体测定步骤参见试剂盒说明书。
1.3 乳腺样品的采集与处理活体采样:每个灌注期结束,采用乳腺采样枪活体采集试验奶牛乳腺组织样品约200 mg,即投入液氮罐(-70 ℃)保存待用。每期轮换采集对侧乳区的相近部位。
总RNA提取:乳腺样品冰上解冻后,利用Trizol法提取乳腺组织总RNA,以2.2%甲醛变性凝胶电泳和ND1000微量分光光度计检测总RNA的纯度和浓度,-70 ℃保存备用。
1.4 酪蛋白基因表达的分析按照TaKaRa反转录试剂盒操作程序进行反转录合成cDNA(反应液在冰上配制)。根据GenBank数据库已公布的牛乳腺αs1-酪蛋白基因(CSN1S1)、αs2-酪蛋白基因(CSN1S2)、β-酪蛋白基因(CSN2)、κ-酪蛋白基因(CSN3)共4个基因序列设计实时定量PCR(real-time PCR)引物。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因,用于检测上述基因的组织mRNA相对表达水平。所有荧光定量引物均跨内含子设计,以避免基因组DNA的污染。引物由生工生物工程(上海)有限公司合成,引物序列信息见下表 2。采用SYBR Green试剂盒,在7500型实时定量PCR仪上检测基因的相对表达量。
| 表2 实时定量PCR引物 Table 2 Real-time PCR primers |
基因表达相对定量的结果采用2-ΔΔCt方法进行处理。计算公式[13]如下:
ΔΔCt=(待测组目的基因Ct-待测组
内参基因Ct)-(对照组目的基因Ct-
对照组内参基因Ct);
基因表达量=2-ΔΔCt。
式中:Ct为初始循环数,即扩增曲线与Threshold line交点的横坐标值,是PCR扩增过程中荧光信号强度达到阈值所需的循环数。
1.5 数据处理与统计分析所获得的数据资料采用Excel对试验数据进行整理,采用SPSS 16.0软件进行方差分析和Duncan氏法多重比较。P<0.05为显著差异水平。
2 结果与分析 2.1 精氨酸灌注对乳品质的影响由表 3可知,精氨酸灌注组的乳蛋白率显著高于酪蛋白模式组和丙氨酸等氮组(P<0.05);乳脂率则以酪蛋白模式组较低,显著低于其他2组(P<0.05);乳中非脂固形物含量和牛乳密度在组间则未发现有显著的差异(P>0.05);但产奶量和乳蛋白产量在精氨酸灌注组和丙氨酸等氮组都显著高于酪蛋白模式组(P<0.05)。
| 表3 精氨酸灌注对泌乳性能和乳品质的影响 Table 3 Effects of arginine infusion on lactation performance and milk quality |
对试验牛灌注期乳成分动态变化分析结果见图 1、图 2、图 3。由图 1可知,灌注期3组的乳蛋白率都呈现波动变化,其中精氨酸灌注组持续在相对较高的水平波动,而酪蛋白模式组则在相对较低的水平波动。在灌注的第5天时,精氨酸灌注组显著高于酪蛋白模式组(P<0.05);而丙氨酸 等氮组与其他2组的差异皆不显著(P>0.05)。
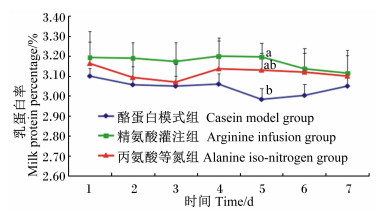 |
同一时间点数据标注字母不同表示差异显著(P < 0.05)。下图同。 Values of the same time point with different letters dif- fe red significantly (P<0.05).The same as below. 图1 灌注期乳蛋白率的动态变化 Fig. 1 Dynamics of milk protein percentage during infusing stage |
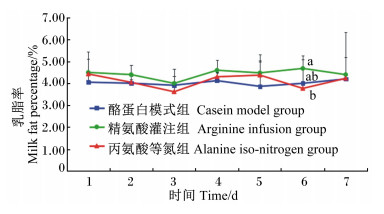 | 图2 灌注期乳脂率的动态变化 Fig. 2 Dynamics of milk fat percentage during infusing stage |
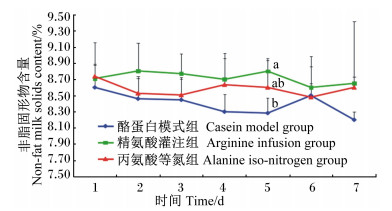 | 图3 灌注期乳中非脂固形物含量的动态变化 Fig. 3 Dynamics of milk non-fat milk solids content during infusing stage |
由图 2可知,在灌注期乳脂率略有波动。在第6天时,精氨酸灌注组的乳脂率显著高于丙氨酸等氮组(P<0.05),但与酪蛋白模式组间差异不显著(P>0.05)。
由图 3可知,在灌注期,3组乳中非脂固形物含量都呈现有波动变化,其中精氨酸灌注组持续在相对较高的水平波动,而酪蛋白模式组则在相对较低的水平波动。灌注的第5天时,精氨酸灌注组显著高于酪蛋白模式组(P<0.05),但与丙氨酸等氮组间差异不显著(P>0.05)。
2.2 精氨酸灌注对酪蛋白含量的影响由表 4可知,α-酪蛋白含量以酪蛋白模式组最低,显著低于其他2组(P<0.05);β-酪蛋白含量在组间没有显著的差异(P>0.05);κ-酪蛋白含量以精氨酸灌注组最高,显著高于其他2组(P<0.05),丙氨酸等氮组次之,酪蛋白模式组最低。所测定几种酪蛋白加和计为总酪蛋白,其在牛乳中的含量以及其日产量皆以精氨酸灌注组为高(P<0.05);总酪蛋白在乳蛋白中的比例在73.18%~92.63%变动,其中精氨酸灌注组也显著高于酪蛋白模式组(P<0.05),但与丙氨酸等氮组无显著差异(P>0.05)。
| 表4 精氨酸灌注对酪蛋白含量的影响 Table 4 Effects of arginine infusion on casein protein content |
对于灌注期各酪蛋白含量具体的变化见图 4、图 5、图 6。由图 4可知,在灌注期,3组的α-酪蛋白含量都呈现波动变化,其中精氨酸灌注组在灌注后上升并持续在相对较高的水平波动,酪蛋白模式组在相对最低的水平波动。灌注的第3~7天期间组间出现了显著差异(P<0.05),都以精氨酸灌注组最高。其中第3天时,3组间的差异皆显著(P<0.05);第4、5、6天丙氨酸等氮组与精氨酸灌注组差异不显著(P>0.05);第7天时丙氨酸等氮组与酪蛋白模式组的差异不显著(P>0.05)。
 | 图4 灌注期乳中α-酪蛋白含量的动态变化 Fig. 4 Dynamics of α-casein content in milk during infusing stage |
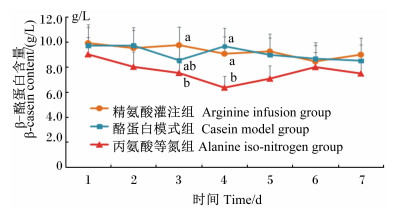 | 图5 灌注期乳中β-酪蛋白含量的动态变化 Fig. 5 Dynamics of β-casein content in milk during infusing stage |
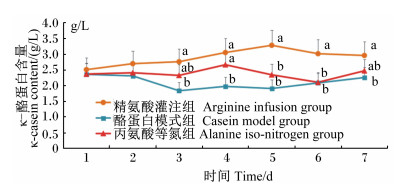 | 图6 灌注期乳中κ-酪蛋白含量的动态变化 Fig. 6 Dynamics of κ-casein content in milk during infusing stage |
由图 5可知,在灌注期,3组的β-酪蛋白含量皆呈现波动变化。灌注的第3、4天时组间出现了显著差异(P<0.05),皆以精氨酸灌注组与酪蛋白模式组相对较高,而丙氨酸等氮组相对较低。
由图 6可知,在灌注期期间,κ-酪蛋白含量在精氨酸灌注组在相对较高的水平波动,丙氨酸等氮组较低,酪蛋白模式组则在相对最低的水平波动。灌注的第3~7天期间组间出现了显著差异(P<0.05),其中都以精氨酸灌注组最高;丙氨酸等氮组除第4天与酪蛋白模式组差异显著外(P<0.05),其他检测时间都与酪蛋白模式组无显著差异(P>0.05)。
2.3 精氨酸灌注对酪蛋白基因表达的影响由表 5可知,酪蛋白基因CSN1S1、CSN1S2的 表达量在酪蛋白模式组、丙氨酸等氮组显著的低 于精氨酸灌注组(P<0.05);酪蛋白基因CSN2、CSN3的表达量在3组间的差异不显著(P>0.05)。
| 表5 精氨酸灌注对酪蛋白基因表达的影响 Table 5 Effect of arginine infusion on the expression of casein gene |
乳成分基本上是稳定的,但各种成分如乳蛋白也会在一定范围内波动[14]。乳蛋白率的变化范围为3.0%~3.7%,其中主要包括有酪蛋白、乳清蛋白、脂肪球蛋白。约有90%以上的乳蛋白是在乳腺上皮中以氨基酸为原料合成的。采用14C标记氨基酸、13C标记小肽的研究表明,牛乳中酪蛋白、α-乳清蛋白、β-乳球蛋白都是由乳腺上皮细胞利用血液中的氨基酸或小肽从头合成的[15, 16]。由此可见,作为乳蛋白合成的前体物,必需氨基酸的供应量和氨基酸组成的平衡性对乳蛋白和合成都具有重要的意义[17, 18]。近年来的研究另外表明,部分功能性氨基酸除作为乳蛋白合成的底物外,还通过遗传或代谢等通径参与乳蛋白合成的调控。就精氨酸而言,作为一种条件性必需氨基酸和功能性氨基酸,不仅参与动物体蛋白质的合成与沉积,还通过多种酶及其代谢物广泛地参与机体代谢,在动物体内发挥着重要代谢调控效应[19, 20, 21]。
本研究是参考前期体外研究结果在酪蛋白模式基础上的精氨酸灌注,结果表明,精氨酸灌注组相对于对照组显著提高了产奶量和乳蛋白率。分析其原因,精氨酸灌注可能通过对相关代谢途径的调控促进了乳腺的泌乳性能和其泌蛋白的合成。由于精氨酸在体内可分解为尿素和鸟苷酸,进而合成多胺类物质来调节细胞的生长[22]。因此,从乳腺组织发育的研究来看,精氨酸为乳腺发育所必需,缺乏则可能导致大鼠乳腺DNA和RNA的含量的降低[23]。研究也表明,精氨酸可以通过促进大鼠乳腺组织乳导管树发育[24]、大鼠乳腺组织腺泡的发育[7]和奶牛乳腺上皮细胞的增殖[25]等,为泌乳代谢提供良好的基础,从而发挥对泌乳性能的促进作用。另外,从机体内蛋白质的生物合成角度来看,产奶量的降低伴随着乳腺上皮细胞总RNA量的降低[26]。而精氨酸则可通过Janus激酶2(JAK2)-信号转导和转录活化蛋白5(STAT5)和mTOR信号转导通路调控乳腺上皮细胞酪蛋白基因mRNA的转录[5]来调控其蛋白质的生物合成。除此之外,精氨酸还可促进多种内分泌激素的释放,如胰岛素、生长激素、催乳素[27]。基于此分析,精氨酸还可能通过调控这些激素的分泌,来直接或间接作用于乳腺的发育、泌乳性能以及其乳蛋白的合成[28],但这在本研究中并没有涉及,尚需要进一步开展激素相关的机理研究。
3.2 精氨酸灌注对牛乳酪蛋白含量的影响奶牛的酪蛋白基因全长200 kb位于第6染色体上(6/BTA 6q31-33)上,按顺序为CSN1S1、CSN1S2、CSN2、CSN3等基因形成基因簇,并分别编码αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白等蛋白质[29, 30]。牛乳酪蛋白中的αs1-酪蛋白[31]和β-酪蛋白[32]为牛乳中主要的酪蛋白类型;而κ-酪蛋白虽然含量较低,但同样也是牛乳酪蛋白的重要组分[33]。在本研究中,所检测的α-酪蛋白、β-酪蛋白、κ-酪蛋白含量分别在52.70%~62.96%、27.96%~38.56%、9.01%~10.24%内变动,基本符合奶牛酪蛋白含量的一般分布。与不同牛群(高乳脂率瑞士红牛、低乳脂率瑞士红牛、瑞士荷斯坦奶牛)牛乳酪蛋白含量的研究结果显示,αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白含量分别在30.74%~32.31%、5.97%~6.99%、47.21%~47.63%、13.55%~15.28%内变动[34],本研究与此也有一定的一致性。
对于本研究的不同处理,精氨酸显著提高了牛乳中α-酪蛋白的含量,以及CSN1S1、CSN1S2基因的表达量,该结果与精氨酸可提高奶牛乳腺上皮细胞αs1-酪蛋白的合成量及其基因CSN1S1的表达量[5]相一致。虽然本研究没有分别测定αs1-酪蛋白、αs2-酪蛋白的含量,但其基因CSN1S1、CSN1S2表达量结果表明,精氨酸提高了这2种酪蛋白基因在奶牛乳腺的表达量。对于其调控机制,一方面是上述的通过调控信号转导通路因子机制;另一方面也可能是通过调控表观遗传修饰机制来实现的,但后者的推测尚有待于进一步的试验研究。本研究中精氨酸并没有显著提高牛乳β-酪蛋白含量,而与精氨酸提高了奶牛乳腺上皮细胞β-酪蛋白合成量[5]的结果有所不同,这可能与体内试验和体外试验方法的不同、组织间代谢的影响等有关。另外在本研究中,精氨酸灌注组牛乳中κ-酪蛋白的含量也有显著的提高,这与精氨酸提高乳腺上皮细胞κ-酪蛋白含量和CSN3表达量的结果[6]相一致,至于本研究中CSN3的表达量并未有显著的提高还有待进一步地研究阐明。综合以上结果表明,精氨酸可提高牛乳α-酪蛋白和κ-酪蛋白的含量,进而提高酪蛋白(乳蛋白)的合成。但胡良宇等[7]采用精氨酸处理大鼠却只显著提高了其乳腺β-酪蛋白含量,与本研究结果的不同可能主要是由于不同物种间所泌乳中酪蛋白的组分有所不同,其受到调控的反映也有所不同所致[34, 35]。
另有研究表明,牛乳酪蛋白的组成与含量以及酪蛋白各基因的多态性都与奶牛泌乳性能、乳成分以及乳制品加工特性等密切相关[36, 37]。比如,κ-酪蛋白的糖基化程度可能影响酪蛋白、乳蛋白以及牛乳等的产量[38]。作为牛乳中的重要组分[33],CSN3敲除后的大鼠不能泌乳并且所分泌的酪蛋白胶束不稳定[39],而且该基因的多态性与凝乳性能和干酪品质相关联[40]。在本研究中,精氨酸灌注组牛乳的κ-酪蛋白含量及其基因表达量相对于其他2组都同时有明显的提高。因此推测,一方面牛乳蛋白的性能也有可能因为κ-酪蛋白合成量与其基因CSN3表达量的改变而有相应的改变;另一方面,κ-酪蛋白含量的提高也可能是进一步提高其他种类酪蛋白合成的原因之一[38],但这都有待下一步开展试验予以阐明。
4 结 论灌注精氨酸提高了乳蛋白中α-酪蛋白和κ-酪蛋白含量,以及酪蛋白基因CSN1S1、CSN1S2的表达量,有利于牛乳中乳蛋白率和乳品质的提高,可为奶牛生产实践中牛乳品质调控技术及其机理的研究提供一定的试验参考资料。
| [1] | JACHIK P.Regionalization vs. globalization of the world dairy economy:conflict or complementarity[C]//Advances in dairy technology:proceedings of the western Canadian dairy seminar.[s.l.]:WCDS,2004.http://www.wcds.ca/proc/2004/Manuscripts/93Jachnik.pdf.( 1) 1) |
| [2] | MYKKÄNEN H M,WASSERMAN R H.Enhanced absorption of calcium by casein phosphopeptides in rachitic and normal chicks[J].The Journal of Nutrition,1980,110(11):2141-2148.( 1) 1) |
| [3] | BIONAZ M,HURLEY W,LOOR J.Milk protein synthesis in the lactating mammary gland:Insights from transcriptomics analyses[M]//HURLEY W H.Milk protein.New York:InTech North America.2012.http://dx.doi.org/10.5772/46054.( 1) 1) |
| [4] | TAN B,YIN Y L,KONG X F,et al.L-arginine stimulates proliferation and prevents endotoxin-induced death of intestinal cells[J].Amino Acids,2010,38(4):1227-1235.( 1) 1) |
| [5] | WANG M Z,XU B L,WANG H G,et al.Effects of arginine concentration on the in vitro expression of casein and mTOR pathway related genes in mammary epithelial cells from dairy cattle[J].PLoS One,2014,9(5):e95985.( 4) 4) |
| [6] | CHEN L M,LI Z T,WANG M Z,et al.Preliminary report of arginine on synthesis and gene expression of casein in bovine mammary epithelial cell[J].International Research Journal of Agricultural Science and Soil Science,2013,3(1):17-23.( 2) 2) |
| [7] | 胡良宇,吴佳诚,王梦芝,等.饲粮添加精氨酸对娩后Wistar大鼠乳腺组织发育及酪蛋白合成的影响[J].动物营养学报,2015,27(4):1326-1332.( 3) 3) |
| [8] | DOEPEL L,LAPIERRE H.Deletion of arginine from an abomasal infusion of amino acids does not decrease milk protein yield in Holstein cows[J].Journal of Dairy Science,2011,94(2):864-873.( 1) 1) |
| [9] | NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington,D.C.:The National Academies Press,2001.( 1) 1) |
| [10] | 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007.( 1) 1) |
| [11] | 徐巧云,丁洛阳,王梦芝,等.颈静脉灌注精氨酸对泌乳奶牛养分消化和氮利用的影响[J].动物营养学报,2015,27(12):3736-3743.( 1) 1) |
| [12] | 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004:120-133.( 2) 2) |
| [13] | LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.( 1) 1) |
| [14] | 陈艳珍.影响牛乳成分含量变化的因素[J].乳业科学与技术,2005(4):186-188.( 1) 1) |
| [15] | DAVIS S R,MEPHAM T B.Metabolism of L-(U-14C) valine,L-(U-14C) leucine,L-(U-14C) histidine and L-(U-14C) phenylalanine by the isolated perfused lactating guinea-pig mammary gland[J].Biochemical Journal,1976,156(3):553-560.( 1) 1) |
| [16] | BACKWELL F R,BEQUETTE B J,WILSON D,et al.Evidence for the utilization of peptides for milk protein synthesis in the lactating dairy goat in vivo[J].American Journal of Physiology,1996,271(4):R955-R960.( 1) 1) |
| [17] | CHO J,OVETON T R,SCHWAB C G,et al.Determining the amount of rumen-protected merhionine supplement that corresponds to the optimal levels of methionine in metabolizable protein for maximizing milk protein production and profit on dairy farms[J].Journal of Dairy Science,2007,90(10):4908-4916.( 1) 1) |
| [18] | 张兴夫,杜瑞平,敖长金,等.不同氨基酸模式对奶牛乳腺上皮细胞对酪蛋白合成的影响[J].动物营养学报,2013,25(8):1762-1768.( 1) 1) |
| [19] | JOHNSON L R.Regulation of gastrointestinal mucosal growth[J].Physiological Reviews,1988,68(2):456-502.( 1) 1) |
| [20] | MONCADA S,HIGGS A.The L-arginine-nitric oxide pathway[J].The New England Journal of Medicine,1993,329(27):2002-2012.( 1) 1) |
| [21] | MORRIS S M.Arginine:beyond protein1'2'3'4[J].American Journal of Clinical Nutrition,2006,83(2):508S-512S.( 1) 1) |
| [22] | 董矜,田亚平,房征宇.L-精氨酸对Hela细胞增殖的调控作用研究[J].军医进修学院学报,2004,25(2):100-102.( 1) 1) |
| [23] | PAU M Y,MILNER J A.Effect of arginine deficiency on mammary gland development in the rat[J].The Journal of Nutrition,1982,112(10):1827-1833.( 1) 1) |
| [24] | ALKAREEM M A,ALBAYATI M A,WAEL K.The effect of L-arginine and a ntagonist L-NAME on the mammary gland of pregnant mice[J/OL].Journal of Physics:Conference Series,2013.http://www.arpapress.com/Volumes/JPCS/Vol6/JPCS_6_04.pdf.( 1) 1) |
| [25] | 徐柏林,王梦芝,张兴夫,等.精氨酸水平对奶牛乳腺上皮细胞体外生长及κ-酪蛋白基因表达的影响[J].动物营养学报,2012,24(5):852-858.( 1) 1) |
| [26] | CAPUCO A V,WOOD D L,BALDW N R,et al.Mammary cell number,proliferation,and apoptosis during a bovine lactation:relation to milk production and effect of bST[J].Journal of Dairy Science,2001,84(10):2144-2187.( 1) 1) |
| [27] | 侯玉洁,徐俊,赵国琦,等.精氨酸的生理学功能及其在畜禽生产中的应用[J].中国饲料,2013(5):32-37.( 1) 1) |
| [28] | NEVILLE M C,MCFADDEN T B,FORSYTH I.Hormonal regulation of mammary differentiation and milk secretion[J].Journal of Mammary Gland Biology and Neoplasia,2002,7(1):49-66.( 1) 1) |
| [29] | BAI W L,YIN R H,ZHAO S J Y,et al.Short Communication:characterization of a κ-casein genetic variant in the Chinese Yak,Bos grunniens[J].Journal of Dairy Science,2008,91(3):1204-1208.( 1) 1) |
| [30] | CAROLI A M,CHESSA S,ERHARDT G J.Invited review:milk protein polymorphisms in cattle:effect on animal breeding and human nutrition[J].Journal of Dairy Science,2009,92(11):5335-5352.( 1) 1) |
| [31] | MERCIER J C,GROSCLAUDE F,RIBADEAU-DUMAS B.Structure primaire de la caseine αs1-bovine.Séquence compléte[J].European Journal of Biochemistry,1971,23(1):41-51.( 1) 1) |
| [32] | FARRELL H M,Jr,JIMENEZ-FLORES R,BLECK G T,et al.Nomenclature of the proteins of cows' milk-sixth revision[J].Journal of Dairy Science,2004,87(6):1641-1674.( 1) 1) |
| [33] | GUTIÉRREZ-ADÁN A,MAGA E A,MEADE H,et al.Alterations of the physical characteristics of milk from transgenic mice producing bovine κ-casein[J].Journal of Dairy Science,1996,79(5):791-799.( 2) 2) |
| [34] | HALLÉN E,WEDHOLM A,ANDR N A,et al.Effect of β-casein,κ-casein and β-lactoglobulin genotypes on concentration of milk protein variants[J].Journal of Animal Breeding and Genetics,2008,125(2):119-129.( 2) 2) |
| [35] | YONEDA M,SHIRAISHI J,KURAISHI T,et al.Gastric proteinase digestion of caseins in newborn pups of the mouse[J].Journal of Dairy Science,2001,84(8):1851-1855.( 1) 1) |
| [36] | HECK J M,A SCHENNINK,H J VAN VALENBERG H J F,et al.Effects of milk protein variants on the protein composition of bovine milk[J].Journal of Dairy Science,2009,92(3):1192-1202.( 1) 1) |
| [37] | BARLOWSKA J,WOLANCIUK A,LITWI CZUK Z,et al.Milk proteins' polymorphism in various species of animals associated with milk production utility[M]//HURLEY W H.Milk protein.New York:InTech North America,2012:235-264.( 1) 1) |
| [38] | ROBITAILLE G,NG-KWAI-HANG K F,MONARDES H G.Association of κ-casein glycosylation with milk production and composition in Holsteins[J].Journal of Dairy Science,1991,74(10):3314-3317.( 2) 2) |
| [39] | SHEKAR P C,GOEL S,RANI S D,et al.κ-casein-deficient mice fail to lactate[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(21):8000-8005.( 1) 1) |
| [40] | REN D,CHEN B,CHEN Y L,et al.The effects of κ-casein polymorphism on the texture and functional properties of mozzarella cheese[J].International Dairy Journal,2013,31(2):65-69.( 1) 1) |




