2. 北京市畜牧总站, 北京 100110;
3. 北京农学院, 北京 102206
2. Animal Husbandry and Veterinary Station of Beijing, Beijing 100110, China;
3. Beijing University of Agriculture, Beijing 102206, China
营养物质的吸收利用与瘤胃发育相互影响,二者也对犊牛时期及成年后生产性能具有重要的意义。而饲料作为动物营养物质的主要来源,其组成及物理形态对犊牛瘤胃的发育至关重要。犊牛的饲料包括液体和固体2种形态。其中液体饲料主要包括鲜奶及代乳粉,犊牛采食液体饲料时由条件反射引导食管沟闭合,使乳液直接进入皱胃,形成凝块,经消化酶作用,进入肠道吸收[1],为断奶前犊牛的生长提供主要的营养物质;固体饲料则直接进入到瘤胃,参与瘤胃的生长发育,包括固体饲料的采食刺激、微生物发酵系统的完善、发酵及吸收机制的协调等一系列过程[2],然后再进入皱胃和肠道,在瘤胃中发酵产生的挥发性脂肪酸(VFA)直接刺激瘤胃发育,也是犊牛断奶后及成年时期良好营养物质代谢的前提[3]。因此,固液饲料的相对饲喂量不同会对犊牛生长发育产生影响。研究表明,固体饲料饲喂量缺乏会导致瘤胃角质化不全、发育迟缓,最终影响营养物质的吸收[4]。犊牛对固体饲料采食量的增加可以加快瘤胃对饲料的发酵速率、发酵程度以及对VFA的吸收和代谢[5]。此外,液体饲料饲喂量过少也会引起皱胃病变等疾病[6]。犊牛早期断奶与固液体饲料采食量息息相关,我国规模化奶牛场的通用规则是:犊牛固体饲料采食量连续3 d达到1.0 kg/d,或是在液体饲料饲喂至8周左右给犊牛断奶[7],然而这些饲喂模式仍然会使断奶犊牛产生应激反应,进而造成犊牛疾病及生长发育迟缓,对生产带来损失,更不利于后备牛的早期培育。因此,本试验在保证总干物质采食量(DMI)一致的前提下,改变固液饲料饲喂比例,进而形成了不同的断奶方式,旨在探讨不同固液比例饲喂模式对断奶前后犊牛能量和氮代谢、瘤胃微生物蛋白(MCP)合成以及瘤胃发酵的影响,为犊牛培育中合理的固液饲料饲喂模式及断奶方法提供理论支持。
1 材料与方法 1.1 试验时间及地点动物饲养试验于2015年9月至2015年12月在中国农业科学院中试基地进行。试验期77 d。
1.2 试验设计选用自然分娩、初生重为(36.0±2.5) kg、饲喂足量初乳的(7±2) 日龄中国荷斯坦公犊36头, 采用单因素随机设计,随机分为3个组,每组12头。犊牛7日龄开始全部采食液体代乳粉,21日龄开始训练采食固体颗粒料,21~27日龄为试验过渡期。28日龄时代乳粉DMI为体重的1.2%、颗粒料饲喂量达到200 g/d[8]。
对照(LS)组犊牛参照目前规模化牛场的饲喂方案,固体颗粒料饲喂量每周增加量为200 g/d,液体饲料饲喂量为体重的12.5%,随体重增长而逐步调整。在28~56日龄期间,固体颗粒料:液体饲料由1: 2逐步降低为1: 1;56日龄时,固体饲料采食量达到1 kg/d左右,进行断奶。
高液体饲料比例(HL)组犊牛饲喂以液体代乳粉为主,总DMI与LS组保持一致,但其中固体颗粒料饲喂量每周增加量为100 g/d,其余为液体饲料。犊牛在28~56日龄期间,固体颗粒料:液体饲料为1: 2;在56日龄时进行断奶,此时固体饲料采食量仅为0.6 kg左右。
高固体饲料比例(HS)组犊牛饲喂以固体颗粒料为主,总DMI与LS组保持一致,但其中固体颗粒料饲喂量每周增加量为400 g/d,其余为液体饲料。28~42日龄期间,固体颗粒料:液体饲料由1: 2逐步降低至1: 0;42日龄时固体饲料采食量达到1.0 kg左右,进行断奶。
犊牛代乳粉和颗粒料,采用ZL201210366241.9配方生产,其营养水平[干物质(DM)基础]为:DM 95.13%、有机物(OM)91.81%、粗蛋白质(CP)21.88%、粗脂肪(EE)12.17%、中性洗涤纤维(NDF)4.03%、酸性洗涤纤维(ADF)2.29%、钙(Ca)1.17%、磷(P)0.58%、总能(GE)18.49 MJ/kg。代乳粉为粉末状,颗粒料制粒温度50 ℃,颗粒直径8 mm。
1.3 饲养管理代乳粉乳液的配制,用煮沸后冷却到50~60 ℃的热水按干物质(DM)占12.5%的比例冲泡成乳液,待温度降至40 ℃左右饲喂犊牛,每天2次饲喂(08:00和16:00),采用带有奶嘴的悬挂式奶桶饲喂。
犊牛采用犊牛岛单独饲养,每个犊牛岛占地面积为1.6 m×3.6 m。试验期饲料供给量根据每头犊牛采食情况计算, 提供干净、充足水源。
1.4 消化代谢试验每组选取接近平均体重的6头健康犊牛,采取全收粪尿法分别于断奶前(35日龄)和断奶后(63日龄)利用消化代谢笼(专利号ZL201420358189.7) 进行犊牛消化代谢试验。试验期均为7 d,其中预试期3 d,正试期4 d。记录每头犊牛每天采食量、排粪量和排尿量,采集粪尿样品。
1.5 样品采集与测定 1.5.1 饲料样品试验中采集具有代表性的饲料样品,依照AOAC(2000)[9]的方法测定其营养成分含量,其中:CP含量以KDY-9830全自动凯氏定氮仪测定;EE含量采用ANKOM-XT15i全自动脂肪分析仪测定;GE以PARR-6400全自动氧弹量热仪测定;同时采用张丽英[10]的方法测定OM、NDF、ADF、Ca和P含量。
1.5.2 消化代谢试验样品消化代谢试验的正试期中,每天采集日粪便总量的10%作为混合样品,每100 g鲜粪加入10%的稀硫酸10 mL固氮。连续收集每头犊牛日排尿量的1%作为尿样,用10%稀硫酸调整尿样使pH≤3。正试期每天采集具有代表性的饲料样品。收集的饲料、粪、尿样品于-20 ℃冷冻保存待测。饲粮样DM、CP含量和GE,粪样中DM、CP含量和粪能及粪氮排出量,尿样中尿能、尿氮排出量测定参考AOAC(2001)[9]中方法进行测定,试验仪器如上所述。计算饲粮消化能、代谢能、GE表观消化率、GE代谢率和消化能代谢率,公式如下:

|
式中:甲烷能按GE的8%[11]计算。
1.5.3 瘤胃液样品每组选取接近组平均体重的6头犊牛,分别于28、42、56和84日龄晨饲后2 h,采用灭菌口腔导管采集瘤胃内容物100 mL,4层纱布过滤后,立即用便携式pH计(testo-206-pH2) 测定瘤胃液pH,然后分装于10 mL灭菌离心管中,放入液氮带回实验室,-80 ℃保存待测。瘤胃液4 ℃解冻,取上清液1 mL,加25%偏磷酸溶液0.3 mL,振荡3~5 s混匀后,静置30 min,15 000×g离心15 min后,取上清液0.5 mL。瘤胃液中VFA浓度参照Cao等[12]方法测定;氨态氮(NH3-N)浓度采用靛酚比色法[13]测定;MCP含量参照Makkar等[14]的方法测定。
1.6 统计分析以SAS 9.2软件进行统计。除消化代谢试验中能量与氮的数据利用one-way ANOVA模型进行分析外,其他数据利用MIXED模型进行分析。差异显著(P < 0.05) 时采用最小显著差数(least significant difference,LSD)法进行比较。
one-way ANOVA模型为:
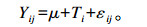
|
式中:μ为平均值;T为分组(i=1,2,3),固定效应;ε为残差j=(1,2,3,…,18)。
MIXED模型为:
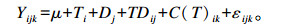
|
式中:μ为平均值;T为分组(i=1,2,3),固定效应;D为日龄(j=35,63),固定效应;C为犊牛(k=1,2,3,…,18),随机效应;ε为残差。
2 结果与分析 2.1 犊牛采食量由表 1可知,断奶前,不同固液比例对犊牛总DMI未产生显著性影响(P>0.05)。断奶后,HL组犊牛总DMI显著低于其他2组(P < 0.05)。
|
|
表 1 不同固液比例饲喂模式对犊牛总干物质采食量的影响(干物质基础) Table 1 Effects of feed patterns of different solid and liquid feed ratios on total DMI of calves (DM basis, n=18) |
由表 2可知,断奶前,与LS组相比,HL组饲喂模式有减少粪能(P=0.081) 的趋势,同时HL组GE表观消化率显著提高(P<0.05)。断奶后,与HL组相比,HS组通过显著降低尿能(P<0.05),从而显著提高了消化能代谢率(P<0.05),而LS组与HL组间消化能代谢率无显著差异(P>0.05)。
|
|
表 2 不同固液比例饲喂模式对犊牛能量消化代谢的影响(干物质基础) Table 2 Effects of feed patterns of different solid and liquid feed ratios on energy digestion and metabolism of calves (DM basis, n=18) |
由表 3可知,断奶前,HL组较LS和HS组显著提高了氮利用率和沉积氮(P<0.05);断奶后,通过降低尿氮排出量(P=0.073) 及总排出氮(P<0.05),HS和LS组氮沉积和氮利用率较HL组显著提高(P<0.05);另外,HS组犊牛断奶后氮的生物学价值显著高于HL组(P<0.05),与LS组差异不显著(P>0.05);然而,3组断奶前后犊牛尿氮排出量和吸收氮无显著差异(P>0.05)。
|
|
表 3 不同固液比例饲喂模式对犊牛氮消化代谢的影响(干物质基础) Table 3 Effects of feed patterns of different solid and liquid feed ratios on N digestion and metabolism of calves (DM basis, n=18) |
由表 4可知,HS组饲喂模式下犊牛瘤胃液pH较低,其中56日龄时,HS组显示出低于HL与LS组的趋势(P=0.061),84日龄时HS和LS组显著低于HL组(P<0.05)。与HL和HS组相比,42日龄时LS组犊牛瘤胃液NH3-N浓度有增高的趋势(P=0.099)。随着犊牛日龄增加,瘤胃液MCP含量显著提高(P<0.05),断奶后不同组表现出差异,其中56日龄时,HS、LS组有高于HL组的趋势(P=0.051),到84日龄时,HS组显著高于HL组(P<0.05)。
|
|
表 4 不同固液比例饲喂模式对犊牛瘤胃液中pH、NH3-N浓度和MCP含量的影响 Table 4 Effects of feed patterns of different solid and liquid feed ratios on pH, NH3-N concentration and MCP content in rumen fluid of calves (n=18) |
由表 5可知,不同饲喂模式对断奶后犊牛瘤胃液VFA含量产生了一定的影响,同时随着犊牛日龄的增加总挥发性脂肪酸(TVFA)浓度显著提高(P<0.05)。56日龄时HS组TVFA浓度显示出高于LS组的趋势(P=0.087),84日龄时HS及LS组显著高于HL组(P<0.05);而其他日龄各组间无显著差异(P>0.05)。56日龄时,LS组乙酸比例有低于其他组的趋势(P=0.082);另外84日龄时,HS组犊牛瘤胃液中乙酸、丁酸比例及显著高于其他2组(P<0.05),乙酸/丙酸显著高于HL组(P<0.05)。戊酸比例在犊牛断奶前后不受饲喂模式的显著影响(P>0.05)。
|
|
表 5 不同固液比例饲喂模式对犊牛瘤胃液VFA浓度的影响 Table 5 Effects of feed patterns of different solid and liquid feed ratios on VFA concentration in rumen fluid of calves (n=18) |
胃肠道对固液饲料中营养物质的消化利用及吸收水平会直接影响犊牛断奶前后的生长性能[15]。Jasper等[16]与Anderson等[17]的试验中分别通过增加液体饲料饲喂量及添加固体颗粒料饲喂量发现,液体饲料采食量的增加有助于提高犊牛断奶前的营养物质表观消化率,而固体颗粒料的添加则具有提高断奶后营养物质表观消化率的作用。从本试验可以看出,断奶前,不同固液比例条件下犊牛总DMI无显著差异,HL组GE表观消化率和氮利用率较高,与Khan等[18]的研究结果一致。这一阶段犊牛对营养物质的消化吸收过程中对皱胃的依赖性较强,液体饲料采食量较高且液体饲料采食持续时间较长时,大量的液体饲料到达皱胃后,由皱胃分泌的凝乳酶、蛋白酶、淀粉酶等对液体饲料进行消化吸收。另外,与液体营养物质吸收相关的内分泌激素,如胰岛素、胰岛素样生长因子1等可以激发肠道局部反应,刺激肠道吸收,从而提高了营养物质的代谢能。而在此期间犊牛瘤胃尚未发育,固体饲料到达瘤胃后,营养物质不能被充分吸收,从而导致了高固体饲料饲喂下消化能较低。从氮的消化利用结果可以看出,液体代乳粉饲喂量增加显著提高了断奶前犊牛沉积氮和氮利用率,与许先查等[19]的研究结果一致。
断奶后,固体饲料的采食对犊牛采食量具有积极的促进作用,Di Giancamillo等[20]发现饲喂固体饲料的犊牛大部分时间采食饲料和反刍,而只饲喂液体饲料的犊牛则多数时间在舔舐它可以接触到的任何物品,因此足量固体饲料的采食能够促进断奶后犊牛DMI的增加。本试验结果也表明,高固体比例饲喂模式下,断奶后犊牛的总DMI显著提高。另外,断奶后,瘤胃承担主要的消化作用,哺乳期固体饲料饲喂量较高时,犊牛瘤胃发育较为完善,采食量明显增长,并通过刺激胃肠道促进消化酶的分泌或提高酶活性从而提高碳水化合物的消化吸收,降低尿能,提高GE表观消化率和GE代谢率。从本试验还可以看出,哺乳期饲喂高比例固体饲料,可以使断奶后(63~84日龄)总排出氮减低,沉积氮、氮利用率以及氮的生物学价值提高,原因可能是固体饲料消化及吸收较好促进了犊牛胃肠道微生物的发育,进而改善了胃肠道代谢活动,结合断奶后MCP含量的变化,原因可能是,固体饲料增加了胃肠道内的多种蛋白质分解菌的数量,可以更多地将饲粮中CP降解合成为MCP,胃肠道消化酶的活性也较高,各种消化酶与代谢产物间相互作用,改善氨基酸等的平衡,从而提高氮利用率,减少粪尿中氮的排出。结合能量与氮的消化代谢结果可以发现,高固体比例饲喂在犊牛断奶后促进了机体对能量和氮的利用。
3.2 不同固液比例饲喂模式对犊牛瘤胃发酵的影响瘤胃液中pH、NH3-N和VFA浓度作为反刍动物瘤胃发酵的重要指标,反映了瘤胃功能和瘤胃内环境的稳定性。本试验中,提高断奶前犊牛固体饲料的饲喂量,可降低断奶前后犊牛瘤胃液pH,这与仁瑞清[21]改变饲喂模式对犊牛瘤胃液pH研究的结果一致。固体饲料聚集在瘤胃发酵产酸,从而降低了瘤胃液pH。瘤胃液pH并不直接影响瘤胃的发育,但Krehbiel等[22]研究发现,它可以通过改变瘤胃液中丁酸的比例从而引起各VFA比例的变化,作为瘤胃发育的最佳刺激物,丁酸的吸收也伴随着瘤胃液pH的下降而增加[23]。而瘤胃液pH会直接影响瘤胃上皮细胞对VFA的吸收和代谢,从而间接影响瘤胃发育。可见在正常的生理范围内,丙酸、丁酸浓度提高不但会导致较低的瘤胃液pH,而且能够加强瘤胃上皮对它们的吸收,这将有利犊牛瘤胃的迅速发育[23]。
瘤胃液中NH3-N是保证瘤胃MCP合成效率的首要条件,其浓度动态变化反映了瘤胃中蛋白质降解与MCP合成的动态平衡关系[24]。瘤胃液内NH3-N浓度在2 mmol/L即可满足瘤胃微生物合成蛋白的需要[25],本试验结果中瘤胃液NH3-N浓度处于2.47~7.00 mmol/L,符合瘤胃微生物的生长条件,且断奶后犊牛瘤胃液NH3-N浓度要显著低于断奶前,与Anderson等[17]研究结果一致。初生犊牛瘤胃功能尚未发育完全,随着日龄增加,瘤胃发育成熟以及微生物菌群逐渐建立,瘤胃微生物在增殖的过程中,将更多的NH3-N转化为MCP[26],降低了NH3-N浓度,这也正好解释了随着犊牛日龄的增加瘤胃液MCP含量增加的现象。瘤胃中MCP可为反刍动物提供50%~80%的小肠可吸收蛋白质[27],其在瘤胃的合成主要与微生物可利用能量与蛋白质相关。增加固体饲料饲喂比例,提高了断奶后期犊牛瘤胃MCP的合成,说明该饲喂模式可以促进瘤胃微生物对饲粮中的能量和蛋白质的利用,与本代谢试验结果中饲喂高比例固体饲料时能量及氮代谢变化情况相符合,也证实其有助于提高犊牛营养物质消化利用。由此表明,提高固体饲料饲喂比例对瘤胃液NH3-N浓度无影响的同时,提高了瘤胃微生物对饲粮中蛋白质的利用。
3.3 不同固液比例饲喂模式对犊牛瘤胃发酵产物的影响从本试验可以发现,随着犊牛日龄的增加瘤胃液TVFA浓度显著提高,这与张海涛等[28]的研究结果相一致,其中乙酸、丙酸、丁酸为主要组成成分,VFA作为反刍动物瘤胃内碳水化合物发酵的重要产物,其浓度是由发酵产量、发酵速度、瘤胃上皮吸收速度和瘤胃排空速度决定,是衡量瘤胃发育成熟度的重要指标[29], 其代谢也反映了瘤胃上皮细胞的发育水平。30日龄犊牛的短链脂肪酸代谢水平相当于成年牛的40%,而60日龄犊牛的短链脂肪酸代谢水平接近成年牛[2],即犊牛在60日龄前瘤胃内VFA随着日龄的增长逐渐增加。VFA是刺激瘤胃发育的关键因素,随着犊牛采食固体饲料的逐渐增加,犊牛瘤胃功能逐渐发育完善,同时断奶后犊牛瘤胃发酵状况逐渐改善,其中84日龄饲喂高比例固体饲料的犊牛瘤胃液TVFA浓度达到54.29 mmol/L,与饲喂高比例液体饲料的犊牛相比,乙酸、丙酸比例及TVFA浓度分别提高了33.36%、48.41%和40.10%。这与Kristensen等[3]通过限制液体采食量来提高犊牛固体饲料采食量后,显著增加了瘤胃液TVFA浓度的研究结果一致,这是因为固体饲料的饲喂不但能为瘤胃提供必要的化学刺激,也能提供一定的物理刺激,最终促进VFA的产生或浓度的增加。其中乙酸在参与三羧酸循环的过程中被分解为CO2和H2O同时释放出ATP来供应能量[30],丙酸则作为唯一的生糖VFA[31],作用于糖异生过程,促进饲粮中营养物质的高效利用。另外,高固体饲料饲喂模式下,丁酸的比例也显著增加,且断奶后仍有增长。丁酸在经瘤网胃壁吸收的过程中,大部分转变为β-羟丁酸而作为几种体组织尤其是肌肉组织的能量来源,其对于幼龄反刍动物的瘤胃发育也至关重要,不仅可以促进瘤胃上皮细胞增殖和分化[32],还可以提高胃肠道敏感性和促进肠道蠕动。在固体饲料刺激下,瘤胃内微生物相互作用刺激瘤胃微生物快速繁殖,使丁酸比例大量增加,这也解释了高固体饲料饲喂的犊牛,瘤胃内pH降低的原因。
固体饲料的采食状况关系到犊牛整个生长时期尤其是断奶后的营养物质吸收及代谢状况。吴端钦等[33]研究表明,用固体颗粒料来代替部分代乳粉对奶公犊牛进行饲喂可以促进犊牛的健康生长。本试验结果中,高比例的固体饲料进入犊牛瘤胃,通过发酵能够产生较多挥发性的脂肪酸,改善瘤胃发酵环境,刺激犊牛的复胃特别是瘤胃的发育,进而提高营养物质中能量及氮利用率,从而减少营养物质损耗。
4 结论① 适量增加固体饲料饲喂比例有助于改善断奶前后犊牛瘤胃发酵,促进瘤胃MCP的合成,提高断奶后犊牛饲粮能量代谢率、氮的生物学价值及氮利用率。
② 采用高固体饲料饲喂模式,犊牛在42日龄固体饲料采食量达到1.0 kg/d时实施断奶具有一定优势。
| [1] | BERENDS H, VAN DEN BORNE J J G C, STOCKHOFE-ZURWIEDEN N, et al. Effects of solid feed level and roughage-to-concentrate ratio on ruminal drinking and passage kinetics of milk replacer, concentrates, and roughage in veal calves[J]. Journal of Dairy Science, 2015, 98(8): 5621–5629. DOI: 10.3168/jds.2015-9367 |
| [2] | VI R L B, MCLEOD K R, KLOTZ J L, et al. Rumen development, intestinal growth and hepatic metabolism in the pre-and postweaning ruminant[J]. Journal of Dairy Science, 2004, 87(Suppl.): E55–E65. |
| [3] | KRISTENSEN N B, SEHESTED J, JENSEN S K, et al. Effect of milk allowance on concentrate intake, ruminal environment, and ruminal development in milk-fed Holstein calves[J]. Journal of Dairy Science, 2007, 90(9): 4346–4355. DOI: 10.3168/jds.2006-885 |
| [4] | SUÁREZ B J, VAN REENEN C G, STOCKHOFE N, et al. Effect of roughage source and roughage to concentrate ratio on animal performance and rumen development in veal calves[J]. Journal of Dairy Science, 2007, 90(5): 2390–2403. DOI: 10.3168/jds.2006-524 |
| [5] | VAZQUEZ-ANON M, HEINRICHS A J, ALDRICH J M, et al. Postweaning age effects on rumen fermentation end-products and digesta kinetics in calves weaned at 5 weeks of age[J]. Journal of Dairy Science, 1993, 76(9): 2742–2748. DOI: 10.3168/jds.S0022-0302(93)77611-0 |
| [6] | WELCHMAN D D, BAUST G N. A survey of abomasal ulceration in veal calves[J]. Veterinary Record, 1987, 121(25/26): 586–590. |
| [7] | 戚建允, 李妍. 犊牛早期断奶的饲养管理工作实践[J]. 中国奶牛, 2011(21) :36–37. DOI: 10.3969/j.issn.1004-4264.2011.21.016 |
| [8] | 许先查, 刁其玉, 王建红, 等. 液态饲料饲喂量对0~2月龄犊牛生长性能的影响[J]. 畜牧与兽医, 2011, 43(2) :4–8. |
| [9] | AOAC.Official methods of analysis of the association of official analytical chemists[S].17th ed.Arlington:AOAC, 2000. |
| [10] | 张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 中国农业大学出版社: 2007. |
| [11] | DENG K D, JIANG C G, TU Y, et al. Energy requirements of Dorper crossbred ewe lambs[J]. Journal of Animal Science, 2014, 92(5): 2161–2169. DOI: 10.2527/jas.2013-7314 |
| [12] | CAO Y C, YANG H J. Ruminal digestibility and fermentation characteristics in vitro of fenugreek and alfalfa hay combination with or without the inoculation of Neocallimastix sp. YAK11[J]. Animal Feed Science and Technology, 2011, 169(1/2): 53–60. |
| [13] | VERDOUW H, VAN ECHTELD C J A, DEKKERS E M J. Ammonia determination based on indophenol formation with sodium salicylate[J]. Water Research, 1978, 12(6): 399–402. DOI: 10.1016/0043-1354(78)90107-0 |
| [14] | MAKKAR H P S, SHARMA O P, DAWRA R K, et al. Simple determination of microbial protein in rumen liquor[J]. Journal of Dairy Science, 1982, 65(11): 2170–2173. DOI: 10.3168/jds.S0022-0302(82)82477-6 |
| [15] | BERENDS H, VAN DEN BORNE J J G C, MOLLENHORST H, et al. Utilization of roughages and concentrates relative to that of milk replacer increases strongly with age in veal calves[J]. Journal of Dairy Science, 2014, 97(10): 6475–6484. DOI: 10.3168/jds.2014-8098 |
| [16] | JASPER J, WEARY D M. Effects of Ad libitum milk intake on dairy calves[J]. Journal of Dairy Science, 2002, 85(11): 3054–3058. DOI: 10.3168/jds.S0022-0302(02)74391-9 |
| [17] | ANDERSON K L, NAGARAJA T G, MORRILL J L, et al. Ruminal microbial development in conventionally or early-weaned calves[J]. Journal of Animal Science, 1987, 64(4): 1215–1226. DOI: 10.2527/jas1987.6441215x |
| [18] | KHAN M A, LEE H J, LEE W S, et al. Structural growth, rumen development, and metabolic and immune responses of Holstein male calves fed milk through step-down and conventional methods[J]. Journal of Dairy Science, 2007, 90(7): 3376–3387. DOI: 10.3168/jds.2007-0104 |
| [19] | 许先查, 刁其玉, 屠焰, 等. 液体饲料饲喂量对哺乳期犊牛生长性能、消化代谢的影响[J]. 饲料工业, 2010, 31(19) :47–50. DOI: 10.3969/j.issn.1001-991X.2010.19.014 |
| [20] | DI GIANCAMILLO A, BOSI G, ARRIGHI S, et al. The influence of different fibrous supplements in the diet on ruminal histology and histometry in veal calves[J]. Histology and Histopathology, 2003, 18(3): 727–733. |
| [21] | 仁瑞清. 不同饲喂模式对犊牛生长以及胃肠道发育的影响[D]. 硕士学位论文. 保定: 河北农业大学, 2012. |
| [22] | KREHBIEL C R, HARMON D L, SCHNEIDER J E. Effect of increasing ruminal butyrate on portal and hepatic nutrient flux in steers[J]. Journal of Animal Science, 1992, 70(3): 904–914. DOI: 10.2527/1992.703904x |
| [23] | BALDWIN R L, MCLEOD K R. Effects of diet forage:concentrate ratio and metabolizable energy intake on isolated rumen epithelial cell metabolism in vitro[J]. Journal of Animal Science, 2000, 78(3): 771–783. DOI: 10.2527/2000.783771x |
| [24] | GHORBANI G R, MORGAVI D P, BEAUCHEMIN K A, et al. Effects of bacterial direct-fed microbials on ruminal fermentation, blood variables, and the microbial populations of feedlot cattle[J]. Journal of Animal Science, 2002, 80(7): 1977–1985. DOI: 10.2527/2002.8071977x |
| [25] | CLARK K J, TAMBORELLO T J, XU Z C, et al. An unusual group-A rotavirus associated with an epidemic of diarrhea among three-month-old calves[J]. Journal of the American Veterinary Medical Association, 1996, 208(4): 552–554. |
| [26] | CROCKER L M, DEPETERS E J, FADEL J G, et al. Influence of processed corn grain in diets of dairy cows on digestion of nutrients and milk composition[J]. Journal of Dairy Science, 1998, 81(9): 2394–2407. DOI: 10.3168/jds.S0022-0302(98)70131-6 |
| [27] | STORM E, ØRSKOV E R. The nutritive value of rumen micro-organisms in ruminants.1.Large-scale isolation and chemical composition of rumen micro-organisms[J]. British Journal of Nutrition, 1983, 50(2): 463–470. DOI: 10.1079/BJN19830114 |
| [28] | 张海涛, 王加启, 卜登攀, 等. 影响犊牛瘤胃发育的因素研究[J]. 乳业科学与技术, 2008, 31(2) :86–89. |
| [29] | 云强. 蛋白水平及Lys/Met对断奶犊牛生长、消化代谢及瘤胃发育的影响[D]. 硕士学位论文. 北京: 中国农业科学院, 2010. http://cdmd.cnki.com.cn/Article/CDMD-82101-2010170835.htm |
| [30] | 翁秀秀. 饲喂不同日粮奶牛瘤胃发酵和VFA吸收特性及其相关基因表达的研究[D]. 博士学位论文. 兰州: 甘肃农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10733-1014012284.htm |
| [31] | REYNOLDS C K, AIKMAN P C, LUPOLI B, et al. Splanchnic metabolism of dairy cows during the transition from late gestation through early lactation[J]. Journal of Dairy Science, 2003, 86(4): 1201–1217. DOI: 10.3168/jds.S0022-0302(03)73704-7 |
| [32] | 杨春涛, 刁其玉, 曲培滨, 等. 热带假丝酵母菌与桑叶黄酮对犊牛营养物质代谢和瘤胃发酵的影响[J]. 动物营养学报, 2016, 28(1) :224–234. |
| [33] | 吴端钦, 贺志雄, 谭支良. 瘤胃微生物脂肪代谢的研究进展[J]. 华北农学报, 2011, 26(Supp1.2) :235–238. |




