2. 中国农业科学院饲料研究所, 国家水产饲料安全评价基地, 北京 100081
2. National Aquafeed Safety Assessment Station, Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
大口黑鲈(Micropterus salmoides),俗称加州鲈,隶属鲈形目(Perciformes),太阳鱼科(Certrarchidae),黑鲈属(Micropterus)。自20世纪80年代从美国加利福尼亚州引入我国后,现已成为我国重要的淡水经济鱼类。大口黑鲈是一种广温性、肉食性鱼类,对饲料氧化十分敏感[1]。因此,为了防止饲料氧化对鱼体健康产生危害,需要在饲料中添加外源性的抗氧化剂。
硒(selenium, Se)于1817年被瑞典化学家Berzelius发现,是动物体必需的微量元素。硒是谷胱甘肽过氧化酶(glutathione peroxidase, GSH-Px)的重要组成成分,能保护机体免受过氧化产物和自由基对细胞成分的氧化损伤,从而使细胞结构保持完整性和正常功能[2]。硒被证实可以调节动物的炎症反应、免疫反应、甲状腺激素分泌,同时具有抗肿瘤活性[3]。饲料中的硒主要通过无机硒和有机硒2种形式进行添加,其中无机硒包括亚硒酸钠(Na2SeO3)和硒酸钠(Na2SeO4)等,有机硒有酵母硒(selenium-yeast,SY)和硒代蛋氨酸(SeMet)等[4]。研究表明,有机硒比亚硒酸盐的毒性小[5],且生物利用率优于无机硒[6]。饲料中硒缺乏会抑制鱼类的生长[7],而高水平的硒具有毒性[8]。有研究表明,饲料中添加0.24~0.32 mg/kg酵母硒可以促进鲤鱼[9](Cyprinus carpio)、0.4 mg/kg酵母硒可以促进鲈鱼[10](Lateolabrax japonicus)、0.6 mg/kg酵母硒可以促进(Elopichthys bambusa)幼鱼[11]生长。饲料中硒含量超过3.0和4.6 mg/kg时,可分别导致虹鳟[12](Salmo gairdneri)、亚口鱼[13](Catostomidae)死亡率升高。虽然酵母硒目前的应用十分广泛,但对它在水产动物饲料中的使用风险和安全阈值尚未确定。因此,本试验参考农业部1224公告及欧盟对动物饲料中酵母硒单独或与其他抗氧化剂复合使用时的最高推荐剂量(0.5 mg/kg),以大口黑鲈为靶动物,对酵母硒进行耐受性评价试验,以确定其在水产饲料中的安全限量。
1 材料与方法 1.1 试验鱼试验用大口黑鲈于2015年6月购自佛山市三水白金种苗有限公司。试验正式开始前,试验鱼在养殖系统中暂养2周,暂养期间投喂未添加酵母硒的基础饲料。
1.2 试验饲料本试验依据农业部《饲料原料和饲料添加剂水产靶动物耐受性评价试验指南(试行)》设计。在大口黑鲈的基础饲料中分别添加0、0.5、2.5和5.0 mg/kg(以硒计)酵母硒(由法国乐思福公司提供,硒含量为2 g/kg)制成4种试验饲料,依次命名为Y0、Y0.5、Y2.5、Y5.0。其中,0.5 mg/kg为硒的最高推荐剂量(农业部1224公告),而2.5和5.0 mg/kg分别是它的5和10倍。将试验饲料制成直径为2 mm的膨化颗粒饲料(大豆磷脂溶解在鱼油中在制粒前添加),自然晾干后于-20 ℃保存备用。试验饲料Y0、Y0.5、Y2.5、Y5.0中硒含量分别为0.76、1.29、3.50、6.35 mg/kg。在正式试验开始后,模拟实际养殖环境条件,将饲料存放在室温下,避光保存。试验饲料组成及营养水平见表 1。
|
|
表 1 试验饲料组成及营养水平 Table 1 Composition and nutrient levels of experimental diets |
试验在国家水产饲料安全评价基地(北京南口)室内循环流水养殖系统中进行。随机挑选体质健康、个体均匀的大口黑鲈[平均体重为(12.99±0.01) g],分配到24个容积为0.26 m3的圆锥形养殖桶中。按照投喂试验饲料的不同,试验鱼共分为4个组,每组6个养殖桶(重复),每桶20尾鱼。试验期为10周。试验结束后,禁食24 h,分别对各桶鱼称重并取样。
试验鱼每天表观饱食投喂2次,投喂时间为08:00、16:00。定期检测水质,水质条件保持在溶氧(DO)浓度>7.0 mg/L,总氨氮(NH4+-N)浓度 < 0.3 mg/L,pH=7.5~8.5,水温23~25 ℃。
1.4 测定指标 1.4.1 生长性能各指标计算公式如下:

|
式中:N0为初始鱼数量(尾);Nt为终末鱼数量(尾);W0为初始鱼体总重(g);Wt为终末鱼体总重(g);Wd为死亡鱼体总重(g);C为摄食量(g);B为饲料中硒的含量;t为试验天数。
1.4.2 形体指标每桶随机取3尾鱼测量体长、体重、肝脏重、内脏重并计算形体指标,计算公式如下:

|
饲料中粗蛋白质、粗脂肪、水分、粗灰分含量和总能分别采用凯氏定氮法、酸水解全脂肪测定法、105 ℃常压干燥法、550 ℃灼烧法和氧弹仪燃烧法测定;饲料和肝脏组织中硒含量检测参考GB/T 13883—2008中方法。
1.4.4 血浆生化指标及组织抗氧化指标每桶随机取6尾鱼,用80 mg/L三氯叔丁醇麻醉后尾静脉取血,采用氟化钠-草酸钾(2%氟化钠+4%草酸钾)抗凝,在4 ℃、4 000 r/min的条件下离心10 min,取上层血浆,分装后保存于-80 ℃的冰箱中,待测总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、总蛋白(total protein, TPRO)、白蛋白(albumin, ALB)、葡萄糖(glucose, GLU)、尿素氮(urea nitrogen, UN)、总胆汁酸(total bile acid,TBA)、总胆红素(total bilirubin, TBILI)、免疫球蛋白M(immunoglobulin M, IgM)含量及碱性磷酸酶(alkaline phosphatase, AKP)、谷草转氨酶(aspartate transaminase, AST)、谷丙转氨酶(alanine transaminase, ALT)活性,上述指标测定所用试剂盒均购自南京建成生物工程研究所。
每桶再随机取4尾鱼,取出肝脏、心脏和肌肉后保存于-80 ℃冰箱中,待测抗氧化指标:丙二醛(malonaldehyde, MDA)、总抗氧化能力(total antioxidative capacity, T-AOC)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、GSH-Px、谷胱甘肽硫转移酶(glutathione S-transferase, GST)。抗氧化指标测定所用试剂盒均购自南京建成生物工程研究所。
1.4.5 组织切片每桶随机取2尾鱼,每尾鱼取0.5 cm×0.5 cm×0.5 cm大小的肝脏组织,用0.7%的生理盐水冲洗后,在4%的多聚甲醛固定液中固定24 h,经脱水、透明、石蜡包埋组织后,用组织切片机切厚度为7 μm的切片,用苏木精-伊红(HE)染色法染色后,在光学显微镜下观察、拍照(Leica DM2500, Leica, 德国)。
1.5 数据统计试验数据用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),并用Duncan氏多重比较法检验组间差异的显著性,P < 0.05为差异显著。试验数据以平均值±标准误(mean±SE)表示。
2 结果与分析 2.1 酵母硒对大口黑鲈生长性能及形体指标的影响由表 2可知,虽然各酵母硒添加组大口黑鲈的增重率相对较高,但各组之间终末均重、增重率和特定生长率均无显著差异(P>0.05)。各酵母硒添加组大口黑鲈的摄食率和饲料系数均显著高于Y0组(P < 0.05),其他各组间无显著差异(P>0.05)。各组大口黑鲈的肥满度、肝体比和脏体比无显著差异(P>0.05),但各酵母硒添加组的肝体比较Y0组有下降趋势。
|
|
表 2 酵母硒对大口黑鲈生长性能及形体指标的影响 Table 2 Effects of Se-yeast on growth performance and morphometric parameters of largemouth bass (Micropterus salmoides) (n=6) |
由表 3可知,各组大口黑鲈血浆中LDL-C、TBA、GLU、ALB、TBILI含量,AST、ALT活性以及HDL-C/TC、LDL-C/TC均无显著差异(P>0.05)。Y0.5组血浆中TG和TC含量显著高于其余各组(P < 0.05),但均在文献[14-16]报道的参考范围内,并且该组血浆中HDL-C含量显著高于其余各组(P < 0.05)。血浆中AKP活性随酵母硒添加量的增加而降低,除Y2.5组与Y0.5组和Y5.0组差异不显著(P>0.05) 外,其他组间差异显著(P < 0.05)。Y5.0组血浆中TPRO含量显著高于Y0组(P < 0.05),与Y0.5组、Y2.5组无显著差异(P>0.05)。Y2.5组血浆中UN含量显著高于其他各组(P < 0.05),但各组的数值都在文献[14-16]报道的参考范围内。Y2.5组、Y5.0组血浆中IgM含量显著高于Y0组、Y0.5组(P < 0.05)。
|
|
表 3 酵母硒对大口黑鲈血浆生化指标的影响 Table 3 Effects of Se-yeast on plasma biochemical indices of largemouth bass (Micropterus salmoides) (n=6) |
由表 4可知,Y2.5组肝脏中MDA含量显著高于其余各组(P < 0.05),但总体来看各组MDA含量均低于参考范围[14-17],Y0.5组MDA含量与Y0组、Y5.0组无显著差异(P>0.05)。Y0.5组肝脏中T-AOC及SOD和GST活性与Y2.5组肝脏中T-AOC及SOD、CAT、GST和GSH-Px活性均显著高于Y0组(P < 0.05),而Y5.0组肝脏中GSH-Px和GST活性则较Y0组显著降低(P < 0.05)。
|
|
表 4 酵母硒对大口黑鲈肝脏抗氧化指标的影响 Table 4 Effects of Se-yeast on antioxidant indices in liver of largemouth bass (Micropterus salmoides) (n=6) |
由表 5可知,各组大口黑鲈肌肉中SOD、CAT活性以及MDA含量无显著差异(P>0.05)。Y2.5组肌肉中T-AOC显著高于Y5.0组(P < 0.05),与Y0组、Y0.5组无显著差异(P>0.05)。肌肉组织中未检出GSH-Px、GST。
|
|
表 5 酵母硒对大口黑鲈肌肉抗氧化指标的影响 Table 5 Effects of Se-yeast on antioxidant indices in muscle of largemouth bass (Micropterus salmoides) (n=6) |
由表 6可知,各组大口黑鲈心脏中T-AOC以及SOD、CAT、GSH-Px活性与MDA含量均无显著差异(P>0.05)。心脏组织中未检出GST。
|
|
表 6 酵母硒对大口黑鲈心脏抗氧化指标的影响 Table 6 Effects of Se-yeast on antioxidant indices in heart of largemouth bass (Micropterus salmoides) (n=6) |
由表 7可知,各组大口黑鲈血浆中CAT活性无显著差异(P>0.05)。Y0组血浆中MDA含量显著高于其他各组(P < 0.05)。Y5.0组血浆中T-AOC显著低于其他各组(P < 0.05),但其SOD活性则显著高于其他各组(P < 0.05)。Y2.5组血浆中GSH-Px、GST活性显著高于Y0组和Y0.5组(P < 0.05),与Y5.0组无显著差异(P>0.05)。
|
|
表 7 酵母硒对大口黑鲈血浆抗氧化指标的影响 Table 7 Effects of Se-yeast on antioxidant indices in plasma of largemouth bass (Micropterus salmoides) (n=6) |
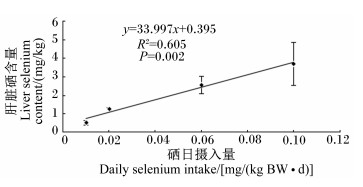
本试验中考虑本底硒含量(0.76 mg/kg),用总硒含量计算硒日摄入量。由表 8可知,各组大口黑鲈硒日摄入量无显著差异(P>0.05)。Y5.0组肝脏硒含量显著高于Y0组、Y0.5组(P < 0.05),与Y2.5组无显著差异(P>0.05)。对硒日摄入量和肝脏硒含量的关系做线性回归分析,如图 1所示。由图 1可知,硒日摄入量和肝脏硒含量呈显著线性相关(P < 0.05),肝脏硒含量随硒日摄入量的提高呈线性增加。
|
|
表 8 酵母硒对大口黑鲈硒日摄入量和肝脏硒含量的影响 Table 8 Effects of Se-yeast on daily selenium intake and selenium content in liver of largemouth bass (Micropterus salmoides) (n=6) |
|
图 1 硒日摄入量和肝脏硒含量的关系 Figure 1 Relationship between daily selenium intake and liver selenium content |
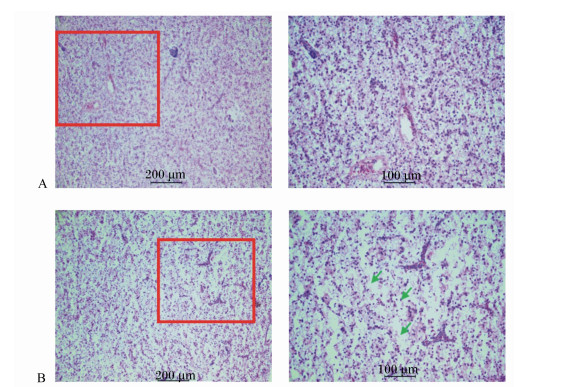
如图 2所示,各组肝脏均出现不同程度的损伤。对照组(Y0组)观察了12尾鱼,6尾正常,6尾出现肝脏细胞膜溶解,细胞间隙不清,细胞崩解;Y0.5组观察了12尾鱼,10尾正常,2尾出现细胞间隙不清,细胞崩解;Y2.5组观察了12尾鱼,10尾正常,2尾出现肝脏细胞膜溶解,细胞崩解;Y5.0组观察了12尾鱼,4尾正常,8尾出现肝脏细胞膜消失,细胞崩解。
|
A:正常肝细胞;B:绿色箭头显示肝脏细胞损伤,细胞膜溶解,细胞崩解。右图为左图红框部位的放大图。 A: the normal hepatic cells; B: the green arrow showed the cell damage, cell membrane dissolution and cell disruption. Right figure was the enlarged drawing of red frame part in left figure. 图 2 大口黑鲈肝脏组织切片 Figure 2 Hepatic histological slices of largemouth bass (Micropterus salmoides) |
本试验中,虽然各组增重率没有统计学差异,但未添加酵母硒的Y0组大口黑鲈的增重率、特定生长率和终末均重均最低;饲料中添加0.5、2.5和5.0 mg/kg酵母硒对大口黑鲈的生长性能稍有改善,但饲料系数也随之提高。目前,关于酵母硒对动物生长性能影响结果的报道并不一致。许友卿等[11]报道,饲料中添加0.77 mg/kg的酵母硒能显著提高鱤鱼的增重率、特定生长率,降低饲料系数。常仁亮等[18]研究发现,以10%硒酵母(含硒量0.6 mg/kg)替代鱼粉饲喂中国对虾后显著降低饲料系数。Lin[6]研究发现,饲料中添加0.8 mg/kg的硒代蛋氨酸显著提高了石斑鱼的增重率。这些关于硒对生长性能影响的研究结果均与本试验有所不同,表明动物的种类、发育阶段不同,对硒的吸收能力及机体自身的抗氧化能力等方面存在很大差异。有关于硒日摄入量对大鼠体内蓄积毒性的研究得出,含纳米硒、无机硒及高硒蛋白的3种饲料中硒含量为4和5 mg/kg时,雌鼠体重显著下降[19]。在大鼠的饮水中加入一定浓度的亚硒酸钠进行6个月的试验,研究发现,当硒含量为6 mg/kg时,体重下降,当浓度为15 mg/kg时,体重下降更显著且影响存活率[20]。本研究中,饲料本底硒含量(0.76 mg/kg)已超出农业部公告中硒元素的最高推荐剂量(0.5 mg/kg)。饲料中添加酵母硒对大口黑鲈生长性能无显著影响,可能是由于饲料本底硒(0.76 mg/kg)已经可以满足大口黑鲈生长的需求量,虽然有进一步提高增重率和特定生长率的趋势,但没有达到统计学差异。鱼粉、磷虾粉等动物蛋白质源中含有较高水平的硒元素,因此在高鱼粉水产动物饲料中补充硒元素要慎重。
3.2 酵母硒对大口黑鲈血浆生化指标的影响血液生化指标检测为鱼类营养水平、机体代谢及疾病诊断提供重要信息,是衡量鱼类健康状况的重要参考依据[21]。TPRO包括ALB和球蛋白(GLB),其中ALB是由肝脏合成的机体蛋白质来源之一,主要功能是维持血液中胶体渗透压,用于提供能量和修复组织[22]。由本试验结果可知,饲料中添加酵母硒对大口黑鲈血浆中ALB含量没有产生显著影响,但使TPRO含量显著增加,TPRO含量反映了机体蛋白质合成与代谢的强弱程度,说明酵母硒对蛋白质的组织沉积有增加作用,有助于组织器官的生长。TC和TG是血液脂肪的组成成分,反映体内胆固醇以及饲料中脂类在动物体中的吸收与代谢状况。HDL-C是将各组织中的胆固醇运送回肝脏进行代谢,血浆中HDL-C含量下降不利于胆固醇的代谢、转运和清除,将影响肝脏的正常脂肪代谢[23]。饲料中添加2.5、5.0 mg/kg酵母硒时,大口黑鲈血浆中HDL-C含量低于参考范围[14-16],且TC和TG含量在参考范围[14-16]内,说明胆固醇的代谢、转运和清除可能受到抑制,将导致脂肪代谢受阻。本试验中,0.5 mg/kg酵母硒的添加使血浆中TC和TG含量在参考范围[14-16]内,同时显著提高HDL-C的含量,这与在泥鳅[24]、大鼠[25]中得出的结果相似,说明适量的酵母硒能改善大口黑鲈血液中脂肪的转运和代谢,有利于维持鱼体健康。AKP、AST和ALT活性主要反映动物肝脏受损程度,正常生理条件下鱼体血浆中AKP、AST和ALT活性很低,当动物肝细胞受损时其活性会显著升高,升高程度与肝细胞受损程度相一致[26]。此外,血浆中AKP活性和TBA含量显著升高是动物胆汁淤积症的主要症状,本试验中,各组大口黑鲈血浆中TBA含量没有显著差异,但酵母硒的添加显著降低了大口黑鲈血浆中AKP活性,说明酵母硒对肝脏的保护作用也可能和促进胆汁酸循环有关[27]。血浆IgM是鱼体特异性体液免疫应答和抵抗力的重要指标,且是研究最广泛的一种免疫球蛋白[28]。本研究发现,当饲料中添加2.5、5.0 mg/kg酵母硒时,大口黑鲈血浆中IgM含量达到最高,硒摄入过量激活大口黑鲈免疫系统,可能引发炎症反应,说明高剂量酵母硒的添加对大口黑鲈有一定的风险。
3.3 酵母硒对大口黑鲈肝脏、肌肉、心脏和血浆抗氧化指标的影响本试验中,饲料中添加0.5、2.5 mg/kg酵母硒可提高大口黑鲈肝脏中T-AOC及SOD、CAT、GSH-Px、GST活性。在氧化应激情况下,抗氧化防御系统包括SOD、CAT、GSH-Px等,这些抗氧化酶对于清除活性氧(ROS)至关重要[29]。作为GSH-Px的活性中心,硒的抗氧化性主要通过此酶来发挥。SOD能催化超氧阴离子(O2-)生成过氧化氢(H2O2),CAT能催化H2O2转变为水(H2O)和氧气(O2)[30],共同保护组织免受损伤。Hao等[24]研究发现,饲料中添加0.5 mg/kg硒能显著提高泥鳅肝脏中GSH-Px和SOD活性,与本试验结果相似。在鲫鱼[31]、雏鸡[32]的研究中发现添加硒能提高肝脏中GSH-Px活性。本试验结果显示,饲料中添加2.5 mg/kg酵母硒显著提高了大口黑鲈肝脏中MDA含量,但各组肝脏中MDA含量均低于参考范围[14-17];饲料中添加0.5 mg/kg酵母硒使肝脏T-AOC及SOD、GST、GSH-Px活性显著升高,说明酵母硒的适量添加提高了肝脏的总抗氧化能力,可保护肝脏免受损伤;而饲料中添加5.0 mg/kg酵母硒使肝脏GSH-Px和GST活性显著降低,说明过高剂量的酵母硒可导致大口黑鲈肝脏组织处于氧化应激状态,致使抗氧化系统过度活跃。心脏和肌肉组织对硒的敏感性不及肝脏和血浆,各组大口黑鲈心脏和肌肉中T-AOC、MDA、SOD、CAT和GSH-Px活性没有显著差异。本试验在心脏组织中未检出GST,可能因为GST在不同组织中表达水平不同,而GST对大口黑鲈心脏应激反应不敏感或在心脏中不表达[17]。
本试验发现,随着酵母硒添加量的增加,大口黑鲈血浆中GSH-Px、SOD活性升高及MDA含量下降,CAT、GST活性没有显著变化。有研究表明,适量硒的添加能提高鲫鱼[31]血浆和鲈鱼[10]血清中GSH-Px的活性,降低肉鸡[33]血浆、大鼠[34]血清中MDA含量,这与本研究结果一致。SOD能催化超氧阴离子发生歧化反应,对过氧化和噬菌作用造成的组织损伤起防御保护作用。本试验中,随着酵母硒添加量的增加,大口黑鲈血浆中SOD活性逐渐升高,说明机体清除自由基的能力增强[35]。T-AOC是衡量机体抗氧化能力的综合指标,研究报道,硒在较低浓度时以消除自由基为主,表现为有益的生理效应,而在较高浓度下以产生ROS为主,ROS的增加导致氧化应激,造成不同器官和组织的细胞损害[36],说明产生了毒性效应。饲料中添加5.0 mg/kg酵母硒使大口黑鲈血浆中T-AOC显著降低,这表明硒的过量添加可能对大口黑鲈产生了毒害作用。
3.4 酵母硒对大口黑鲈肝脏组织学的影响目前,在集约化养殖模式下,大口黑鲈仍以冰鲜鱼为主要食物来源,全程饲喂配合饲料的模式仍在探索中[37]。长期饲喂人工配合饲料的大口黑鲈在生产中的主要病理反应即为肝胆损伤,其主要原因与饲料碳水化合物水平、脂质氧化等因素有关[38]。本研究对各组大口黑鲈的肝脏组织进行了病理学分析,从大口黑鲈的肝脏组织切片可以看出,各组的肝脏均出现了不同程度的损伤,尤其是未添加酵母硒的Y0组和添加最高推荐剂量10倍的Y5.0组,出现较高比例肝脏细胞膜消失、细胞间隙不清和细胞崩解等病变的样本。Y0.5组和Y2.5组的大口黑鲈肝脏病灶得到相应改善,但Y2.5组的大口黑鲈肝脏中MDA含量和血浆中IgM含量达到最高,硒摄入过量导致脂质过氧化和激活免疫系统,可能引发炎症反应,说明高剂量硒的添加对大口黑鲈有一定的风险。本试验实施过程模拟大口黑鲈野外饲喂模式,饲料在夏季高温、高湿、自然光照的环境下储存,10周内饲料会发生一定程度的氧化变质,大口黑鲈对脂质氧化较为敏感[39],长期摄食氧化油脂会导致组织受损。虽然饲料会发生一定程度的氧化变质,但本试验所使用的鱼油已经提前添加200 mg/kg特丁基对苯二酚(TBHQ)作为抗氧化剂。本实验室前期对TBHQ的评价试验中,200 mg/kg TBHQ对大口黑鲈饲料中的鱼油可以起到很好的保鲜作用[40]。肝脏出现损伤也有可能与饲料中含有相对较高的碳水化合物有关。徐祥泰等[38]报道,饲料中淀粉含量高于10%,即有可能导致大口黑鲈肝脏病变。谭肖英等[41]报道,大口黑鲈饲料中碳水化合物15%~23%的主要影响大口黑鲈内脏器官的相对质量及肝脏的营养成分组成。同时,过高水平的硒对鱼类也具有一定的肝细胞毒性[8]。本试验结果显示,饲料中添加0.5 mg/kg的酵母硒(总硒含量为1.29 mg/kg)可有效缓解肝脏组织损伤,但饲料中仅添加酵母硒仍未能完全抵御大口黑鲈因氧化油脂所造成的组织损伤。
4 结论① 饲料中添加0.5 mg/kg酵母硒(总硒含量为1.29 mg/kg)对大口黑鲈具有一定的脂肪代谢促进作用和抗氧化保护功能,且对大口黑鲈是安全的。
② 本试验条件下,综合生长性能、血浆生化指标、组织抗氧化指标及肝脏组织结构,饲料本底硒含量为0.76 mg/kg时,大口黑鲈对饲料中酵母硒的耐受剂量为0.5 mg/kg(以硒计),即为硒的最高推荐剂量,安全系数为1。
③ 鱼粉、磷虾粉等动物蛋白质源中含有较高水平的硒元素,因此在高鱼粉水产动物饲料中补充硒要慎重。
| [1] | YUN B, XUE M, WANG J, et al. Effects of lipid sources and lipid peroxidation on feed intake, growth, and tissue fatty acid compositions of largemouth bass (Micropterus salmoides)[J]. Aquaculture International, 2013, 21(1): 97–110. DOI: 10.1007/s10499-012-9538-0 |
| [2] | ZENG H W, COMBS G F, Jr. Selenium as an anticancer nutrient:roles in cell proliferation and tumor cell invasion[J]. The Journal of Nutritional Biochemistry, 2008, 19(1): 1–7. DOI: 10.1016/j.jnutbio.2007.02.005 |
| [3] | KÖHRL J, BRIGELIUS-FLOHÉ R, BÖCK A, et al. Selenium in biology:facts and medical perspectives[J]. Biological Chemistry, 2000, 381(9/10): 849–864. |
| [4] | KORHOLA M, VAINIO A, EDELMANN K. Selenium yeast[J]. Annals of Clinical Research, 1986, 18(1): 65–68. |
| [5] | BROWN K M, PICKARD K, NICOL F, et al. Effects of organic and inorganic selenium supplementation on selenoenzyme activity in blood lymphoctyes, granulocytes, platelets and erythrocytes[J]. Clinical Science, 2000, 98(5): 593–599. DOI: 10.1042/cs0980593 |
| [6] | LIN Y H. Effects of dietary organic and inorganic selenium on the growth, selenium concentration and meat quality of juvenile grouper Epinephelus malabaricus[J]. Aquaculture, 2014, 430: 114–119. DOI: 10.1016/j.aquaculture.2014.03.048 |
| [7] | POSTON H A, COMBS G F, J r, LEIBOVITZ L. Vitamin E and selenium interrelations in the diet of Atlantic salmon (Salmo salar):gross, histological and biochemical deficiency signs[J]. The Journal of Nutrition, 1976, 106(7): 892–904. |
| [8] | GATLIN D M Ⅲ, WILSON R P. Dietary selenium requirement of fingerling channel catfish[J]. The Journal of Nutrition, 1984, 114(3): 627–633. |
| [9] | GABER M M. Efficiency of selenium ion inclusion into common carp (Cyprinus carpio L.) diets[J]. African Journal of Agricultural Research, 2008, 4(4): 348–353. |
| [10] | 梁萌青, 王家林, 常青, 等. 饲料中硒的添加水平对鲈鱼生长性能及相关酶活性的影响[J]. 中国水产科学, 2006, 13(6) :1017–1022. |
| [11] | 许友卿, 李太元, 丁兆坤, 等. 添加酵母硒对鳡鱼消化酶活性与饲料转化率的影响[J]. 水产科学, 2013, 32(7) :391–395. |
| [12] | BELL J G, PIRIE B J, ADRON J W, et al. Some effects of selenium deficiency on glutathione peroxidase (EC 1.11.1.9) activity and tissue pathology in rainbow trout (Salmo gairdneri)[J]. British Journal of Nutrition, 1986, 55(2): 305–311. DOI: 10.1079/BJN19860038 |
| [13] | HAMILTON S J, HOLLEY K M, BUHL K J, et al. Toxicity of selenium and other elements in food organisms to razorback sucker larvae[J]. Aquatic Toxicology, 2002, 59(3/4): 253–281. |
| [14] | 于利莉, 薛敏, 王嘉, 等. 大口黑鲈对饲料中丁基羟基茴香醚的耐受性评价[J]. 动物营养学报, 2016, 28(3) :747–758. |
| [15] | 袁瑞敏, 刘永坚, 王贵平, 等. 氧化鱼油饲料中添加维生素C对大口黑鲈幼鱼生长及抗氧化能力的影响[J]. 广东农业科学, 2016, 43(1) :136–144. |
| [16] | 张露露. 胆汁酸在大口黑鲈饲料中有效性及耐受性评价[D]. 硕士学位论文. 泰安: 山东农业大学, 2015: 23-28. |
| [17] | 刘金桃, 艾立川, 王嘉, 等. 大口黑鲈对饲料中乙氧基喹啉的耐受性评价[J]. 动物营养学报, 2015, 27(4) :1152–1162. |
| [18] | 常仁亮, 韩保平, 顾润润. 硒酵母的培养及其养虾效果[J]. 水产学报, 2000, 24(5) :458–462. |
| [19] | JIA X, LI N, CHEN J. A subchronic toxicity study of elemental Nano-Se in Sprague-Dawley rats[J]. Life Sciences, 2005, 76(17): 1989–2003. DOI: 10.1016/j.lfs.2004.09.026 |
| [20] | CRESPO A M, NEVE J, PINTO R E. Plasma and liver selenium levels in the rat during supplementation with 0.5, 2, 6, and 15 ppm selenium in drinking water[J]. Biological Trace Element Research, 1993, 38(2): 139–147. DOI: 10.1007/BF02784050 |
| [21] | SILVEIRA-COFFIGNY R, PRIETO-TRUJILLO A, ASCENCIO-VALLE F. Effects of different stressors in haematological variables in cultured Oreochromis aureus S.[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2004, 139(4): 245–250. |
| [22] | AHMED A F, CONSTABLE P D, MISK N A. Effect of feeding frequency and route of administration on abomasal luminal pH in dairy calves fed milk replacer[J]. Journal of Dairy Science, 2002, 85(6): 1502–1508. DOI: 10.3168/jds.S0022-0302(02)74219-7 |
| [23] | 石桂城, 董晓惠, 陈刚, 等. 饲料脂肪水平对吉富罗非鱼生长性能及其在低温应激下血清生化指标和肝脏脂肪酸组成的影响[J]. 动物营养学报, 2012, 24(11) :2154–2164. DOI: 10.3969/j.issn.1006-267x.2012.11.013 |
| [24] | HAO X F, LING Q F, HONG F S. Effects of dietary selenium on the pathological changes and oxidative stress in loach (Paramisgurnus dabryanus)[J]. Fish Physiology and Biochemistry, 2014, 40(5): 1313–1323. DOI: 10.1007/s10695-014-9926-7 |
| [25] | 冯润荷, 王鹏华. 不同剂量有机硒对大鼠血脂代谢影响的实验研究[J]. 天津医科大学学报, 2009, 15(4) :729–730. |
| [26] | NYBLOM H, BERGGREN U, BALLDIN J, et al. High AST/ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking[J]. Alcohol and Alcoholism, 2004, 39(4): 336–339. DOI: 10.1093/alcalc/agh074 |
| [27] | CHIANG J Y L. Bile acid metabolism and signaling[J]. Comprehensive Physiology, 2013, 3(3): 1191–1212. |
| [28] | ESTENSORO I, CALDUCH-GINER J A, KAUSHIK S, et al. Modulation of the IgM gene expression and IgM immunoreactive cell distribution by the nutritional background in gilthead sea bream (Sparus aurata) challenged with Enteromyxum leei (Myxozoa)[J]. Fish & Shellfish Immunology, 2012, 33(2): 401–410. |
| [29] | ATENCIO L, MORENO I, JOS Á, et al. Effects of dietary selenium on the oxidative stress and pathological changes in tilapia (Oreochromis niloticus) exposed to a microcystin-producing cyanobacterial water bloom[J]. Toxicon, 2009, 53(2): 269–282. DOI: 10.1016/j.toxicon.2008.11.011 |
| [30] | DAVID M, MUNASWAMY V, HALAPPA R, et al. Impact of sodium cyanide on catalase activity in the freshwater exotic carp, Cyprinus carpio (Linnaeus)[J]. Pesticide Biochemistry and Physiology, 2008, 92(1): 15–18. DOI: 10.1016/j.pestbp.2008.03.013 |
| [31] | ZHOU X X, WANG Y B, GU Q, et al. Effects of different dietary selenium sources (selenium nanoparticle and selenomethionine) on growth performance, muscle composition and glutathione peroxidase enzyme activity of crucian carp (Carassius auratus gibelio)[J]. Aquaculture, 2009, 291(1/2): 78–81. |
| [32] | SURAI P F. Effect of selenium and vitamin E content of the maternal diet on the antioxidant system of the yolk and the developing chick[J]. British Poultry Science, 2000, 41(2): 235–243. DOI: 10.1080/713654909 |
| [33] | MOORE M A, WANDER R C, XIA Y M, et al. Selenium supplementation of Chinese women with habitually low selenium intake increases plasma selenium, plasma glutathione peroxidase activity, and milk selenium, but not milk glutathione peroxidase activity[J]. The Journal of Nutritional Biochemistry, 2000, 11(6): 341–347. DOI: 10.1016/S0955-2863(00)00089-9 |
| [34] | 李锋, 李宣海, 程五凤, 等. 补充VE、Se对大鼠肝纤维化和抗氧化功能影响的研究[J]. 营养学报, 2003, 25(1) :60–64. |
| [35] | MUÑOZ M, CEDEÑO R, RODRÍGUEZ J, et al. Measurement of reactive oxygen intermediate production in haemocytes of the penaeid shrimp, Penaeus vannamei[J]. Aquaculture, 2000, 191(1/2/3): 89–107. |
| [36] | MÉNDEZ-ARMENTA M, NAVA-RUIZ C, FERNÁNDEZ-VALVERDE F, et al. Histochemical changes in muscle of rats exposed subchronically to low doses of heavy metals[J]. Environmental Toxicology and Pharmacology, 2011, 32(1): 107–112. DOI: 10.1016/j.etap.2011.03.001 |
| [37] | 吴锐全, 黄樟翰, 卢迈新. 大口黑鲈营养研究及配合饲料发展前景[J]. 广东饲料, 2004, 13(2) :38–39. |
| [38] | 徐祥泰, 陈乃松, 刘子科, 等. 饲料中不同淀粉源及水平对大口黑鲈肝脏组织学的影响[J]. 上海海洋大学学报, 2016, 25(1) :61–70. DOI: 10.12024/jsou.20150401405 |
| [39] | YUAN Y, CHEN Y J, LIU Y J, et al. Dietary high level of vitamin premix can eliminate oxidized fish oil-induced oxidative damage and loss of reducing capacity in juvenile largemouth bass (Micropterus salmoides)[J]. Aquaculture Nutrition, 2014, 20(2): 109–117. DOI: 10.1111/anu.2014.20.issue-2 |
| [40] | 刘金桃. 大口黑鲈(Micropterus salmoides)对乙氧基喹啉和特丁基对苯二酚的耐受性研究[D]. 硕士学位论文. 青岛: 中国海洋大学, 2015: 33-39. |
| [41] | 谭肖英, 刘永坚, 田丽霞, 等. 饲料中碳水化合物水平对大口黑鲈Micropterus salmoides生长、鱼体营养成分组成的影响[J]. 中山大学学报:自然科学版, 2005, 44(增刊1) :258–263. |




