瘤胃是反刍动物特有的消化器官,食物进入瘤胃后在瘤胃微生物的作用下产生短链脂肪酸(short chain fatty acids, SCFA),其中85%的SCFA被瘤胃上皮细胞直接吸收,并可为机体提供85%的代谢能[1]。进入瘤胃的氨、氨基酸、小肽、葡萄糖、无机离子等营养素绝大部分被瘤胃上皮细胞吸收。瘤胃上皮不仅具有吸收、物质转运等功能,也是瘤胃微生物附着、生长并进行微生物消化和代谢的部位。瘤胃内栖息着大量的微生物群体,这些微生物可以利用氨、氨基酸、小肽作为氮源,挥发性脂肪酸(volatile fatty acids,VFA)作为碳源合成微生物蛋白,供宿主利用。由此可见,反刍动物瘤胃上皮及微生物对营养物质的吸收以及生产性能的发挥影响巨大。葡萄糖与SCFA是反刍动物体内重要的营养物质,其转运过程中涉及许多调控因子,这些调控因子也参与瘤胃上皮细胞的增殖调控。目前,国内外许多学者都针对瘤胃上皮细胞增殖相关基因表达做了大量研究,主要包括胰岛素样生长因子(insulin-like growth factor, IGF)、表皮生长因子(epidermal growth factor, EGF)、钠氢交换蛋白(sodium hydrogen exchanger, NHE)、单羧酸转运载体(monocarboxylate transporters, MCTs)、G蛋白偶联受体(G protein-coupled receptor, GPR)等,其中IGF、EGF参与葡萄糖的转运,NHE、MCT、GPR与SCFA的转运有关,目前研究主要集中于IGF、NHE和EGF,而在NHE和EGF的研究中,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)可能是一个切入点。从饲粮营养水平和饲养制度影响MCT和GPR表达出发进行反刍动物瘤胃发育研究,可能是一个突破点。目前,相关综述仅涉及调控瘤胃上皮细胞增殖的基因种类,对具体的分子机制还不清楚。本文对瘤胃上皮细胞增殖和物质转运的分子机制进行综述,对于进一步理解瘤胃发育过程及建立最佳的反刍动物营养供给策略具有重要意义。
1 瘤胃上皮的结构和功能特点成年反刍动物瘤网胃占到整个消化道容积的70%左右,瘤胃壁由黏膜(瘤胃上皮),浆膜和肌层构成[1]。瘤胃上皮属于复层结构上皮,分为4层,由黏膜层向浆膜层依次分为基底层、棘状细胞层、颗粒细胞层和角质化细胞层。基底层细胞承担瘤胃上皮的更新与损伤修复。此外,基底层与棘状细胞层含有大量线粒体,参与VFA代谢与生酮作用。颗粒细胞层之间有许多紧密的桥粒连接,其功能主要是阻止物质以扩散方式进入瘤胃上皮。角质化细胞层直接与瘤胃内容物接触,细胞内含有大量角蛋白,是瘤胃内环境与外界环境的屏障。瘤胃上皮多细胞结构构成瘤胃上皮屏障,调节营养物质的吸收,防止有毒物质和微生物易位进入血液[2]。瘤胃上皮附着大量的微生物,包括细菌、原虫、真菌和古细菌[3],这些微生物与宿主的消化吸收、营养免疫息息相关。
新生反刍动物的瘤胃中是无菌的,但出生后1~2 d瘤胃内便出现微生物,微生物的定植会引起宿主营养物质消化代谢的变化。幼龄反刍动物从以消化母乳为主逐渐转变为以消化饲料为主,在这一过程中瘤胃微生物的种类与数量也随之发生改变[4]。成熟的瘤胃和网胃正常情况下吸收的VFA占总量的75%左右[5],VFA是成年反刍动物能量的主要来源。乙酸和丁酸在瘤胃上皮中生成酮体,丙酸则生成乳酸和葡萄糖。幼龄反刍动物与成年反刍动物相比,瘤胃发育不完善,瘤胃内的优势菌群与成年反刍动物不同,瘤胃上皮细胞基底层与颗粒细胞层不具备生酮功能,此时,葡萄糖是其主要能量来源。然而,犊牛在30日龄时,瘤胃上皮细胞代谢的VFA已经达到成年牛的40%。体内研究发现,羔羊从2日龄到6月龄对葡萄糖的利用率约降低90%,而对丁酸盐和乳酸盐的利用率却逐渐升高[6],这在体外也得到证实[5]。瘤胃上皮细胞中无瘤胃生酮酶,产生生酮酶的细胞应该在具有大量的线粒体的基底层中[7]。反刍动物瘤胃上皮生酮作用主要依靠线粒体内3-羟基-3-甲基-戊二酸单酰辅酶A(HMG-CoA)合成酶(限速酶)、乙酰乙酰辅酶A(Acetoacetyl-CoA)硫解酶等[8],HMG-CoA合成酶与Acetoacetyl-CoA硫解酶是瘤胃发育成熟的标志,HMG-CoA合成酶与Acetoacetyl-CoA硫解酶的mRNA表达水平在0~84日龄阶段逐渐上升,84日龄即可达到成年反刍动物的水平。随着年龄的变化,幼龄反刍动物从消化母乳逐渐转变到消化饲草和饲料,瘤胃内的微生物种类与数量也不断变化,成年后最终趋于稳定。
2 瘤胃上皮细胞增殖和物质转运分子机制 2.1 胰岛素家族胰岛素家族包括IGF-1、IGF-2以及IGF-1受体(IGF-1R)、IGF-2受体(IGF-2R)和胰岛素样受体蛋白(IGF/InsR) 3种受体,6种高亲和力的结合蛋白[胰岛素样生长因子结合蛋白(IGFBP)1~6]等[9]。
IGF-1能够促进DNA和RNA合成与细胞增殖,促进细胞从G1期进入S期[10]。IGF-1参与细胞增殖的调控,目前已知的IGF-1信号转导途径(如图 1所示)包括:磷脂酰肌醇-3-激酶(PI3K)/丝氨酸/苏氨酸激酶(AKT)信号转导途径(简称AKT信号转导途径)、Ras/Raf/丝裂原活化蛋白/胞外信号调节激酶的激酶(MEK)/胞外信号调节激酶(ERK)信号转导途径(简称ERK信号转导途径)、14-3-3蛋白/Raf-1信号转导途径。其中,AKT与ERK信号转导途径控制细胞的增殖。ERK信号转导途径通过加快细胞G1周期进程,促进细胞周期蛋白D1(cyclin D1) 蛋白的表达来促进细胞增殖,而AKT信号转导途径则通过抑制cyclin D1的降解来促进细胞的增殖,14-3-3蛋白/Raf-1信号转导途径通过钝化凋亡蛋白BAD来促进细胞增殖[11]。IGF-1通过与IGF1-R结合来发挥生理功能,研究发现,IGF-1促进了山羊瘤胃上皮细胞ERK蛋白的磷酸化,用IGF-1处理瘤胃上皮细胞后,其cyclin D1蛋白的表达水平显著高于对照组(未用IGF-1处理)[12],这很好地印证了ERK信号转导途径的作用。
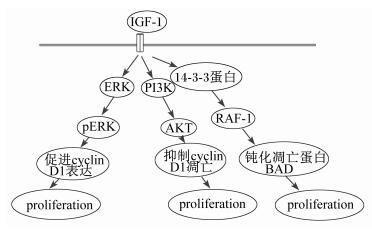
|
IGF-1:胰岛素样生长因子insulin-like growth factor;ERK:胞外信号调节激酶extracellular signal-regulated kinase;PI3K:磷脂酰肌醇-3-激酶phosphatidylinositol 3-kinase;AKT:丝氨酸/苏氨酸激酶serine/threonine kinase;pERK:磷酸化胞外信号调节激酶phosphorylated extracellular signal-regulated kinase;cyclin D1:细胞周期蛋白D1;proliferation:增殖。 图 1 IGF-1信号转导途径示意图 Figure 1 The sketch map of signal transduction pathways of IGF-1[11-12] |
饲粮营养水平能够影响IGF-1的表达,高营养水平饲粮能够促进IGF-1和IGF-1R的表达,且IGF-1和IGF-1R的表达具有很好的一致性,cyclin D1和细胞周期蛋白依赖性激酶4(CDK4) 蛋白表达量升高,通过加快细胞周期促进瘤胃上皮细胞的增殖[12]。研究发现,饲粮的直与支链淀粉比值不同也会影响瘤胃上皮细胞的IGF-1和IGF-1R的表达量[13],猜测可能是饲粮的直/支链淀粉比值不同,其过瘤胃速率不同,导致VFA比例不同,进而影响了IGF-1和IGF-1R的表达量,但仍需要后续试验进行验证。
胰岛素受体(InsR)通过将胰岛素与IGF-2的信号介导入细胞内,来影响细胞的增殖和分化过程。IGF-2与胰岛素和InsR的a亚单位结合后,酪氨酸残基上的b亚单位会自动发生磷酸化,通过酪氨酸的磷酸化将信号传递给胰岛素受体底物-1(IRS-1),进而使PI3K和ERK激活,影响多种信号转导通路[14],进而影响细胞的增殖。目前在瘤胃上皮研究中,有关InsR的报道较少,侯明[15]研究表明异丁酸可以促进InsR的表达。IGF促进瘤胃上皮细胞增殖主要是通过对IGFBP家族的调控。对于IGFBP-3与IGFBP-5的研究较多,二者功能相反,IGFBP-3的表达上调能够促进细胞的增殖[16]。饲粮能量水平、结构与类型影响IGFBP-3的表达,高能量饲粮显著提高IGFBP-3 mRNA的表达量[11]。Steele等[17]研究发现,谷物饲粮下调了IGFBP-3的表达,上调了IGFBP-5的表达,而翁秀秀[18]研究则表明谷物饲粮均上调了IGFBP-3与IGFBP-5的表达,促进了瘤胃上皮细胞的增殖,其原因尚不清楚。随饲粮中性洗涤纤维(NDF)与淀粉(starch)比例的增加,IGFBP-5的表达量显著降低,IGFBP-6的表达量升高,而IGFBP-3的表达量无显著变化[19]。IGFBP-6与IGF-2结合,抑制细胞增殖,但具体机制仍需研究。此外,瘤胃内丁酸含量的升高引起IGFBP-3的表达量下调,进而促进瘤胃上皮细胞的增殖[20]。饲养制度也能够影响IGFBP-3与IGFBP-5的表达,28日龄断奶促进了羔羊瘤胃发育和IGFBP-5的表达,可能与早期断奶羔羊瘤胃内SCFA含量高有关,也可能是羔羊早期断奶后采食固体饲料促进了瘤胃发育,但IGFBP-3的表达与瘤胃乳头发育呈正相关[21],这与前人研究结果不一致,其机制尚待研究。
IGF-1参与葡萄糖转运的调控,在非反刍动物上研究较多,在反刍动物上研究较少。目前已知有2种转运蛋白参与葡萄糖的转运,一种是钠-葡萄糖共转运蛋白1(sodium/glucose cotransporter 1,SGLT1),一种是葡萄糖转运蛋白(glucose transporter,GLUT)。任宏政[22]在人类癌症的研究中发现,IGF-1能够促进易化葡萄糖转运蛋白(facilitateal glucose transports protein,Glut)的表达。在葡萄糖转运过程中,IGF-1结合于IGF-1R的信号通路,增强GLUT1的表达,能够显著增强葡萄糖的转运能力[23]。但Ader等[24]在绵羊的研究中发现GLUT2对葡萄糖的转运能力极低,在反刍动物上,IGF-1对葡萄糖的转运影响尚未见报道。
2.2 EGFEGF是一类强效促生长因子,其功能包括促进机体胃肠道的发育、修复损伤的黏膜组织、促进营养物质的吸收与代谢。
EGF可以促进细胞的增殖,初乳中的EGF可以促进幼龄动物胃肠道的发育,促进肠壁细胞DNA、蛋白质的合成。EGF具有促进人的结肠细胞增殖和促进细胞RNA和蛋白质合成的作用[25]。体外研究证实EGF能够促进瘤胃上皮细胞增殖[26]。Bedford等[27]研究发现EGF先与细胞膜表面的特异性受体结合,将细胞外的刺激信号传入细胞内,启动转录因子,进行细胞增殖。EGF的受体为受体酪氨酸激酶(TPK),另一部分受体为GPR,2种受体共同进行信号传递。受体TPK是EGF诱导细胞增殖的关键。TPK介导的主要信号转导途径是两面神激酶(IAK)-信号传导及转录激活因子(STAT)途径和TPK-Ras-丝裂原活化蛋白激酶(MAPK)途径,GPR介导的信号途径是GPR-Ras-1/细胞周期蛋白42(cdc42)-c-Jun氨基末端激酶(JNK)途径和GPR-Ras-MAPK途径[28]。Ras鸟核苷酸酶能够将信号从上游分子传导至下游分子,MAPK属于蛋白激酶家族。张译夫等[29]研究表明,在牦牛卵丘细胞中EGF能够调节低氧诱导因子-α(HIF-α)、Bax和Bcl-2 mRNA的表达量,进而调控卵丘细胞的凋亡。Bax抑制细胞凋亡的发生,Bcl-2是一种抗凋蛋白,HIF-α通过抑制Bcl-2表达的信号途径来促进神经细胞凋亡。但在瘤胃中EGF能否通过提高HIF-α、Bax和Bcl-2 mRNA的表达量,进而调控瘤胃上皮细胞的凋亡尚未可知。EGF能够促进猪小肠中PCNA的表达[30],PCNA是一种周期蛋白,能够促进DNA的合成,从而促进细胞增殖[31],但在反刍动物瘤胃中是否有PCNA表达,EGF是否能够通过促进PCNA表达来促进瘤胃上皮细胞增殖尚不清楚。EGF同样与葡萄糖的转运密切相关,SGLT1表达上调可以促进葡萄糖的转运[32],EGF可促进断奶仔猪肠道中SGLT1的表达,进而促进葡萄糖的转运[33]。已有研究证实瘤胃中存在SGLT1的表达且瘤胃中葡萄糖以SGLT1介导吸收[34],但瘤胃中EGF对SGLT1表达的调控尚未见报道。
2.3 NHENHE存在于所有的真核生物细胞中,是一种跨膜蛋白,迄今为止,NHE家族共发现有10种构型,分别命名为NHE-1~10。NHE具有调节细胞内的pH、稳定细胞的容量、影响离子的转运以及细胞的增殖与凋亡的功能。Na+与H+的等比例交换需要借助NHE,细胞外的Na+经NHE与细胞内的H+进行交换[35](如图 2所示)。通过NHE能够调节细胞内pH的动态平衡。研究发现,NHE之所以能够调节细胞的增殖可能与其调控细胞周期有关,NHE-1的激活促使细胞快速通过G2/M期,而缺少NHE-1的细胞S期出现显著延迟,细胞分裂停滞[36]。细胞中代谢酶的最适pH偏碱性,NHE活化会导致细胞内偏碱性,使代谢酶的活性增强[37],细胞增殖的关健因素如蛋白质、DNA和RNA合成在pH偏碱时增加,引起细胞增殖活跃,Na+/H+ ATP酶(Na+/H+ ATPase)与细胞的增殖有关。目前,NHE-1在肿瘤的研究中较多,刘剑等[38]在体外研究中表明,NHE-1与食管癌KYSE-70细胞增殖有关。近几年,NHE-1在反刍动物前胃中的研究成为了热点,NHE-1在反刍动物瘤胃中高度表达[39],反刍动物瘤胃上皮细胞通过NHE-1泵出H+导致细胞内偏碱性,细胞内偏碱性利于化学反应的进行,细胞增殖加快。饲养方式会影响Na+/H+ ATPase基因的表达,通过提高酶的活性加速细胞的增殖。饲粮中精料比例提高时,VFA含量提高,瘤胃液pH下降,VFA含量和pH调控NHE-1和NHE-3的表达[40],但对NHE-2的表达无显著影响,猜测可能是其他因素调控了NHE-2的表达[41],具体原因还需要进一步探索。在大鼠上的研究表明,阻断NHE-1后,PCNA的表达量显著减少[42],但在反刍动物瘤胃上皮细胞中,PCNA是否表达、NHE-1是否影响PCNA的表达尚待揭示。NHE-1调控瘤胃上皮细胞增殖的分子机制尚未完全清楚,有待于进一步研究。
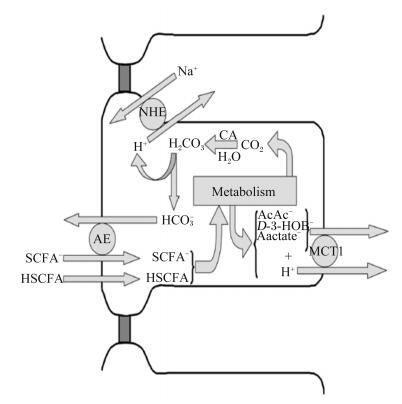
|
NHE:钠氢交换蛋白sodium hydrogen exchanger;CA:碳酸酐酶carbonic anhydrase;AE:阳阴离子交换蛋白anion exchanger;D-3-HOB-:D-羟基丁酸的离子形式ionized D-3-hydroxybutyrate;lactate-:乳酸的离子形式;MCT1:单羧酸转运载体1 monocarboxylate transporters-1;SCFA:短链脂肪酸short chain fatty acids;HSCFA:短链脂肪酸的质子化形式protonated short chain fatty acids;SCFA-:短链脂肪酸的离子形式ionized short chain fatty acids。 图 2 NHE与MCT转运SCFA示意图 Figure 2 The sketch map of NHE and MCT transporting SCFA[35] |
MCTs属于单羧酸转运家族,是哺乳动物细胞膜上负责跨膜转运的蛋白。迄今为止,单羧酸转运家族共发现14个成员,只有MCT1、MCT2、MCT4具有单羧酸转运功能[39]。目前对MCTs的研究集中在人类和单胃动物上,在人类肿瘤的研究中,正常的细胞由于大量的乳酸、丙酸等代谢产物积聚,抑制了细胞的增长,而肿瘤细胞则无此现象。Alves等[43]发现MCTs在肿瘤细胞中大量表达,其功能主要是参与乳酸等的转运。MCTs促进肿瘤细胞增殖的具体分子机制可能与MCTs转运乳酸和丙酮酸,防止乳酸在肿瘤细胞中积累,促进肿瘤细胞生存有关。
研究证实,在反刍动物瘤胃上皮中同样存在MCT1和MCT4的表达[43],MCT1主要位于瘤胃上皮的基底层和棘层细胞中,MCT4主要位于角质层与颗粒层细胞中。MCT对于反刍动物瘤胃VFA的转运来说尤为重要,VFA是反刍动物主要的能量来源。在瘤胃中VFA的吸收分2个过程:1) 瘤胃中VFA通过上皮细胞膜而摄入;2) VFA在基底面通过上皮细胞膜而排出。VFA经由不同的途径进入瘤胃上皮细胞,瘤胃VFA的运输模式如下:在低pH条件下,VFA与质子耦合经被动扩散穿过细胞膜。吸收率由角质层顶膜处的pH决定,在高pH条件下离子共转运载体MCT1以1 : 1方式共转运H+和单羧酸阴离子[44](如图 2所示)。SCFA能够促进瘤胃发育已被广泛证实[45],提示SCFA可能通过特定的信号通路促进了MCT1的表达,进而促进瘤胃的发育。饲粮中精料比例由10%增加到35%时,山羊瘤胃上皮中MCT1、MCT4表达量显著提高[46]。由于精料比例的提高,瘤胃内pH下降、SCFA含量升高,体内试验表明pH与SCFA含量共同调控MCT1和MCT4的表达,但体外试验显示pH与SCFA含量对MCT4的表达无显著影响[43],因此饲粮对于MCT4表达的调控还有待于进一步研究。
2.5 GPRGPR是当前研究生命活动最活跃的领域之一。GPR存在于细胞表面和GTP结合蛋白偶联,与细胞外多种配体相结合从而调控多种生理反应。VFA对于反刍动物来说是重要的能量来源,其中GPR41和GPR43是目前为止被证实的2种仅有的特异性SCFA的受体。孤儿G蛋白偶联受体(尚未确定其特异性天然配体的G蛋白偶联受体)GPR41和GPR43能被丙酸等SCFA激活[47]。GPR41和GPR43能够感知消化道内的脂肪酸,将小鼠GPR41基因敲除,小鼠肠道脂肪酸吸收减少,而去除肠道微生物,GPR41基因敲除的小鼠与正常小鼠体重无显著差异,这说明GPR41调控作用通过肠道微生物发酵产生SCFA来激活[48]。GPR41和GPR43与MAPK信号途径密切相关,MAPK包括了应激活化蛋白激酶p38、蛋白激酶JNK和ERK。MAPK是一条重要的信号传导通路,调控细胞的分化、增殖,主要负责磷酸化和下调抗凋亡蛋白Bcl-XL的表达。研究发现,MCT1与GPR41和GPR43的表达部位相吻合[49],GPR41和GPR43可能通过类似的通路来调节MCT1,提示GPR41和GPR43可能通过对MCT1的调控来发挥功能。此外,GPR41影响细胞周期,参与细胞由G1期向S期转变过程[50]。近几年,GPR41和GPR43成为了反刍动物瘤胃发育方面的研究热点,瘤胃上皮也有GPR41和GPR43的表达,最新研究发现,GPR43存在于牛的瘤胃上皮,而不是胰岛,瘤胃中产生VFA,GPR41和GPR43可感知VFA,为VFA作为信号分子直接介导瘤胃上皮细胞增殖提供了理论依据[51]。
近几年,饲粮因素对GPR41和GPR43表达的影响引起了人们的广泛关注,高精料饲粮促进丁酸产生且促进了GPR43的表达,进而促进瘤胃上皮细胞的增殖[24]。丁酸是基因转录的调节因子,猜想丁酸可能活化了MAPK,通过下调抗凋亡蛋白Bcl-XL的表达进而促进细胞增殖,高精料饲粮促进GPR43的表达机制还需进一步研究证实。目前,GPR41和GPR43对瘤胃上皮细胞增殖的具体调控机制尚待揭示,且饲粮营养水平和饲养制度对于GPR41和GPR43表达的影响研究甚少,这对于反刍动物瘤胃发育研究来说,是一个很好的出发点。
3 小结近10年,瘤胃发育一直是反刍动物营养研究的热点,目前研究主要集中于IGF、NHE、EGF、MCTs和GPR调控瘤胃上皮细胞增殖和物质转运的分子机制,大量的研究也表明饲粮营养水平和饲养制度能够影响上述基因的表达。在IGF的研究中,IGFBP家族对于上皮细胞增殖的调控是一个值得研究的点。在NHE和EGF的研究中,PCNA是否在反刍动物瘤胃上皮细胞中表达,EGF与NHE-1是否影响PCNA的表达尚待揭示。在反刍动物上,对GPR的研究才刚刚开始,GPR41和GPR43具体的调控机制尚不清楚,从饲粮营养水平和饲养制度影响GPR41和GPR43的表达出发进行反刍动物瘤胃发育研究,可能是一个突破点。目前对MCTs的研究主要集中在单胃动物上,其调控细胞增殖的具体机制尚未完全清楚,且反刍动物是否与单胃动物具有相同的调控机制还有待揭示。MCTs在反刍动物体内与SCFA的转运密切相关,SCFA又是反刍动物的主要能量来源,研究也证明SCFA能够促进瘤胃上皮细胞的增殖,所以从MCTs作为切入点,深入地研究SCFA在瘤胃上皮细胞的转运及促进瘤胃上皮细胞增殖的机制对反刍动物营养研究具有重要的意义。
| [1] | 韩正康, 陈杰. 反刍动物瘤胃的消化和代谢[M]. 北京: 科学出版社, 1988. |
| [2] | STUMPFF F, GEORGI M I, MUNDHENK L, et al. Sheep rumen and omasum primary cultures and source epithelia:barrier function aligns with expression of tight junction proteins[J]. Journal of Experimental Biology, 2011, 214(17): 2871–2882. DOI: 10.1242/jeb.055582 |
| [3] | KIM M, MORRISON M, YU Z T. Status of the phylogenetic diversity census of ruminal microbiomes[J]. FEMS Microbiology Ecology, 2011, 76(1): 49–63. DOI: 10.1111/fem.2011.76.issue-1 |
| [4] | WANG Z, ELEKWACHI C, JIAO J Z, et al. Changes in metabolically active bacterial community during rumen development, and their alteration by rhubarb root powder revealed by 16S rRNA amplicon sequencing[J]. Frontiers in Microbiology, 2017, 8: 159. |
| [5] | BALDWIN R L. Use of isolated ruminal epithelial cells in the study of rumen metabolism[J]. Journal of Nutrition, 1998, 128(2): 293S–296S. |
| [6] | NOCEK J E, HERBEIN J H, POLAN C E. Influence of ration physical form, ruminal degradable nitrogen and age on rumen epithelial propionate and acetate transport and some enzymatic activities[J]. Journal of Nutrition, 1980, 110(12): 2355–2364. |
| [7] | PENNER G B, STEELE M A, ASCHENBACH J R, et al. Ruminant Nutrition Symposium:molecular adaptation of ruminal epithelia to highly fermentable diets[J]. Journal of Animal Science, 2010, 89(4): 1108–1119. |
| [8] | LANE M A, BALDWIN R L, JESSE B W. Developmental changes in ketogenic enzyme gene expression during sheep rumen development[J]. Journal of Animal Science, 2002, 80(6): 1538–1544. DOI: 10.2527/2002.8061538x |
| [9] | SAMANI A A, YAKAR S, LEROITH D, et al. The role of the IGF system in cancer growth and metastasis:overview and recent insights[J]. Endocr Rev, 2007, 28(1): 20–47. DOI: 10.1210/er.2006-0001 |
| [10] | STEIN G S, STEIN J L, LIAN J B. Cell cycle and growth control[J]. Journal of Cellular Biochemistry, 1994, 54(4): 373–374. DOI: 10.1002/(ISSN)1097-4644 |
| [11] | HEMATULIN A, SAGAN D, ECKARDT-SCHUPP F, et al. NBS1 is required for IGF-1 induced cellular proliferation through the Ras/Raf/MEK/ERK cascade[J]. Cellular Signalling, 2008, 20(12): 2276–2285. DOI: 10.1016/j.cellsig.2008.08.017 |
| [12] | LU J, ZHAO H, XU J, et al. Elevated cyclin D1 expression is governed by plasma IGF-1 through Ras/Raf/MEK/ERK pathway in rumen epithelium of goats supplying a high metabolizable energy diet[J]. Journal of Animal Physiology and Animal Nutrition, 2013, 97(6): 1170–1178. DOI: 10.1111/jpn.2013.97.issue-6 |
| [13] | REN W, ZHAO F F, ZHANG A Z, et al. Gastrointestinal tract development in fattening lambs fed diets with different amylose to amylopectin ratios[J]. Canadian Journal of Animal Science, 2016, 96(3): 425–433. DOI: 10.1139/cjas-2015-0165 |
| [14] | 祝兴林, 王哲, 夏成, 等. 胰岛素受体mRNA在新生犊牛组织中的表达[J]. 中国兽医科学, 2005, 35(10) :786–789. |
| [15] | 侯明. 纤维分解酶、异丁酸及其混合物对犊牛瘤胃发育的影响[D]. 太谷: 山西农业大学, 2014. http://www.cqvip.com/QK/98510X/201509/666190995.html |
| [16] | BAXTER R C. Signalling pathways involved in antiproliferative effects of IGFBP-3:a review[J]. Molecular Pathology, 2001, 54(54): 145–148. |
| [17] | STEELE M A, CROOM J, KAHLER M, et al. Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J]. Regulatory, Integrative and Comparative Physiology, 2011, 300(6): R1515–R1523. DOI: 10.1152/ajpregu.00120.2010 |
| [18] | 翁秀秀. 饲喂不同日粮奶牛瘤胃发酵和VFA吸收特性及其相关基因表达的研究[D]. 博士学位论文. 兰州: 甘肃农业大学, 2013. |
| [19] | 赵勐. 日粮中性洗涤纤维和淀粉比例调控奶牛乳成分合成与瘤胃代谢机制研究[D]. 北京: 中国农业科学院, 2015. |
| [20] | STEELE M A, SCHIESTEL C, ALZAHAL O, et al. The periparturient period is associated with structural and transcriptomic adaptations of rumen papillae in dairy cattle[J]. Journal of Dairy Science, 2015, 98(4): 2583–2595. DOI: 10.3168/jds.2014-8640 |
| [21] | 刘婷, 李发弟, 李冲, 等. 断奶时间对不同日龄湖羊羔羊瘤胃形态及表皮生长相关基因表达的影响[J]. 动物营养学报, 2016, 28(5) :1384–1393. |
| [22] | 任宏政. 葡萄糖转运蛋白1在食管癌组织中的表达及其与IGF-1表达关系的研究[D]. 郑州: 郑州大学, 2005. |
| [23] | 吴红霞. Glut-1和IGF-1R蛋白在乳腺浸润性癌中的表达及临床意义[J]. 山西医科大学学报, 2016, 47(4) :329–332. |
| [24] | ADER P, BLÖCK M, PIETZSCH S, et al. Interaction of quercetin glucosides with the intestinal sodium/glucose co-transporter (SGLT-1)[J]. Cancer Letters, 2001, 162(2): 175–180. DOI: 10.1016/S0304-3835(00)00645-5 |
| [25] | CHANG C J, CHAO J C J. Effect of human milk and epidermal growth factor on growth of human intestinal Caco-2 cells[J]. Journal of Pediatric Gastroenterology and Nutrition, 2002, 34(4): 394–401. DOI: 10.1097/00005176-200204000-00015 |
| [26] | 卢劲晔. 日粮能量水平对山羊瘤胃上皮生长的影响及机理研究[D]. 南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013282659.htm |
| [27] | BEDFORD A, TAO C, HUYNH E, et al. Epidermal growth factor containing culture supernatant enhances intestine development of early-weaned pigs in vivo:potential mechanisms involved[J]. Journal of Biotechnology, 2015, 196/197: 9–19. DOI: 10.1016/j.jbiotec.2015.01.007 |
| [28] | 崔志新, 崔彦博, 唐燕红, 等. 表皮生长因子对表皮细胞增殖和凋亡的调控作用[J]. 食品与药品, 2005, 7(11) :15–19. DOI: 10.3969/j.issn.1672-979X.2005.11.005 |
| [29] | 张译夫, 潘阳阳, 温泽星, 等. 表皮生长因子对牦牛卵丘细胞低氧诱导因子-1α表达的影响及与凋亡的关联性分析[J]. 畜牧兽医学报, 2016, 47(6) :1154–1161. |
| [30] | 槐玉英, 梁梓森, 纪少丽, 等. 重组表皮生长因子对仔猪小肠上皮细胞增殖活性的影响[J]. 畜牧与兽医, 2016, 48(4) :70–75. |
| [31] | TOUEILLE M, SAINT-JEAN B, CASTROVIEJO M, et al. The elongation factor 1A:a novel regulator in the DNA replication/repair protein network in wheat cells?[J]. Plant Physiology & Biochemistry, 2007, 45(2): 113–118. |
| [32] | PUTNEY L K, BARBER D L. Na-H exchange-dependent increase in intracellular pH times G2/M entry and transition[J]. Journal of Biological Chemistry, 2003, 278(45): 44645–44649. DOI: 10.1074/jbc.M308099200 |
| [33] | SONG X Z, XU J Q, WANG T, et al. Traditional Chinese medicine decoction enhances growth performance and intestinal glucose absorption in heat stressed pigs by up-regulating the expressions of SGLT1 and GLUT2 mRNA[J]. Livestock Science, 2010, 128(1/2/3): 75–81. |
| [34] | ASCHENBACH J R, BHATIA S K, PFANNKUCHE H, et al. Glucose is absorbed in a sodium-dependent manner from forestomach contents of sheep[J]. Journal of Nutrition, 2000, 130(11): 2797–2801. |
| [35] | GÄBEL G, ASCHENBACH J R, MVLLER F. Transfer of energy substrates across the ruminal epithelium:implications and limitations[J]. Animal Health Research Reviews, 2002, 3(1): 15–30. DOI: 10.1079/AHRR200237 |
| [36] | XU S, WANG D, ZHANG P, et al. Oral administration of Lactococcus lactis-expressed recombinant porcine epidermal growth factor stimulates the development and promotes the health of small intestines in early-weaned piglets[J]. Journal of Applied Microbiology, 2015, 119(1): 225–235. DOI: 10.1111/jam.2015.119.issue-1 |
| [37] | MCLEAN L A, ROSCOE J, JØRGENSEN N K, et al. Malignant gliomas display altered pH regulation by NHE-1 compared with nontransformed astrocytes[J]. American Journal of Physiology:Cell Physiology, 2000, 278(4): C676–C688. |
| [38] | 刘剑, 王峰, 何炜, 等. 钠氢交换蛋白1基因在体外对食管癌KYSE-70细胞增殖和侵袭作用的影响[J]. 肿瘤, 2013, 33(2) :126–131. DOI: 10.3781/j.issn.1000-7431.2013.02.004 |
| [39] | GRAHAM C, GATHERAR I, HASLAM I, et al. Expression and localization of monocarboxylate transporters and sodium/proton exchangers in bovine rumen epithelium[J]. Regulatory Integrative and Comparative Physiology, 2007, 292(2): R997–R1007. |
| [40] | CASTAÑEDA-CORRAL G, ROCHA-GONZÁLEZ H I, ARAIZA-SALDAÑA C I, et al. Blockade of peripheral and spinal Na+/H+ exchanger increases formalin-induced long-lasting mechanical allodynia and hyperalgesia in rats[J]. Brain Research, 2012, 1475: 19–30. DOI: 10.1016/j.brainres.2012.08.001 |
| [41] | 闫磊. 日粮精料水平对瘤胃上皮SCFA吸收相关载体表达的影响及其机理研究[D]. 南京: 南京农业大学, 2014. http://www.doc88.com/p-9793175135633.html |
| [42] | 胡从智. 钠氢交换体NHE1在高盐诱导血管平滑肌细胞增殖和钙离子调控中的作用[D]. 遵义: 遵义医学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10661-1016760936.htm |
| [43] | ALVES V A, PINHEIRO C, MORAIS-SANTOS F, et al. Characterization of monocarboxylate transporter activity in hepatocellular carcinoma[J]. World Journal of Gastroenterology, 2014, 20(33): 11780–11787. DOI: 10.3748/wjg.v20.i33.11780 |
| [44] | 石彩叶. 异丁酸对犊牛瘤胃及小肠黏膜组织形态和功能基因表达的影响[D]. 晋中: 山西农业大学, 2013. http://www.cnki.com.cn/Article/CJFDTOTAL-DWYX201508021.htm |
| [45] | LAARMAN A H, DIONISSOPOULOS L, ALZAHAL O, et al.Effects of butyrate during subacute ruminal acidosis on vfa transport capacity in the rumen epithelium of Holstein dairy cows[C]//Proceedings of 2004 ADSA-ASAS-CSAS Joint Annual Meeting.Kansas City, Mo:JAM, 2014. |
| [46] | YAN L, ZHANG B, SHEN Z M. Dietary modulation of the expression of genes involved in short-chain fatty acid absorption in the rumen epithelium is related to short-chain fatty acid concentration and pH in the rumen of goats[J]. Journal of Dairy Science, 2014, 97(9): 5668–5675. DOI: 10.3168/jds.2013-7807 |
| [47] | BROWN A J, GOLDSWORTHY S M, BARNES A A, et al. The orphan g protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids[J]. Journal of Biological Chemistry, 2003, 278(13): 11312–11319. DOI: 10.1074/jbc.M211609200 |
| [48] | SAMUEL B S, SHAITO A, MOTOIKE T, et al. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, GPR41[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(43): 16767–16772. DOI: 10.1073/pnas.0808567105 |
| [49] | 孙雨婷, 罗军, 朱江江, 等. 奶山羊短链脂肪酸受体GPR41基因的克隆及组织表达分析[J]. 畜牧兽医学报, 2012, 43(2) :319–323. |
| [50] | 吴瑨. GPR41受体在组蛋白乙酰化过程中的作用及其功能研究[D]. 上海: 华东师范大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10269-1012488346.htm |
| [51] | WANG A, AKERS R M, JIANG H. Short communication:presence of G protein-coupled receptor 43 in rumen epithelium but not in the islets of Langerhans in cattle[J]. Journal of Dairy Science, 2012, 95(3): 1371–1375. DOI: 10.3168/jds.2011-4886 |




