瘤胃微生物蛋白质(MCP)是反刍动物的主要氮素来源之一,能提供蛋白质需要量的40%~80%,其合成量的高低可以反映瘤胃中微生物的数量和微生物蛋白质合成的效率[1],并且与瘤胃对氮源的有效利用有关[2]。瘤胃原虫对细菌的吞噬和消化所导致的瘤胃内氮循环无疑降低了氮的利用效率[3-5]。因此,原虫被认为是瘤胃氮代谢效率低的主要原因之一。研究表明,去原虫有利于尿素氮向瘤胃的转运[6],降低瘤胃内氮循环,利于细菌蛋白质的合成[7]。而油脂和脂肪酸作为反刍动物的很好的能量补充物,对原虫的生长有负效应[8],能够促进瘤胃微生物蛋白质的合成,降低瘤胃内氮循环[9-10]。有报道称富含十八碳脂肪酸的植物油脂可以减少甲烷的产生,改善瘤胃发酵环境[11-12];并且,有研究表明体外培养条件下添加植物油脂对培养液酶活力、微生物活力[13]、瘤胃原虫数量、细菌蛋白质及DNA含量[14]都有一定的影响。目前,不少研究报道明确指出不饱和脂肪酸对瘤胃原虫和细菌的负面作用与其不饱和度有关[15-16],但不饱和度对原虫吞噬细菌活力和原虫群体结构影响的规律尚不得而知。本试验选取6种不同不饱和度的长链脂肪酸,分别为硬脂酸、油酸、亚油酸、亚麻油酸、花生四烯酸和二十碳五烯酸,其不饱和键个数从0~5依次递增,拟系统地研究长链脂肪酸的不饱和度对瘤胃原虫群体结构和原虫吞噬细菌循环的影响规律,为降低瘤胃原虫吞噬细菌循环过程中氮损失和提高饲粮中氮素利用效率提供参考资料。
1 材料与方法 1.1 试验动物与饲养管理取3头1.5周岁、体重(29.4±2.7)kg、装有永久性瘤胃瘘管的萨能奶山羊,单圈饲养,以玉米+豆粕+羊草为基础饲粮,精粗比为2:8,每日按体重的2.5%干物质量供料,在每天07:00、19:00分2次等量饲喂,自由饮水。
1.2 试验设计与体外培养底物配制6种体外培养底物,这6种体外培养底物中添加的长链脂肪酸分别为硬脂酸(A组)、油酸(B组)、亚油酸(C组)、α-亚麻油酸(D组)、花生四烯酸(E组)、二十碳五烯酸(F组),脂肪酸的添加水平为培养底物的3%。体外培养底物组成见表 1。硬脂酸(Cat# 21-12-8)、油酸(Cat# 112-80-1)、亚油酸(Cat# 60-33-3)、α-亚麻油酸(Cat# 463-40-1)和花生四烯酸(Cat# 506-32-1)均购自北京北灵威化学技术有限公司,纯度≥99.0%;二十碳五烯酸(Cat# 10417-94-4)购自上海柯维化学技术有限公司,纯度≥99.0%;木聚糖(Cat# 9014-63-5)、阿拉伯聚糖(Cat# 87-72-9)、葡聚糖(Cat# 9004-54-0)、甘露聚糖(Cat# 9036-88-8)、果胶(Cat# 9000-69-5)和木质素(Cat# 8061-51-6)购自美国Sigma公司,纯度≥99.0%;纤维二糖(Cat# 528-50-7)、可溶性淀粉(Cat# 9005-84-9)购自国药集团化学试剂公司,纯度≥99.0%;尿素(Cat# 57-13-6)购自北京惠宝联化科技有限公司,纯度≥99.0%;酪蛋白(Cat# 9000-71-9)购自北京索莱宝科技有限公司,纯度≥99.0%。
|
|
表 1 体外培养底物组成(风干基础) Table 1 Composition of in vitro culture substrates (air-dry basis) |
体外培养试验参照Menke等[17]的方法,在底物和培养液的配制量上略做修改,具体操作如下:晨饲前通过瘤胃瘘管从3头瘘管山羊瘤胃采集瘤胃液,按人工唾液盐:瘤胃液=2:1配制好培养液,通CO2 39 ℃水浴预热备用。准确称取各组1.50 g培养底物置于250 mL的三角瓶中,分别加入150 mL培养液,通CO2 39 ℃ 50 r/min振荡培养。每组各设3个重复。在培养10 h后进行原虫吞噬细菌试验,培养24 h后结束,取20 mL培养液分装于2个离心管,一部分用于细菌和原虫数量的测定,一部分用于细菌蛋白质和原虫蛋白质含量的测定。
1.4 瘤胃微生物计数 1.4.1 细菌计数以2%结晶紫溶液(2 g结晶紫溶于10 mL 95%乙醇和90 mL 0.8%草酸铵溶液)进行染色,用16×25血球计数板在显微镜(奥林巴斯CKX41,日本)(1 000×)下计数。细菌数量计算公式如下:
细菌密度(cells/mL)=N/S×D×16×10×1 000=N/S×D×16×104。
式中:N为计数方格的总数;S为计数方格数;D为稀释倍数。
1.4.2 原虫计数参考卢德勋等[18]和Nsabimana等[19]的方法对瘤胃原虫染色计数。以MFS染液(氯化钠8 g、甲基绿0.6 g、福尔马林溶液100 mL,定容至1 000 mL)染色,用16×25血球计数板在显微镜(奥林巴斯CKX41,日本)(1 000×)下计数。原虫数量计算公式如下:
原虫密度(cells/mL)=N/4×D×16×10×1 000=N×D×4×104。
式中:N为计数4个中方格的总数;D为稀释倍数。
1.4.3 原虫种属鉴定及计数通过形态学观察对原虫鉴定到属的水平,计数方法同上。
1.5 细菌粗蛋白质和原虫粗蛋白质含量的测定取培养液加等体积生理盐水39 ℃水浴振荡(125 r/min)培养60 min,并辅以搅拌;再经4层纱布过滤,滤液离心(150×g,10 min),收集沉淀为原虫,用生理盐水洗涤2次后用生理盐水悬浮,-20 ℃贮存待测。滤液离心后的上清液再经过冷冻高速离心(22 000×g,15 min),收集沉淀为细菌。将收集的细菌和原虫分开制成冻干样品,然后用全量凯氏定氮法测定粗蛋白质含量,用于计算培养液中细菌蛋白质和原虫蛋白质的含量。
1.6 原虫吞噬细菌试验 1.6.1 无菌瘤胃液与荧光标记瘤胃细菌(fluorescence-labeled rumen bacteria,FLRB)的制备无菌瘤胃液的制备:采集瘤胃液,过2 μm滤膜,滤液离心(22 000×g,15 min),收集沉淀,用灭菌生理盐水清洗和离心各2遍,然后悬浸于灭菌生理盐水中。
FLRB的制备:将制备的无菌瘤胃液加1.5 mL三氯三嗪基氨基荧光素(DTAF)染色,60 ℃水浴2 h;离心(22 000×g,15 min),将上层DTAF溶液倒出,再用灭菌生理盐水洗涤和离心各3遍;之后悬浸于与取样同体积的灭菌生理盐水中,-20 ℃保存。-20 ℃保存的FLRB在使用时解冻并离心(22 000×g,15 min)后,用对应的无菌瘤胃液悬浸制成2倍浓度的FLRB悬液。
1.6.2 原虫吞噬细菌试验方法按照参考文献[20]的方法,略改动,具体步骤如下:1) 按试验设计同时制备2份培养底物,一份不加培养液备用,另外一份按上述体外培养试验方法进行体外培养;2) FLRB解冻后离心,加入1/2体积的无菌瘤胃液,加入适量备用底物,置水浴锅(39 ℃);3) 在体外培养进行至10 h时,取与标记菌同体积的培养液分离原虫,用1/2体积的无菌瘤胃液悬浸;4) 合并原虫与标记菌培养液进行吞噬试验;5) 每5 min取培养液制切片,连续取5次,用倒置荧光显微镜(奥林巴斯CKX41,日本)检测虫体内FLRB的数量,每组3个重复,每片以12个原虫平均值计。
1.6.3 瘤胃细菌和原虫之间氮循环相关指标计算根据原虫吞噬细菌速率和原虫密度可以得到原虫吞噬细菌量,再结合细菌密度可以计算出由于原虫吞噬造成的细菌周转时间和周转率,计算公式如下:
吞噬细菌量[cells/(mL·h)]=吞噬细菌速率×原虫密度;
细菌周转时间(h)=细菌密度/吞噬细菌量;
细菌周转率(%)=吞噬细菌量/细菌密度。
参考Sherr等[21]、李洪波等[22]、王家玲等[23]的报道可知,荧光标记细菌(fluorescence-labeled bacteria,FLB)的平均体积为0.10 μm3,换算为氮的系数是0.054 pg/μm3,因此得到原虫在瘤胃内循环中对细菌氮的吞噬速率,计算公式如下:
吞噬细菌氮速率[pg/(cell·h)]=原虫吞噬速率×0.054。
根据吞噬细菌氮速率和原虫密度,推算出每只山羊每天瘤胃内由于原虫吞噬而产生的氮循环量(山羊瘤胃体积按4 L计),同时,可以通过瘤胃氮循环量换算出瘤胃细菌蛋白质循环量。
氮循环量[mg/(d·头)]=吞噬氮速率×原虫密度×4×24×10-9;
细菌蛋白质循环量[mg/(d·头)] =氮循环量×6.25。
1.7 统计分析采用SPSS 13.0软件的Regression的Curve Estimation过程进行回归分析,并采用单因素方差分析(one-way ANOVA)进行方差分析和Tukey’s多重比较。以P<0.05作为差异显著性判断标准。
2 结果 2.1 不同长链脂肪酸对原虫蛋白质、细菌蛋白质含量的影响由表 2可知,原虫蛋白质含量以A组最高,为0.591 mg/mL,显著高于C、D、E组(P<0.05),A组与B、F组之间差异不显著(P>0.05)。原虫蛋白质含量的排序为A组>B组>F组>E组>D组>C组。细菌蛋白质含量以A组最低,为0.123 mg/mL,以D组最高,为0.285 mg/mL,D组显著高于A、B、E、F组(P<0.05),但与C组差异不显著(P>0.05)。
|
|
表 2 不同长链脂肪酸对原虫蛋白质、细菌蛋白质含量以及原虫、细菌密度的影响 Table 2 Effects of different long-chain fatty acids on protozoal protein and bacterial protein contents, protozoal and bacterial densities |
由表 2可知,原虫密度以A组最高,为2.691×105 cells/mL,以B组最低,为1.714×105 cells/mL,A组显著高于B组(P<0.05),A、C、D、E、F组之间差异不显著(P>0.05)。细菌密度以D组最高,为5.752×109 cells/mL,以A组最低,为4.728×109 cells/mL,D组显著高于A、B、E、F组(P<0.05),但与C组差异不显著(P>0.05)。
2.3 不同长链脂肪酸对各属原虫比例的影响由表 3可知,头毛虫属(Ophryoscolecinae)比例以F组最高(5.318%),显著高于B和D组(P<0.05),同时,头毛虫属也是原虫所鉴定出的属中含量最少的属;体外添加不同长链脂肪酸对厚毛虫属(Dasytricharuminantium)、内纤毛虫属(Entodinium)、双毛虫属(Diplodiniinae)、等毛虫属(Isotrichidae)、前毛虫属(Epidinium)比例的影响均不显著(P>0.05),厚毛虫属以C组最高(13.836%),A组最低(10.734%);内纤毛虫属以C组最高(32.536%),B组最低(30.825%);双毛虫属以E组最高(14.380%),F组最低(10.765%);等毛虫属以A组最高(18.091%),F组最低(14.875%);前毛虫属以A组最高(15.394%),C组最低(10.724 %)。
|
|
表 3 不同长链脂肪酸对各属原虫比例的影响 Table 3 Effects of different long-chain fatty acids on protozoal percentage of each genus |
由图 1可知,原虫吞噬细菌量随着吞噬试验时间的推移而逐渐增长,各组整体增长趋势基本一致。在0~15 min内,原虫吞噬细菌量增长较为迅速,而35 min后各组的涨势逐渐趋于平缓。所以,0~35 min内原虫吞噬细菌量随时间变化的结果可以比较可靠地用作线性回归分析来计算原虫吞噬细菌速率。
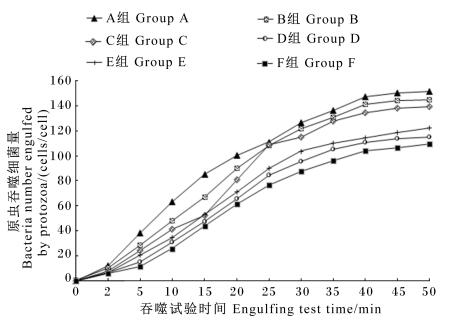
|
图 1 原虫吞噬细菌量随吞噬试验时间的变化 Figure 1 Change of bacteria number engulfed by protozoa with time of engulfing test |
各组原虫对FLRB的吞噬量(Y, cells/cell)与吞噬试验时间(X, min)进行线性回归分析,各组拟合后得出的回归方程:A组,Y=14.192+3.838X(R2=0.98;P<0.001;n=9);B组,Y=6.774+3.829X(R2=0.99;P<0.001;n=9);C组,Y=2.202+3.790X(R2=0.99;P<0.001;n=9);D组,Y=0.522+3.142X(R2=0.99;P<0.001;n=9);E组,Y=2.333+3.303X(R2=0.99;P<0.001;n=9);F组,Y=-0.597+2.914X(R2=0.99;P<0.001;n=9)。以上方程的R2都在0.98以上,表明线性关系良好、结果可靠。
据回归方程计算的原虫吞噬细菌速率(表 3),A~F组依次为244.50、236.51、229.60、189.04、200.51、174.24 cells/(cell·h),以A组(硬脂酸)最高,F组(二十碳五烯酸)最低,基本随不饱和键数量的增加而降低,但花生四烯酸较α-亚麻油酸为高。以换算系数换算得出原虫吞噬细菌氮速率,A~F组依次为1.32、1.28、1.24、1.02、1.08、0.94 pg/(cell·h)。
2.5 不同长链脂肪酸对细菌和原虫之间氮循环的影响根据原虫密度和原虫吞噬细菌速率可以计算得到原虫吞噬细菌量(表 4),以A组最高,为657.95×105 cells/(mL·h),以D组最低,为391.50×105 cells/(mL·h)。据细菌密度和原虫吞噬细菌量计算出由于原虫吞噬造成的细菌周转时间和周转率(表 4),以D组细菌周转率最低,为0.68%,其周转时间为146.92 h(每小时约有0.68%的细菌被原虫吞噬,原虫吞噬经过146.92 h细菌可周转更新一轮);以A组细菌周转率最高,为1.39%,其周转时间为71.86 h;瘤胃内细菌周转率排序为D组<B组<F组<E组<C组<A组。吞噬细菌氮速率(表 4)是由原虫吞噬细菌速率换算得到的,根据吞噬细菌氮速率可以估计出每只山羊每天瘤胃内由于原虫吞噬而产生的氮循环量(表 4),A~F组依次为34.10、21.06、31.18、20.28、25.67、23.63 mg/(d·头),据此可以换算出细菌蛋白质循环量(表 4),A~F组依次为213.13、131.63、194.88、126.75、160.44、147.69 mg/(d·头)。
|
|
表 4 不同长链脂肪酸对细菌和原虫之间氮循环的影响 Table 4 Effects of different long-chain fatty acids on nitrogen recycling between bacteria and protozoa |
原虫仅能通过吞噬细菌来获得氮源,所以,原虫的存在增加了氮在瘤胃内的周转和消耗。研究表明,长链脂肪酸中的不饱和键可以抑制原虫和细菌的生长,因此部分研究学者利用原虫和细菌对脂肪酸响应的差异来抑制原虫的生长[24]。本试验中,6组中原虫密度最高的是A组,B、C、D、E、F组相比于A组分别降低了36.31%、2.68%、23.04%、7.99%、2.68%,说明不饱和脂肪酸的添加对瘤胃原虫的生长有抑制作用,且以油酸和α-亚麻油酸降低原虫密度效果较优。不饱和脂肪酸可以降低瘤胃原虫数量[5],也正是因为瘤胃原虫数量的下降使得其对细菌的吞噬作用减少,因此本试验中B、C、D、E、F组瘤胃细菌密度相较于A组均有所升高,究其原因可能是原虫对不饱和脂肪酸的响应度高于细菌,从而导致原虫活力降低的程度超过其对细菌的吞噬程度,因此在观测时间内瘤胃细菌密度升高,并且,以α-亚麻油酸组的细菌密度最高。Ivan等[25]报道称十八碳不饱和脂肪酸能够通过对瘤胃内氢气(H2)的利用达到显著抑制或毒害原虫作用。早期有研究表明,瘤胃原虫和细菌在脂肪酸的氢化过程中均起到一定作用[26-27],后来有研究证明原虫的这种氢化作用主要来自于被吞噬的细菌[28]。此外,脂肪酸对微生物的毒性作用可能与其改变微生物脂双分子层细胞膜有关[29],脂肪酸中的双键会影响原虫分子的空间结构,破坏细胞的完整性。
总体来看,除了头毛虫属,其他原虫属在各组间差异均不显著。相比于硬脂酸,其他长链脂肪酸添加有降低内纤毛虫属、等毛虫属、前毛虫属比例的趋势,这与原虫密度的结果相一致。从厚毛虫属的结果得到,其他长链脂肪酸组相比硬脂酸组有上升趋势,而在双毛虫属中,油酸、花生四烯酸组相对于硬脂酸组有上升趋势。长链脂肪酸的添加对不同种属原虫的效果不同,这种差异的产生可能与不同种属原虫对长链脂肪酸的氢化能力不同有关;另外,也可能与原虫种属间不同的繁殖速率、捕食细菌行为、对营养物质的消化利用以及对长链脂肪酸适应性有关。本试验中内纤毛虫属为原虫中优势菌属,比例占到30%~35%,这与王洪荣等[30]以及王梦芝等[31]的研究结果相一致。另外,研究表明,内纤毛虫属可以功能选择性吞噬多种细菌,每小时最大吞噬量可达4 100个[32],也正是由于对硬脂酸组拥有的内纤毛虫属比例较大,其吞噬细菌速率最快,氮循环效率最高。
3.2 体外培养条件下不同长链脂肪酸对山羊瘤胃原虫吞噬细菌循环的影响瘤胃内细菌周转率从低到高排序为α-亚麻油酸组、油酸组、二十碳五烯酸组、花生四烯酸组、亚油酸组、硬脂酸组。所以,不饱和长链脂肪酸的添加可以降低瘤胃内细菌的周转率,并以ɑ-亚麻油酸在调控瘤胃氮循环方面效果最好。从吞噬细菌氮速率来看,由于原虫吞噬能力的下降,吞噬细菌氮速率也随之减缓,本试验中吞噬细菌氮速率的高低排序为硬脂酸组、油酸组、亚油酸组、花生四烯酸组、α-亚麻油酸组、二十碳五烯酸组,各组相比于硬脂酸组均有所下降,而硬脂酸组之所以不能降低原虫吞噬细菌氮速率原因可能是因为硬脂酸为饱和脂肪酸,对瘤胃微生物的毒害作用极少或没有,这与Wallace等[24]指出的十八碳脂肪酸对瘤胃细菌的负面作用没有显著影响相一致。Oldick等[33]报道称增加不饱和脂肪酸的不饱和度可以使瘤胃原虫数量直线下降,因此,本试验中二十碳五烯酸之所以降低原虫吞噬细菌氮速率效果最好可能是因为其不饱和程度在6种长链脂肪酸中最高(含有5个不饱和键)。各组原虫吞噬细菌氮速率的由高到低排序与其不饱和度从低到高排序的顺序基本一致,除了α-亚麻油酸在降低吞噬细菌速率上优于不饱和程度更高的花生四烯酸。原因可能与脂肪酸双键位置有关,α-亚麻油酸和二十碳五烯酸第1个不饱和键的位置均在第3个碳原子上,而花生四烯酸在第6个碳原子上。
原虫虽然有降解蛋白质的能力,但其本身不能合成蛋白质,并且原虫自溶一般可以提供十二指肠微生物蛋白的20%左右[34]。本试验中,油酸、亚油酸、α-亚麻油酸、花生四烯酸二十碳五烯酸组的原虫蛋白质含量相比于硬脂酸组分别降低了6.77%、27.75%、23.18%、19.46%、8.80%,且硬脂酸组显著高于亚油酸、α-亚麻油酸和花生四烯酸组,说明添加3%的不饱和长链脂肪酸能够降低瘤胃原虫蛋白质含量,其原因可能是因为不饱和长链脂肪酸对瘤胃原虫的负面作用,并随不饱和度的增加其效应加大[35]:一方面,不饱和长链脂肪酸抑制原虫生长,使原虫密度下降,数量减少,而原虫生物量很大程度上决定了原虫蛋白质含量,所以原虫蛋白质含量降低;另一方面,原虫本身无法合成蛋白质,原虫不能利用氮源合成自身所需要的氨基酸,只能利用微生物和饲粮中的蛋白质和肽作为主要氮源[30],而不饱和长链脂肪酸的添加会抑制原虫吞噬细菌的能力,阻碍其获得氮源,从而导致原虫蛋白质含量降低。
4 结论体外培养条件下,山羊瘤胃原虫吞噬细菌速率基本上随长链脂肪酸不饱和键数量的增加而降低,瘤胃细菌周转率以亚麻油酸组最低,为0.68%,周转时间最长,为146.92 h。综上,α-亚麻油酸抑制瘤胃原虫吞噬细菌循环效果最好。
| [1] | CARDOZO P W, CALSAMIGLIA S, FERRET A, et al. Effects of natural plant extracts on ruminal protein degradation and fermentation profiles in continuous culture[J]. Journal of Animal Science, 2004, 82(11): 3230–3236. DOI: 10.2527/2004.82113230x |
| [2] | SANTOS A B, PEREIRA M L A, SILVA H G O, et al. Nitrogen metabolism in lactating goats fed with diets containing different protein sources[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(5): 658–666. DOI: 10.5713/ajas.2013.13493 |
| [3] | COLEMAN.The interrelationship between rumen ciliate protozoa and bacteria[M]//MCDONALD I W, WARNER A C I.Digestion and metabolism in the ruminant.Armidale:University of New England Publishing Unit, 1975:149-164. |
| [4] | 王梦芝, 王洪荣, 李国祥, 等. 用荧光染色法研究山羊瘤胃原虫对细菌吞噬速率的初报[J]. 中国农业科学, 2008, 41(5) :1476–1481. |
| [5] | JOUAN J P. Effect of rumen protozoa on nitrogen utilization by ruminants:altering ruminal nitrogen metabolism to improve protein utilization[J]. The Journal of Nutrition, 1996, 126(4): 1335S–1336S. |
| [6] | FRIKINS J L, YU Z, MORRISON M. Ruminal nitrogen metabolism:perspectives for integration of microbiology and nutrition for dairy[J]. Journal of Dairy Science, 2007, 90(Suppl.1): E1–E16. |
| [7] | KOENIG K M, NEWBOLD C J, MCINTOSH F, et al. Effects of protozoa on bacterial nitrogen recycling in the rumen[J]. Journal of Animal Science, 2000, 78(9): 2431–2445. DOI: 10.2527/2000.7892431x |
| [8] | ZHANG C M, GUO Y Q, YUAN Z P, et al. Effect of octadeca carbon fatty acids on microbial fermentation, methanogenesis and microbial flora in vitro[J]. Animal Feed Science and Technology, 2008, 146(3/4): 259–269. |
| [9] | STERN M D, VARGA G A, CLARK J H, et al. Evaluation of chemical and physical properties of feeds that affect protein metabolism in the rumen[J]. Journal of Dairy Science, 1994, 77(9): 2762–2786. DOI: 10.3168/jds.S0022-0302(94)77219-2 |
| [10] | FRIKINS J L. Maximizing microbial protein synthesis in the rumen:altering ruminal nitrogen metabolism to improve protein utilization[J]. The Journal of Nutrition, 1996, 126(4): 1347S–1354S. |
| [11] | JAL Ď D, ĎEREŠÑÁKOVÁ Z. Effect of plant oils and malate on rumen fermentation in vitro[J]. Czech Journal of Animal Science, 2002, 47(3): 106–111. |
| [12] | JOHNSON K A, KINCAID R L, WESTBERG H H, et al. The effect of oilseeds in diets of lactating cows on milk production and methane emissions[J]. Journal of Dairy Science, 2002, 85(6): 1509–1515. DOI: 10.3168/jds.S0022-0302(02)74220-3 |
| [13] | 王曙, 王梦芝, 卢占军, 等. 不同植物油脂对体外培养条件下培养液酶活及微生物活力的影响[J]. 动物营养学报, 2011, 23(8) :1309–1316. |
| [14] | 拟豪杰, 钱金华, 李丹枫, 等. 不同油脂对瘤胃原虫、细菌蛋白质及DNA影响的研究[J]. 中国畜牧杂志, 2011, 47(11) :33–37. |
| [15] | JENKINS T C. Lipid metabolism in the rumen[J]. Journal of Dairy Science, 1993, 76(12): 3851–3863. DOI: 10.3168/jds.S0022-0302(93)77727-9 |
| [16] | BACH A, STERN M D. Effects of different levels of methionine and ruminally undegradable protein on the amino acid profile of effluent from continuous culture fermenters[J]. Journal of Animal Science, 1999, 77(12): 3377–3384. DOI: 10.2527/1999.77123377x |
| [17] | MENKE K H, STEINGASS H. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J]. Animal Research and Development, 1988, 28: 7–55. |
| [18] | 卢德勋, 谢崇文. 现代反刍动物营养研究方法和技术[M]. 北京: 北京农业出版社, 1991. |
| [19] | NSABIMANA E, KIŠIDAYOVÁ S, MACHEBOEUF D, et al. Two-step freezing procedure for cryopreservation of rumen ciliates, an effective tool for creation of a frozen rumen protozoa bank[J]. Applied and Environmental Microbiology, 2003, 69(7): 3826–3832. DOI: 10.1128/AEM.69.7.3826-3832.2003 |
| [20] | WANG M Z, WANG H R, LI G X, et al. The preliminary report on rumen protozoa grazing rate on bacteria with a fluorescence-labeled technique[J]. Agricultural Sciences in China, 2008, 7(6): 768–774. DOI: 10.1016/S1671-2927(08)60113-3 |
| [21] | SHERR B F, SHERR E B, FALLON R D. Use of monodispersed, fluorescently labeled bacteria to estimate in situ protozoan bacterivory[J]. Applied and Environment Microbiology, 1987, 53: 958–965. |
| [22] | 李洪波, 肖天, 赵三军, 等. 海洋异养浮游细菌参数的测定和估算[J]. 海洋科学, 2005, 29(2) :58–63. |
| [23] | 王家玲, 李顺鹏. 微生物的生长与代谢[M]//王家玲. 环境微生物学. 2版. 北京: 高等教育出版社, 2004: 45-60. |
| [24] | WALLACE R J, CHANDHARY L C, MCKAIN N, et al.Biohydrogenation of fatty acids in the Rumen:how, why and how to change it[C]//Proceedings of the 5th Joint Symposium of Japan-Korea-China on Rumen Metabolism and Physiology.2005:2-11. |
| [25] | IVAN M, MIR P S, KOENIG K M, et al. Effects of dietary sunflower seed oil on rumen protozoa population and tissue concentration of conjugated linoleic acid in sheep[J]. Small Ruminant Research, 2001, 41(3): 215–227. DOI: 10.1016/S0921-4488(01)00220-6 |
| [26] | WRIGHT D E. Hydrogenation of lipids by rumen protozoa[J]. Nature, 1959, 184(4690): 875–876. DOI: 10.1038/184875a0 |
| [27] | WRIGHT D E. Hydrogenation of chloroplast lipids by rumen bacteria[J]. Nature, 1960, 185(4712): 546–547. DOI: 10.1038/185546a0 |
| [28] | SINGH S, HAWK J C. The in vitro lipolysis and biohydrogenation of monogalactosyldigly ceride by whole rumen contents and its fractions[J]. Journal of the Science of Food and Agriculture, 1979, 30(6): 603–612. DOI: 10.1002/(ISSN)1097-0010 |
| [29] | KEWELOH H, HEIPIEPER H J. Trans unsaturated fatty acids in bacteria[J]. Lipids, 1996, 31(2): 129–137. DOI: 10.1007/BF02522611 |
| [30] | 王洪荣, 秦韬, 王超. 青蒿素对山羊瘤胃发酵和微生物氮素微循环的影响[J]. 中国农业科学, 2014, 47(24) :4904–4914. DOI: 10.3864/j.issn.0578-1752.2014.24.014 |
| [31] | 王梦芝. 山羊瘤胃原虫与细菌吞噬关系和微生物AA变化机制的研究[D]. 博士学位论文. 扬州: 扬州大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-11117-2008086933.htm |
| [32] | 张苏江. 塔里木盆地粗饲料资源研究与利用[M]. 北京: 中国农业科学技术出版社, 2013. |
| [33] | OLDICK B S, FIRKINS J L. Effects of degree of fat saturation on fiber digestion and microbial protein synthesis when diets are fed twelve times daily[J]. Journal of Animal Science, 2000, 78(9): 2412–2420. DOI: 10.2527/2000.7892412x |
| [34] | JOUANY J P, USHIDA K. The role of protozoa in feed digestion review[J]. Asian-Australasian Journal of Animal Science, 1999, 12(1): 113–128. DOI: 10.5713/ajas.1999.113 |
| [35] | DIJKSTRA J, GERRITS W J J, BANNINK A, et al.Modelling lipid metabolism in the rumen[M]//MCNAMARA J P, FRANCE J, BEEVER D E.Modelling nutrient utilization in farm animals.Egham:CABI Publishing, 2000:25-36. |




