2. 河南省动物疫病与公共卫生重点实验室, 洛阳 471023;
3. 河南省肉羊繁育工程技术研究中心, 洛阳 471023
2. Key Laboratory of Animal Disease and Public Health of Henan Province, Luoyang 471023, China;
3. Research Center of Breeding Engineering Technology for Meat Sheep of Henan Province, Luoyang 471023, China
纤维素是一种由800~1 200个葡萄糖分子聚合而成的高分子化合物,是世界上最丰富的可再生有机资源。我国是农业大国,农作物秸秆产量约占世界的20%[1-2],由于秸秆以多聚糖形式存在,目前仅有10%的秸秆用于反刍动物饲料[3]。秸秆一般需要在体外先采用物理或化学方法进行处理后再进行利用,但这些方法不仅效率低,而且容易造成环境二次污染,很难推广应用[4-5]。因此,目前研究主要集中在秸秆的生物降解方面,即利用微生物产生的纤维素酶降解纤维素。纤维素酶主要分为三大类,即葡聚糖内切酶(endo-glucanases)、葡聚糖外切酶(exo-glucanase)和β-葡萄糖苷酶(β-glucosidases)[6-7],目前纤维素酶已应用于酒精、造纸、畜牧、食品和纺织等行业[8-10],所以对纤维素酶的研究具有广阔的应用前景和社会意义。
由于天然微生物产酶量低、产酶单一,且产不同纤维素酶的微生物之间很难达到最佳配合,所以纤维素的自然生物降解是一个漫长的过程,根本无法适应实际生产的需求。因此,借助分子生物学方法将不同纤维素酶基因整合到微生物高效表达系统中是最理想最有效的措施。已有报道通过基因工程技术将不同来源的纤维素酶基因克隆到细菌、真菌、酵母等微生物中,但这些研究主要是对单一纤维素酶的克隆与表达[10-14]。纤维素酶单独应用效果不佳,需按照一定比例配合后才可应用。目前,蛋白质的融合表达技术已臻于成熟,可形成一种具有多功能的复合蛋白质,大大简化了后期蛋白质的纯化和工艺流程等[15]。目前已有利用大肠杆菌pET载体系列表达纤维素酶基因的报道[12, 16-17]。但迄今为止,关于不同纤维素酶在大肠杆菌中的融合表达还鲜有报道。
在前期工作中,我们已经从土壤中筛选获得2株具有纤维素降解能力的枯草芽孢杆菌(Bacillus subtilis)N42和Bacillus subtilis N22,并通过体外试验初步确定了分别含有2种纤维素酶。为进一步探讨这2种纤维素酶的协同作用,本研究首先克隆2个纤维素酶基因,根据2个纤维素酶基因两端的碱基特点,设计一段柔性连接肽将2个纤维素酶基因融合后重组入大肠杆菌表达载体pET32a(+)中,评估其在大肠杆菌BL21(DE3) 中表达的效果,并对表达的融合纤维素酶的性质进行分析,以期获得1株能够高效表达不同纤维素酶融合蛋白的重组大肠杆菌,并为进一步研究融合纤维素酶高效降解纤维素奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒Bacillus subtilis N42、Bacillus subtilis N22为本实验室分离鉴定;感受态大肠杆菌DH5α、BL21(DE3) 和pMD18-T、pET32a(+)均购自TaKaRa公司;BL21(DE3)/pET32a(+)-Cel42、BL21(DE3)/pET32a(+)-Cel22为本实验室构建保存。
1.1.2 酶和主要试剂PyrobestTM DNA Polymerase,T4 DNA连接酶,限制性内切酶BamHⅠ、XhoⅠ、NcoⅠ、XhoⅠ,DNA marker,蛋白质marker均购于TaKaRa公司;异丙基-β-D-硫代半乳糖苷(IPTG)、X-gal、Goldview核酸染色剂、Ni-NTA SefinoseTM Resin Kit均购于北京索莱宝科技有限公司;质粒纯化试剂盒和DNA琼脂糖凝胶回收试剂盒均购于北京天根生化科技有限公司。
1.2 方法 1.2.1 目的基因的克隆根据GenBank上公布的Bacillus subtilis的内切葡聚糖酶基因序列(KF240848.1) 和β-1, 3-1, 4-葡聚糖酶基因序列(KM 009051.1),利用Primer premier 5.0软件设计2对引物,F1:5′-CATGCCATGGGAGTGCAGATGAAAC-3′,R1:5′-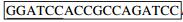
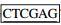
以Bacillus subtilis N42和Bacillus subtilis N22全基因组为模板,分别用引物F1/R1和F2/R2进行扩增,获取的基因分别命名为Cel42和Cel22,然后分别克隆至pMD18-T中,得到pMD18-T-Cel42和pMD18-T-Cel22,并送生工生物工程(上海)股份有限公司测序。
1.2.2 融合表达载体的构建将上述质粒pMD18-T-Cel42和pMD18-T-Cel22同时用BamHⅠ/XhoⅠ进行双酶切,DNA琼脂糖凝胶回收试剂盒回收目的片段后用T4 DNA连接酶16 ℃连接过夜,转化大肠杆菌DH5α感受态细胞,筛选阳性克隆,PCR和双酶切鉴定,得到质粒pMD18-T-Cel42-Cel22。将该质粒与表达载体pET32a(+)分别经NcoⅠ/XhoⅠ酶切回收后连接,转化大肠杆菌DH5α感受态细胞,筛选阳性克隆,经PCR和双酶切鉴定后送生工生物工程(上海)股份有限公司测序,命名为pET32a(+)-Cel42-Cel22。
1.2.3 重组质粒的转化及十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测将重组质粒pET32a(+)-Cel42-Cel22转化到宿主菌大肠杆菌BL21(DE3) 中,挑取阳性菌株接入含氨苄青霉素终浓度为100 μg/mL的LB培养液中。37 ℃、220 r/min过夜培养,以1:50转接入200 mL含同样抗性浓度的LB培养液,培养至600 nm处光密度(OD)值=0.6时,加入0.5~2.0 mmol/L浓度的IPTG,37 ℃、180 r/min诱导培养12 h。4 ℃、3 500 r /min离心30 min,用1:20体积的磷酸盐缓冲液(PBS,pH 7.0) 洗涤细胞,12 000 r/min离心10 min。弃上清,加入6 mL的PBS,放到-80 ℃冰箱中,反复冻融3~5次,在冰上用超声破碎仪破碎细胞,12 000 r/min离心10 min,取上清液用于SDS-PAGE检测。
1.2.4 融合纤维素酶Cel42-Cel22的酶活性测定分别制备浓度为0、0.2、0.4、0.6、0.8、1.0、1.2 mg/mL的葡萄糖标准溶液,测定其OD540 nm值,绘制葡萄糖标准溶液的标准曲线。
将重组菌培养液4 ℃、12 000 r/min离心30 min,超声破碎后离心所得上清液即为粗酶液。
1.2.4.1 葡聚糖内切酶活性测定葡聚糖内切酶活性测定采用二硝基水杨酸(DNS)法[18]。取1 mL粗酶液与2 mL 1.0%羧甲基纤维素钠溶液(pH 4.8) 混匀,50 ℃恒温水浴30 min,加入2 mL DNS试剂,沸水浴10 min,冷却后定容到5 mL,混匀。采用分光光度计测定OD540 nm值,计算溶液中的葡萄糖浓度。根据在pH 4.8、50 ℃保温30 min条件下,1 min内水解羧甲基纤维素钠生成1 μg葡萄糖所需的酶量为1个酶活性单位(U),计算葡聚糖内切酶的活性。
1.2.4.2 葡聚糖外切酶活性测定取1 mL粗酶液与2 mL 1.0%的微晶纤维素钠溶液(pH 4.8) 混匀,50 ℃水浴反应30 min,离心,取上清,同上步骤采用DNS法测定上清液中的还原糖含量。根据1 min内由底物产生1.0 μg还原糖所需的酶量定义为1个酶活性单位(U),计算葡聚糖外切酶的活性。
1.2.5 融合纤维素酶Cel42-Cel22的最适反应温度与热稳定性取25 μL经Ni-NTA SefinoseTM Resin Kit纯化的融合纤维素酶Cel42-Cel22(pH 4.0~5.0),添加25 μL 1%羧甲基纤维素钠溶液(pH 4.8),分别在30、35、40、45、50、55、60、65 ℃静置60 min,测定纤维素酶活性,以确定最适反应温度。为了确定融合纤维素酶Cel42-Cel22的热稳定性,将25 μL纯化的融合纤维素酶Cel42-Cel22(pH 4.0~5.0) 分别在30、35、40、45、50、55、60、65、70、75、80、85、90 ℃保温60 min,取出后立即放入冰水浴中,再添加25 μL 1%羧甲基纤维素钠溶液(pH 4.8),静置作用60 min,测定纤维素酶活性。
1.2.6 融合纤维素酶Cel42-Cel22的最适反应pH及酸碱稳定性用100 mmol/L柠檬酸钠缓冲液(pH 3.0)、100 mmol/L醋酸盐缓冲液(pH 4.0~5.0)、100 mmol/L磷酸盐缓冲液(pH 6.0~7.0)、100 mmol/L Tris-HCl (pH 8.0~9.0)、100 mmol/L碳酸氢钠/氢氧化钠缓冲液(pH 10.0~11.0) 和100 mmol/L氯化钾/氢氧化钠缓冲液(pH 12.0) 将25 μL纯化的融合纤维素酶Cel42-Cel22分别调至pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,然后加入25 μL相应pH的1%羧甲基纤维素钠,于最适温度下反应60 min,测定纤维素酶活性。为了确定融合纤维素酶Cel42-Cel22的酸碱稳定性,将纯化的融合纤维素酶Cel42-Cel22分别调至pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,于室温静置2 h后,再添加25 μL相应pH的1%羧甲基纤维素钠,于最适温度下反应60 min,测定纤维素酶活性。
1.2.7 金属离子对融合纤维素酶Cel42-Cel22活性的影响为确定金属离子对融合纤维素酶Cel42-Cel22活性的影响,向融合纤维素酶Cel42-Cel22反应体系中分别加入不同的金属离子——Na+、K+、Mg2+、Fe2+、Cu2+、Mn2+、Ni2+、Hg2+、Co2+、Al3+、Fe3+,使金属离子终浓度为1 mmol/L,室温静置60 min后,测定纤维素酶活性。
1.2.8 数据统计与分析试验数据使用Excel 2007统计软件进行统计,并用绘图软件Graphpad Prism 5绘制折线图和柱状图。
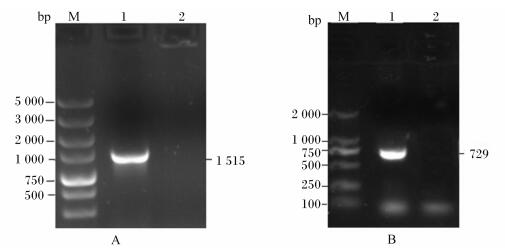
2 结果 2.1 纤维素酶基因Cel42和Cel22的克隆结果以特异性引物扩增后得到2个基因片段(图 1),与预期目的片段大小相符,经测序大小分别为1 515和729 bp,并提交到GenBank(登录号分别为KJ130416和KJ130415),将这2个基因通过NCBI进行Blast,结果显示Cel42基因与Bacillus subtilis的β-1, 4-葡聚糖内切酶具有高度的同源性,Cel22基因与Bacillus subtilis的β-1, 4-葡聚糖外切酶具有高度的同源性,说明已成功扩增出目的基因。
|
图A中,M代表DNA marker,1代表Cel42基因,2代表阴性对照;图B中,M代表DNA marker,1代表Cel22基因,2代表阴性对照。 In figure A, M represented DNA marker, 1 represented Cel42 gene and 2 represented negative control; in figure B, M represented DNA marker, 1 represented Cel22 gene and 2 represented negative control. 图 1 Cel42和Cel22基因PCR扩增图 Figure 1 PCR amplification map of Cel42 and Cel22 genes |
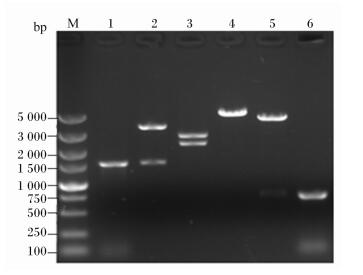
以构建的pMD18-Cel42-Cel22质粒为模板,分别用引物F1/R1和F2/R2进行PCR扩增,可以得到2条大小分别约为1.50和0.75 kb的DNA片段,分别与Cel42和Cel22基因片段大小相符。pMD18-Cel42-Cel22质粒经BamHⅠ单酶切后可得到1条大小约为4.95 kb的条带,经NcoⅠ/BamHⅠ双酶切后得到2条大小分别约为3.45和1.50 kb的条带,经NcoⅠ/XhoⅠ双酶切后得到2条大小分别约为2.70和2.25 kb的条带,经BamHⅠ/XhoⅠ双酶切后得到2条大小分别约为4.20和0.75 kb的条带,结果均与预期相符(图 2)。
|
M:DNA marker;1:F1/R1引物的PCR扩增产物;2:NcoⅠ/BamHⅠ双酶切产物;3:NcoⅠ/XhoⅠ双酶切产物;4:BamHⅠ单酶切产物;5:BamHⅠ+XhoⅠ双酶切产物;6:F2/R2引物的PCR产物。 M: DNA marker; 1: PCR amplification product based on primers F1/R1; 2: NcoⅠ/BamHⅠ digested product; 3: NcoⅠ/XhoⅠdigested product; 4: BamHⅠ digested product; 5: BamHⅠ/XhoⅠdigested product; 6: PCR amplification product based on primers F2/R2. 图 2 重组质粒pMD18-Cel42-Cel22 PCR扩增产物及酶切产物 Figure 2 PCR amplification and enzyme digested products of recombinant plasmid pMD18-Cel42-Cel22 |
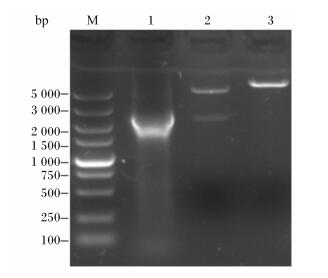
重组质粒pET32a(+)-Cel42-Cel22经NcoⅠ/XhoⅠ双酶切得到2条大小分别约为5.90和2.24 kb的条带,经XhoⅠ单酶切得到1条大小约为8.10 kb的条带,用引物对F1/R1扩增出1条大小约为1.50 kb的条带,均与预期结果一致(图 3)。
|
M:DNA marker;1:F1/R1引物的PCR扩增产物,2:NcoⅠ/XhoⅠ双酶切产物;3:XhoⅠ单酶切产物。 M: DNA marker; 1: PCR amplification product based on primers F1/R1; 2: NcoⅠ/XhoⅠ digested product; 3: XhoⅠdigested product. 图 3 重组质粒pET32a(+)-Cel42-Cel22 PCR扩增产物及酶切产物 Figure 3 PCR amplification and enzyme digested products of recombinant plasmid pET32a(+)-Cel42-Cel22 |
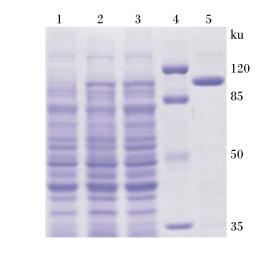
重组菌株BL21(DE3)/pET32a(+)-Cel42-Cel22在25 ℃、1 mmol/L IPTG的培养条件下诱导表达后,SDS-PAGE结果显示,与对照菌株BL21(DE3)/pET32a(+)相比,诱导的阳性重组菌株BL21(DE3)/pET32a(+)-Cel42-Cel22在101 ku附近出现1条明显条带,与预期估测的融合蛋白分子质量大小相似(图 4),表明Cel42-Cel22纤维素酶融合基因通过大肠杆菌表达载体pET32a(+)得到了有效表达。
|
1:BL21(DE3)/pET32a(+);2和3:BL21(DE3)/pET32a(+)-Cel42-Cel22;4:蛋白质marker;5:纯化的融合蛋白。 1: BL21(DE3)/pET32a(+); 2 and 3: BL21(DE3)/pET32a(+)-Cel42-Cel22; 4: protein marker; 5: purified fusion protein. 图 4 融合蛋白的SDS-PAGE图 Figure 4 SDS-PAGE map of fusion protein |
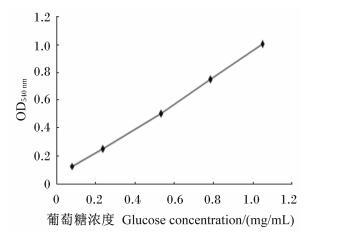
根据标准溶液中不同浓度葡萄糖的OD540 nm值绘制的标准曲线(图 5)和酶活性计算方法,计算出粗酶液中葡聚糖内切酶的活性为57.62 U/mL,葡聚糖外切酶的活性为32.57 U/mL。
|
图 5 葡萄糖标准曲线 Figure 5 The standard curve of glucose |
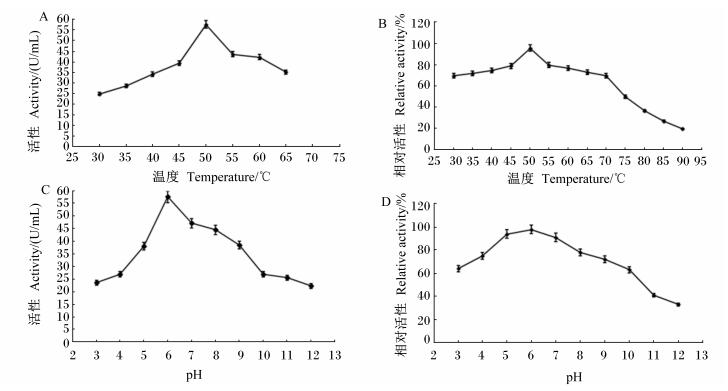
纯化的融合纤维素酶Cel42-Cel22在30~65 ℃温度下测得的纤维素酶活性结果如图 6-A所示。由图 6-A可以看出融合纤维素酶Cel42-Cel22最适反应温度为50 ℃。将纯化的融合纤维素酶Cel42-Cel22经30~90 ℃保温处理60 min后,再以羧甲基纤维素钠为底物,测定其残余纤维素酶活性,检测其对热的稳定性,检测结果如图 6-B所示。由图 6-B可以看出,在30~70 ℃时,70%以上的纤维素酶能够保持活性,而温度高于70 ℃后则纤维素酶活性急剧下降。
|
A:温度对融合纤维素酶Cel42-Cel22活性的影响;B:温度对融合纤维素酶Cel42-Cel22稳定性的影响;C:pH对融合纤维素酶Cel42-Cel22活性的影响;D:pH对融合纤维素酶Cel42-Cel22稳定性的影响。 A: effect of temperature on fusion cellulose Cel42-Cel22 activity; B: effect of temperature on stability of fusion cellulose Cel42-Cel22; C: effect of pH on fusion cellulase Cel42-Cel22 activity; D: effect of pH on stability of fusion cellulase Cel42-Cel22. 图 5 温度和pH对融合纤维素酶Cel42-Cel22活性及稳定性的影响 Figure 5 Effects of temperature and pH on fusion cellulase Cel42-Cel22 activity and stability |
将纯化的融合纤维素酶Cel042-Cel22在不同pH条件下进行酶促反应,检测其纤维素酶活性,结果如图 6-C所示。由图 6-C可以看出,该融合纤维素酶Cel042-Cel22酶促反应的最适pH为6.0。将纯化的融合纤维素酶Cel042-Cel22在pH 3.0~12.0范围内处理后,再检测其纤维素酶活性,测定其对pH的稳定性,结果如图 6-D所示。由图 6-D可以看出,在pH 4.0~9.0之间75%以上的纤维素酶保持活性。
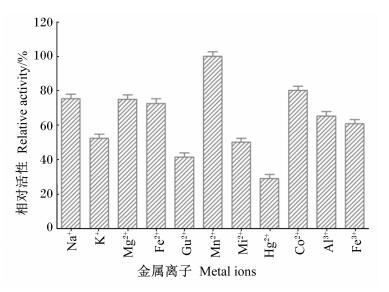
2.8 金属离子对融合纤维素酶Cel042-Cel22活性的影响金属离子对融合纤维素酶Cel042-Cel22活性的影响如图 7所示。由图 7可以看出,在检测的离子范围内,除Mn2+对纤维素酶活性没有明显的影响外,其余金属离子均有不同程度的抑制作用,其中Hg2+对纤维素酶活性的抑制作用最大,相对活性只有28.94%,Cu2+次之,相对活性为41.53%。2种铁离子(Fe2+、Fe3+)对纤维素酶活性的影响中,Fe2+的生物学效价高于Fe3+。
|
图 6 金属离子对融合纤维素酶Cel42-Cel22活性的影响 Figure 6 Effect of metal ions on fusion cellulase Cel42-Cel22 activity |
纤维素的降解是一个复杂的过程,需要多种不同种类的纤维素酶共同完成[18]。虽然利用混合菌种的复合菌系协同发酵能提高纤维素的降解率,但由于菌株选育、优化等过程较为复杂,从而限制了纤维素大规模的工业应用[19]。利用基因工程方法将不同的纤维素酶基因整合到单一菌株内,可使工业生产条件更易调控、生产过程更简化。而不同纤维素酶基因的融合是该方法的一个关键点,且基因之间合适的连接接头是保持融合蛋白空间结构稳定、发挥良好生物学活性的前提。一般用于接头的氨基酸主要包括脯氨酸(Pro)、甘氨酸(Gly)、丝氨酸(Ser)、苏氨酸(Thr)、丙氨酸(Ala)等[20]。本研究为了将2种纤维素酶基因融合表达,在Cel42基因3'端中添加了一段核苷酸序列GGATCTGGCGGT,翻译成的氨基酸为Gly-Ser-Gly-Gly,同时借助BamHⅠ酶切位点的碱基序列GGATCC的优势,其翻译的氨基酸为Gly-Ser,从而构成了一个由6个氨基酸组成的柔性接头(GSGGGS),利用这样一段连接肽进行双纤维素酶基因之间的连接,使得2个纤维素酶基因位于同一个开放阅读框(ORF)内,获得了融合基因Cel42-Cel22,并将其插入大肠杆菌表达载体pET32a(+)中。通过PCR和酶切鉴定结果可以看出,本研究成功构建了融合表达载体pET32a(+)-Cel42-Cel22。该重组载体转化到BL21(DE3) 后,通过诱导可成功表达融合纤维素酶Cel42-Cel22,表达的粗酶液中葡聚糖内切酶活性为57.62 U/mL,葡聚糖外切酶活性为32.57 U/mL,相对于已报道的在大肠杆菌表达葡聚糖内切酶和葡聚糖外切酶活性[16]具有一定的优势,但与其他表达系统表达的纤维素酶活性[21]相比还有些欠缺。由于pET系列载体表达的蛋白质容易形成包涵体,可导致部分蛋白质生物学活性丧失[22],这可能是导致融合纤维素酶活性不是很理想的原因之一。
酶学性质研究中发现融合表达的融合纤维素酶Cel42-Cel22的最适反应pH为6.0,最适反应温度为50 ℃,这与短小芽孢杆菌S124A所产纤维素酶的最适反应pH和最适反应温度[23]一致。本试验表达的融合纤维素酶Cel42-Cel22在pH 4.0~9.0范围内时75%以上的纤维素酶可以保持活性,温度在30~70 ℃范围内时70%以上的纤维素酶能够保持活性,而温度高于70 ℃则其活性急剧下降,表明该融合纤维素酶Cel42-Cel22可适应较宽广的温度和pH范围,所以较适合于实际生产应用。
由于纤维素的降解是内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶协同作用的结果,而本研究中仅将来源于2株不同菌株的内切葡聚糖酶和外切葡聚糖酶的基因进行了融合表达,如想进一步提高融合纤维素酶的产量和活性,在后续研究中可根据生长的需要将更多的纤维素酶基因整合到该载体中。此外,如果将宿主菌改为乳酸菌之类的益生菌,并进一步将携带多种纤维素酶基因的乳酸杆菌开发成生物制剂,势必会提升其在实际生产中的应用价值,值得进一步研究。
4 结论① 本试验成功克隆了Bacillus subtilis的β-1, 4-葡聚糖内切酶基因Cel42和β-1, 4-葡聚糖外切酶基因Cel22,通过设计一段连接肽将2个基因融合在一个ORF内,并成功实现了融合纤维素酶Cel42-Cel22在大肠杆菌中的表达,粗酶液中葡聚糖内切酶活性为57.62 U/mL,葡聚糖外切酶活性为32.57 U/mL。
② 本试验所得融合纤维素酶Cel42-Cel22的最适反应温度为50 ℃,最适反应pH为6.0,温度在30~70 ℃范围内时可维持70%以上的纤维素酶活性,pH在4.0~9.0范围内时可保持75%以上的纤维素酶活性,金属离子Hg2+和Cu2+则对其具有明显的抑制作用。
| [1] | 张森翔, 尹小燕, 龚志伟, 等. 纤维素酶降解秸秆特性及其基因工程研究进展[J]. 生物技术通报, 2015, 31(5) :20–26. |
| [2] | JIANG D, ZHUANG D F, FU J Y, et al. Bioenergy potential from crop residues in China:availability and distribution[J]. Renewable and Sustainable Energy Reviews, 2012, 16(3): 1377–1382. DOI: 10.1016/j.rser.2011.12.012 |
| [3] | 陈晓琳, 孙娟, 王月超, 等. 不同类农作物秸秆在肉羊瘤胃中的降解特性研究[J]. 中国畜牧杂志, 2015, 51(5) :45–51. |
| [4] | 蒋发现, 徐勇, 朱均均, 等. 稀酸预处理对玉米秸秆中4类非木质素组分的降解规律研究[J]. 林产化学与工业, 2015, 35(2) :38–46. |
| [5] | YUAN J S, TILLER K H, AL-AHMAD H, et al. Plants to power:bioenergy to fuel the future[J]. Trends in Plant Science, 2008, 13(8): 421–429. DOI: 10.1016/j.tplants.2008.06.001 |
| [6] | RAHNAMA N, FOO H L, RAHMAN N A A, et al. Saccharification of rice straw by cellulase from a local Trichoderma harzianum SNRS3 for biobutanol production[J]. BMC Biotechnology, 2014, 14: 103. DOI: 10.1186/s12896-014-0103-y |
| [7] | BHAT M K, BHAT S. Cellulose degrading enzymes and their potential industrial applications[J]. Biotechnology Advances, 1997, 15(3/4): 583–620. |
| [8] | JAIN K K, KUMAR S, DESWAL D, et al. Improved production of thermostable cellulase from Thermoascus aurantiacus RCKK by fermentation bioprocessing and its application in the hydrolysis of office waste paper, algal pulp, and biologically treated Wheat straw[J]. Applied Biochemistry and Biotechnology, 2017, 181(2): 784–800. DOI: 10.1007/s12010-016-2249-7 |
| [9] | SHARMA S, SHARMA V, KUILA A. Cellulase production using natural medium and its application on enzymatic hydrolysis of thermo chemically pretreated biomass[J]. Biotechnology, 2016, 6: 139. |
| [10] | OHMIYA K, SAKKA K, KIMURA T, et al. Application of microbial genes to recalcitrant biomass utilization and environmental conservation[J]. Journal of Bioscience and Bioengineering, 2003, 95(6): 549–561. DOI: 10.1016/S1389-1723(03)80161-5 |
| [11] | YANG P Z, ZHANG H F, CAO L L, et al. Construction of Aspergillus niger integrated with cellulase gene from Ampullaria gigas Spix for improved enzyme production and saccharification of alkaline-pretreated rice straw[J]. Biotechnology, 2016, 6: 236. |
| [12] | IRFAN M, GULER H I, BELDUZ A O, et al. Cloning, purification and characterization of a cellulase-free xylanase from Geobacillus thermodenitrificans AK53[J]. Applied Biochemistry and Microbiology, 2016, 52(3): 277–286. DOI: 10.1134/S0003683816030066 |
| [13] | ZHOU H Z, GAO Y H, GAO G, et al. Oral Administration of recombinant Lactococcus lactis expressing the cellulase gene increases digestibility of fiber in geese[J]. Current Microbiology, 2015, 71(6): 693–698. DOI: 10.1007/s00284-015-0904-9 |
| [14] | LU R H, ZHAO A C, LI J, et al. Screening, cloning and expression analysis of a cellulase derived from the causative agent of hypertrophy sorosis scleroteniosis, Ciboria shiraiana[J]. Gene, 2015, 565(2): 221–227. DOI: 10.1016/j.gene.2015.04.018 |
| [15] | ZHANG R G, DUAN G C, SHI Q F, et al. Construction of a recombinant Lactococcus lactis strain expressing a fusion protein of Omp22 and HpaA from Helicobacter pylori for oral vaccine development[J]. Biotechnology Letters, 2016, 38(11): 1911–1916. DOI: 10.1007/s10529-016-2173-5 |
| [16] | GAO D F, LUAN Y Q, WANG Q, et al. Construction of cellulose-utilizing Escherichia coli based on a secretable cellulase[J]. Microbial Cel Factories, 2015, 14: 159. DOI: 10.1186/s12934-015-0349-7 |
| [17] | WANG Q F, QIAN C L, ZHANG X Z, et al. Characterization of a novel thermostable β-glucosidase from a metagenomic library of termite gut[J]. Enzyme and Microbial Technology, 2012, 51(6/7): 319–324. |
| [18] | STEPANOVA E V, KOROLEVA O V, VASILCHENKO L G, et al. Fungal decomposition of oat straw during liquid and solid state fermentation[J]. Applied Biochemistry and Microbiology, 2003, 39(1): 65–74. DOI: 10.1023/A:1021702211169 |
| [19] | FANG H, XIA L M. High activity cellulase production by recombinant Trichoderma reesei ZU-02 with the enhanced cellobiohydrolase production[J]. Bioresource Technology, 2013, 144: 693–697. DOI: 10.1016/j.biortech.2013.06.120 |
| [20] | JIANG W, FANG B S. Construction and evaluation of a novel bifunctional phenylalanine-formate dehydrogenase fusion protein for bienzyme system with cofactor regeneration[J]. Journal of India Microbiology & Biotechnology, 2016, 43(5): 577–584. |
| [21] | LI W, HUAN X J, ZHOU Y, et al. Simultaneous cloning and expression of two cellulase genes from Bacillus subtilis newly isolated from Golden Takin (Budorcas taxicolor bedfordi)[J]. Biochemical and Biophysical Research Communications, 2009, 383(4): 397–400. DOI: 10.1016/j.bbrc.2009.04.027 |
| [22] | MIERENDORF R, YEAGER K, NOVY R. The pET system:your chioce for expression[J]. Advanced Products and Protocols for Molecular Biology Research, 1994, 1(1): 3–36. |
| [23] | BALASUBRAMANIAN N, SIMÕES N. Bacillus pumilus S124A carboxymethyl cellulose; a thermo stable enzyme with a wide substrate spectrum utility[J]. International Journal of Biological Macromolecules, 2014, 67: 132–139. DOI: 10.1016/j.ijbiomac.2014.03.014 |



