2. 浙江艾格生物科技股份有限公司, 长兴 313100
2. Zhejiang Egg Bioscience Co., Inc., Changxing 313100, China
n-3(又称omega-3) 多不饱和脂肪酸主要包括α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA),对人类心血管疾病、中枢神经系统疾病、精神健康疾病、炎症反应和免疫功能等具有改善作用,并以DHA效果最受关注[1-2]。据报道,鸡蛋DHA仅以磷脂型结合形式存在[3],这相对增加了脂肪酸氧化稳定性和吸收利用活性[4-6],并可以产生抗炎、抑制肿瘤及胆固醇等特殊生物活性[7-10]。动物体内n-3多不饱脂肪酸沉积受饲粮脂肪酸组成直接影响,具体表现在一方面由植物来源的ALA逐步转化生成EPA、DPA和DHA,另一方面由饲粮直接摄取沉积DHA等长链多不饱和脂肪酸。鱼油、微型藻类和亚麻籽是3种主要的n-3多不饱和脂肪酸饲粮来源,其中鱼油富集在蛋品中的DHA含量最高、微型藻类次之、亚麻籽最低,然而添加鱼油会导致鲜蛋产生鱼腥味,影响储存和风味品质[11]。通过研究3种不同来源n-3多不饱和脂肪酸的协同竞争效应,可以在生产中获得最佳功能富集效果,但目前鲜有相关报道。因此,本文通过在蛋鸡饲粮中添加亚麻籽、鱼油及其组合,研究其对蛋黄中n-3多不饱和脂肪酸沉积及肝脏脂肪酸代谢(脂肪酸组成、碳链延长酶及去饱和酶基因表达)的影响,旨在为生产富含n-3多不饱和脂肪酸蛋品提供参考。
1 材料与方法 1.1 试验设计、动物饲养及样品采集选择28周龄海兰褐壳蛋鸡96只,随机分为4组,每组24只。对照组饲喂基础饲粮,试验Ⅰ组饲喂基础饲粮+10%亚麻籽,试验Ⅱ组饲喂基础饲粮+10%亚麻籽+5%鱼油,试验Ⅲ组饲喂基础饲粮+5%鱼油。试验饲粮组成及营养水平见表 1。饲养21 d后连续收集7 d鸡蛋,进行蛋黄分离和喷雾干燥,制成蛋黄粉。试验结束后每组随机选取4只鸡,屠宰采集肝脏组织,液氮冻存,用于脂肪酸组成和基因表达分析。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
根据Christie[12]描述方法,对组织冻干粉、蛋黄喷干粉或饲粮风干样品进行脂肪酸甲酯化处理。称取0.5 g样品,依次加入2 mL正己烷和5 mL甲酰氯(乙酰氯:甲醇=1:8),充分振荡混合、80 ℃水浴反应2 h,每15 min振荡混合1次。结束后流水冷却至室温,加入15 mL 6%碳酸钠(Na2CO3)溶液。充分反应后5 000×g离心5 min,吸取上层有机相,即为脂肪酸甲酯化产物,用于脂肪酸含量或组成分析。
气相色谱仪为Agilent 7890A,氢离子火焰检测器(FID),毛细管色谱柱规格为Agilent 19091N-213、260 ℃、30 m×320 μm×0.5 μm。升温程序为:180 ℃保持1 min,10 ℃/min升至250 ℃,保持15 min,平衡3 min,后运行3 min。进样量1 μL,进样口温度270 ℃,FID温度275 ℃。载气为高纯氮气,流速1.0 mL/min,分流比为20:1。
ALA、EPA、DPA、DHA的甲酯化标准品购自Sigma公司,22种脂肪酸甲酯化混合标准品购自Sigma公司。采用外标标准曲线测定4种脂肪酸绝对含量,峰面积归一化法分析脂肪酸组成。
1.3 肝脏组织基因表达分析利用试剂盒提取总RNA,微量紫外分光光度计测定RNA浓度和纯度,利用ReverTra Ace qPCR RT试剂盒合成第1链cDNA。根据NCBI公布的基因序列设计合成基因引物,见表 2。实时定量PCR反应在ABI StepOne Plus上进行,反应体系:SYBR Green Master(ROX)5 μL, 无菌水3 μL, 上、下游引物各0.75 μL, cDNA 0.5 μL;反应温度:95 ℃ 30 s,95 ℃ 5 s、62 ℃ 34 s, 40个循环。采用ΔΔCt法计算基因表达水平,3次重复结果计算平均值和标准差。
|
|
表 2 实时定量PCR所检测基因及其引物序列 Table 2 List of genes and sequences of the primers for real-time quantitative PCR |
所有数据以“平均值±标准差”形式表示,统计分析在SPSS 16.0软件中进行。利用单因素方差分析(one-way ANOVA)和Duncan氏多重比较,对不同组间差异及其显著性进行分析;利用一般线性模型(general linear model)进行双因素方差分析,计算亚麻籽、鱼油及其互作对相关指标影响的显著程度。
2 结果与分析 2.1 4种饲粮脂肪酸组成比较如表 3所示,试验组饲粮n-3多不饱和脂肪酸比例高于对照组,其中试验Ⅰ组和Ⅱ组饲粮的ALA比例在5%以上,而在试验Ⅲ组和对照组未检测到ALA;试验Ⅰ组和对照组EPA比例接近,仅为试验Ⅱ组或Ⅲ组饲粮的25%左右;DPA在4种饲粮中均未被检测到,DHA比例以试验Ⅱ组饲粮最高、试验Ⅲ组次之,试验Ⅰ组和对照组接近且均为最低。
|
|
表 3 4种饲粮脂肪酸组成比较 Table 3 Comparison of fatty acid composition among four different diets |
|
|
表 4 不同组间蛋黄n-3多不饱和脂肪酸含量比较 Table 4 Comparison of n-3 PUFA contents in egg yolk from different groups |
|
|
表 5 不同组间蛋鸡肝脏脂肪酸组成比较 Table 5 Comparison of fatty acid composition in liver of hens among different groups |
如表 4所示,试验Ⅰ组、Ⅱ组和Ⅲ组蛋黄n-3多不饱和脂肪酸含量均显著高于对照组(P<0.05);试验Ⅱ组的ALA、DPA含量和n-3多不饱和脂肪酸总量最高,显著高于其他各组(P<0.05);试验Ⅲ组的EPA和DHA含量最高,显著高于其他各组(P<0.05)。双因素方差分析显示,亚麻籽、鱼油及其互作对蛋黄n-3多不饱和脂肪含量的影响均达到极显著水平(P<0.01)。
2.3 肝脏脂肪酸组成比较如表 5所示,与对照组相比,试验组的单不饱和脂肪酸比例显著降低(P<0.05)、n-3多不饱和脂肪酸比例显著增加(P<0.05),试验Ⅱ组和Ⅲ组的n-6多不饱和脂肪酸比例显著降低(P<0.05);对照组和试验Ⅲ组的C18:3(包括α和γ)含量低于检测限,对照组的C20:4、C20:5、C22:5含量均低于检测限。从数值上看,试验Ⅰ组的C18:2、C20:2和C20:3比例与对照组接近,为4组中最高;试验Ⅱ组的C14:0、C20:0和C20:5比例为4组中最高,试验Ⅲ组的C16:0、C20:1、C20:4、C22:5和C22:6比例为4组中最高。仅在试验Ⅰ组和Ⅱ组存在C18:3,并以试验Ⅰ组显著高于试验Ⅱ组(P<0.05)。
双因素方差分析显示,亚麻籽除了对C14:0、C18:1、C24:1、C22:6、C18:2和C20:3(顺8, 11, 14) 的影响没有达到显著程度(P>0.05) 外,对其他脂肪酸的影响都达到显著程度(P<0.05);鱼油除了对C20:0、C24:0、γC18:3和C20:2的影响没有达到显著程度(P>0.05) 外,对其他脂肪酸的影响都达到显著程度(P<0.05);亚麻籽和鱼油对肝脏C18:0、C22:0、C24:0、C16:1、C20:1、C18:3、C22:5、C22:6、C20:4和C20:3比例的互作影响达到显著程度(P<0.05)。
2.4 肝脏脂肪酸延长酶和去饱和酶基因表达水平比较如图 1所示,与对照组相比,试验Ⅰ组的脂肪酸延长酶1(ELOVL1)、脂肪酸延长酶2(ELOVL2)、脂肪酸去饱和酶1(FADS1)、脂肪酸去饱和酶2(FADS2) 基因表达水平显著升高(P<0.05),硬脂酰辅酶A去饱和酶1(SCD1) 基因表达水平无显著差异(P>0.05);试验Ⅱ组的FADS1和FADS2基因表达水平显著升高(P<0.05),ELOVL2和SCD1基因表达水平显著降低(P<0.05),ELOVL1基因表达水平无显著差异(P>0.05);试验Ⅲ组所有延长酶和去饱和酶基因表达水平均显著降低(P<0.05)。
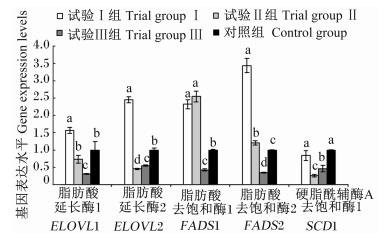
|
图 1 肝脏脂肪酸延长酶与去饱和酶基因表达水平比较 Figure 1 Comparison of gene expression levels of fatty acid elongase and desaturase |
|
|
表 6 脂肪酸延长酶和去饱和酶基因表达水平的双因素方差分析 Table 6 Two-way ANOVA of gene expression levels of fatty acid elongase and desaturase |
双因素方差分析显示,饲粮添加亚麻籽、鱼油对ELOVL1、ELOVL2、FADS1、FADS2和SCD1基因表达水平的影响都达到显著程度(P<0.05);亚麻籽和鱼油对ELOVL1和SCD1基因表达水平的互作影响没有达到显著程度(P>0.05),对其他基因表达水平的影响达到显著程度(P<0.05)。
3 讨论 3.1 亚麻籽、鱼油饲粮对蛋黄n-3多不饱和脂肪酸的富集作用亚麻籽、鱼油和藻类是畜禽产品中n-3多不饱和脂肪酸的主要饲粮来源[13]。亚麻籽可以为家禽饲粮提供蛋白质、油脂和α-亚麻酸,利用其生产富含n-3多不饱和脂肪酸的鸡蛋已经得到许多国家市场认可[14],可使每枚鸡蛋ALA含量增加至200 mg,DHA含量增加至90 mg[15-16]。鱼油以富含DHA和EPA为主,饲粮添加鱼油可以直接富集DHA和EPA[17-19],但因容易产生鱼腥味在很多国家不被接受,其添加量被控制在1.5%以下,DHA富集程度只能到每枚蛋100 mg[20-21]。经过微囊包被或除臭处理的鱼油,对蛋品质负面影响依然存在[22]。微藻类则主要富含DHA,商品名为“DHA金”的异养型微藻能够获得更大程度富集n-3长链多不饱和脂肪酸,饲粮添加4.8%“DHA金”可使蛋中DHA含量增加到200 mg以上,蛋品风味仍然处于可接受程度[23]。
本试验结果显示,普通饲粮添加5%鱼油使蛋黄中以DHA和EPA沉积为主(试验Ⅲ组);10%亚麻籽饲粮使蛋黄以沉积ALA和DHA为主(试验Ⅰ组);10%亚麻籽+5%鱼油饲粮使蛋黄仍以沉积DHA和ALA为主(试验Ⅱ组),n-3多不饱和脂肪酸沉积总量比单纯10%亚麻籽饲粮或5%鱼油饲粮都有所增加。其中,普通饲粮添加5%鱼油使蛋黄DHA含量增加10倍,折合鲜蛋DHA含量最高到达每枚200 mg以上,属于现有研究较高水平。
从饲粮组成分析来看,试验Ⅰ组和对照组饲粮的DHA比例接近,但在DHA沉积上存在显著差异,说明饲喂单纯亚麻籽饲粮的蛋黄DHA主要来源于亚麻酸体内转化;试验Ⅱ组饲粮n-3多不饱和脂肪酸比例总和与DHA比例同为最高,但蛋黄富集DHA程度却低于试验Ⅲ组,即试验Ⅱ组蛋黄DHA含量仅处于试验Ⅰ组和Ⅲ组之间。从双因素方差分析看,亚麻籽、鱼油对4种n-3多不饱和脂肪酸沉积的影响都达到显著程度,并且存在显著性互作效应。这种互作效应对不同种n-3多不饱和脂肪酸表现不同,对总量有促进作用,但未达到叠加效应程度;对EPA和DHA沉积有抑制作用,表现互作组沉积量低于单独添加5%鱼油组。
此现象说明,饲粮不同n-3多不饱和脂肪酸之间在吸收、转化过程可能存在相互影响,沉积总量仍取决于饲粮组成特点。Cachaldora等[24]通过提高饲粮ALA含量和EPA/DHA值研究发现,过量长链n-3多不饱和脂肪酸可以抑制ALA转化生成DHA过程。Lemahieu等[11]研究指出,不同n-3脂肪酸的生物活性不同,鱼油和亚麻籽n-3脂肪酸组成差异将导致其组织沉积效果不同。可以推测,一方面随DHA含量增加可能反馈性抑制ALA向DHA转化过程,另一方面随ALA转化DHA过程加强可能抑制DHA直接吸收沉积,具体机制有待从吸收、转化2个层次展开深入研究。
3.2 亚麻籽、鱼油饲粮对蛋鸡肝脏脂肪酸代谢的调控作用肝脏是禽类脂肪酸代谢主要器官。无论添加鱼油还是添加亚麻籽,都增加了肝脏长链n-3多不饱和脂肪酸比例,鱼油增加了饱和脂肪酸比例、对亚麻籽没有影响。结合饲粮组成特点可以推测,鱼油对机体长链不饱和脂肪酸从头合成有抑制作用,但可以从饲粮吸收相对较多DHA等n-3多不饱和脂肪酸。而亚麻籽主要能够激活脂肪酸延长酶和去饱和酶基因表达,促进长链不饱和脂肪酸的体内合成过程,但直接从饲粮吸收DHA等长链n-3多不饱和脂肪酸相对较少。这与蛋黄DHA沉积规律一致,说明亚麻籽和鱼油对蛋鸡脂肪酸代谢途径具有不同的调控作用。
如图 2所示,体内存在n-3和n-6 2种不饱和脂肪酸代谢途径,都是在碳链延长酶和去饱和酶催化作用下完成[25]。其中,Δ6去饱和酶主要在C18和C24不饱和脂肪酸的第6位和7位特异性引入双键,Δ5去饱和酶主要在C20不饱和脂肪酸的第5位和6位引入双键,使C—C单键转换成C=C形成更高程度不饱和脂肪酸;碳链延长酶ELOVL1催化C22不饱和脂肪酸碳链延长,ELOVL2催化C20和C22脂肪酸碳链延长,形成长链不饱和脂肪酸[26-29]。2种代谢途径的底物和终产物不同,n-6途径以亚油酸为底物、以DPA为终产物,n-3途径以ALA为底物、以DHA为终产物,它们通过共同中间产物和催化酶发生交叉联系。
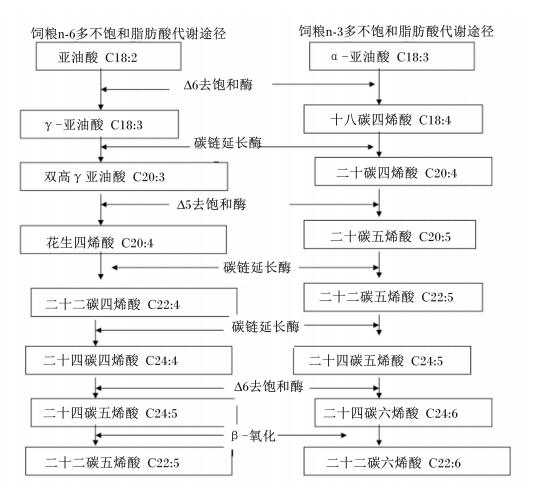
|
图 2 饲粮中n-3和n-6多不饱和脂肪酸在肝脏的代谢途径 Figure 2 The metabolism pathways of dietary n-3 and n-6 PUFA in liver |
在本研究中,亚麻籽富含ALA等n-3途径合成底物,并表现促进脂肪酸延长酶和去饱和酶基因表达;而鱼油含有DHA等n-3途径终产物,表现抑制脂肪酸延长酶和去饱和酶基因表达。这进一步说明,鱼油饲粮以DHA、EPA等n-3多不饱和脂肪酸直接吸收沉积为主,亚麻籽以DHA的从头合成为主。结合双因素方差分析结果可以推测,鱼油对肝脏自身脂肪酸转化代谢有显著抑制作用,机体组织脂肪酸组成更多取决于饲粮组成;亚麻籽能够激活肝脏自身脂肪酸转化代谢,促进体内n-3多不饱和脂肪酸合成途径。
4 结论① 饲粮添加亚麻籽或鱼油可使蛋黄n-3多不饱和脂肪酸富集沉积,沉积总量以同时添加10%亚麻籽和5%鱼油的饲粮组为最高。
② 蛋黄DHA沉积以饲粮添加5%鱼油效果最佳,折合鲜蛋DHA含量在每枚200 mg以上,属于同类研究较高水平。
③ 饲粮添加亚麻籽促进肝脏ALA转化生成DHA作用,主要表现为上调脂肪酸延长酶和去饱和酶基因表达;添加鱼油后对上述过程有明显抑制作用,表现为下调相关基因表达。
| [1] | GOGUS U, SMITH C. n-3 omega fatty acids:a review of current knowledge[J]. International Journal of Food Science and Technology, 2010, 45(3): 417–436. DOI: 10.1111/ifs.2010.45.issue-3 |
| [2] | SIRIWARDHANA N, KALUPAHANA N S, MOUSTAID-MOUSSA N. Health benefits of n-3 polyunsaturated fatty acids:eicosapentaenoic acid and docosahexaenoic acid[J]. Advances in Food and Nutrition Research, 2012, 65: 211–222. DOI: 10.1016/B978-0-12-416003-3.00013-5 |
| [3] | 朱玲娇. 禽蛋磷脂组成及其结构特点分析研究[D]. 硕士学位论文. 武汉: 华中农业大学, 2013: 82-84. http: //cdmd. cnki. com. cn/Article/CDMD-10504-1013336438. htm |
| [4] | 秦德元, 张鹏. 酶法合成EPA/DHA型卵磷脂[J]. 中国油脂, 2004, 29(9) :45–47. |
| [5] | SCHARITER J A, PACHUSKI J, FRIED B, et al. Determination of neutral lipids and phospholipids in the cercariae of Schistosoma mansoni by high performance thin layer chromatography[J]. Journal of Liquid Chromatography & Related Technologies, 2002, 25(10/11): 1615–1622. |
| [6] | STILLWELL W, EHRINGER W, JENSKI L J. Docosahexaenoic acid increases permeability of lipid vesicles and tumor cells[J]. Lipids, 1993, 28(2): 103–108. DOI: 10.1007/BF02535772 |
| [7] | SHIROUCHI B, NAGAO K, INOUE N, et al. Effect of dietary omega 3 phosphatidylcholine on obesity-related disorders in obese otsuka long-evans tokushima fatty rats[J]. Journal of Agricultural and Food Chemistry, 2007, 55(17): 7170–7176. DOI: 10.1021/jf071225x |
| [8] | 马琴. 二十二碳六烯酸—磷脂生物活性的研究[D]. 硕士学位论文. 青岛: 中国海洋大学, 2009: 77. http: //cdmd. cnki. com. cn/Article/CDMD-10423-2009171430. htm |
| [9] | ISHIGAMORI H, HOSOKAWA M, KOHNO H, et al. Docosahexaenoic acid-containing phosphatidylethanolamine enhances HL-60 cell differentiation by regulation of c-jun and c-myc expression[J]. Molecular and Cellular Biochemistry, 2005, 275(1/2): 127–133. |
| [10] | 杨玉红, 王静凤, 龙腾腾, 等. 磷脂型DHA对肿瘤细胞凋亡的影响[J]. 中国药理学通报, 2011, 27(2) :178–182. |
| [11] | LEMAHIEU C, BRUNEEL C, RYCKEBOSCH E, et al. Impact of different omega-3 polyunsaturated fatty acid (n-3 PUFA) sources (flaxseed, Isochrysis galbana, fish oil and DHA Gold) on n-3 LC-PUFA enrichment (efficiency) in the egg yolk[J]. Journal of Functional Foods, 2015, 19: 821–827. DOI: 10.1016/j.jff.2015.04.021 |
| [12] | CHRISTIE W W.Preparation of ester derivatives of fatty acids for chromatographic analysis[M]//CHRISTIE W W.Advances in Lipid Methodology.Dundee:Oily Press, 1993:69-119. |
| [13] | FRAEYE I, BRUNEEL C, LEMAHIEU C, et al. Dietary enrichment of eggs with omega-3 fatty acids:a review[J]. Food Research International, 2012, 48(2): 961–969. DOI: 10.1016/j.foodres.2012.03.014 |
| [14] | SURAI P F, SPARKS N H C. Designer eggs:from improvement of egg composition to functional food[J]. Trends in Food Science & Technology, 2001, 12(1): 7–16. |
| [15] | AYMOND W M, VAN ELSWYK M E. Yolk thiobarbituric acid reactive substances and n-3 fatty acids in response to whole and ground flaxseed[J]. Poultry Science, 1995, 74(8): 1388–1394. DOI: 10.3382/ps.0741388 |
| [16] | BEAN L D, LEESON S. Long-term effects of feeding flaxseed on performance and egg fatty acid composition of brown and white hens[J]. Poultry Science, 2003, 82(3): 388–394. DOI: 10.1093/ps/82.3.388 |
| [17] | BOVET P, FAEH D, MADELEINE G, et al. Decrease in blood triglycerides associated with the consumption of eggs of hens fed with food supplemented with fish oil[J]. Nutrition, Metabolism, and Cardiovascular Diseases, 2007, 17(4): 280–287. DOI: 10.1016/j.numecd.2005.12.010 |
| [18] | CACHALDORA P, GARCÍA-REBOLLA P, ALVAREZ C, et al. Effect of type and level of fish oil supplementation on yolk fat composition and n-3 fatty acids retention efficiency in laying hens[J]. British Poultry Science, 2006, 47(1): 43–49. DOI: 10.1080/00071660500475541 |
| [19] | CARRILLO S, LÓPEZ E, CASAS M M, et al. Potential use of seaweeds in the laying hen ration to improve the quality of n-3 fatty acid enriched eggs[J]. Journal of Applied Phycology, 2008, 20(5): 721–728. DOI: 10.1007/s10811-008-9334-4 |
| [20] | GONZALEZ-ESQUERRA R, LEESON S. Effect of feeding hens regular or deodorized menhaden oil on production parameters, yolk fatty acid profile, and sensory quality of eggs[J]. Poultry Science, 2000, 79(11): 1597–1602. DOI: 10.1093/ps/79.11.1597 |
| [21] | VAN ELSWYK M E. Comparison of n-3 fatty acid sources in laying hen rations for improvement of whole egg nutritional quality:a review[J]. British Journal of Nutrition, 1997, 78(1): S61–S69. DOI: 10.1079/BJN19970135 |
| [22] | LAWLOR J B, GAUDETTE N, DICKSON T, et al. Fatty acid profile and sensory characteristics of table eggs from laying hens fed diets containing microencapsulated fish oil[J]. Animal Feed Science and Technology, 2010, 156(3/4): 97–103. |
| [23] | HERBER-MCNEILL S M, VAN ELSWYK M E. Dietary marine algae maintains egg consumer acceptability while enhancing yolk color[J]. Poultry Science, 1998, 77(3): 493–496. DOI: 10.1093/ps/77.3.493 |
| [24] | CACHALDORA P, GARCÍA-REBOLLAR P, ALVAREZ C, et al. Double enrichment of chicken eggs with conjugated linoleic acid and n-3 fatty acids through dietary fat supplementation[J]. Animal Feed Science and Technology, 2008, 144(3/4): 315–326. |
| [25] | QIU X. Biosynthesis of docosahexaenoic acid (DHA, 22:6-4, 7, 10, 13, 16, 19):two distinct pathways[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2003, 68(2): 181–186. DOI: 10.1016/S0952-3278(02)00268-5 |
| [26] | JAKOBSSON A, WESTERBERG R, JACOBSSON A. Fatty acid elongases in mammals:their regulation and roles in metabolism[J]. Progress in Lipid Research, 2006, 45(3): 237–249. DOI: 10.1016/j.plipres.2006.01.004 |
| [27] | 孙晓艳, 林艳丽, 熊福银, 等. 二十碳五烯酸和二十二碳六烯酸的生物合成途径研究进展[J]. 生物技术通讯, 2012, 23(5) :755–758. |
| [28] | SCHACKMANN M J, OFMAN R, DIJKSTRA I M, et al. Enzymatic characterization of ELOVL1, a key enzyme in very long-chain fatty acid synthesis[J]. Biochimica et Biophysica Acta (BBA):Molecular and Cell Biology of Lipids, 2015, 1851(2): 231–237. DOI: 10.1016/j.bbalip.2014.12.005 |
| [29] | ROSERO D S, BOYD R D, ODLE J, et al. Optimizing dietary lipid use to improve essential fatty acid status and reproductive performance of the modern lactating sow:a review[J]. Journal of Animal Science and Biotechnology, 2016, 7: 34. DOI: 10.1186/s40104-016-0092-x |




