玉米赤霉烯酮(zearalenone,ZEA)又名F-2毒素,是由镰刀菌产生的一种2, 4-二羟基苯甲酸内酯类化合物[1]。调查结果显示,ZEA是中国饲料原料及配合饲料检出水平最高的霉菌毒素之一[2]。饲料中较高水平的ZEA能够引起母猪不孕、流产和假发情等繁殖障碍[3],长期饲喂低水平ZEA饲料,造成母猪发情周期延长、产仔数减少、仔猪体弱、死胎和不育[4],ZEA已经成为养猪业的第二大杀手[5-6]。国内外有关ZEA的研究多集中在生殖系统[7],而ZEA对断奶小母猪血清抗氧化功能、血清抗体水平及外周血淋巴细胞增殖率的影响尚未见系统报道。本试验旨在研究饲粮中不同水平ZEA(0.5~1.5 mg/kg)对断奶小母猪生长性能,血清抗氧化功能,血清猪瘟、伪狂犬病和高致病性猪蓝耳病病毒抗体水平及外周血淋巴细胞增殖率的影响,以期揭示ZEA的氧化应激和免疫毒性,为ZEA的毒性机制及养猪生产中相关疾病的防治和繁殖障碍提供理论依据和思路。
1 材料与方法 1.1 试验材料ZEA购自于以色列Fermentek公司,色谱纯,纯度保证值为98%。
1.2 试验设计与饲养管理选择25~28日龄健康的三元杂交(杜×长×大)断奶雌性小母猪40头,在产床上继续饲养10 d,然后转入试验笼,单笼(0.48 m2)饲养,根据日龄[(35±1) 日龄]和平均体重[(14.01±0.86) kg]分成4组,每组10头,组间初始体重差异不显著(P > 0.05)。断奶小母猪基础饲粮参考NRC(2012) 营养需要配制,其组成及营养水平见表 1。对照组饲喂基础饲粮,试验组在基础饲粮中分别添加0.5、1.0和1.5 mg/kg ZEA,ZEA测定值分别为(0.52±0.07) mg/kg、(1.04±0.03) mg/kg和1.51±0.13 mg/kg。预试期10 d,正试期35 d。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
单体笼使用塑料漏缝地板,安装有乳头饮水器和料槽,小母猪自由采食和饮水。试验开始前对猪舍进行全面清扫、消毒,试验期间每周进行1次猪舍消毒。舍内安装红外保温灯,第1周维持试验笼内温度在30 ℃左右,第2周将猪舍内环境温度维持在26~28 ℃。猪舍相对湿度为65%。预试期10 d,正试期35 d,自由采食饮水。小母猪管理和免疫按常规进行。其中,猪瘟病毒疫苗于小母猪出生后第21天肌肉注射;伪狂犬病病毒疫苗于小母猪出生后72 h内滴鼻,第28天进行2次免疫;高致病性猪蓝耳病病毒疫苗于小母猪出生第14天进行肌肉注射免疫。试验结束后小母猪全部屠宰。动物试验于2016年4—6月在山东农业大学畜牧科技园进行。
1.3 ZEA污染饲粮的配制将色谱纯(纯度为98%)的晶体粉末状ZEA由乙酸乙酯溶解制成溶液,再将含有ZEA的乙酸乙酯溶液喷洒到一定量的滑石粉载体上,并放置过夜使乙酸乙酯挥发,制成1 000 mg/kg的ZEA预混剂,然后用不含毒素的玉米粉进一步将1 000 mg/kg的ZEA预混剂稀释成10 mg/kg的ZEA预混剂,最后按照各组饲粮中ZEA的设计水平,用ZEA预混剂替代配方中的玉米和载体配制成试验饲粮。试验所需饲粮于试验正式开始前1周一次性配合完成,装袋后储存于干燥通风处。在试验前和试验结束分别取样后,立即进行饲粮中养分含量和毒素水平检测。取样方法按照《饲料采样方法》(GB/T 14699.1—1993)。
1.4 饲粮常规养分和毒素的测定饲粮常规养分测定参考AOAC(2012) 的方法进行。粗蛋白质含量用凯氏定氮法测定;消化能用HR-15氧弹式热量计测定;钙含量根据高锰酸钾滴定法测定;总磷含量根据钼黄比色法测定;氨基酸含量用日立835-50氨基酸自动分析仪进行测定。
饲粮毒素水平测定:饲粮中ZEA、呕吐毒素、黄曲霉毒素和烟曲霉毒素水平委托青岛出入境检测检疫局测定。采用免疫亲和柱层析净化,以液相色谱法荧光检测器测定ZEA和黄曲霉毒素的水平,外标法定量。采用免疫亲和层析净化高效液相色谱-串联质谱法,以液相色谱结合紫外检测器测定烟曲霉毒素和呕吐毒素的水平,外标法定量。黄曲霉毒素、ZEA、呕吐毒素和烟曲霉毒素的最低检测限分别为1.0 μg/kg、0.1 mg/kg、0.1 mg/kg和0.25 mg/kg。各组饲粮ZEA的实际测定值分别为0 mg/kg(0、0) mg/kg,(0.52±0.07) mg/kg(0.59、0.45 mg/kg),(1.04±0.03) mg/kg(1.01、1.07 mg/kg)和(1.51±0.13) mg/kg(1.38、1.64 mg/kg)(括号内为2次的测定值),2次均未检测到其他毒素或者毒素水平低于检测限水平。
1.5 样品采集与指标测定 1.5.1 生长性能测定每天记录小母猪采食量与剩料量,试验前后对小母猪进行称重,计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.5.2 血样的采集、处理与测定正试期第35天晨饲前,对小母猪进行前腔和耳缘静脉空腹采血。使用真空抗凝管(内加K2EDTA)采集耳缘静脉全血15 mL,采血后立即颠倒混匀8次,血液标本于0 ℃中暂存,立即带回实验室用于测定外周血淋巴细胞增殖率。另用真空促凝管采集前腔静脉血30 mL,于3 000 r/min下离心10 min分离血清,用以测定抗体水平、抗氧化功能。
1.5.3 血清抗氧化功能分析血清中谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量均采用752型紫外可见分光光度计测定,具体步骤按照试剂盒说明书进行测定。GSH-Px试剂盒(A005)、MDA试剂盒(A003) 和SOD试剂盒(A001-1) 购于南京建成生物工程研究所。
1.5.4 血清抗体水平分析按照猪瘟、伪狂犬病和高致病性猪蓝耳病病毒抗体酶联免疫吸附测定(ELISA)试剂盒(CIVTEST SUISHC/PPC,法国LSI公司)说明书步骤进行操作,ELISA仪(FAME 24/20,瑞士HAMILTON公司)测450 nm波长下吸光度(OD)值,与ELISA试剂盒中标准品及其对应OD值进行比对,进行抗体水平分析。
1.5.5 外周血淋巴细胞增殖率的测定血液预处理:将全血与D-Hanks溶液按1 : 1混合,加入到淋巴细胞分离液中于2 000 r/min离心30 min。取中间白细胞部分,用红细胞裂解液裂解其中红细胞后,用RPMI-1640(美国Hyclone公司)清洗3次,每次清洗后离心5 min(2 000 r/min),用台盼蓝染色计数活细胞数(应在95%以上),然后将脾淋巴细胞悬浮于RPMI-1640完全培养液调整细胞密度到2×106个/mL。
淋巴细胞增殖率测定:将上述细胞悬液分加于96孔培养板中,每孔190 μL,同时加10 μL伴刀豆凝集素A(ConA)。将培养板置于5%的CO2培养箱内,37 ℃培养72 h。培养结束前4 h,每孔加入100 μL 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),继续培养。培养结束后,每孔吸出100 μL上清液,加入100 μL二甲基亚砜(DSMO)溶解紫色结晶产物,用酶联免疫检测仪在570 mn波长下测定OD值。以对照组吸光度值为1,将试验组与对照组进行比较,分析得出各试验组细胞数量相对于对照组的百分比,即为淋巴细胞增殖率。
1.6 数据处理与分析数据分析采用SAS 9.2统计软件,各组间差异采用单因素方差(one-way ANOVA)分析,采用正交多项式比较法对不同ZEA水平梯度的处理效应进行一次线性回归分析,用Duncan氏多组极差检验法进行多重比较,显著性水平P < 0.05。
2 结果与分析 2.1 ZEA对断奶小母猪生长性能的影响由表 2可知,ZEA对断奶小母猪的平均日增重、平均日采食量和料重比均没有显著影响(P > 0.05)。但是,随着饲粮ZEA水平的升高,饲粮料重比呈一次线性降低的趋势(P=0.075)。
|
|
表 2 玉米赤霉烯酮对断奶小母猪生产性能的影响 Table 2 Effects of ZEA on performance of weaning gilts (n=10) |
由表 3可知,与对照组相比,0.5、1.0和1.5 mg/kg ZEA组的血清GSH-Px活性均显著降低(P < 0.05),而血清MDA含量则显著升高(P < 0.05)。随着饲粮ZEA水平的增加,血清GSH-Px和SOD活性呈一次线性降低(P < 0.05),血清MDA含量则呈一次线性升高(P < 0.05)。
|
|
表 3 玉米赤霉烯酮对断奶小母猪血清抗氧化功能的影响 Table 3 Effects of ZEA on serum antioxidant function of weaning gilts (n=10) |
由表 4可知,1.5 mg/kg ZEA组的血清猪瘟、伪狂犬病病毒抗体水平均显著低于对照组(P < 0.05),1.0 mg/kg ZEA组的血清猪瘟病毒抗体水平显著低于对照组(P < 0.05),各组间的血清高致病性猪蓝耳病病毒抗体水平差异不显著(P > 0.05)。随着饲粮ZEA水平的增加,断奶小母猪的血清猪瘟、伪狂犬病和高致病性猪蓝耳病病毒抗体水平均呈一次线性降低(P < 0.05)。
|
|
表 4 玉米赤霉烯酮对断奶小母猪血清抗体水平的影响(以OD450 nm表示) Table 4 Effects of ZEA on serum antibody levels of weaning gilts (expressed as OD450 nm, n=10) |
由图 1可知,与对照组相比,1.0和1.5 mg/kg ZEA组的外周血淋巴细胞增殖率显著降低(P < 0.05),而0.5 mg/kg组无显著变化(P > 0.05)。随着饲粮ZEA水平的增加,断奶小母猪的外周血淋巴细胞增殖率呈一次线性降低(P < 0.05)。
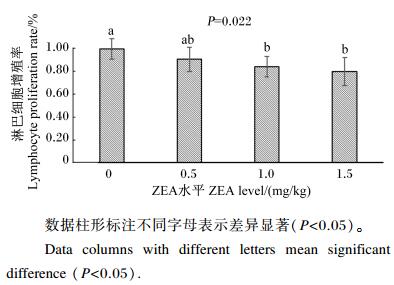
|
图 1 玉米赤霉烯酮对断奶小母猪外周血淋巴细胞增殖率的影响 Figure 1 Effects of ZEA on lymphocyte proliferation rate in peripheral blood of weaning gilts (n=10) |
近期有关ZEA在动物饲粮中的研究,多是采用已知ZEA水平的天然污染饲粮为试验材料[1, 8-10]。为了避免天然污染饲粮中,其他毒素对ZEA毒性的机制研究产生的干扰,本研究选择高纯度ZEA,在本实验室前期研究结果[1, 3, 9-10]基础上,继续探索较低水平ZEA(0.5~1.5 mg/kg)对断奶小母猪的氧化应激和免疫毒性。
3.1 ZEA对断奶小母猪生长性能的影响ZEA在断奶小母猪平均日采食量、平均日增重及料重比方面的研究结论并不一致。有研究报道,断奶仔猪饲粮中添加3 mg/kg的ZEA没有显著影响仔猪平均日采食量、平均日增重和料重比[11]。饲粮添加1~3 mg/kg的ZEA对仔猪的平均日增重和料重比也没有显著改变[12]。然而Powell-Jones等[13]研究发现,ZEA具有潜在促生长作用,而在结论中,并未对ZEA具体水平进行分析。本研究条件下,饲粮中添加0.5~1.5 mg/kg ZEA对小母猪的平均日采食量、平均日增重和料重比均没有显著影响,但值得一提的是,断奶小母猪的料重比随着ZEA水平的增加呈现出线性降低趋势(P=0.075),表明低水平(0.5~1.5 mg/kg)ZEA具有潜在的促生长作用。另有报道显示,随着饲粮中ZEA水平(3.0~9.0 mg/kg)的增加,母猪(初始体重为64 kg)的采食量、平均日增重和饲粮报酬均呈现下降趋势[14]。综上所述,饲粮中不同水平的ZEA在生猪不同生长阶段具有不同的作用效果,有关ZEA水平与动物生长性能之间的相关性及其作用机理的研究,尚需进一步研究证实。
3.2 ZEA对断奶小母猪血清抗氧化功能的影响自由基反应对动物机体的防御机制是必要的,正常动物体内自由基的产生与清除处于动态平衡。研究表明,ZEA能够刺激动物机体产生氧化应激[15-16],使机体氧化能力超过抗氧化能力,进而增加动物体内氧自由基的数量,最终导致生物膜脂过氧化[17-18]。饲粮中添加2.0和3.2 mg/kg ZEA使仔猪血清中GSH-Px的活性显著低于不添加ZEA组[19]。血清MDA含量作为反映细胞损伤的生物标记物,在本研究条件下,对照组血清MDA含量均显著低于ZEA组,且随着ZEA水平的增加呈一次线性增加;对照组血清GSH-Px活性显著高于ZEA组,随着ZEA水平增加呈一次线性下降。我国《饲料卫生标准》规定仔猪饲粮中ZEA最高限定水平为0.5 mg/kg(GB 13078.2—2006),欧盟关于仔猪饲粮中ZEA的最高限定水平为0.1 mg/kg[20]。值得强调的是,本研究条件下,饲粮中添加0.5 mg/kg ZEA足以能够引起仔猪氧化应激反应,使机体血清抗氧化功能显著降低,给我国《饲料卫生标准》仔猪饲粮中ZEA限量标准提供了理论依据。尽管研究者们对ZEA降低血清抗氧化功能的观点普遍认可[21-23],但尚未见低水平ZEA对动物机体启动过氧化机制的研究报道,其分子机制有待畜牧工作者进行更深层次的探究。
3.3 ZEA对断奶小母猪血清抗体水平的影响猪瘟、伪狂犬病和高致病性猪蓝耳病均是对仔猪健康有巨大威胁的传染病。多数情况下,免疫接种能够起到相对理想的效果,但是多年来免疫失败或猪群体免疫反应低下的现象也是屡见不鲜,成为疫情爆发的重大安全隐患。报道显示,正常猪瘟免疫18 d后,2.0和3.2 mg/kg ZEA组仔猪体内猪瘟病毒抗体水平显著低于对照组[24]。本研究结果显示,饲粮中添加1.0和1.5 mg/kg ZEA能够显著降低猪瘟病毒抗体水平,且1.5 mg/kg ZEA组伪狂犬病病毒抗体水平显著低于对照组;猪瘟、伪狂犬病和高致病性猪蓝耳病病毒抗体水平随着饲粮中ZEA水平的增加均呈一次线性下降,提示ZEA抑制了病毒抗体的产生,对断奶小母猪体液免疫功能产生了负面影响。单一毒素ZEA启动机体病毒抗体水平降低的最低水平尚未见报道,因此饲粮中ZEA水平与断奶小母猪体内病毒抗体水平变化的相关性探索及其机理,将是本课题组接下来的重要研究内容之一。
3.4 ZEA对断奶小母猪外周血淋巴细胞增殖率的影响淋巴细胞的增殖能力是反映细胞免疫功能的一项重要指标。Lioi等[25]研究发现,ZEA能够抑制牛淋巴细胞的增殖;另有研究显示,ZEA能够极显著抑制离体小鼠脾脏T淋巴细胞和B淋巴细胞的增殖[26-27]。众多研究表明,离体条件下ZEA可使淋巴细胞内环境稳态失调而发挥免疫毒性作用,对小鼠外周血淋巴细胞产生直接毒害作用[28-30]。前人关于ZEA对淋巴细胞增殖率的研究结论,大多是在离体条件下得出的,而采食ZEA饲粮对断奶小母猪外周血淋巴细胞增殖率的研究却鲜有报道。本研究结果表明,饲粮中添加1.0 mg/kg的ZEA能够使小母猪外周血淋巴细胞增殖率显著降低,提示饲粮中1.0 mg/kg ZEA足以诱导小母猪的细胞免疫。本课题组将通过细胞和分子生物学手段,进一步探索饲粮中ZEA水平与断奶小母猪细胞免疫和体液免疫的相关性。
4 结论① 饲粮中0.5~1.5 mg/kg ZEA对断奶小母猪生长性能没有显著影响,但小母猪料重比随饲粮ZEA水平的升高呈一次线性降低。
② 饲粮0.5 mg/kg ZEA足以诱导断奶小母猪血清的氧化应激反应,血清GSH-Px活性显著降低,血清MDA含量则显著升高,且二者随饲粮ZEA水平升高呈一次线性变化。
③ 饲粮1.0 mg/kg ZEA足以诱导断奶小母猪的体液免疫和细胞免疫反应,血清病毒(猪瘟、伪狂犬病和高致病性猪蓝耳病病毒)抗体水平和外周血淋巴细胞增殖率随饲粮ZEA水平增加均呈一次线性降低。
| [1] | 陈祥兴, 杨维仁, 张崇玉, 等. 镰刀菌毒素对断奶仔猪生长性能、小肠二糖酶活性和抗氧化能力的影响[J]. 动物营养学报, 2015, 27(6) :1875–1882. |
| [2] | 戎晓平, 赵丽红, 计成, 等. 我国部分地区饲料原料及配合饲料玉米赤霉烯酮污染情况调研[J]. 中国畜牧杂志, 2015, 51(22) :20–24. DOI: 10.3969/j.issn.0258-7033.2015.22.004 |
| [3] | JIANG S Z, YANG Z B, YANG W R, et al. Effects of purified zearalenone on growth performance, organ size, serum metabolites, and oxidative stress in postweaning gilts[J]. Journal of Animal Science, 2011, 89(10): 3008–3015. DOI: 10.2527/jas.2010-3658 |
| [4] | 陈继发, 曲湘勇, 彭灿阳, 等. 玉米赤霉烯酮对猪生产的影响及其毒性吸附研究[J]. 动物营养学报, 2016, 28(3) :680–686. |
| [5] | FITZPATRICK D W, PICKEN C A, MURPHY L C, et al. Measurement of the relative binding affinity of zearalenone, α-zearalenol and β-zearalenol for uterine and oviduct estrogen receptors in swine, rats and chickens:an indicator of estrogenic potencies[J]. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology, 1989, 94(2): 691–694. DOI: 10.1016/0742-8413(89)90133-3 |
| [6] | 邓友田, 袁慧. 玉米赤霉烯酮毒性机理研究进展[J]. 动物医学进展, 2007, 28(2) :89–92. |
| [7] | ZHENG W L, PAN S Y, WANG G G, et al. Zearalenone impairs the male reproductive system functions via inducing structural and functional alterations of sertoli cells[J]. Environmental Toxicology and Pharmacology, 2016, 42: 146–155. DOI: 10.1016/j.etap.2016.01.013 |
| [8] | DÖLL S, GERICKE S, DÄNICKE S, et al. The efficacy of a modified aluminosilicate as a detoxifying agent in Fusarium toxin contaminated maize containing diets for piglets[J]. Journal of Animal Physiology and Animal Nutrition, 2005, 89(9/10): 342–358. |
| [9] | 杨立杰, 牛群升, 张崇玉, 等. 短期饲喂镰刀菌毒素饲粮诱导断奶仔猪阴户、血清代谢和氧化应激指标的改变[J]. 猪业科学, 2016, 33(3) :85–88. |
| [10] | 牛群升, 杨维仁, 黄丽波, 等. 镰刀菌毒素对断奶小母猪阴户、生殖器官指数、子宫雌激素受体分布和表达的影响[J]. 动物营养学报, 2016, 28(5) :1525–1533. |
| [11] | ŠPERANDA M, LIKER B, ŠPERANDA T, et al. Haematological and biochemical parameters of weaned piglets fed on fodder mixture contaminated by zearalenone with addition of clinoptilolite[J]. Acta Veterinaria, 2006, 56(2/3): 121–136. |
| [12] | 赵虎, 杨在宾, 杨维仁, 等. 玉米赤霉烯酮对仔猪生产性能和内脏器官发育影响的研究[J]. 粮食与饲料工业, 2008(10) :37–38. DOI: 10.3969/j.issn.1003-6202.2008.10.015 |
| [13] | POWELL-JONES W, RAEFORD S, LUCIER G W. Binding properties of zearalenone mycotoxins to hepatic estrogen receptors[J]. Molecular Pharmacology, 1981, 20(1): 35–42. |
| [14] | YOUNG L G, VESONDER R F, FUNNELL H S, et al. Moldy corn in diets of swine[J]. Journal of Animal Science, 1981, 52(6): 1312–1318. DOI: 10.2527/jas1981.5261312x |
| [15] | 王建花, 张燚, 龙淼. 玉米赤霉烯酮所致氧化应激的研究进展[J]. 畜牧与饲料科学, 2015, 36(9) :30–32. |
| [16] | 王旭, 黄德玉, 吴庆华, 等. 真菌毒素引起的氧化应激及其毒理学意义[J]. 生态毒理学报, 2015, 10(6) :62–70. |
| [17] | LAUTERT C, FERREIRO L, WOLKMER P, et al. Individual in vitro effects of ochratoxin A, deoxynivalenol and zearalenone on oxidative stress and acetylcholinesterase in lymphocytes of broiler chickens[J]. SpringerPlus, 2014, 3(1): 506. DOI: 10.1186/2193-1801-3-506 |
| [18] | 伍宇超, 杨维仁, 杨在宾, 等. 低剂量玉米赤霉烯酮和吸附剂对育成期蛋鸡生长性能、血清生化指标和抗氧化指标的影响[J]. 动物营养学报, 2016, 28(4) :1137–1144. |
| [19] | 姜淑贞. 玉米赤霉烯酮对断奶仔猪的毒性初探及改性蒙脱石的脱毒效应研究[D]. 博士学位论文. 泰安: 山东农业大学, 2010. |
| [20] | European Commission. Commission recommendation of 17 August 2006 on the presence of deoxynivalenol, zearalenone, ochratoxin A, T-2 and HT-2 and fumonisins in products intended for animal feeding[J]. Official Journal of the European Union, 2006, 229: 7–9. |
| [21] | 朱祖贤, 朱风华, 王友令, 等. 霉菌毒素对肉鸡抗氧化和免疫功能的影响[J]. 中国畜牧杂志, 2014, 50(19) :78–82. DOI: 10.3969/j.issn.0258-7033.2014.19.018 |
| [22] | 尹淑彤, 张圆圆, 单安山, 等. 玉米赤霉烯酮对鼠和猪母体免疫损伤的影响及改性埃洛石脱毒作用的研究[C]//中国畜牧兽医学会. 中国畜牧兽医学会动物营养学分会第七届中国饲料营养学术研讨会论文集. 北京: 中国畜牧兽医学会, 2014. |
| [23] | 徐明龙, 郭保平, 胡进, 等. 玉米赤霉烯酮对原代大鼠睾丸支持细胞增殖相关基因表达以及氧化应激的影响[J]. 江苏农业科学, 2016, 44(4) :298–302. |
| [24] | 姜淑贞, 杨维仁, 杨在宾, 等. 玉米赤霉烯酮污染日粮添加改性蒙脱石对断奶仔猪免疫指标的影响[J]. 中国农业科学, 2012, 45(16) :3382–3390. DOI: 10.3864/j.issn.0578-1752.2012.16.018 |
| [25] | LIOI M B, SANTORO A, BARBIERI R, et al. Ochratoxin A and zearalenone:a comparative study on genotoxic effects and cell death induced in bovine lymphocytes[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2004, 557(1): 19–27. DOI: 10.1016/j.mrgentox.2003.09.009 |
| [26] | 范小龙, 刘长永, 剡海阔, 等. 玉米赤霉烯酮对小鼠脾淋巴细胞增殖及分泌细胞因子的影响[J]. 中国畜牧兽医, 2011, 38(5) :48–54. |
| [27] | 潘顺叶, 王光光, 范文桐, 等. 玉米赤霉烯酮诱导CTLL-2细胞凋亡途径的研究[J]. 中国兽医科学, 2016, 46(3) :398–402. |
| [28] | 王亚超, 邓俊良, 徐世文. 玉米赤霉烯酮对体外培养鸡脾脏淋巴细胞内环境稳态的影响[C]//中国畜牧兽医学会. 中国畜牧兽医学会家畜内科学分会第七届代表大会暨学术研讨会论文集(下册). 北京: 中国畜牧兽医学会, 2011. |
| [29] | 许利娜. 玉米赤霉烯酮对离体培养小鼠胸腺细胞、胸腺上皮细胞及脾脏淋巴细胞的毒性研究[D]. 硕士学位论文. 广州: 华南农业大学, 2008. |
| [30] | 梁梓森, 许利娜, 邓衔柏, 等. 玉米赤霉烯酮对小鼠脾淋巴细胞增殖与细胞凋亡的影响[C]//中国畜牧兽医学会. 中国畜牧兽医学会动物解剖学及组织胚胎学分会第十五次学术研讨会论文集. 杨凌: 中国畜牧兽医学会, 2008. |




