2. 天津现代晨辉科技集团有限公司, 天津市水族动物功能性饲料企业重点实验室, 天津 301800;
3. 天津海友佳音生物科技股份有限公司, 天津 300350
2. Tianjin Enterprise Key Lab of the Functional Feed of Aquatic Animals, Tianjin Chenhui Modern Technology Group Co., Ltd., Tianjin 301800, China;
3. Tianjin Ocean Pal Carol Biotech Co., Ltd., Tianjin 300350, China
蛋白质是生命的物质基础,机体中的每一个细胞和所有重要组成部分都有蛋白质参与。蛋白质摄入量不足会影响抗体的形成;蛋白质的缺乏也会导致维生素或微量元素的缺乏,从而降低机体的营养水平和免疫能力,影响养殖动物的健康。补充适量的相应氨基酸,可以起到增强蛋白质的合成和提高免疫力的作用。其中有一类氨基酸叫做功能性氨基酸,它是指除了合成蛋白质外还具有其他特殊功能的氨基酸,不仅对动物的正常生长和维持是必需的,而且对很多生物活性物质的合成也是必需的[1]。精氨酸(Arg)是功能性氨基酸的一种。目前Arg在哺乳动物方面报道颇多[2-5],研究表明,Arg参与体内蛋白质的沉积,通过多种酶参与机体代谢,并通过其代谢产物一氧化氮(NO)和多胺等在动物体内发挥多重营养生理效应[4];此外,作为一种重要的生物活性物质,多胺能参与蛋白质合成、细胞增殖分化,还能调节基因的表达[5-6]。
Arg是鱼类的一种必需氨基酸,Arg及其代谢产物NO、鸟氨酸和瓜氨酸可以起到增强细胞吞噬和杀菌、促进免疫球蛋白的合成等免疫调节作用。研究发现,手术前摄入适量的Arg能够有效减少术后脓毒血症的发生,提高抗感染的能力[7]。在断奶仔猪饲粮中添加适量的Arg可以有效降低仔猪肠绒毛的隐窝深度,提高肠道白细胞介素2(IL-2) 基因表达水平,从而增强肠道的免疫功能[3]。一些Arg在水产动物免疫方面的研究表明,Arg可以增强斑点叉尾巨噬细胞产生NO的能力,提高抵抗爱德华氏菌的免疫能力[8]。在饲料中添加Arg也有助于提高美国红鱼[9]和杂交条纹鲈[10]免疫细胞的呼吸爆发活性、吞噬作用和溶菌酶的活力。
鲤鱼俗称鲤拐子,原产亚洲,是温带性淡水鱼,杂食性。鲤鱼生长很快,肉质鲜美,是我国养殖鱼的主要品种之一。Arg作为一种功能性氨基酸在水产动物上的研究目前还不深入[11],本试验以鲤鱼为研究对象,通过在体外培养基中添加Arg的方法,筛选敏感的免疫指标,确定Arg适宜添加浓度,再通过体内注射Arg来进一步验证其对鲤鱼生理生化指标及免疫力的影响,以期为绿色环保健康的水产养殖提供参考。
1 材料与方法 1.1 试验设计试验鱼来自天津市换新水产良种场同一批繁殖的鲤鱼鱼种,鱼体消毒后放入水箱中暂养1周。Arg购自台湾MDbio公司,纯度为99.4%。
体外试验:取体格健壮、大小相似(平均体重34 g)的试验鱼27尾,麻醉后,静脉取血,然后解剖获得头肾和中肾,放在0.85%生理盐水中,洗去附着的血细胞。向RPMI-1640培养基中分别加入0、0.5、1.0、1.5和2.0 mmol/L的Arg,制成5种不同浓度梯度的培养基,用于白细胞的培养,用2个独立的复合样品(每个样本3个重复)进行免疫学指标的测定。
体内试验:将150尾重量和大小相近的鲤鱼,随机分为5组,每组3个重复,每个重复10尾,以重复为单位放养于水箱(110 L)中,投喂商业饲料,每天2次。1周后,用Arg药剂配制不同浓度的Arg溶液,5组试验鱼Arg注射量分别为0、25、50、100和200 mg/kg鱼体重,腹腔注射,注射剂量为0.5 mL,注射完后继续每天投喂商业饲料,投喂2周后解剖采样。
1.2 样品制备与测定体外试验:按照程镇燕等[12]方法进行白细胞的分离和原代培养,调整细胞悬浮液密度至每毫升2×107个细胞,要求用0.1%台盼蓝染色测定活力均大于95%。将肾脏白细胞培养12和48 h后测定增殖指数,培养2、6、12、24 h后测定呼吸爆发活力,培养12 h后测定吞噬活力,培养18 h后测定杀菌率。具体测定方法参考程镇燕等[12]的方法。
体内试验:用经过7%肝素钠溶液润湿的注射器从尾部静脉抽血,将每条鱼的血液单独放1个离心管里,血液样本以4 000 r/min离心10 min,收集血清,血清保存在-80 ℃冰箱中待测。之后解剖鱼体,取肝胰脏,放入匀浆器中进行研磨,用0.85%生理盐水进行稀释,2 500 r/min离心10 min,取上清液进行白蛋白(ALB)、NO含量及一氧化氮合酶(NOS)活性的测定(具体测定方法参照南京建成生物工程研究所试剂盒说明书)。取头肾、中肾放于生理盐水中清洗表面血污,然后放在培养液中进行培养,按照Buentello等[8]的方法进行增殖指数、呼吸爆发活力和吞噬活力的测定。
1.3 数据处理所得数据用SPSS 16.0统计软件做单因素方差分析(one-way ANOVA),若差异达到显著水平(P < 0.05),则采用Duncan氏法进行组间多重比较。
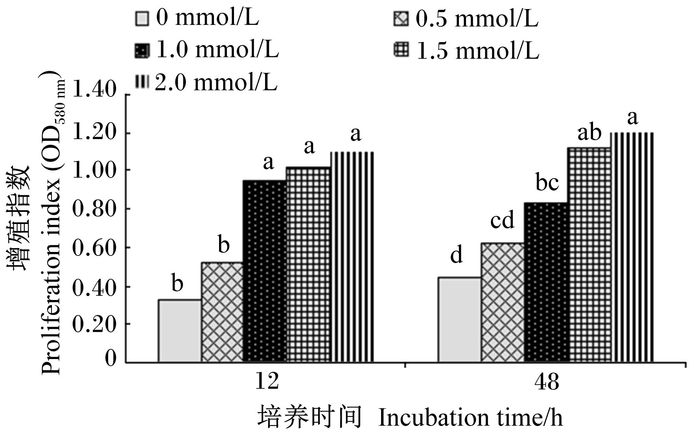
2 结果 2.1 培养基中添加Arg对鲤鱼肾脏白细胞增殖指数的影响如图 1所示,培养基中添加Arg后,鲤鱼肾脏白细胞的增殖指数明显升高。培养12 h后,1.0、1.5和2.0 mmol/L Arg组肾脏白细胞的增殖指数显著高于0和0.5 mmol/L Arg组(P < 0.05),0和0.5 mmol/L Arg组之间无显著差异(P>0.05),1.0、1.5和2.0 mmol/L Arg组之间无显著差异(P>0.05)。培养48 h后,随着培养基中Arg浓度的增加,肾脏白细胞的增殖指数逐渐提高,2.0 mmol/L Arg组肾脏白细胞的增殖指数最高,显著高于0、0.5、1.0 mmol/L Arg组(P < 0.05),但与1.5 mmol/L Arg组差异不显著(P>0.05)。除添加1.0 mmol/L Arg组培养48 h后的肾脏白细胞的增殖指数较培养12 h有所降低外,其他均有所增高。
|
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 培养基中添加Arg对鲤鱼肾脏白细胞增殖指数的影响 Figure 1 Effects of culture media supplemented with Arg on proliferation index of leukocytes in carp kidney |
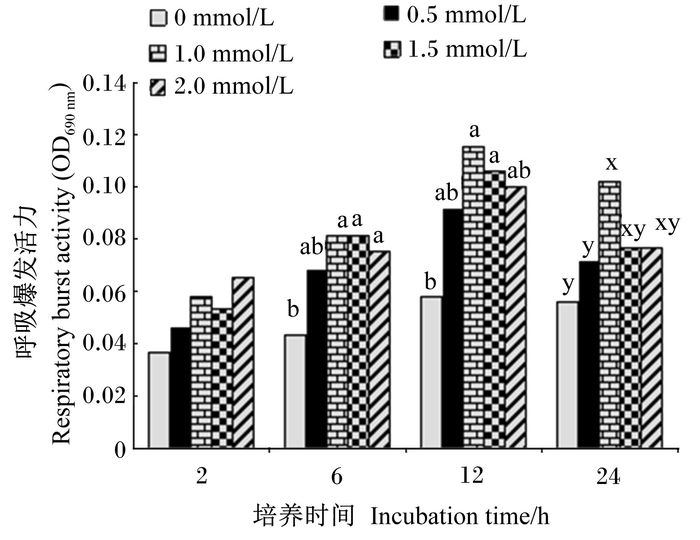
如图 2所示,培养基中添加Arg后,鲤鱼肾脏白细胞的呼吸爆发活力明显升高。培养2 h后,0.5、1.0、1.5、2.0 mmol/L Arg组肾脏白细胞呼吸的爆发活力较0 mmol/L Arg组均有所增加,但是各组之间差异不显著(P>0.05)。培养6、12、24 h后,1.0、1.5、2.0 mmol/L Arg组之间肾脏白细胞的呼吸爆发活力差异不显著(P>0.05),但是较0和0.5 mmol/L Arg组却有明显提高,其中1.0 mmol/L Arg组显著高于0 mmol/L Arg组(P < 0.05);随着培养时间的延长,各组肾脏白细胞的呼吸爆发活力均呈现先上升后下降的趋势,且最高值发生在培养12 h后的1 mmol/L Arg组中。
|
图 2 培养基中添加Arg对鲤鱼肾脏白细胞呼吸爆发活力的影响 Figure 2 Effects of culture media supplemented with Arg on respiratory burst activity of leukocytes in carp kidney |
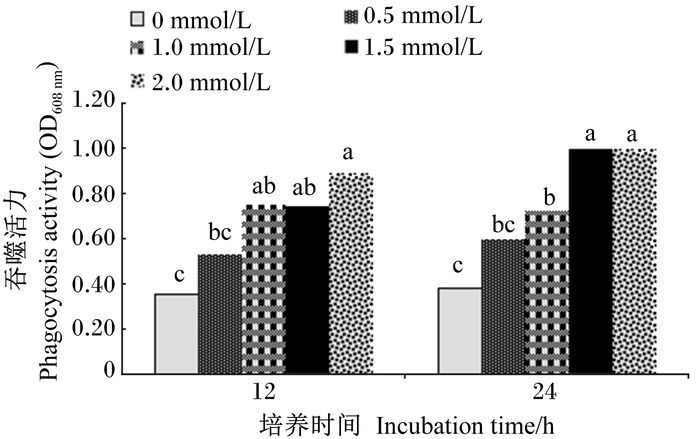
如图 3所示,培养基中添加Arg后,鲤鱼肾脏白细胞的吞噬活力均有所提高。培养12 h后,各组肾脏白细胞的吞噬活力随着培养基中Arg浓度的增加呈上升趋势,2.0 mmol/L Arg组肾脏白细胞的吞噬活力最高,显著高于0和0.5 mmol/L Arg组(P < 0.05),与1.0、1.5 mmol/L Arg组差异不显著(P>0.05)。培养24 h后,各组肾脏白细胞的吞噬活力也是随着培养基中Arg浓度的增加呈上升的趋势,1.5、2.0 mmol/L Arg组肾脏白细胞的吞噬活力显著高于其他各组(P < 0.05)。
|
图 3 培养基中添加Arg对鲤鱼肾脏白细胞吞噬活力的影响 Figure 3 Effects of culture media supplemented with Arg on phagocytosis activity of leukocytes in carp kidney |
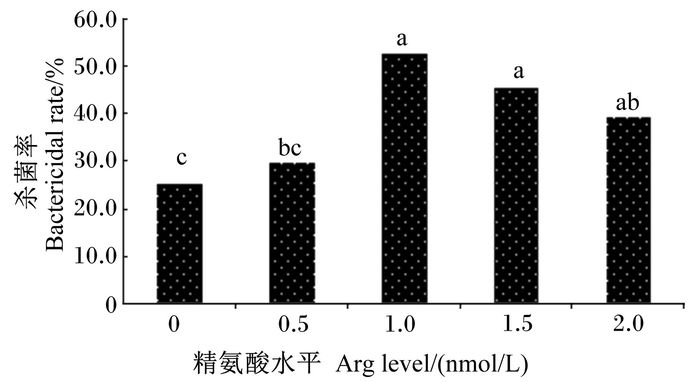
如图 4所示,培养基中添加Arg培养18 h后,鲤鱼肾脏白细胞的杀菌率(迟钝爱德华氏菌)均有明显提升。1.0、1.5和2.0 mmol/L Arg组之间肾脏白细胞的杀菌率没有显著差异(P>0.05),但是1.0、1.5 mmol/L Arg组肾脏白细胞的杀菌率显著高于0和0.5 mmol/L Arg组(P < 0.05),其中在1 mmol/L Arg组肾脏白细胞的杀菌率达到顶峰。
|
图 4 培养基中添加Arg对鲤鱼肾脏白细胞杀菌率的影响 Figure 4 Effects of culture media supplemented with Arg on bactericidal rate of leukocytes in carp kidney |
如表 1所示,鲤鱼注射Arg后,肾脏白细胞呼吸爆发活力、吞噬活力和增殖指数均有所提高。随着Arg注射浓度的增加,肾脏白细胞呼吸爆发活力呈现先上升后趋于稳定的趋势,100和200 mg/kg Arg组达到最高值,显著高于0和25 mg/kg Arg组(P < 0.05),与50 mg/kg Arg组差异不显著(P>0.05)。随着Arg注射浓度的增加,肾脏白细胞吞噬活力呈逐渐提高的趋势(P < 0.05),200 mg/kg组达到最高值,与100 mg/kg Arg组差异不显著(P>0.05),但显著高于其他各组(P < 0.05)。肾脏白细胞增殖指数的变化趋势与吞噬活力变化趋势一致,除25 mg/kg Arg组与0 mg/kg Arg组差异不显著(P>0.05) 外,其余各组均显著高于0 mg/kg Arg组(P < 0.05),200 mg/kg组达到最高值。
|
|
表 1 注射Arg对鲤鱼肾脏白细胞呼吸爆发活力、吞噬活力和增殖指数的影响 Table 1 Effects of Arg injection on respiratory burst activity, phagocytosis activity and proliferation index of leukocytes in carp kidney |
如表 2所示,鲤鱼注射Arg后,血清ALB、NO含量及血清和肝胰脏NOS活性有不同程度提高。随着Arg注射浓度的增加,血清ALB的含量呈现先上升后下降的趋势,100 mg/kg Arg组血清ALB含量最高,显著高于0、25、50 mg/kg Arg组(P < 0.05),但0、25、50 mg/kg Arg组之间差异不显著(P>0.05)。
|
|
表 2 注射Arg对鲤鱼肝胰脏、血清中白蛋白、一氧化氮含量及一氧化氮合酶活性的影响 Table 2 Effects of Arg injection on ALB, NO contents and NOS activity in hepatopancreas and serum of carp |
50 mg/kg Arg组肝胰脏中NO的含量最高,显著高于其他各组(P < 0.05);100、200 mg/kg Arg组之间差异不显著(P>0.05),但显著高于0和25 mg/kg Arg组(P < 0.05)。血清NO的含量则随着Arg注射浓度的增加呈上升趋势,200 mg/kg Arg组血清NO含量最高,显著高于0、25和50 mg/kg Arg组(P < 0.05),与100 mg/kg Arg组差异不显著(P>0.05)。
血清和肝胰脏中NOS活性随着Arg注射浓度的增加而呈现先上升后下降的趋势。25 mg/kg Arg组肝胰脏中NOS活性最高,显著高于0和200 mg/kg Arg组(P < 0.05),之后随着Arg注射浓度的增加呈下降趋势。50 mg/kg Arg组血清NOS活性最高,显著高于其他各组(P < 0.05),之后随着Arg注射浓度的提高呈下降趋势。
3 讨论 3.1 Arg对鲤鱼肾脏白细胞增殖能力的影响研究表明,Arg可以合成多胺,从而促进细胞的增殖,成为细胞免疫的重要营养成分,细胞内Arg的浓度可以调控多胺的合成[13]。本研究在体内和体外试验中均发现,添加Arg提高了鲤鱼肾脏白细胞的增殖指数,说明肾脏白细胞可以利用Arg作为一种重要的营养成分。而且,随着Arg浓度的增加,白细胞的增殖指数得到提升,当在培养基中添加1 mmol/L Arg培养12 h或体内注射100 mg/kg Arg培养白细胞时,增殖指数最高。这与在斑点叉尾[14]和小鼠[15]上的研究一致,均表明Arg可以促进淋巴细胞的增殖。
3.2 Arg对鲤鱼肾脏白细胞呼吸爆发活力的影响呼吸爆发是组织重新获得氧供应的短时间内,激活的中性粒细胞耗氧量显著增加,产生大量氧自由基,在细胞发挥免疫作用中,病原微生物被吞噬后,免疫细胞的一种氧依赖的杀伤机制。当机体被病菌侵入时,机体内的巨噬细胞会在Arg的推动下产生NO,NO则通过刺激超氧阴离子的产生从而引起呼吸爆发[9, 16]。体内研究试验也证实了这一点,随着Arg注射浓度的增加,血清和肝胰脏中NO的含量提高,而呼吸爆发活力也随着培养时间和Arg注射浓度的增加而相应提高。这与在斑点叉尾[14]上的研究结果一致,此外,在饲料中添加Arg的研究也发现,其能提高美国红鱼[9]和杂交条纹鲈[10]的呼吸爆发活力。
3.3 Arg对鲤鱼肾脏白细胞吞噬能力和杀菌能力的影响细胞的吞噬能力与其数量和吞噬活性有关,本研究中,将其数量统一在每毫升5×107个细胞,其吞噬活性随着Arg浓度的增加而上升。对于断奶仔猪的试验表明,当饲粮中添加Arg时,能够促进中性粒细胞在发炎部位的集合,提高了细胞吞噬活力[17]。研究还表明,饲料中添加Arg有助于鲤鱼头肾等免疫器官的生长,提高白细胞的吞噬率,增强对疾病的抵抗能力[18]。这与本研究结果一致。相似的结果还见于斑点叉尾[14]、牙鲆[19]的研究中。细胞呼吸爆发产生的活性氧可杀灭入侵的病原,超氧阴离子是一种重要的活性氧,其产生量可反映吞噬细胞的杀菌活性[9]。本试验发现随着Arg浓度的增加,白细胞的杀菌率得到提高,也从侧面反映了细胞中NO含量的增加,导致呼吸爆发活力的增强,增加的NO提高了机体抵抗有害菌的侵害,说明添加Arg可促进NO的合成,提高机体的抗病免疫能力。从体内试验来看,注射Arg也提高了血清和肝胰脏NOS的活性,吞噬细胞可以通过NOS利用Arg产生NO,NO增强了吞噬细胞活性氧的杀菌活性[20]。
3.4 注射Arg对鲤鱼血清和肝胰脏中ALB、NO含量及NOS活性的影响本试验发现,注射一定浓度的Arg可以有效提高鲤鱼血清ALB的含量,而Arg又是生物体内NO合成的前体物质,随着Arg浓度的增加,鲤鱼血清和肝胰脏中NO含量提高,血清中NO含量在Arg注射浓度为200 mg/kg时达到最高值。在异育银鲫上的研究结果表明,饲料中添加Arg后,异育银鲫血清中的NO含量呈剂量依赖性增加[21]。NOS是NO合成的关键酶,其活性反映组织产生NO的能力。研究表明,饲料中添加Arg可以提高建鲤头肾诱导型一氧化氮合成酶(iNOS)[18]及军曹鱼血清NOS活性[22];此外,异育银鲫肝脏总NOS活性随饲料中Arg水平的增加而增强[21]。本试验发现,体内注射Arg后提高了血清和肝胰脏中NOS的活性,相应的,NOS活性的增强也促进了血清和肝胰脏中NO的产生。由此可以说明,Arg能提高鲤鱼NOS活性,促进NO生成。经相关研究表明,Arg-NO途径被认为是杀死细胞内微生物的有效机制,同时也是巨噬细胞对靶细胞毒性的主要机制[4]。产生的NO可以起到杀死动物体内的寄生虫、细菌、病毒,抑制癌症细胞的增殖,提高免疫力和抗病能力的作用[23-24]。所以,添加一定浓度的Arg有利于促进鲤鱼肝胰脏和血清中的细胞产生NO,从而提高鲤鱼的免疫力和抗病能力。
4 结论Arg提高了鲤鱼肾脏白细胞的免疫力,体外试验表明Arg的适宜浓度为1.0 mmol/L。正常摄食情况下,Arg在鲤鱼体内注射适宜浓度为50~100 mg/kg。
| [1] |
印遇龙, 孔祥峰, 伍国耀. 动物功能性氨基酸营养研究进展[C]//动物营养研究进展——中国畜牧兽医学会动物营养学分会第八届全国代表大学暨第十届学术研讨会论文集. 杭州: 中国畜牧兽医学会, 2008: 132-145.
|
| [2] |
LIU Y L, HUANG J J, HOU Y Q, et al. Dietary arginine supplementation alleviates intestinal mucosal disruption induced by Escherichia coli lipopolysaccharide in weaned pigs[J]. British Journal of Nutrition, 2008, 100(3): 552-560. DOI:10.1017/S0007114508911612 |
| [3] |
谭碧娥, 李新国, 孔祥峰, 等. 精氨酸对早期断奶仔猪肠道生长、组织形态及IL-2基因表达水平的影响[J]. 中国农业科学, 2008, 41(9): 2783-2788. |
| [4] |
刘俊峰, 胡慧, 孔祥峰, 等. 母猪精氨酸营养研究进展[J]. 动物营养学报, 2010, 22(4): 840-844. |
| [5] |
吴信, 印遇龙, 伍国耀. 功能性氨基酸——精氨酸和精氨酸生素在猪生产中的研究与应用进展[J]. 饲料与畜牧:新饲料, 2009(8): 8-11. |
| [6] |
NIEVES C Jr, LANGKAMP-HENKEN B. Arginine and immunity:a unique perspective[J]. Biomedicine & Pharmacotherapy, 2002, 56(10): 471-482. |
| [7] |
TSUEI B J, BERNARD A C, BARKSDALE A R, et al. Supplemental enteral arginine is metabolized to ornithine in injured patients[J]. Journal of Surgical Research, 2005, 123(1): 17-24. DOI:10.1016/j.jss.2004.07.006 |
| [8] |
BUENTELLO J A, REYES-BECERRIL M, ROMERO-GERALDO M J, et al. Effects of dietary arginine on hematological parameters and innate immune function of channel catfish (Ictalurus punctatus)[J]. Journal of Aquatic Animal Health, 2007, 19: 195-203. DOI:10.1577/H07-004.1 |
| [9] |
CHENG Z Y, BUENTELLO J A, GATLIN D M Ⅲ. Effects of dietary arginine and glutamine on growth performance, immune responses and intestinal structure of red drum, Sciaenops ocellatus[J]. Aquaculture, 2011, 319(1/2): 247-252. |
| [10] |
CHENG Z Y, GATLIN D M Ⅲ, BUENTELLO J A. Dietary supplementation of arginine and/or glutamine influences growth performance, immune responses and intestinal morphology of hybrid striped bass (Morone chrysops×Morone saxatilis)[J]. Aquaculture, 2012, 362-363: 39-43. DOI:10.1016/j.aquaculture.2012.07.015 |
| [11] |
程镇燕, 陈韶阳, 乔秀亭. 鱼类功能性氨基酸营养免疫研究进展[J]. 饲料研究, 2014(9): 53-57. |
| [12] |
程镇燕, 李建, 雷五长, 等. 谷氨酰胺对点带石斑鱼免疫细胞免疫力的影响[J]. 水产科学, 2014, 33(10): 606-610. DOI:10.3969/j.issn.1003-1111.2014.10.002 |
| [13] |
BARBUL A. Arginine:biochemistry, physiology, and therapeutic implications[J]. Journal of Parenteral & Enteral Nutrition, 1986, 10(2): 227-238. |
| [14] |
POHLENZ C, BUENTELLO J A, MWANGI W, et al. Arginine and glutamine supplementation to culture media improves the performance of various channel catfish immune cells[J]. Fish & Shellfish Immunology, 2012, 32(5): 762-768. |
| [15] |
SUAREZ BUTLER M F, LANGKAMP-HENKEN B, HERRLINGER-GARCIA K A, et al. Arginine supplementation enhances mitogen-induced splenocyte proliferation but does not affect in vivo indicators of antigen-specific immunity in mice[J]. The Journal of Nutrition, 2005, 135(5): 1146-1150. |
| [16] |
NEWSHOLME P, BRENNAN L, RUBI B, et al. New insights into amino acid metabolism, β-cell function and diabetes[J]. Clinical Science, 2005, 108(3): 185-194. DOI:10.1042/CS20040290 |
| [17] |
TAN B, LI X G, KONG X F, et al. Dietary L-arginine supplementation enhances the immune status in early-weaned piglets[J]. Amino Acids, 2009, 37(2): 323-331. DOI:10.1007/s00726-008-0155-1 |
| [18] |
CHEN G F, LIU Y, JIANG J, et al. Effect of dietary arginine on the immune response and gene expression in head kidney and spleen following infection of Jian carp with Aeromonas hydrophila[J]. Fish & Shellfish Immunology, 2015, 44(1): 195-202. |
| [19] |
GALINDO-VILLEGAS J, FUKADA H, MASUMOTO T, et al. Effect of dietary immunestimulants on some innate immune responses and disease resistance against Edwardsiella tarda infection in Japanese flounder (Paralichthys olivaceus)[J]. Nippon Suisan Gakkaishi, 2006, 54(2): 153-162. |
| [20] |
WEYTS F A A, FLIK G, VERBURG-VAN KEMENADE B M. Cortisol inhibits apoptosis in carp neutrophilic granulocytes[J]. Developmental & Comparative Immunology, 1998, 22(5/6): 563-572. |
| [21] |
TU Y Q, XIE S Q, HAN D, et al. Dietary arginine requirement for gibel carp (Carassis auratus gibelio var. CAS Ⅲ) reduces with fish size from 50 g to 150 g associated with modulation of genes involved in TOR signaling pathway[J]. Aquaculture, 2015, 449: 37-47. DOI:10.1016/j.aquaculture.2015.02.031 |
| [22] |
REN M C, AI Q H, MAI K S. Dietary arginine requirement of juvenile cobia (Rachycentron canadum)[J]. Aquaculture Research, 2014, 45(2): 225-233. DOI:10.1111/are.2014.45.issue-2 |
| [23] |
雷晓青, 吴伟宗, 方洛云, 等. 精氨酸营养生理功能研究新进展[J]. 中国畜牧杂志, 2009, 45(3): 46-49. |
| [24] |
石丹, 周小秋, 赵叶, 等. 精氨酸对鱼类免疫功能的影响及其机制[J]. 动物营养学报, 2015, 27(10): 3026-3032. DOI:10.3969/j.issn.1006-267x.2015.10.006 |




