2. 扬州大学动物科学与技术学院, 扬州 225009
2. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China
在羔羊的饲粮中,牧草所占的比例通常较低,因为牧草中的干物质较少,在瘤胃中的发酵率低。而谷物饲料是羔羊饲粮的主要成分,谷物中的主要营养成分为淀粉。淀粉是由多个葡萄糖基单元通过糖苷键结合成的高分子多糖,主要由2种分子结构组成:直链和支链。通常情况下,淀粉同时含有直链和支链2种形式[1-2]。相关研究证明,二者比例不同会影响羔羊的生理功能。刘文[3]研究发现饲喂高直链与支链淀粉比的豌豆淀粉饲粮,能提高羔羊血液中免疫球蛋白的浓度,并对羔羊的生长性能及肉品质有较好的影响。Ren等[4]研究了不同直链与支链淀粉比饲粮对育肥羔羊胃肠道发育的影响,发现不同直链与支链淀粉比会显著影响羔羊肠道的发育。瘤胃是羔羊非常重要的消化器官之一,营养物质的消化主要依靠瘤胃中的微生物。微生物对发酵底物具有选择性,可通过发酵摄入的底物间接改变瘤胃微生态环境[5],因此,不同直链与支链淀粉比的精料在瘤胃中发酵可能会对瘤胃中的微生物产生一定的影响。一些研究表明,单胃动物在不同日龄时的肠道菌群结构存在差异[6-7]。那么,羔羊在不同日龄时的瘤胃细菌菌群结构是否也存在着差异。目前,关于淀粉与不同日龄反刍动物瘤胃细菌菌群关系的报道仍相对较少。因此,本试验采用PCR-变性梯度凝胶电泳(DGGE)技术,研究精料中不同直链与支链淀粉比对不同日龄羔羊瘤胃细菌菌群的影响,对于深入了解不同淀粉组成对反刍动物消化道健康的影响至关重要。同时,也为充分发挥淀粉作为营养源对反刍动物肠道健康和机体健康的保障作用提供科学的理论依据。
1 材料与方法 1.1 试验材料 1.1.1 试验动物及设计试验采用单因素随机设计,选择健康、初生重无显著差异(P>0.05) 的48只初生公羔,随机分成4组,每组3个重复,每个重复4只。试验全期77 d。分别在21、35、56和77日龄,在每个重复中选择1只羔羊屠宰,并进行指标的测定。
1.1.2 试验饲粮试验精料的配制参照NRC(1985) 建议的育肥羔羊营养需要量进行。分别选择木薯淀粉(TS)、玉米淀粉(CS)、小麦淀粉(WS)和豌豆淀粉(PS)作为各组羔羊饲粮中唯一的淀粉来源,配制4种在淀粉和氮含量以及能量水平基本一致的试验精料。试验中所选用的淀粉源均为食品级(上海龙凤食品有限公司)。精料中直链和支链淀粉的含量根据Englyst等[8]描述的方法进行分析测定。TS、CS、WS和PS中直链与支链淀粉比分别为0.12、0.23、0.24和0.48。试验精料组成及营养水平见表 1。
|
|
表 1 试验精料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental concentrates (air-dry basis) |
试验前1周清扫、冲洗羊舍,并进行消毒处理。羔羊进行全舍饲饲养,采用瓶喂法人工哺乳至56日龄,并于产后7 d补饲对应的试验精料及优质苜蓿,并供应充足清洁饮水。每日饲喂4次(04:30、10:00、15:30和21:00)。试验全期定时进行畜舍消毒,密切观察羔羊健康状况。
1.2 样品采集分别在21、35、56和77日龄,在每个重复中选择1只羔羊,颈静脉放血致死后打开腹腔,采集羔羊瘤胃内容物,经无菌4层纱布过滤后,分装到无菌冻存管中,迅速投入液氮中带回实验室-80 ℃保存,用于微生物菌群的测定分析。
1.3 瘤胃液基因组DNA的提取及16S rDNA V6~V8区的扩增采用十六烷基三甲基溴化铵(CTAB)/十二烷基硫酸钠(SDS)方法提取各样品基因组DNA,以基因组DNA为模板,选择通用引物U968-GC-F和L1401R扩增16S rDNA的基因序列,引物信息见表 2。
|
|
表 2 引物信息 Table 2 Information of primers |
PCR扩增体系(50 μL)为:10×PCR buffer 5 μL;dNTP(2.5 mmol/L)3.2 μL;rTaq(5 U/μL)0.4 μL;U968-GC-F(20 μmol/L)1 μL;L1401R(20 μmol/L)1 μL;模板DNA 50 ng;补ddH2O至50 μL。PCR扩增程序为:预变性(94 ℃ 5 min);解链(94 ℃ 30 s),退火(56 ℃ 20 s),延伸(72 ℃ 40 s),共35个循环;最终72 ℃延伸7 min。
1.4 PCR产物的DGGE分析取10 μL PCR产物进行DGGE分析。采用变性梯度为35%~62%、浓度为8%的聚丙烯酰胺凝胶在1×TAE缓冲液中80 V、60 ℃下电泳16 h。电泳结束后采用银染法染色。
1.5 DGGE图谱中优势条带的回收与测序用灭菌的手术刀切下目的条带,采用Omega公司DNA凝胶回收试剂盒回收目的条带,以2 μL回收产物为模板,以U968F/L1401R(不含GC夹子)为引物进行PCR扩增,获得目的DNA片段。将重新扩增的DNA片段切胶回收、纯化处理后,连接到PMD18-T载体上,并转化至DH5α感受态细胞中,筛选阳性克隆。菌液由华大基因对插入的细菌16S rDNA片段序列进行测定。
1.6 多样性指数、相似性系数及条带测序细菌多样性指数是用来表示群落物种数、个体数和均匀度的综合指标。根据DGGE图谱中各泳道样品条带数目和每个条带的强度,分析各组样品中细菌多样性指数、均匀度和丰富度。采用Quantity one软件对DGGE图谱中各泳道条带数目、条带强度进行数字化分析。多样性指数、均匀度和丰富度计算公式如下:
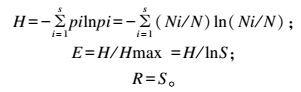
|
式中:H为多样性指数;E为均匀度;R为丰富度;pi为样品中单一条带的强度占该泳道全部条带总强度的比率;N为DGGE图谱某一单一泳道上全部条带的强度;Ni为第i条带的强度;S是某样品中总条带数目。
利用戴斯系数计算各组样品间PCR-DGGE图谱的相似性,计算公式如下:
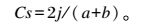
|
式中:j是样品A与B间相同的条带数;a和b分别是各自的条带数。
克隆条带测序结果于GenBank中进行序列对比分析,获得序列分类的信息,序列上传至NCBI获得序列登录号。
1.7 数据处理与分析DGGE图谱数据采用SPSS 16.0统计软件进行单因素方差分析,并用Duncan氏法进行多重比较检验,测定结果以平均值±标准差表示。统计分析结果以P < 0.05为差异显著。
2 结果与分析 2.1 PCR产物的DGGE分析结果分别从饲喂不同直链与支链淀粉比精料的21、35、56和77日龄羔羊瘤胃内容物中提取总DNA。经电泳分析,瘤胃微生物基因组DNA片段较大,且条带清晰,可用于后续PCR扩增分析。基因组DNA经V6~V8区通用引物(U968-GC-F和L1401R)PCR扩增后得到的16S rDNA片段大小为480 bp左右,可用于后续DGGE分析。
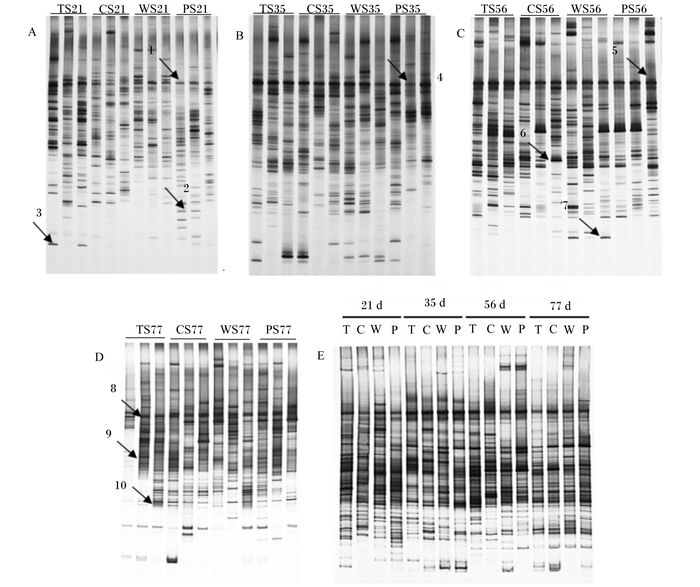
瘤胃细菌16S rDNA PCR产物的DGGE图谱分析结果见图 1。PCR-DGGE图谱中,强度高的电泳条带代表优势菌群,条带数量越多代表细菌丰富度越高,条带位置则代表细菌种类。由此可见,饲喂不同直链与支链淀粉比精料的羔羊在不同日龄时具有丰富的电泳条带。不同组羔羊于21、35、56和77日龄时瘤胃内细菌有共同的优势条带,如条带1、4、5、6、8、9和10;同时,不同组羔羊于21和56日龄也出现了特征条带,如条带2、3和7。不同泳道的条带强度、数量及位置的差异表明,同一日龄下精料中不同直链与支链淀粉比之间和同一直链与支链淀粉比下不同日龄之间羔羊瘤胃细菌菌群的结构组成均存在差异。不同日龄羔羊瘤胃内也存在共同的优势条带。
|
A.21日龄21 days of age;B.35日龄35 days of age;C.56日龄56 days of age;D.77日龄77 days of age;E.21~77日龄21 to 77 days of age。 T:TS组TS group; C:CS组CS group; W:WS组WS group;P:PS组PS group。 图 1 不同日龄羔羊瘤胃细菌16S rDNA PCR产物的DGGE图谱 Figure 1 DGGE profile of 16S rDNA PCR products from rumen bacteria in lambs at different days of age |
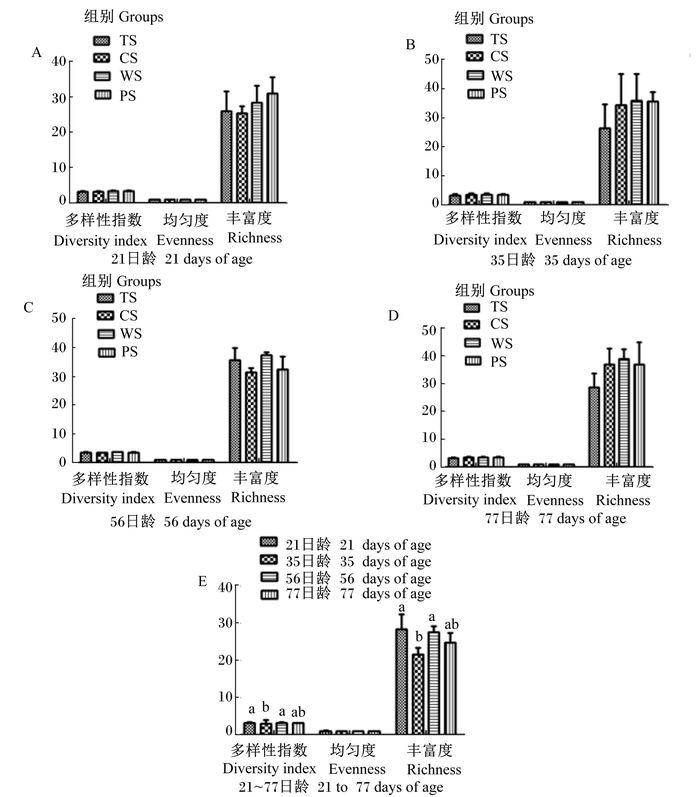
细菌16S rDNA V6~V8区PCR-DGGE图谱多样性分析见图 2。饲喂不同直链与支链淀粉比精料的羔羊瘤胃微生物多样性指数于21、35、56和77日龄时无显著性差异(P>0.05)。不同日龄对羔羊瘤胃细菌多样性的影响结果表明,多样性指数和丰富度随日龄增加有所降低,且21日龄显著高于35日龄(P < 0.05),略高于56和77日龄(P>0.05),各日龄间羔羊瘤胃细菌均匀度差异不显著(P>0.05)。
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 2 瘤胃细菌16S rDNA V6~V8区PCR-DGGE图谱的多样性分析 Figure 2 Diversity analysis of V6 to V8 of rumen bacterial 16S rDNA PCR-DGGE profile |
饲喂不同直链与支链淀粉比精料对21、35、56和77日龄羔羊瘤胃细菌相似性的影响分别见表 3、表 4、表 5和表 6。不同日龄对羔羊瘤胃细菌相似性的影响见表 7。结果显示,饲喂不同直链与支链淀粉比精料的羔羊21、35、56和77日龄瘤胃细菌无明显的组内相似性;但随日龄增加组内羔羊瘤胃细菌相似性系数有所提高。而相同日龄的平行样本间瘤胃细菌具有相对较高的相似性。
|
|
表 3 戴斯系数比较21日龄羔羊瘤胃细菌PCR-DGGE图谱的相似性 Table 3 Comparison of PCR-DGGE profile similarity of rumen bacteria in lambs at 21 days of age by Dice coefficients |
|
|
表 4 戴斯系数比较35日龄羔羊PCR-DGGE图谱的相似性 Table 4 Comparison of PCR-DGGE profile similarity of rumen bacteria in lambs at 35 days of age by Dice coefficients |
|
|
表 5 戴斯系数比较56日龄羔羊PCR-DGGE图谱的相似性 Table 5 Comparison of PCR-DGGE profile similarity of rumen bacteria in lambs at 56 days of age by Dice coefficients |
|
|
表 6 戴斯系数比较77日龄羔羊PCR-DGGE图谱的相似性 Table 6 Comparison of PCR-DGGE profile similarity of rumen bacteria in lambs at 77 days of age by Dice coefficients |
|
|
表 7 戴斯系数比较不同日龄羔羊PCR-DGGE图谱的相似性 Table 7 Comparison of PCR-DGGE profile similarity of rumen bacteria in lambs at different days of age by Dice coefficients |
|
|
表 8 DGGE回收条带的基因片段序列的比对结果 Table 8 Comparison of genomic sequences in bands of DGGE by sequencing and BLAST analysis |
从DGGE图谱上共回收10个条带(图 1),克隆测序结果见表 4。其中,条带1是饲喂不同直链与支链淀粉比精料的羔羊21日龄共有,测序后最接近Butyricimonas virosa,条带4是饲喂不同直链与支链淀粉比精料的羔羊35日龄共有,测序后最接近Prevotella ruminicola;条带5和6是饲喂不同直链与支链淀粉比精料的羔羊56日龄共有,测序后最接近Propionispira arcuata、生痰月形单胞菌(Selenomonas sputigena);条带8、9和10是饲喂不同直链与支链淀粉比精料的羔羊77日龄共有,测序后最接近布氏瘤胃球菌(Ruminococcus bromii)、Prevotella multisaccharivorax、Prevotella dentalis。PS组羔羊21日龄时2个试验重复出现条带2,而其他组羔羊未检测到,测序后最接近Butyricimonas paravirosa;条带3代表的细菌在21日龄的TS组羔羊瘤胃内含量相对较高,测序后最接近Prevotella marshii;条带7代表的细菌在56日龄的WS组羔羊瘤胃内含量相对最高,测序后最接近牛单胞月形菌(Selenomonas bovis)。所测定的10个条带多属于厚壁菌门和拟杆菌门。条带2与数据库中同源性最高的Butyricimonas paravirosa的相似性仅为88%,而与未培养细菌的相似性为96%,因此该序列所代表的可能为新的未培养细菌。条带3与数据库中同源性最高的Prevotella marshiia的相似性仅为90%,而与未培养瘤胃细菌的相似性为93%,因此这个序列所代表的有可能为新的未培养瘤胃细菌。
3 讨论反刍动物胃肠道内的微生物多以厚壁菌门和拟杆菌门为主[10-11]。已有研究表明,20日龄羔羊瘤胃已经出现了普雷沃氏菌门、瘤胃壁细菌门及拟杆菌门的细菌[12],且在21日龄时,羔羊瘤胃内的微生物已可以消化部分成年羊可利用的饲料[13]。随着日龄的增长和采食量的增加,兼性厌氧菌逐步被厌氧菌取代[14],此阶段羔羊瘤胃内的优势菌不稳定,但依然以拟杆菌门和厚壁菌门为优势菌[12]。在本研究中,DGGE图谱中条带的测序结果显示,所测序的共有条带和特征条带多属厚壁菌门和拟杆菌门,与前人研究结果一致。
增进对瘤胃微生物种属多样性和种群密度的了解是改善瘤胃发酵功能的前提。而瘤胃微生物群落结构受到宿主遗传背景、健康和饲粮等因素的影响, 并且表现出地域、季节和饲喂方式之间的区别[15]。DGGE图谱分析得出的多样性指数越大,就表示物种多样性越高;均匀度越接近于1,表示均匀程度越高,相应的优势物种不明显;丰富度的高低,表示物种数目的多少。通常情况下,微生物多样性高则生态系统会更加稳定。本研究发现,饲喂不同直链与支链淀粉比精料的羔羊于21、35、56和77日龄时瘤胃内细菌多样性指数、均匀度和丰富度均无显著性差异。张永婧等[16]研究发现,与小麦麸饲粮组相比,大豆皮饲粮组猪回肠食糜中微生物的多样性显著提高,与本试验研究结果不一致。田亚东等[17]研究发现,饲喂分别以玉米、小麦、大米为单一淀粉源配制的饲粮未能影响肉仔鸡肠道菌群的多样性和均匀度,与本试验的研究结果相似。因为前人研究的对于通过饲粮调节来改变动物消化道微生物的研究结果不一致,所以从本试验研究结果可以反映出,饲喂不同直链与支链淀粉比精料对羔羊瘤胃内优势菌无显著性影响,而是否存在菌群组成的细微变化有待于深入研究。
哺乳动物和禽类在刚出生时胃肠道内的微生物数量较少,而随着采食饲料和与外界环境的接触,胃肠道菌群逐渐增多。本试验研究日龄对羔羊瘤胃细菌多样性影响的结果发现,21日龄羔羊瘤胃内细菌多样性指数显著高于35日龄,到达56和77日龄后有所上升,但数值上依然低于21日龄。瘤胃微生物呈现这种由高降低后再升高的变化可能是随着羔羊日龄的增加,其饮食和生长环境在变化,对精料和牧草的采食量增多,瘤胃内细菌菌群结构变化较大,在适应之后瘤胃细菌逐渐增多,并趋于稳定状态。
本试验中,结合DGGE图谱和条带的测序结果发现,分别在21、35、56和77日龄时,4组羔羊瘤胃内存在着以厚壁菌门和拟杆菌门为主的共有菌,且含有与营养物质代谢相关的菌。21日龄时,在4组羔羊瘤胃内均检测到Butyricimonas virosa。研究发现Butyricimonas virosa是从鼠粪便中分离出的一种能够利用葡萄糖,其发酵终产物为丁酸和异丁酸的菌种[18]。因此,可以推测早期补饲不同淀粉源的饲粮可通过促进Butyricimonas virosa的增长繁殖,产生短链脂肪酸尤其是丁酸,进而促进幼龄动物瘤胃发育。77日龄时,在4组羔羊瘤胃内均检测到Ruminococcus bromii。有研究报道,Ruminococcus bromii可以将人体肠道内大分子的碳水化合物分解成单糖或寡糖提供给其他细菌,有利于Eubacterium、Bifidobacterium、Anaerostipes等细菌的生长[19]。因此,在77日龄时饲喂不同淀粉源的饲粮可能对瘤胃健康起着非常重要的作用。另外,本试验从DGGE凝胶上回收了3个特征性条带,分别为:条带2(代表未培养细菌)、条带3(代表未培养瘤胃细菌)和条带7(代表Selenomonas bovis)。Selenomonas bovis是牦牛瘤胃内容物中分离出来的一种菌,可发酵阿拉伯糖、葡萄糖、甘露糖等,其发酵葡萄糖的终产物为乙酸和丙酸[20]。本试验中,WS组3个试验重复中均检测到了Selenomonas bovis。由此可知,小麦淀粉饲粮能促进Selenomonas bovis在羔羊瘤胃内的生长繁殖。
4 结论① 基于PCR-DGGE分析得出,不同直链与支链淀粉比精料对羔羊瘤胃内优势细菌的多样性无显著性影响;随日龄增加瘤胃细菌多样性由高降低后再升高。
② 饲喂小麦淀粉饲粮可促进56日龄羔羊瘤胃内Selenomonas bovis的生长。
| [1] |
TESTER R F, KARKALAS J, QI X. Starch-composition, fine structure and architecture[J]. Journal of Cereal Science, 2004, 39(2): 151-165. DOI:10.1016/j.jcs.2003.12.001 |
| [2] |
LIU C, WANG S J, COPELAND L, et al. Physicochemical properties and in vitro digestibility of starches from field peas grown in China[J]. LWT:Food Science and Technology, 2015, 64(2): 829-836. DOI:10.1016/j.lwt.2015.06.060 |
| [3] |
刘文. 不同直/支链淀粉比对羔羊生长性能、养分消化率及肉质的影响[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10223-1015592954.htm
|
| [4] |
REN W, ZHAO F F, ZHANG A Z, et al. Gastrointestinal tract development in fattening lambs fed diets with different amylose to amylopectin ratios[J]. Canadian Journal of Animal Science, 2016, 96(3): 425-433. DOI:10.1139/cjas-2015-0165 |
| [5] |
赵芳芳, 张爱忠, 姜宁, 等. 淀粉对动物胃肠道菌群影响的研究进展[J]. 黑龙江畜牧兽医, 2015(15): 71-74. |
| [6] |
ZHAO W J, WANG Y P, LIU S Y, et al. The Dynamic distribution of porcine microbiota across different ages and gastrointestinal tract segments[J]. PLoS One, 2015, 10(2): e0117441. DOI:10.1371/journal.pone.0117441 |
| [7] |
NIU Q, LI P H, HAO S S, et al. Dynamic Distribution of the Gut microbiota and the relationship with apparent crude fiber digestibility and growth stages in pigs[J]. Scientific Reports, 2015, 5: 9938. DOI:10.1038/srep09938 |
| [8] |
ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions[J]. European Journal of Clinical Nutrition, 1992, 46(Suppl 2): S33-S50. |
| [9] |
HUO W J, ZHU W Y, MAO S Y. Impact of subacute ruminal acidosis on the diversity of liquid and solid-associated bacteria in the rumen of goats[J]. World Journal of Microbiology and Biotechnology, 2014, 30(2): 669-680. DOI:10.1007/s11274-013-1489-8 |
| [10] |
CALLAWAY T R, DOWD S E, EDRINGTON T S, et al. Evaluation of bacterial diversity in the rumen and feces of cattle fed different levels of dried distillers grains plus solubles using bacterial tag-encoded FLX amplicon pyrosequencing[J]. Journal of Animal Science, 2010, 88(12): 3977-3983. DOI:10.2527/jas.2010-2900 |
| [11] |
ROSS E M, MOATE P J, BATH C R, et al. High throughput whole rumen metagenome profiling using untargeted massively parallel sequencing[J]. BMC Genetics, 2012, 13: 53. |
| [12] |
岳喜新. 蛋白水平及饲喂量对早期断奶羔羊生长性能及消化代谢的影响[D]. 硕士学位论文. 阿拉尔: 塔里木大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10757-1011079344.htm
|
| [13] |
WALKER D M, WALKER G J. The development of the digestive system of the young animal.V.the development of rumen function in the young lamb[J]. Journal of Agricultural Science, 1959, 53(3): 374-380. DOI:10.1017/S0021859600020797 |
| [14] |
MINATO H, OTSUKA M, SHIRASAKA S, et al. Colonization of microorganisms in the rumen of young calves[J]. Journal of General and Applied Microbiology, 1992, 38(5): 447-456. DOI:10.2323/jgam.38.447 |
| [15] |
LIU K L, WANG J Q, BU D P, et al. Isolation and biochemical characterization of two lipases from a metagenomic library of China Holstein cow rumen[J]. Biochemical and Biophysical Research Communications, 2009, 385(4): 605-611. DOI:10.1016/j.bbrc.2009.05.110 |
| [16] |
张永婧, 刘强, 张文明, 等. 不同纤维来源饲粮和细胞壁降解酶对猪肠道微生物菌群多样性的影响[J]. 动物营养学报, 2016, 28(10): 3275-3283. DOI:10.3969/j.issn.1006-267x.2016.10.031 |
| [17] |
田亚东, 张大为, 李敬, 等. 不同谷物饲粮对肉仔鸡肠道微生物群落多样性的影响[J]. 华北农学报, 2013, 28(4): 184-189. |
| [18] |
SAKAMOTO M, TAKAGAKI A, MATSUMOTO K, et al. Butyricimonas synergistica gen.nov., sp.nov.and Butyricimonas virosa sp.nov., butyric acid-producing bacteria in the family 'Porphyromonadaceae' isolated from rat faeces[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(7): 1748-1753. DOI:10.1099/ijs.0.007674-0 |
| [19] |
ZE X L. Degradation and utilization of resistant starch by microbiota in human large intestine[J]. Journal of Dentistry, 2013, 41(1): 60-70. DOI:10.1016/j.jdent.2012.10.003 |
| [20] |
ZHANG K G, DONG X Z. Selenomonas bovis sp. nov., isolated from yak rumen contents[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(8): 2080-2083. DOI:10.1099/ijs.0.007641-0 |




