2. 陕西省商洛市畜牧产业发展中心, 商洛 726000
2. The Development Centre of Animal Husbandry of Shangluo City of Shaanxi Province, Shangluo 726000, China
奶牛围产期包括产前3周和产后3周,此阶段奶牛营养生理和代谢模式较为特殊,神经内分泌改变[1],营养素摄入不足且利用率低,主要营养素(脂质、蛋白质、钙、磷等)的体贮动员显著增强[2-3],各器官代谢和免疫功能下降,面临的应激因素增加(分娩、饲粮转换、代谢应激、氧化应激和环境应激等)[4],奶牛防御有害微生物侵袭的屏障功能减弱[4-5],极易遭受各种代谢性疾病(脂肪肝、酮病、乳热病等)和微生物疾病(细菌性乳房炎、细菌性子宫炎等)的困扰,给奶业造成巨大损失[6-8]。因此,研究奶牛围产期营养过程的生理生化机理,制订有效的营养调控技术方案和饲养管理规程,对保障奶牛健康和泌乳性能的持续高效发挥,促进奶业可持续发展具有重要意义。
1 典型代谢:理论基础解析关键营养素摄入、消化、吸收、转运、代谢、转化、利用和排泄的机制网络,阐明主要代谢应激和疾病的发生机理,是调控奶牛围产期营养高效利用和健康的理论基础。以脂肪肝和酮病为例,能量负平衡(negative energy balance, NEB)导致体脂动员,大量未酯化脂肪酸(non-esterified fatty acids, NEFA)进入肝脏代谢供能,主要有3条代谢通路[9-11]:1)完全氧化,生成CO2和H2O,并释放大量ATP,高效供能;2)不完全氧化生成酮体,主要是β-羟基丁酸(β-hydroxybutyric acid, BHBA),供能效率低,且酮体积累极易诱发奶牛酮病;3)经酯化反应生成甘油三酯(triglyceride, TG),若TG不能以极低密度脂蛋白(very low density lipoprotein, VLDL)形式转运出肝脏,则导致肝细胞脂肪浸润或脂肪肝的发生[12-16]。因此,为降低脂肪肝和酮病发生的风险,可通过下列途径加以调控:1)促进NEFA的完全氧化,可通过增加肝脏肉毒碱含量,促进其限速酶肉毒碱棕榈酰转移酶(CPT1)的表达来实现[10-11];2)降低BHBA合成,可通过调控其关键酶β-羟基-β-甲基戊二酰辅酶A(β-hydroxy-β-methylglutaryl-CoA, HMG-CoA)和HMG-CoA还原酶基因的表达和分泌来实现[17];3)促进VLDL的合成,将过量TG转运出肝脏[18-22]。
添加一些营养调控剂(如胆碱、丙三醇和维生素E等),可增强奶牛围产期抗氧化和免疫功能,并降低代谢性疾病的发生,提高产后泌乳和繁殖性能[1, 5, 23-26]。Lean等[27]系统综述了奶牛围产期营养需要及其调控的研究进展和技术原理,并提出了奶牛围产期代谢性疾病发病率的限值和调控目标(表 1),可用于指导牧场奶牛围产期营养和技术管理。
|
|
表 1 奶牛围产期主要代谢性疾病发生率的限值和调控目标1) Table 1 Alarm incidence rates of main metabolic diseases and regulatory targets in transition dairy cow |
奶牛从停乳到泌乳经历复杂的生理生化适应和代谢调控机制,此过渡期是神经内分泌、机体代谢信号、消化道微生物及其代谢产物、动物内部和外部应激及各类病原共同调控的结果[6, 28-30]。关于围产期奶牛群体监测、营养需要、代谢调控和健康干预等已有一些经典综述[23, 27, 31-34]。结合本课题组历年研究基础,以下将围绕奶牛围产期能量代谢,兼顾蛋白质代谢,简述奶牛围产期能量和蛋白质代谢调控的技术思路。
本课题组以提高饲粮能量的总体利用率为核心,以提高机体代谢葡萄糖(metabolizable glucose,MG)供应为主要技术思路,主要研究内容(图 1)包括:1)瘤胃健康与高效发酵的生理机制和综合调控;2)小肠营养素(主要是淀粉)高效利用的科学基础及调控技术;3)肝脏能量代谢和高效转化的通路解析及营养调控;4)奶牛饲料数据库建设、营养评估技术体系和相关软件的研发。为平衡瘤胃和小肠碳水化合物的合理分配和能量的高效转化,本课题组整合系列研究成果,提出反刍动物碳水化合物平衡指数(carbohydrate balance index, CBI)的概念,计算公式为:CBI=peNDF/RDS,其中peNDF表示物理有效中性洗涤纤维(physically effective neutral detergent fiber),目前建议采用peNDF8.0,RDS表示瘤胃可降解淀粉(rumen degradable starch)。关于不同长度peNDF在CBI和奶牛生理中的贡献度,仍需通过研究进行量化[35-37]。
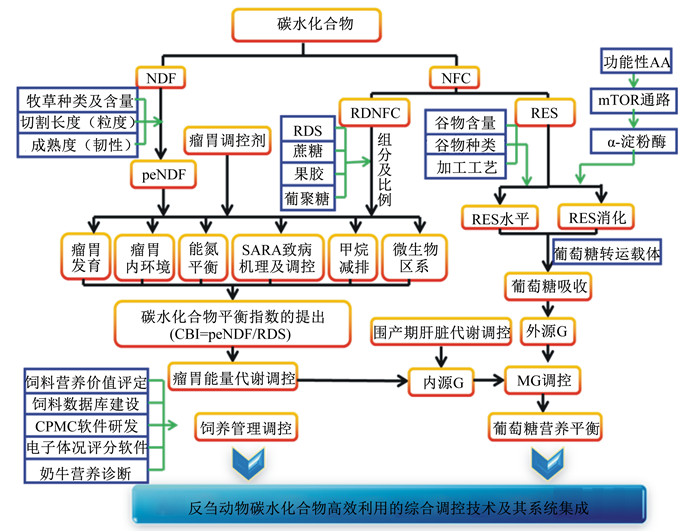
|
CBI:碳水化合物平衡指数carbohydrate balance index;NDF:中性洗涤纤维neutral detergent fiber;NFC:非纤维性碳水化合物non-fibrous carbohydrate;G:葡萄糖glucose;MG:代谢葡萄糖metabolizable glucose;mTOR:哺乳动物雷帕霉素靶蛋白mammalian target of rapamycin;peNDF:物理有效中性洗涤纤维physically effective neutral detergent fiber;RDNFC:瘤胃可降解非纤维性碳水化合物rumen degradable non-fibrous carbohydrate;RES:过瘤胃淀粉rumen escape starch;RDS:瘤胃可降解淀粉rumen degradable starch;AA:氨基酸amino acids。 图 1 反刍动物碳水化合物营养及能量代谢调控的研究网络 Figure 1 A research network of carbohydrate nutrition and regulation of energy metabolism in ruminants[37] |
瘤胃内环境稳态对奶牛机体能量、蛋白质和其他营养素的供应至关重要,乙酸是乳脂合成的重要底物和调控因子;丙酸是奶牛肝脏糖异生的主要底物,而葡萄糖不仅是奶牛生命活动的主要能量来源,还是乳糖合成的前体物质;微生物蛋白(MCP)是小肠蛋白质的重要组成部分,与过瘤胃蛋白质(rumen undegraded protein,RUP)和内源蛋白质(endogenous crude protein, ECP)共同构成奶牛机体代谢蛋白质(metabolizable protein,MP)来源。奶牛围产期瘤胃微生物区系发生变化,瘤胃功能有所下降。Pitta等[38]比较研究了初产和经产奶牛围产期瘤胃微生物组的动态变化,发现在所有菌群中,拟杆菌属(Bacteroidetes)和厚壁菌门(Firmicutes)的丰度最高,奶牛分娩前后Bacteroidetes与Firmicutes的比例由6 : 1增加到12 : 1,这可能与奶牛机体代谢生理和饲粮转换等有关。随泌乳启动,奶牛由干奶饲粮(高粗饲粮)转入泌乳饲粮(高精饲粮),瘤胃牛链球菌(Streptococcus bovis)和乳酸杆菌(Lactobacillus)等乳酸生成菌的数量显著增加,而反刍兽新月形单胞菌(Selenomonas ruminantium)和埃氏巨型球菌(Megasphaera elsdenii)的数量则显著减少[39],这可能导致:1)丙酸产量减少,肝脏糖异生底物不足,大量生糖氨基酸用于糖异生,造成氨基酸“浪费”,加剧能量和蛋白质的负平衡;2)乳酸生成量增加,降低瘤胃内pH,诱发酸中毒,损伤瘤胃上皮,并降低MCP合成量;3)瘤胃能量和蛋白质利用转化和输出效率下降,进而刺激机体脂肪和蛋白质动员,加剧肝脏代谢负担,并增加酮病和脂肪肝等疾病的发生风险;4)乳腺泌乳的能量和底物不足,降低奶牛产后泌乳性能。因此,保障奶牛围产期(尤其是围产后期)瘤胃健康和能量高效产出,对维持奶牛机体健康和产后泌乳性能具有重要意义。
实现瘤胃和小肠碳水化合物营养的最适分配,在保障瘤胃健康的前提下,提高瘤胃养分高效转化和利用效率,是奶牛围产期瘤胃代谢调控的重要技术思路,CBI体系为实现这一目标提供了技术参考。关于CBI的研究进展和实践应用,可参考本课题组的部分研究结果[36-37, 40-46]。瘤胃内环境和营养代谢的可调控性已毋庸置疑,且相关调控措施较多(图 1)。与其他生理阶段相比,奶牛围产期瘤胃代谢调控的研究明显偏少。王晓旭[47]利用体外复合培养技术研究发现,酿酒酵母(Saccharomyces cerevisiae)+产朊假丝酵母(Candida utilis)+伯顿毕赤酵母(Burton pichia pastoris)这一组合利用乳酸生成丙酸的能力最强,并可促进Selenomonas ruminantium和Megasphaera elsdenii生成丙酸;采用复合微生态制剂分别饲喂围产期健康和酮病奶牛后发现其可调控瘤胃微生物区系,提高瘤胃短链脂肪酸(SCFA)和血液葡萄糖浓度,降低血液BHBA浓度,提高血液葡萄糖浓度,且对奶牛无负面影响。
2.2 增强小肠消化和吸收功能,提高外源葡萄糖和MP供应量进入小肠的营养物质,在一系列消化酶的作用下降解为小分子物质,通过自由扩散或相关转运载体的协助被吸收,经血液循环和代谢转化被机体各组织利用。胰腺可分泌多种消化酶,如α-淀粉酶、胰蛋白酶和胰脂肪酶,在小肠多种营养物质的消化过程中发挥重要作用。奶牛饲粮淀粉在小肠消化吸收的供能效率显著高于瘤胃,但过瘤胃淀粉(rumen escape starch, RES)的小肠消化率不超过70%,其限制性因素之一是胰腺α-淀粉酶分泌不足[48-51]。
围绕此关键科学问题,本课题组以奶山羊和青年奶牛为试验对象,结合胰腺组织孵育和原代细胞培养技术,系统研究了亮氨酸(Leu)、苯丙氨酸(Phe)等功能性氨基酸对反刍动物胰腺消化酶表达和分泌的影响及信号传导网络[35, 37]。于红霞[49]研究发现,十二指肠灌注3或6 g Leu可提高奶山羊胰腺α-淀粉酶分泌量,且不依赖于胰岛素;进一步研究发现,Phe亦可调控奶山羊胰腺外分泌功能,增强小肠消化酶活性,进而提高淀粉和其他营养素的消化率,Leu和Phe主要通过激素和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路调控奶山羊胰腺蛋白质合成[51-53]。在此基础上,我们联用荷斯坦青年牛多插管灌注、胰腺组织孵育和胰腺腺泡细胞原代培养等技术,初步阐明Phe、Leu、异亮氨酸(Ile)和缬氨酸(Val)调控胰腺酶表达和分泌的机制,并构建了调控网络[48, 54-56],目前正在探究奶牛胰腺对功能性氨基酸的特异性感知和响应网络。
集成CBI体系和奶畜胰腺外分泌功能的综合调控技术,可保障瘤胃健康和高效发酵,提高小肠RES和其他营养素的消化率,我们初步建立了一种优化反刍家畜饲粮营养素总体利用率的技术思路,该体系对小肠营养物质吸收层次的影响仍需深究。奶牛围产期高强度的脂肪代谢导致机体自由基蓄积,易诱发氧化应激,因此通过在饲粮中添加脂肪缓解NEB并不适当;在保证饲粮营养均衡和小肠氨基酸平衡的前提下,通过饲料加工工艺或其他措施适当增加RES和RUP含量,并辅以适量过瘤胃氨基酸(如Leu、Phe),或可成为缓解奶牛围产期NEB和蛋白质负平衡(negative protein balance, NPB)的新途径。当然,上述功能性氨基酸能否调控围产期奶牛的胰腺外分泌功能,尚需研究支持。
2.3 保障肝脏健康,提高肝脏能量代谢和营养输出肝脏是奶牛的能量代谢枢纽和多种重要蛋白质的合成场所,如白蛋白和VLDL。奶牛机体的葡萄糖约70%源于肝糖异生,葡萄糖和脂类在肝细胞氧化产生的大量ATP是奶牛维持生长、繁殖、泌乳和其他生命活动的重要能量来源。因此,保障肝脏健康,提高其能量代谢和营养输出效率,是奶牛围产期营养调控研究的重点领域之一。
奶牛围产期肝脏健康和代谢面临如下主要问题[5, 57-58]:1)脂质完全氧化能力有限,VLDL合成不足,肝脏TG蓄积,造成肝细胞脂肪浸润或脂肪肝;2)脂质代谢异常旺盛,自由基的产生超出其清除能力,肝细胞遭受氧化应激,造成氧化损伤;3)生糖前体物不足,且肝细胞生糖能力下降,造成机体MG负平衡;4)在神经内分泌和多种因素的综合调控下,肝细胞合成相关代谢酶和活性物质的能力下降;5)肝细胞炎症反应,一些急性期蛋白(如肿瘤坏死因子α)抑制肝细胞功能。造成上述问题的根本原因是奶牛围产期主要营养素的负平衡,尤其是能量和蛋白质。因此,调控肝脏健康可通过2条途径实现:1)促进奶牛营养摄入,提高饲粮营养的总体利用率,缓解NEB和NPB,间接促进肝脏健康;2)调控肝脏能量和脂质代谢的核心通路,减少肝脏脂质沉积,降低肝细胞氧化应激和炎症反应,增强肝脏功能[10, 59]。
研究表明,腺苷一磷酸激活的蛋白激酶(adenosine 5’-monophosphate-activated protein kinase, AMPK)是细胞能量代谢的开关,在肝细胞能量和脂质代谢中发挥核心作用[17]。AMPK是一种高度保守的丝氨酸(Ser)/苏氨酸(Thr)蛋白激酶,由1个催化亚基α和2个调节亚基(β和γ)组成,受AMP/ATP、上游激酶[如肝脏激酶B1(liver kinase B1,LKB1)]和激素(如瘦素)等因素的调控[60-62]。当肝细胞AMPK被激活时,其下游活性蛋白的Ser或Thr残基被磷酸化,进而提高或降低其表达,抑制肝脏脂类合成,促进脂类和碳水化合物的氧化供能(图 2)。有研究证明,瘦素和脂联素均可激活下丘脑AMPK,提高啮齿类动物的采食量[63-65],而注射脑肠肽可激活大鼠下丘脑AMPK,不利于采食[66-67],但瘦素和脑肠肽能否通过激活和抑制下丘脑AMPK调控奶牛围产期干物质采食量(dry matter intake,DMI)尚未见报道。AMPK在奶牛上的相关研究多集中于乳腺和脂肪组织的能量及脂质代谢[68-70],肝脏AMPK的研究较少。Deng等[71]研究发现,BHBA可激活奶牛原代肝细胞AMPK,促进脂质氧化,抑制脂质合成。据此推断,AMPK在奶牛肝脏碳水化合物和脂质代谢中发挥重要作用,其网络有待解析,且现有营养调控措施是否通过AMPK发挥效应亦不明确。
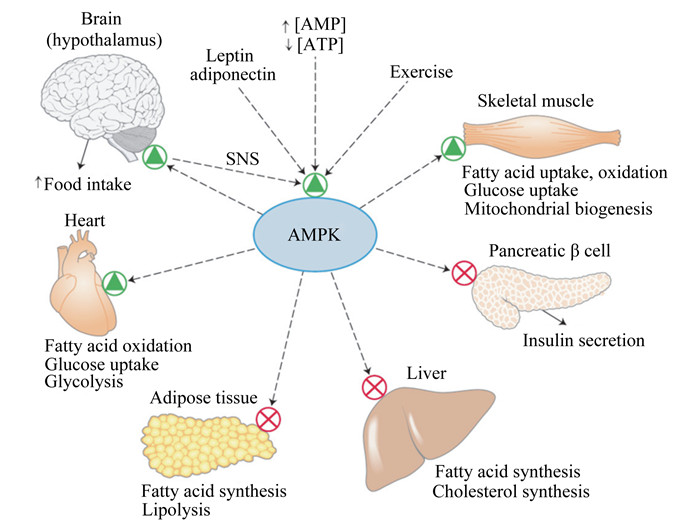
|
Brain:大脑;hypothalamus:下丘脑;Food intake:食物摄入;Heart:心脏;Fatty acid oxidation:脂肪酸氧化;Glucose uptake:葡萄糖摄取;Glycolysis:糖酵解;Adipose tissue:脂肪组织;Fatty acid synthesis:脂肪酸合成;Lipolysis:脂解;Liver:肝脏;Cholesterol synthesis:胆固醇合成;Pancreatic β cell:胰腺β细胞;Insulin secretion:胰岛素分泌;Skeletal muscle:肌肉组织;Fatty acid uptake, oxidation:脂肪酸摄取、氧化;Mitochondrial biogenesis:线粒体生物转化;Exercise:运动;Leptin:瘦素;Adiponectin:脂联素;AMP:腺苷一磷酸adenosine monophosphate;ATP:腺苷三磷酸adenosine triphosphate;SNS:交感神经系统sympathetic nervous system;AMPK:腺苷一磷酸激活的蛋白激酶adenosine 5’-monophosphate-activated protein kinase。 图 2 AMPK在碳水化合物和脂质代谢中的作用 Figure 2 The role of AMPK in carbohydrate and lipid metabolism[17] |
因此,明晰AMPK在奶牛围产期下丘脑采食调控和肝脏糖脂代谢中的作用及机制,筛选可激活肝脏AMPK并调节相关激素分泌的饲料添加剂和(或)活性物质,促进肝脏营养代谢和转化,理论上可有效缓解奶牛围产期营养素负平衡,保障胎儿和母体健康,提高产后泌乳性能。
3 小结奶牛围产期营养素负平衡严重威胁其整个泌乳周期的健康和高效生产,而对DMI的调控相对较难,因此,保障瘤胃健康和营养高效转化,适当增加RES的供应量,同时促进胰腺α-淀粉酶的合成和分泌,并调控肝脏健康和营养代谢,是奶牛围产期营养调控的重要技术途径。
| [1] |
ZEBELI Q, GHAREEB K, HUMER E, et al. Nutrition, rumen health and inflammation in the transition period and their role on overall health and fertility in dairy cows[J]. Research in Veterinary Science, 2015, 103: 126-136. DOI:10.1016/j.rvsc.2015.09.020 |
| [2] |
GRUMMER R R. Nutritional and management strategies for the prevention of fatty liver in dairy cattle[J]. The Veterinary Journal, 2008, 176(1): 10-20. DOI:10.1016/j.tvjl.2007.12.033 |
| [3] |
LOOR J J, EVERTS R E, BIONAZ M, et al. Nutrition-induced ketosis alters metabolic and signaling gene networks in liver of periparturient dairy cows[J]. Physiological Genomics, 2007, 32(1): 105-116. DOI:10.1152/physiolgenomics.00188.2007 |
| [4] |
SORDILLO L M, MAVANGIRA V. The nexus between nutrient metabolism, oxidative stress and inflammation in transition cows[J]. Animal Production Science, 2014, 54(9): 1204-1214. |
| [5] |
SORDILLO L M. Nutritional strategies to optimize dairy cattle immunity[J]. Journal of Dairy Science, 2016, 99(6): 4967-4982. DOI:10.3168/jds.2015-10354 |
| [6] |
ESPOSITO G, IRONS P C, WEBB E C, et al. Interactions between negative energy balance, metabolic diseases, uterine health and immune response in transition dairy cows[J]. Animal Reproduction Science, 2014, 144(3/4): 60-71. |
| [7] |
LEBLANC S. Monitoring metabolic health of dairy cattle in the transition period[J]. Journal of Reproduction and Development, 2010, 56(S): S29-S35. DOI:10.1262/jrd.1056S29 |
| [8] |
MULLIGAN F J, DOHERTY M L. Production diseases of the transition cow[J]. The Veterinary Journal, 2008, 176(1): 3-9. DOI:10.1016/j.tvjl.2007.12.018 |
| [9] |
SUN F, CAO Y, CAI C, et al. Regulation of nutritional metabolism in transition dairy cows:energy homeostasis and health in response to post-ruminal choline and methionine[J]. PLoS ONE, 2016, 11(8): e0160659. DOI:10.1371/journal.pone.0160659 |
| [10] |
孙菲菲, 曹阳春, 李生祥, 等. 胆碱对奶牛围产期代谢的调控[J]. 动物营养学报, 2014, 26(1): 26-33. |
| [11] |
GOSELINK R M A, VAN BAAL J, WIDJAJA H C A, et al. Effect of rumen-protected choline supplementation on liver and adipose gene expression during the transition period in dairy cattle[J]. Journal of Dairy Science, 2013, 96(2): 1102-1116. DOI:10.3168/jds.2012-5396 |
| [12] |
ZARRIN M, GROSSEN-RÖSTI L, BRUCKMAIER R M, et al. Elevation of blood β-hydroxybutyrate concentration affects glucose metabolism in dairy cows before and after parturition[J]. Journal of Dairy Science, 2017, 100(3): 2323-2333. DOI:10.3168/jds.2016-11714 |
| [13] |
ABDELLI A, RABOISSON D, KAIDI R, et al. Elevated non-esterified fatty acid and β-hydroxybutyrate in transition dairy cows and their association with reproductive performance and disorders:A meta-analysis[J]. Theriogenology, 2017, 93: 99-104. DOI:10.1016/j.theriogenology.2017.01.030 |
| [14] |
GERSPACH C, IMHASLY S, GUBLER M, et al. Altered plasma lipidome profile of dairy cows with fatty liver disease[J]. Research in Veterinary Science, 2017, 110: 47-59. DOI:10.1016/j.rvsc.2016.10.001 |
| [15] |
SCHÄFERS S, VON SOOSTEN D, MEYER U, et al. Influence of conjugated linoleic acid and vitamin E on performance, energy metabolism, and change of fat depot mass in transitional dairy cows[J]. Journal of Dairy Science, 2017, 100(4): 3193-3208. DOI:10.3168/jds.2016-11882 |
| [16] |
ZOM R L G, VAN BAAL J, GOSELINK R M A, et al. Effect of rumen-protected choline on performance, blood metabolites, and hepatic triacylglycerols of periparturient dairy cattle[J]. Journal of Dairy Science, 2011, 94(8): 4016-4027. DOI:10.3168/jds.2011-4233 |
| [17] |
LEHNINGER A L, NELSON D L, COX M M. Lehninger principles of biochemistry[M]. 6th ed. New York, NY: W.H.Freeman and Company, 2005.
|
| [18] |
张加力. 重组载脂蛋白B100对奶牛脂肪代谢的调控作用[D]. 博士学位论文. 长春: 吉林大学, 2012.
|
| [19] |
BERNABUCCI U, RONCHI B, BASIRICÒ L, et al. Abundance of mRNA of apolipoprotein B100, apolipoprotein E, and microsomal triglyceride transfer protein in liver from periparturient dairy cows[J]. Journal of Dairy Science, 2004, 87(9): 2881-2888. DOI:10.3168/jds.S0022-0302(04)73418-9 |
| [20] |
ELEK P, GAÁL T, HUSVÉTH F. Influence of rumen-protected choline on liver composition and blood variables indicating energy balance in periparturient dairy cows[J]. Acta Veterinaria Hungarica, 2013, 61(1): 59-70. DOI:10.1556/AVet.2012.053 |
| [21] |
LI X W, GUAN Y, LI Y, et al. Effects of insulin-like growth factor-1 on the assembly and secretion of very low-density lipoproteins in cow hepatocytes in vitro[J]. General and Comparative Endocrinology, 2016, 226: 82-87. DOI:10.1016/j.ygcen.2015.04.001 |
| [22] |
LIU L, LI X W, LI Y, et al. Effects of nonesterified fatty acids on the synthesis and assembly of very low density lipoprotein in bovine hepatocytes in vitro[J]. Journal of Dairy Science, 2014, 97(3): 1328-1335. DOI:10.3168/jds.2013-6654 |
| [23] |
SHAHSAVARI A, D'OCCHIO M, AL JASSIM R. The role of rumen-protected choline in hepatic function and performance of transition dairy cows[J]. The British Journal of Nutrition, 2016, 116(1): 35-44. DOI:10.1017/S0007114516001641 |
| [24] |
王建, 孙鹏, 卜登攀, 等. 围产期奶牛免疫抑制发生原因及其缓解的营养对策[J]. 动物营养学报, 2014, 26(12): 3579-3586. DOI:10.3969/j.issn.1006-267x.2014.12.005 |
| [25] |
WHITE H M, CARVALHO E R, KOSER S L, et al. Short communication:regulation of hepatic gluconeogenic enzymes by dietary glycerol in transition dairy cows[J]. Journal of Dairy Science, 2016, 99(1): 812-817. DOI:10.3168/jds.2015-9953 |
| [26] |
刘大森, 姜明明. 围产期奶牛健康指标体系和营养代谢研究进展[J]. 饲料工业, 2015, 36(8): 1-4. |
| [27] |
LEAN I J, VAN SAUN R, DEGARIS P J. Energy and protein nutrition management of transition dairy cows[J]. Veterinary Clinics of North America:Food Animal Practice, 2013, 29(2): 337-366. DOI:10.1016/j.cvfa.2013.03.005 |
| [28] |
DENG Q, ODHIAMBO J F, FAROOQ U, et al. Intravaginal probiotics modulated metabolic status and improved milk production and composition of transition dairy cows[J]. Journal of Animal Science, 2016, 94(2): 760-770. DOI:10.2527/jas.2015-9650 |
| [29] |
AMETAJ B N, ZHANG G S, DERVISHI E, et al. Targeted metabolomics reveals multiple metabolite alterations in the urine of transition dairy cows preceding the incidence of lameness[J]. Journal of Animal Science, 2016, 94: 72-73. |
| [30] |
CALAMARI L, FERRARI A, MINUTI A, et al. Assessment of the main plasma parameters included in a metabolic profile of dairy cow based on fourier transform mid-infrared spectroscopy:preliminary results[J]. BMC Veterinary Research, 2016, 12(1): 4. DOI:10.1186/s12917-015-0621-4 |
| [31] |
ROCHE J R, BELL A W, OVERTON T R, et al. Nutritional management of the transition cow in the 21st century-a paradigm shift in thinking[J]. Animal Production Science, 2013, 53(9): 1000-1023. |
| [32] |
BERTONI G, TREVISI E. Use of the liver activity index and other metabolic variables in the assessment of metabolic health in dairy herds[J]. Veterinary Clinics of North America:Food Animal Practice, 2013, 29(2): 413-431. DOI:10.1016/j.cvfa.2013.04.004 |
| [33] |
INGVARTSEN K L, MOYES K. Nutrition, immune function and health of dairy cattle[J]. Animal, 2013, 7(S1): 112-122. DOI:10.1017/S175173111200170X |
| [34] |
RETAMAL P M. Nutritional management of the prepartum dairy cow[M]//RISCO C A, RETAMAL P M. Dairy production medicine. Hoboken: John Wiley & Sons, Inc, 2011: 7-17.
|
| [35] |
姚军虎, 曹阳春, 蔡传江. 奶畜能量代谢调控机理与措施[J]. 饲料工业, 2015, 36(17): 1-7. |
| [36] |
姚军虎, 李飞, 李发弟, 等. 反刍动物有效纤维评价体系及需要量[J]. 动物营养学报, 2014, 26(10): 3168-3174. DOI:10.3969/j.issn.1006-267x.2014.10.031 |
| [37] |
姚军虎. 反刍动物碳水化合物高效利用的综合调控[J]. 饲料工业, 2013, 34(17): 1-12. |
| [38] |
PITTA D W, KUMAR S, VECCHIARELLI B, et al. Temporal dynamics in the ruminal microbiome of dairy cows during the transition period[J]. Journal of Animal Science, 2014, 92(9): 4014-4022. DOI:10.2527/jas.2014-7621 |
| [39] |
WANG X X, LI X B, ZHAO C X, et al. Correlation between composition of the bacterial community and concentration of volatile fatty acids in the rumen during the transition period and ketosis in dairy cows[J]. Applied and Environmental Microbiology, 2012, 78(7): 2386-2392. DOI:10.1128/AEM.07545-11 |
| [40] |
徐明. 反刍动物瘤胃健康和碳水化合物能量利用效率的营养调控[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10712-2008037102.htm
|
| [41] |
杜莎. 日粮碳水化合物平衡指数对山羊消化道酶活性和养分瘤胃降解率的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1284452
|
| [42] |
赵向辉. 日粮peNDF水平对山羊咀嚼活动、瘤胃发酵和养分消化率的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10712-2010050337.htm
|
| [43] |
赵向辉. 日粮非纤维性碳水化合物对人工瘤胃发酵、微生物合成和纤维分解菌菌群的影响[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10712-1013150014.htm
|
| [44] |
高洋. 黑麦草NDF组成及粒度对山羊采食行为、瘤胃发酵和瘤胃养分降解动力学的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10712-1011404133.htm
|
| [45] |
李飞. 奶山羊亚急性瘤胃酸中毒模型构建与奶牛日粮CBI的优化[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10712-1014421086.htm
|
| [46] |
刘南南. 日粮碳水化合物平衡指数和延胡索酸对山羊瘤胃发酵、微生物区系和甲烷产生的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=9066997
|
| [47] |
王晓旭. 围产期奶牛瘤胃微生物区系的变化及微生态制剂的调控作用[D]. 博士学位论文. 长春: 吉林大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10183-1012365842.htm
|
| [48] |
刘烨. 十二指肠灌注亮氨酸对奶牛胰腺外分泌功能及血液指标的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10712-1013345500.htm
|
| [49] |
于红霞. 十二指肠灌注亮氨酸对奶山羊胰腺外分泌功能的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2011.
|
| [50] |
于志鹏. 苯丙氨酸和亮氨酸对山羊胰腺发育和外分泌功能的调控研究[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2013.
|
| [51] |
YU Z P, XU M, YAO J H, et al. Regulation of pancreatic exocrine secretion in goats:differential effects of short-and long-term duodenal phenylalanine treatment[J]. Journal of Animal Physiology and Animal Nutrition, 2013, 97(3): 431-438. DOI:10.1111/jpn.2013.97.issue-3 |
| [52] |
YU Z P, XU M, LIU K, et al. Leucine markedly regulates pancreatic exocrine secretion in goats[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(1): 169-177. DOI:10.1111/jpn.2014.98.issue-1 |
| [53] |
YU Z P, XU M, WANG F, et al. Effect of duodenal infusion of leucine and phenylalanine on intestinal enzyme activities and starch digestibility in goats[J]. Livestock Science, 2014, 162: 134-140. DOI:10.1016/j.livsci.2014.01.023 |
| [54] |
刘烨, 刘凯, 徐明, 等. 十二指肠灌注亮氨酸对奶牛胰腺淀粉酶分泌的影响[J]. 动物营养学报, 2013, 25(8): 1785-1790. |
| [55] |
刘凯. 亮氨酸和异亮氨酸对奶畜胰腺外分泌功能的影响及调控机理研究[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2017.
|
| [56] |
LIU K, LIU Y, LIU S M, et al. Relationships between leucine and the pancreatic exocrine function for improving starch digestibility in ruminants[J]. Journal of Dairy Science, 2015, 98(4): 2576-2582. DOI:10.3168/jds.2014-8404 |
| [57] |
杜兵耀, 马晨, 杨开伦, 等. 围产期奶牛的生理特点及营养代谢特征研究进展[J]. 乳业科学与技术, 2016, 39(1): 14-18. |
| [58] |
VAN SAUN R J, SNIFFEN C J. Transition cow nutrition and feeding management for disease prevention[J]. Veterinary Clinics of North America:Food Animal Practice, 2014, 30(3): 689-719. DOI:10.1016/j.cvfa.2014.07.009 |
| [59] |
孙菲菲, 曹阳春, 姚军虎. 奶牛围产期葡萄糖营养平衡及其调控研究进展[J]. 饲料工业, 2013, 34(15): 46-50. |
| [60] |
HARDIE D G, ROSS F A, HAWLEY S A. AMPK:a nutrient and energy sensor that maintains energy homeostasis[J]. Nature Reviews Molecular Cell Biology, 2012, 13(4): 251-262. DOI:10.1038/nrm3311 |
| [61] |
STEINBERG G R, WATT M J, FEBBRAIO M A. Cytokine Regulation of AMPK signalling[J]. Frontiers in Bioscience, 2008, 14: 1902-1916. |
| [62] |
WANG Y, LIANG Y, VANHOUTTE P M. SIRT1 and AMPK in regulating mammalian senescence:a critical review and a working model[J]. FEBS Letters, 2011, 585(7): 986-994. DOI:10.1016/j.febslet.2010.11.047 |
| [63] |
KUBOTA N, YANO W, KUBOTA T, et al. Adiponectin stimulates AMP-activated protein kinase in the hypothalamus and increases food intake[J]. Cell Metabolism, 2007, 6(1): 55-68. DOI:10.1016/j.cmet.2007.06.003 |
| [64] |
MINOKOSHI Y, SHIUCHI T, LEE S, et al. Role of hypothalamic AMP-kinase in food intake regulation[J]. Nutrition, 2008, 24(9): 786-790. DOI:10.1016/j.nut.2008.06.002 |
| [65] |
MINOKOSHI Y, ALQUIER T, FURUKAWA N, et al. AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus[J]. Nature, 2004, 428(6982): 569-574. DOI:10.1038/nature02440 |
| [66] |
KOLA B, HUBINA E, TUCCI S A, et al. Cannabinoids and ghrelin have both central and peripheral metabolic and cardiac effects via AMP-activated protein kinase[J]. Journal of Biological Chemistry, 2005, 280(26): 25196-25201. DOI:10.1074/jbc.C500175200 |
| [67] |
KOLA B, FARKAS I, CHRIST-CRAIN M, et al. The orexigenic effect of ghrelin is mediated through central activation of the endogenous cannabinoid system[J]. PLoS One, 2008, 3(3): e1797. DOI:10.1371/journal.pone.0001797 |
| [68] |
APPUHAMY J, NAYANANJALIE W, ENGLAND E, et al. Effects of AMP-activated protein kinase (AMPK) signaling and essential amino acids on mammalian target of rapamycin (mTOR) signaling and protein synthesis rates in mammary cells[J]. Journal of Dairy Science, 2014, 97(1): 419-429. DOI:10.3168/jds.2013-7189 |
| [69] |
LOCHER L, HÄUSSLER S, LAUBENTHAL L, et al. Effect of increasing body condition on key regulators of fat metabolism in subcutaneous adipose tissue depot and circulation of nonlactating dairy cows[J]. Journal of Dairy Science, 2015, 98(2): 1057-1068. DOI:10.3168/jds.2014-8710 |
| [70] |
MCFADDEN J W, CORL B A. Activation of AMP-activated protein kinase (AMPK) inhibits fatty acid synthesis in bovine mammary epithelial cells[J]. Biochemical and Biophysical Research Communications, 2009, 390(3): 388-393. DOI:10.1016/j.bbrc.2009.09.017 |
| [71] |
DENG Q H, LIU G W, LIU L, et al. BHBA influences bovine hepatic lipid metabolism via AMPK signaling pathway[J]. Journal of Cellular Biochemistry, 2015, 116(6): 1070-1079. DOI:10.1002/jcb.25062 |




