在现代规模化养猪生产中,母猪的繁殖性能和生产性能直接关系着企业的生产效益。目前,养猪行业中后备母猪发情晚、母猪夏季不孕和经产母猪断奶至发情间隔时间长等现象较为普遍,导致母猪较晚进入生产阶段,母猪非生产天数(non-productive days,NPD)增加,极大地降低了养猪企业的经济效益。NPD是衡量种用母猪生产效率的关键指标,其计算方法为:NPD=365-每头母猪年分娩窝数×(妊娠期+哺乳期);其中,每头母猪年分娩窝数=365/繁殖周期[1]。由于母猪妊娠期和哺乳期的时间长度较为固定,因此,每头母猪年分娩窝数成为影响母猪NPD的关键,母猪的性成熟日龄和断奶至发情的间隔时间成为影响母猪生产效率的重要因素。
在规模化养猪企业中,环境因素对养猪生产的影响越来越受到重视。影响家畜生长繁殖的主要环境因素包括温度、湿度、有害气体和光照。光照作为影响母猪繁殖性能的重要生态因子之一,直接或间接影响着母猪的性成熟和发情间隔时间,进而影响母猪NPD和生产效率。但目前关于光照条件(包括光照节律和光照强度)对母猪繁殖性能影响的研究较少,尚缺乏高产母猪适宜光照参数的推荐标准。因此,本文主要综述了光照节律(通常表示为每天的光照时间或光照与黑暗时间之比)和光照强度对后备母猪和经产母猪繁殖性能的影响,阐述了光照影响母猪繁殖性能的作用机理,探讨了温度、湿度等环境因素和营养因素与母猪适宜光照条件的关系,为规模化养猪企业通过光照条件的改善降低母猪NPD、提高母猪繁殖性能和养猪企业生产效益提供理论参考。
1 光照节律对母猪繁殖性能的影响研究发现,光照可以影响摩拉奶牛[2]、蒙古绵羊[3]、大鼠[4]等哺乳动物的性成熟和性激素分泌。光照同样对猪的性成熟和激素分泌起着重要作用,在一定条件下,延长光照时间能有效提高母猪的繁殖性能和生产效率。
1.1 光照节律对后备母猪繁殖性能的影响光照对于后备母猪的繁殖性能具有重要作用,延长光照时间可以促进后备母猪的性成熟,缩短初情期日龄。Christenson[5]研究发现,密闭条件下饲养的后备母猪的初情期日龄和体重均大于非密闭条件下饲养的后备母猪。Rampacek等[6]研究也发现,饲养于密闭圈舍内的后备母猪的初情期日龄较舍外饲养的后备母猪大。这可能是由于封闭圈舍条件下饲喂的后备母猪接触光照的时间受到了限制。光照对后备母猪初情期日龄的影响主要表现为光照节律的不同。研究发现,与自然光照相比,荣昌后备母猪每天补充光照时间到16 h,初情期提前了18.5 d[7]。长光照时间对母猪发情高峰期血液促黄体激素(luteinizing hormone,LH)含量也有显著影响,说明光照可能通过调节机体性激素的分泌影响后备母猪的繁殖性能。Hacker等[8]对103.7日龄的约克夏后备母猪分别给予完全黑暗、18 h人工光照(950 lx)和9.0~10.8 h自然光照,结果显示,各组的初情期日龄和体重分别为200.5日龄和100.7 kg、164.8日龄和83.3 kg、175.3日龄和90.7 kg;与完全黑暗组相比,人工光照组和自然光照组母猪的初情期日龄显著缩短,母猪的黄体数显著升高。Ntunde等[9]将约克夏后备母猪饲喂于完全黑暗、18 h人工光照和9.0~10.8 h自然光照条件下,母猪的初情期日龄和体重分别为193.4日龄和103.3 kg、175.6日龄和90.3 kg、177.1日龄和94.8 kg,自然光照组和人工光照组母猪的初情期日龄显著小于完全黑暗组,与Hacker等[8]的研究结果相一致。由此可知,完全黑暗条件和短光照时间均不利于后备母猪初情期的启动,光照节律在16 h光照8 h黑暗(16L : 8D)和18 h光照6 h黑暗(18L : 6D)条件下能显著缩短后备母猪的初情期日龄。此外,光照节律还能影响母猪子宫和卵巢的发育。研究发现,饲养在长光照时间条件下的后备母猪,子宫、卵巢重量和卵泡体积均大于饲养在短光照条件下的母猪[10-11]。延长光照时间对母猪繁殖器官的发育有一定的积极作用,从而促使后备母猪性成熟的提前。
光照节律对后备母猪性成熟的作用效果可能与季节存在一定的联系。Diekman等[12]分别于2月份至7月份和8月份至次年1月份研究补充光照时间至15 h(300 lx)对后备母猪初情期的影响,结果发现,饲养于8月份至次年1月份的后备母猪补充光照时间至15 h且与成熟公猪接触,初情期比只接触公猪而不额外补充光照时间的后备母猪提前20 d;而饲养于2月份至7月份的后备母猪,补充光照组的初情期日龄与自然光照组无显著差异。这可能是由于2月份至7月份光照时间和温度呈逐渐上升的趋势,后备母猪接受自然光照时间接近于补充光照时间所致。不同季节试验结果的不一致也揭示了光照节律对后备母猪的影响可能存在季节性。Paterson等[13]也分别于9月份和3月份进行不同季节光照节律对后备母猪初情期影响的研究,采用2种不同光照节律,分别为从12 h光照12 h黑暗(12L : 12D)逐渐变化为16L : 8D、8 h光照16 h黑暗(8L : 16D)和从12L : 12D逐渐变化为14.5 h光照9.5 h黑暗(14.5L : 9.5D)、9.5 h光照14.5 h黑暗(9.5 :14.5D)再逐渐恢复到12L : 12D,结果显示,与9月份相比,在3月份进行试验的后备母猪的初情期日龄有缩短的趋势。这也进一步说明光照节律对后备母猪初情期启动的作用可能受到不同季节的影响,但目前关于不同季节光照节律对母猪繁殖性能的影响仍缺乏系统的研究。因此,开展不同季节母猪适宜光照条件的系统研究对提高母猪的繁殖性能具有重要意义。
1.2 光照节律对经产母猪繁殖性能的影响光照节律对经产母猪繁殖性能的影响主要表现在母猪泌乳期失重、断奶至发情间隔时间和断奶仔猪生长性能等方面。Tast等[14]研究发现,当泌乳母猪长期处于16L : 8D的长光照节律时,母猪断奶至发情间隔时间显著缩短。Mcglone等[15]研究表明,母猪分别在1 h光照23 h黑暗(1L :23D)和16L : 8D的光照节律下饲养,与1L : 23D光照节律相比,16L : 8D光照节律时母猪断奶至发情间隔时间缩短4 d,且母猪的泌乳期体重损失降低,尤其是在热应激条件下,与Tast等[14]的研究结果相一致。但有关光照节律对母猪断奶至发情间隔时间的影响的报道却不一致。Gooneratne等[16]报道,分娩前1周给母猪提供16L : 8D、8L :16D光照节律和间断光照节律[8 h光照8 h黑暗2 h光照6 h黑暗(8L : 8D : 2L : 6D)和8 h光照4 h黑暗8 h光照4 h黑暗(8L : 4D : 8L : 4D)],均对断奶至发情间隔时间无显著影响。Mabry等[17]研究发现,16L : 8D和8L : 16D的光照节律对母猪断奶至发情间隔时间无显著影响,与Gooneratne等[16]的研究结果相一致;但16L : 8D光照节律组母猪的泌乳量显著增加,断奶仔猪数和断奶仔猪重增加,这可能是由于长光照时间能刺激母猪催乳素(prolactin,PRL)的分泌[18],使泌乳量增加,从而增加断奶仔猪重。Mabry等[19]研究也证实,与8 h光照时间相比,16 h光照时间显著提高了母猪哺乳次数、断奶仔猪数和断奶窝重。表明光照对泌乳期仔猪生产性能的提高作用是通过改善母猪的泌乳性能实现的,但其具体机制尚不清楚,有待研究者对此进行深入研究。
也有研究发现光照节律对母猪的繁殖性能有负面影响或无显著影响。Perera等[20]报道,将约克夏母猪分别饲养于24 h光照0 h黑暗(24L :0D)、12L : 12D和0 h光照24 h黑暗(0L : 24D)的光照节律下,发现长光照时间显著延长了母猪的发情持续时间,但对受胎率、产仔率、产仔数和断奶至发情间隔时间均无显著影响,对LH、雌激素、孕酮等激素的分泌也无显著影响。Kermabon等[21]研究也证实,光照时间对泌乳母猪血浆LH、促卵泡素(follicle-stimulating hormone,FSH)和雌二醇含量均无显著影响,且长光照时间可能对断奶后发情有不利影响。Prunier等[22]分别于1月份和7月份开展试验,研究不同季节光照节律对母猪繁殖性能的影响,光照时间在妊娠期从12 h逐渐增加到16 h或缩短到8 h,在泌乳期保持恒定,结果表明,长光照时间组母猪在断奶后10 d内发情的比例比短光照时间组低;7月份母猪的泌乳期体重损失、断奶仔猪重和母猪泌乳期血浆FSH含量均高于1月份。表明光照节律对母猪繁殖性能的影响也同样有季节性。
2 光照强度对母猪繁殖性能的影响光照强度是光照条件的另一个重要参数,对母猪的繁殖性能具有一定的影响。Canaday等[23]在12L : 12D的光照节律下,研究明亮环境(433 lx)和昏暗环境(11 lx)对母猪繁殖性能的影响,结果发现,明亮环境下母猪的发情持续时间有增加的趋势。Diekman等[24]将32头杂交后备母猪分别饲养在光照强度为1 200、360、90 lx(自然光照强度)和小于10 lx(限制光照强度)的环境下,结果显示,270日龄内发情母猪的比例分别为50.0%、62.5%、75.0%和12.5%;光照强度大于90 lx时对后备母猪初情期的启动无显著影响,但当光照强度小于10 lx时显著延长了后备母猪的初情期。这说明光照强度对后备母猪初情期的影响存在一定的阈值,当光照强度达到母猪对光照敏感的阈值时,继续增加光照强度对母猪的初情期无显著影响;若光照强度达不到阈值,即使长光照时间也无效。这可能是导致不少学者认为猪对光照变化不敏感的原因。Tast等[25]在12L : 12D的光照节律下,研究不同光照强度(40、200和10 000 lx)对后备母猪激素分泌的影响,发现血浆褪黑激素(melatonin,MT)含量无显著差异。这表明当光照强度超过40 lx时,光照强度对于MT的分泌无显著影响。结合以上研究结果,推测母猪对光照敏感的光照强度阈值可能为10~40 lx。
此外,不同光谱的光线对母猪繁殖性能的影响也不同。研究认为,后备母猪分别饲养于白光、全谱日光、红光和紫外光环境中,红光下的后备母猪性成熟延迟且体重和松果体重量更大,表明红光不利于后备母猪的性成熟[26]。光谱中,红光通常视为无用光,在猪的生理上等同于黑暗条件。因此,在光照试验中,黑暗条件下采集样品也常在红光照射下进行。而在生产中,白光是保持最佳生长性能和繁殖性能的最经济最有效的光。
3 光照条件影响母猪繁殖性能的机理根据繁殖性能与光照时间长短的关系,可将动物分成“长日照发情动物”和“短日照发情动物”2大类群。光照对哺乳动物繁殖性能的影响主要通过改变松果体对MT的合成和分泌来调控动物的内分泌系统,进而影响母猪的繁殖。MT抑制长日照发情动物的性活动,刺激短日照发情动物的性活动,MT供给的持续性是引起性腺反应的关键[27]。动物MT的分泌反映了环境光照的变化情况,MT作为光的周期信号分子在调控动物的季节性繁殖具有严格的昼夜节律性[28],MT的分泌量与光照时间呈显著的负相关关系[29-30]。
3.1 MT对性腺轴的调控作用光照对母猪繁殖性能的影响是通过松果体起作用的。当处于黑暗环境时,视交叉上核产生的内源信号支配颈上神经节的交感神经节后纤维脉冲式释放去甲肾上腺素(NE);NE进入松果体细胞膜,与β受体结合,激活腺苷酸环化酶,这种酶可促进N-乙酰转移酶(NAT)的合成,NAT是松果体合成和分泌MT的关键酶;细胞中NAT含量增加,促进了松果体细胞中MT的合成和分泌;MT作用于下丘脑,又通过下丘脑的分泌活动抑制垂体合成和释放促性腺激素。MT主要是在黑暗中进行合成,延长光照时间,可减少MT的产生,减少其对垂体分泌促性腺激素的抑制作用,从而促进生殖系统的发育[31]。
3.2 MT对卵巢功能的调控作用研究表明,MT也存在于卵母细胞、卵泡细胞和胎盘细胞中[32]。人颗粒细胞中可检测到MT受体MT1和MT2,MT可通过受体调节人颗粒细胞中FSH、LH和促性腺激素释放激素受体的表达[33]。此外,研究也证实猪的颗粒细胞中也存在MT受体,但有关猪卵母细胞中MT受体的报道较少[34]。
卵泡中的颗粒细胞会产生活性氧簇(reactive oxygen species,ROS),过多的ROS能够诱导细胞调亡,导致卵泡闭锁的发生。MT具有很强的抗氧化作用,可以清除ROS,防止卵泡闭锁的发生[35]。在整个卵泡成熟过程中,激素水平是从FSH占据主导地位过渡到LH占据主导地位,而卵泡选择性成熟机制也与颗粒细胞中LH受体的表达有关[36]。卵泡闭锁和颗粒细胞凋亡与卵泡发育密切相关,早期闭锁的卵泡便出现了颗粒细胞的凋亡,这说明卵泡中颗粒细胞调亡会诱导卵泡闭锁。而MT具有的抗氧化作用可通过线粒体途径减少细胞的凋亡[37],从而减少卵泡闭锁的发生。光照通过对MT的影响,间接影响卵巢的发育和卵泡的存活。
4 光照与其他环境因素互作对母猪繁殖性能的影响影响母猪繁殖性能的环境因素除光照外,还包括温度、湿度。目前,有关其他环境因素影响母猪繁殖性能的研究仍较少,且主要集中在环境温度。不同的季节,母猪表现出不同的繁殖能力[38-39],其中不仅包括光照时间的变化,也包括温度和湿度的改变。寒冷季节后备母猪的初情期日龄[(211.1±0.5)日龄]比高温季节[(208.7±0.6)日龄]和多雨季节[(207.4±0.5)日龄]大[40],这可能是寒冷季节的环境温度和湿度均较低所致,温度和湿度的较大变化,会导致母猪的舒适度降低,易引起应激反应,降低其繁殖性能。Iida等[41]报道指出,母猪的初情期日龄与光照时间和高温持续天数有关,与环境湿度无关。表明环境湿度影响母猪繁殖性能的作用较弱,高温可能是影响母猪繁殖性能的关键因素,提示在炎热季节可以通过延长光照时间和降温等措施来缩短后备母猪的初情期日龄。较高环境温度也会影响泌乳母猪的生产性能。Quiniou等[42]研究显示,不同环境温度(18、22、25、27和29 ℃)下,温度高于27 ℃时,泌乳母猪的采食量降低,泌乳期体重损失增加。温度影响母猪生产性能的作用可以归结于对食欲的影响,温度过高降低母猪的食欲,采食量下降,机体营养摄入不足可能是导致母猪繁殖性能降低的主要原因[40]。此外,较高的温度对机体激素的分泌也有一定的影响。报道认为,7月份较高的环境温度使母猪血液FSH和雌二醇含量显著增加,母猪泌乳量和仔猪生长速度显著降低[22]。但温度是否会影响性腺轴和其他激素的分泌以及环境因素对母猪适宜光照条件的影响等问题仍需进一步研究。
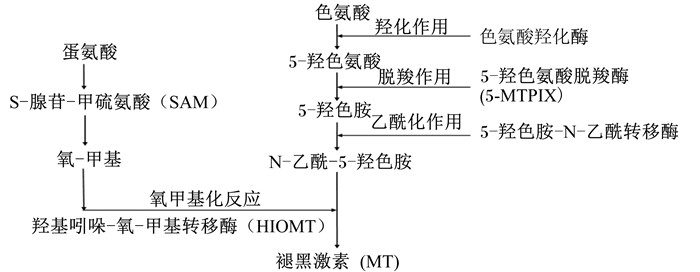
5 光照与营养因素互作对母猪繁殖性能的影响光照通过影响机体MT的分泌来影响母猪的繁殖性能。MT化学结构为N-乙酰-5-甲氧基色胺,主要由脑部松果体合成和分泌。色氨酸是其合成的最初原料,色氨酸通过色氨酸羟化酶(TPH)的羟化作用形成5-羟色氨酸;再经过5-羟色氨酸脱羧酶(5-MTPIX)的脱羧作用形成5-羟色胺;5-羟色胺在5-羟色胺-N-乙酰转移酶的乙酰化作用下转变为N-乙酰-5-羟色胺;最后经羟基-吲哚-氧-甲基转移酶(HIOMT)氧甲基化反应生成MT,NAT是其合成过程中的限速酶[32]。可以看出机体色氨酸的含量是影响机体MT合成的前提,饲粮中色氨酸的含量对机体合成MT具有一定的调节作用。Sanchez等[43]给雄性大鼠饲喂添加125 mg/kg色氨酸的饲粮,发现血液MT含量升高。饲粮中添加色氨酸,可能刺激机体MT的合成。因此,饲粮中的色氨酸水平直接关系着机体MT的合成,从而影响动物机体对光照条件的反应。
此外,蛋氨酸也参与机体MT的合成。蛋氨酸通过形成S-腺苷-甲硫氨酸(SAM)影响MT的合成。SAM是机体中主要的甲基(—CH3)供体,在甲基化和转甲基作用中起着重要作用[44]。在人和动物的松果体中,MT合成的最后一步是N-乙酰-5-羟色胺在HIOMT的催化作用下,由SAM提供氧-甲基生成MT[45]。MT的合成过程如图 1所示。
研究也揭示了松果体内SAM的昼夜节律,SAM在白天含量最高,在夜间含量最低。SAM的含量与MT生物合成存在相关性[46]。此外,持续光照或用普萘洛尔阻滞β-肾上腺受体可以降低松果体中SAM的含量,从而抑制动物MT的合成[47]。这是由于N-乙酰-5-羟色胺的氧甲基化反应是松果体合成MT的关键反应,并且SAM是这一反应的甲基供体。当机体SAM供应不足,将直接抑制机体MT合成。表明饲粮中的蛋氨酸水平可以通过影响SAM间接影响机体MT合成,从而调节动物机体对光照条件的反应。但目前有关营养因素调节母猪生物节律的相关报道仍较少,因此进一步研究营养因素与光照条件对母猪繁殖的影响,探索提高母猪繁殖性能的营养调控措施和环境控制技术显得尤为重要。
6 小结光照是调节母猪繁殖性能的重要环境因素之一,主要通过调节MT的分泌影响母猪情期启动,同时也通过对其他激素的调节影响繁殖性能的改变。长光照时间能抑制MT分泌,促进情期启动;当光照强度低于临界值时,对母猪繁殖不利。此外,色氨酸和蛋氨酸参与MT的合成,通过营养因素的调控可能会改变机体因昼夜节律所带来的不利影响,但这一构想还有待探究。总之,光照对于提高母猪的繁殖性能具有重要的作用,对于这方面的进一步研究对实际生产具有重大指导意义,如何通过营养策略改善环境因素对母猪繁殖性能所带来的不利影响也值得研究者展开更深入的研究。
| [1] |
路永强, 张瑜, 任利忠, 等. 母猪繁殖障碍成因分析[J]. 中国农学通报, 2010, 26(18): 39-42. |
| [2] |
ROY A K, SINGH M, KUMAR P, et al. Effect of extended photoperiod during winter on growth and onset of puberty in Murrah buffalo heifers[J]. Veterinary World, 2016, 9(2): 216-221. DOI:10.14202/vetworld. |
| [3] |
王忻. 非繁殖季节光照控制对蒙古羊发情排卵和褪黑激素受体表达的影响[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1558790
|
| [4] |
王伟, 夏薇, 周聪, 等. 持续光照对雌性大鼠发情周期及卵泡发育的影响[C]//中国畜牧兽医学会动物繁殖学分会第十四届学术研讨会论文集. 青岛: 中国畜牧兽医学会, 2008.
|
| [5] |
CHRISTENSON R K. Influence of confinement and season of the year on puberty and estrous activity of gilts[J]. Journal of Animal Science, 1981, 52(52): 821-830. |
| [6] |
RAMPACEK G B, KREALING R R, KISER T E. Delayed puberty in gilts in total confinement[J]. Theriogenology, 1981, 15(5): 491-499. DOI:10.1016/0093-691X(81)90092-3 |
| [7] |
彭癸友, 覃发芬. 光照对母猪几项繁殖指标的影响[J]. 当代畜牧, 2002(7): 21-26. |
| [8] |
HACKER R R, KING G J, NTUNDE B N, et al. Plasma oestrogen, progesterone and other reproductive responses of gilts to photoperiods[J]. The Journal of the Society for Reproduction and Fertility, 1979, 57(2): 447-451. DOI:10.1530/jrf.0.0570447 |
| [9] |
NTUNDE B N, HACKER R R, KING G J. Influence of photoperiod on growth, puberty and plasma LH levels in gilts[J]. Journal of Animal Science, 1979, 48(6): 1401-1406. DOI:10.2527/jas1979.4861401x |
| [10] |
SURMUHIN A F, CEREMNYH V D, TIMOFEEV V P, et al. Development of gilts subjected to different light regimes[J]. Trudy sverdlovsk.sel'.-khoz.Inst., 1970, 20: 89-100, 253. |
| [11] |
SURMUHIN A F, CEREMNYH V D. The effect of light on the development of the reproductive organs in gilts[J]. Sel'sko-khozyaistvennaya Biologiya, 1970, 104-107. |
| [12] |
DIEKMAN M A, HOAGLAND T A. Influence of supplemental lighting during periods of increasing or decreasing daylength on the onset of puberty in gilts[J]. Journal of Animal Science, 1983, 57(5): 1235-1242. DOI:10.2527/jas1983.5751235x |
| [13] |
PATERSON A M, PEARCE G P. Attainment of puberty in domestic gilts reared under long-day or short-day artificial light regimens[J]. Animal Reproduction Science, 1990, 23(2): 135-144. DOI:10.1016/0378-4320(90)90055-K |
| [14] |
TAST A, HÄLLI O, VIROLAINEN J V, et al. Investigation of a simplified artificial lighting programme to improve the fertility of sows in commercial piggeries[J]. Veterinary Record, 2005, 156(22): 702-705. DOI:10.1136/vr.156.22.702 |
| [15] |
MCGLONE J J, STANSBURY W F, TRIBBLE L F, et al. Photoperiod and heat stress influence on lactating sow performance and photoperiod effects on nursery pig performance[J]. Journal of Animal Science, 1988, 66(8): 1915-1919. DOI:10.2527/jas1988.6681915x |
| [16] |
GOONERATNE A D, THACKER P A. Influence of an extended photoperiod on sow and litter performance[J]. Livestock Production Science, 1990, 24(1): 83-88. DOI:10.1016/0301-6226(90)90033-3 |
| [17] |
MABRY J W, CUNNINGHAM F L, KREALING R, et al. The effect of artificially extended photoperiod during lactation on maternal performance of the sow[J]. Journal of Animalence, 1982, 54(5): 918-921. |
| [18] |
KRAELING R R, MARPLE D N, RAMPACEK G B, et al. Effect of photoperiod and temperature on prolactin secretion in ovariectomized gilts[J]. Journal of Animal Science, 1987, 64(6): 1690-1695. DOI:10.2527/jas1987.6461690x |
| [19] |
MABRY J W, COFFEY M T, SEERLEY R W. A comparison of an 8-versus 16-hour photoperiod during lactation on suckling frequency of the baby pig and maternal performance of the sow[J]. Journal of Animal Science, 1983, 57(2): 292-295. DOI:10.2527/jas1983.572292x |
| [20] |
PERERA A M, HACKER R R. The effects of different photoperiods on reproduction in the sow[J]. Journal of Animal Science, 1984, 58(6): 1418-1422. DOI:10.2527/jas1984.5861418x |
| [21] |
KERMABON A Y, PRUNIER A, DJIANE J, et al. Gonadotropins in lactating sows exposed to long or short days during pregnancy and lactation:serum concentrations and ovarian receptors[J]. Biology of Reproduction, 1995, 53(5): 1095-1102. DOI:10.1095/biolreprod53.5.1095 |
| [22] |
PRUNIER A, DOURMAD J Y, ETIENNE M. Effect of light regimen under various ambient temperatures on sow and litter performance[J]. Journal of Animal Science, 1994, 72(6): 1461-1466. DOI:10.2527/1994.7261461x |
| [23] |
CANADAY D C, SALAK-JOHNSON J L, VISCONTI A M, et al. Effect of variability in lighting and temperature environments for mature gilts housed in gestation crates on measures of reproduction and animal well-being[J]. Journal of Animal Science, 2013, 91(3): 1225-1236. DOI:10.2527/jas.2012-5733 |
| [24] |
DIEKMAN M A, GRIEGER D M. Influence of varying intensities of supplemental lighting during decreasing daylengths on puberty in gilts[J]. Animal Reproduction Science, 1988, 16(3/4): 295-301. |
| [25] |
TAST A, LOVE R J, EVANS G, et al. The photophase light intensity does not affect the scotophase melatonin response in the domestic pig[J]. Animal Reproduction Science, 2001, 65(3/4): 283-290. |
| [26] |
WHEELHOUSE R K, HACKER R R. The effect of four different types of fluorescent light on growth, reproductive performance, pineal weight and retinal morphology of Yorkshire gilts[J]. Canadian Journal of Animal Science, 1982, 62(2): 417-424. DOI:10.4141/cjas82-048 |
| [27] |
王忻, 刘月琴, 张英杰. 光照对动物繁殖季节的作用机制[C]//中国畜牧兽医学会动物繁殖学分会第十四届学术研讨会论文集. 青岛: 中国畜牧兽医学会, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=7140785
|
| [28] |
GRIFFITH M K, MINTON J E. Effect of light intensity on circadian profiles of melatonin, prolactin, ACTH, and cortisol in pigs[J]. Journal of Animal Science, 1992, 70(2): 492-498. DOI:10.2527/1992.702492x |
| [29] |
黄冬维, 储明星. 动物季节性繁殖分子调控机理研究进展[J]. 遗传, 2011, 33(7): 695-706. |
| [30] |
陈玉林, 张小辉. 不同绵羊品种褪黑激素的季节性及昼夜变化规律研究[J]. 家畜生态学报, 2005, 26(1): 35-38. |
| [31] |
ROY D, ANGELINI N L, FUJIEDA H, et al. Cyclical regulation of GnRH gene expression in GT1-7 GnRH-secreting neurons by melatonin[J]. Endocrinology, 2001, 142(11): 4711-4720. DOI:10.1210/endo.142.11.8464 |
| [32] |
REITER R J, TAN D X, TAMURA H, et al. Clinical relevance of melatonin in ovarian and placental physiology:a review[J]. Gynecological Endocrinology, 2014, 30(2): 83-89. DOI:10.3109/09513590.2013.849238 |
| [33] |
WOO M M M, TAI C J, KANG S K, et al. Direct action of melatonin in human granulosa-luteal cells[J]. The Journal of Clinical Endocrinology & Metabolism, 2001, 86(10): 4789-4797. |
| [34] |
KANG J T, KOO O J, KWON D K, et al. Effects of melatonin on in vitro maturation of porcine oocyte and expression of melatonin receptor RNA in cumulus and granulosa cells[J]. Journal of Pineal Research, 2009, 46(1): 22-28. DOI:10.1111/jpi.2008.46.issue-1 |
| [35] |
TAMURA H, NAKAMURA Y, KORKMAZ A, et al. Melatonin and the ovary:physiological and pathophysiological implications[J]. Fertility and Sterility, 2009, 92(1): 328-343. DOI:10.1016/j.fertnstert.2008.05.016 |
| [36] |
WEBB R, NICHOLAS B, GONG J G, et al. Mechanisms regulating follicular development and selection of the dominant follicle[J]. Reproduction Supplement, 2003, 61(2): 71-90. |
| [37] |
JOU M J. Visualization of the antioxidative effect of melatonin at mitochondiral level in oxidative stress induced apoptosis of rat brain astrocytes[C]//Shanghai International Conference on Physiological. Shanghai: Biophysical Society of China, 2004.
|
| [38] |
LOVE R J, EVANS G, KLUPIEC C. Seasonal effects on fertility in gilts and sows[J]. Journal of Reproduction & Fertility Supplement, 1993, 48(1S): 191-206. |
| [39] |
PRUNIER A, QUESNEL H, DE BRAGAN? A M M, et al. Environmental and seasonal influences on the return-to-oestrus after weaning in primiparous sows:a review[J]. Livestock Production Science, 1996, 45(2/3): 103-110. |
| [40] |
TUMMARUK P. Effects of season, outdoor climate and photo period on age at first observed estrus in Landrace×Yorkshire crossbred gilts in Thailand[J]. Livestock Science, 2012, 144(1/2): 163-172. |
| [41] |
IIDA R, KOKETSU Y. Delayed age of gilts at first mating associated with photoperiod and number of hot days in humid subtropical areas[J]. Animal Reproduction Science, 2013, 139(1/2/3/4): 115-120. |
| [42] |
QUINIOU N, NOBLET J. Influence of high ambient temperatures on performance of multiparous lactating sows[J]. Journal of Animal Science, 1999, 77(8): 2124-2134. DOI:10.2527/1999.7782124x |
| [43] |
SANCHEZ S, PAREDES S D, MARTIN M I, et al. Effect of tryptophan administration on circulating levels of melatonin and phagocytic activity[J]. Journal of Applied Biomedicine, 2004, 2(3): 169-177. |
| [44] |
BONDARENKO L A. Role of methionine in nocturnal melatonin peak in the pineal gland[J]. Bulletin of Experimental Biology and Medicine, 2004, 137(5): 431-432. DOI:10.1023/B:BEBM.0000038144.51076.07 |
| [45] |
ITOH M T, HATTORI A, SUMI Y. Hydroxyindole-O-methyltransferase activity assay using high-performance liquid chromatography with fluorometric detection:determination of melatonin enzymatically formed from N-acetylserotonin and S-adenosyl-L-methionine[J]. Journal of Chromatography B:Biomedical Sciences and Applications, 1997, 692(1): 217-221. DOI:10.1016/S0378-4347(96)00503-8 |
| [46] |
CHABANNES B, SARDA N, CRONENBERGER L, et al. Diurnal variations of S-adenosyl-L-methionine and adenosine content in the rat pineal gland[J]. Life Sciences, 1984, 35(6): 589-596. DOI:10.1016/0024-3205(84)90253-4 |
| [47] |
SITARAM B R, SITARAM M, TRAUT M, et al. Nyctohemeral rhythm in the levels of S-adenosylmethionine in the rat pineal gland and its relationship to melatonin biosynthesis[J]. Journal of Neurochemistry, 1995, 65(4): 1887-1894. |