2. 澳大利亚西澳大学动物生理学系, 佩斯 6009, 澳大利亚
2. Department of Animal Physiology, The University of Western Australia, Perth 6009, Australia
周占琴等[1]研究发现,布尔公羊的性情影响其生长速度和繁殖性能。性情急躁的公羊性成熟早,周岁体重小,采精量少,精子密度低,性情稳健公羊的相关表现则优于性情急躁公羊。目前国外对性情的研究比较多,集中在性情的遗传基础以及通过基因调节脑活动与激素的合成。Qui[2]通过对澳洲美利奴羊的研究,筛选出了控制性情的候选基因。Brown等[3]研究也表明,通过选择改善澳大利亚母羊的性情类型与母体行为可以改善羔羊的生长性能,并能在繁殖过程中产生另外有用的性状。Cooke等[4]在肉牛上也发现,母牛的受孕率与母牛的性情评价指数呈负相关,性情指数越高,母牛的性情越偏向于急躁型。研究人员发现,基因在羊的性情和行为的形成中起着重要作用,性情与行为特点不仅影响其自身繁殖力与生产力,甚至影响整个群体的养殖效益。迄今为止,尚未阐明性情影响羊生产性能的机理,关于羊性情与行为关系的研究也不多见。
不同性情的羊,在行为方式、环境变化响应、内分泌上存在差别,进而造成消化吸收、生长发育、生产性能上的差异[5-7]。研究表明,羊的性情影响生长速率和肉质[8-10],但是其中的影响机制仍不够明确。本试验旨在比较安静型和紧张型湖羊胃肠道发育和组织形态的差异,为深入研究性情影响羊消化道的机制提供一些基础资料。
1 材料与方法 1.1 试验动物与饲养管理本试验在江苏省淮安市盱眙县某湖羊养殖场开展,试验动物采用5月龄左右、体重[(30±2) kg]相近的湖羊,通过Hammond等[11]的Pen Score法分为安静型和紧张型,分别选取10只,1种性情的10只羊为1组。试验湖羊饲喂玉米为主要淀粉来源的精饲料和由羊草、玉米青贮组成粗饲料,以全混合日粮(TMR)形式饲喂,精粗比为40 : 60。基础饲粮组成及营养水平见表 1。预试期7 d,正试期60 d。正试期每天06:00和18:00分2次喂料,每只羊单独饲喂。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
参考《饲料检测与分析实验技术》[12]对基础饲粮的粗蛋白质、中性洗涤纤维、酸性洗涤纤维、粗脂肪、钙、总磷含量进行测定。采用凯氏定氮法测定粗蛋白质含量;采用范式洗涤纤维分析法测定中性洗涤纤维和酸性洗涤纤维含量;采用索氏提取法测定粗脂肪含量;采用高锰酸钾法测定钙含量;采用钒钼黄比色法测定总磷含量。
1.2 不同性情湖羊的筛选参考Hammond等[11]的Pen Score法,通过评定湖羊对于测评者靠近后的反应,进行打分分类。具体方法如下:将试验湖羊圈养在1个羊圈,观察者靠近羊群后,观察羊只对于生人靠近后的反应,其中表现温顺,对于观察者靠近没有反应并且允许观察者靠近的羊只记1分;对于观察者靠近表现出轻微侵略行为,并且喜欢站立到角落躲避观察者的羊只记2分;当观察者靠近后,立刻沿着羊圈边缘逃离观察者并且能够准确辨识观察者位置的记3分;其中对观察者表现出较强侵略性,当观察者靠近后,立刻向羊舍门的方向逃离的记4分;当观察者靠近后,表现激动,向门和羊圈栅栏出逃离的记5分。
对于试验动物的Pen Score评分工作由3个观察员开展,每个观察员重复2次打分,最后,综合3人的打分结果,对试验动物的性情进行评定,其中评分为2分及2分以下的湖羊记为温顺型性情,4分及4分以上的记为紧张型性情。按照这种分类方法,分别筛选出2种性情的湖羊各10只。
1.3 样品采集与指标测定 1.3.1 干物质采食量正试期内每天记录采食量,计算干物质采食量。
1.3.2 屠宰性能参照赵有璋等[14]介绍的方法进行屠宰性能的测定。试验期结束前1天空腹24 h,称重后屠宰,去头、蹄、内脏,剥皮后对胴体、心脏、肝脏、肾脏、肺脏和脾脏称重并记录。将瘤胃、网胃、瓣胃、皱胃分割,去食糜,称量各胃室鲜重。屠宰率、器官指数及复胃指数的计算公式如下:
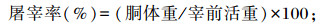
|
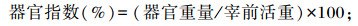
|

|
正试期结束后,迅速完成屠宰,分离得到胃肠道各段,去除内容物洗净并称重,从瘤胃、网胃、瓣胃、皱胃中间部位取组织块(2 cm×2 cm),组织固定液(40%多聚甲醛120 mL,蒸馏水880 mL,NaH2PO4·H2O 4 g,NaHPO4 13 g)中充分固定,常规石蜡脱水,二甲苯溶液脱色后石蜡切片包埋,切片厚度6 μm。经苏木精-伊红(HE)染色后在光学显微镜下观察瘤胃乳头结构和小肠黏膜形态结构。采用Image-pro express图像分析处理系统,每个样品观察3张不连续切片,测量视野瘤胃的乳头长度、宽度、黏膜层厚度和肌肉层厚度,测量小肠各段的绒毛高度、隐窝深度,黏膜层和肌肉层至少选取5个视野进行计量,测量后计算出平均值作为测定数据。
1.4 数据统计分析试验数据用Excel 2003整理统计,利用SPSS 22.0对数据进行t检验,显著水平为P < 0.05。
2 结果 2.1 干物质采食量及屠宰性能由表 2可知,安静型湖羊及紧张型湖羊的干物质采食量、宰前活重及胴体重未见显著差异(P > 0.05),但安静型湖羊的屠宰率显著高于紧张型湖羊(P < 0.05)。2组湖羊心脏、肝脏、脾脏、肺脏、肾脏的器官指数以及眼肌面积均未出现显著差异(P > 0.05)。
|
|
表 2 安静型和紧张型湖羊干物质采食量及屠宰性能的差异 Table 2 Differences of DMI and slaughter performance of Hu sheep with quiet and excited temperaments |
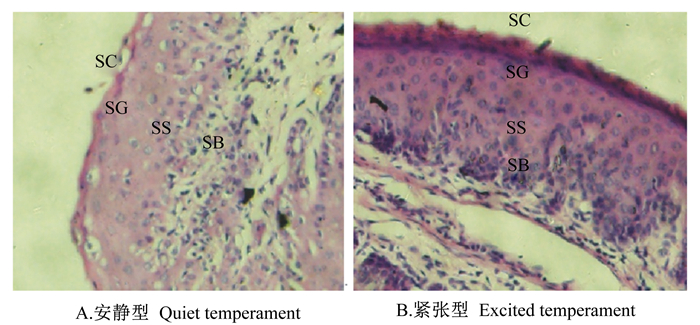
由表 3可知,安静型湖羊及紧张型湖羊的复胃重、复胃指数无显著差异(P > 0.05),并且瘤胃重/复胃重、网胃重/复胃重、瓣胃重/复胃重、皱胃重/复胃重也未发现显著差异(P > 0.05)。安静型湖羊瘤胃上皮的角质层厚度显著小于紧张型湖羊(P < 0.05),而基底层厚度和瘤胃乳头的宽度却显著大于紧张型湖羊(P < 0.05)(表 3和图 1)。
|
|
表 3 安静型和紧张型湖羊复胃发育及组织形态结构的差异 Table 3 Differences of the development and tissue morphological structure of complex stomach of Hu sheep with quiet and excited temperaments |
|
SC:角质层 stratum corneum;SG:颗粒层 stratum granulosum;SS:棘突层 stratum spinosum;SB:基底层 stratum basale。 图 1 安静型和紧张型湖羊瘤胃上皮显微结构上的差异 Figure 1 Differences of microstructure of rumen epithelium of Hu sheep with quiet and excited temperaments (20×) |
干物质采食量作为反刍动物营养中最重要指标之一,对动物生产是否能够健康高效进行起着决定性作用。当然除了饲粮能量水平、环境等一些物理、化学因素会相互作用影响干物质采食量外,动物的心理和感觉因素也会影响干物质采食量[15]。Nkrumah等[16]在肉牛上研究发现紧张型的肉牛干物质采食量高于安静型的肉牛。但是Francisco等[17]在内洛尔牛的研究中却并未发现不同性情肉牛干物质采食量指标的差异。而在本试验中,不同性情湖羊的干物质采食量也未见显著差异。屠宰性能是衡量动物生产性能的重要指标。许多研究均认为羊只宰前活重的差异会最终导致屠宰性能的差异,绵羊的屠宰率会随宰前活重的增大而升高[18]。但在本试验中,安静型湖羊及紧张型湖羊的宰前活重未见显著差异,但安静型湖羊的胴体重呈增长趋势,其屠宰率显著高于紧张型湖羊。另外,有报道称羔羊的代谢活动可由内脏器官的代谢速度和体积大小间接反映[19],内脏器官代谢速度高和体积大的羔羊会增加蛋白质合成量和营养物质吸收量,用于内脏器官的正常代谢消耗[20]。但本试验发现,安静型湖羊和紧张型湖羊在心脏、肝脏、脾脏、肺脏、肾脏的器官指数以及眼肌面积上均未发现显著差异。
反刍动物前胃由瘤胃、网胃、瓣胃及皱胃构成,第1胃是瘤胃,初生反刍动物复胃的30%是瘤胃,但在成年后,瘤胃在复胃总重占比达到60%~80%[21]。反刍动物降解纤维物质依靠瘤胃,其内部食糜分气层、致密层与液体层3层。反刍动物能够有效利用粗饲料中富含的纤维物质主要依靠反刍,反刍时,食糜经食道逆呕至口腔并重新被咀嚼[22]。整个左侧腹腔几乎全被瘤胃占据,食糜过贲门,经消化后从瘤网胃口进入网胃。瘤胃对饲料除机械降解外,还通过包括细菌、产甲烷菌、真菌与原虫以及少数噬菌体等微生物对饲料进行至关重要的发酵降解[23]。瘤胃容量增加和瘤胃上皮发育2方面共同反映瘤胃组织形态的发育。健康情况下,瘤胃重量随着动物机体的生长发育而增加,容量随之增加,有利于成年反刍动物对食物的利用[24]。本试验中,不同性情湖羊复胃的生长发育未见明显差异,此外复胃中的瘤胃、网胃、瓣胃以及皱胃的比例也无显著差异。
除了复胃容积的变化,瘤胃黏膜的发育在反刍动物对饲料尤其是粗饲料的消化与利用方面也发挥着重要作用。在胚胎时期,瘤胃黏膜就开始分化,上皮和固有膜突出形成可以活动的瘤胃乳头,对饲料进行揉搓和磨碎等机械性消化,约有25万个瘤胃乳头突起在1片瘤胃壁上,带来了6倍左右瘤胃黏膜表面积,对于反刍动物的消化吸收有着重要意义[25]。因此,瘤胃乳头的大小是评价瘤胃及其黏膜对营养物质消化和吸收水平的重要标准[26]。本试验发现,安静型湖羊的屠宰率高于紧张型湖羊,进一步研究其复胃发育和组织结构发现,安静型湖羊的瘤胃乳头宽度显著大于紧张型湖羊,这增加了安静型湖羊瘤胃上皮与饲料的接触,促进了饲料中营养物质的消化与吸收,从而提高了羊只的产肉性能。
瘤胃乳头的表面由复层扁平上皮细胞组成,瘤胃上皮组织由外向内可分为4层,由外向内分别为角质层、颗粒层、棘突层和基底层。瘤胃角质化不全是由于瘤胃鳞状上皮细胞产生坚硬的角蛋白层,它是瘤胃乳头的物理屏障,但会使乳头表面覆膜,从而降低瘤胃表层血液流动,进而引起乳头的退化,并在边缘部分形成腐肉,最终令乳头产生结块现象[27],因此角质层的形成主要由于饲料粒度不够,不能摩擦去除不断老化的上皮细胞所引起。角质层曾被认为不利于瘤胃的吸收,而之后的研究发现在正常情况下,在瘤胃内容物的连续磨损下,角质化细胞层只有3~4层,对营养物质的吸收作用影响不大,但是对于瘤胃乳头却具有明显的保护作用。本试验发现,安静型湖羊瘤胃乳头角质层厚度比紧张型湖羊薄,对瘤胃乳头的保护作用一定程度上不如紧张型湖羊。但是也有学者发现,高精饲料饲粮能够使角质层厚度达到15个细胞层,而高粗饲料饲粮条件下,瘤胃上皮角质层仅由4层细胞组成,过厚的角质层显然不利于营养物质的吸收[28]。本试验中,安静型湖羊瘤胃上皮角质层较薄,从而有利于瘤胃乳头吸收营养成分功能的发挥。作为形成瘤胃乳头基础的基底层,该层细胞具有完全功能的线粒体和其他细胞器,本试验中以安静型湖羊的较厚,从而有利于瘤胃上皮的更新和损伤修复。瘤胃乳头的颗粒细胞层具有紧密的连接,但该层为不连续层,没有皮脂腺分泌,水分可自由通过;棘突层是瘤胃上皮组织中短链脂肪酸代谢的部位。因此,颗粒层以及棘突层对于瘤胃上皮对营养物质的转运具有重要意义[29]。但在本试验中不同性情湖羊瘤胃乳头颗粒层以及棘突层厚度未见显著差异。
4 结论安静型湖羊的屠宰率高于紧张型湖羊,复胃发育虽然没有显著差异,但是安静型湖羊瘤胃上皮乳头较宽大,且角质层更薄,更利于营养物质的吸收。
| [1] |
周占琴, 武和平, 陈小强, 等. 布尔山羊的性格行为[J]. 西北农业学报, 2008, 17(4): 10-13. |
| [2] |
QUI X Y. Gene polymorphisms associated with temperament in Merino sheep[D]. Ph. D. Thesis. Perth: The University of Western Australia, 2015.
|
| [3] |
BROWN D J, FOGARTY N M, IKER C L, et al. Genetic evaluation of maternal behaviour and temperament in Australian sheep[J]. Animal Production Science, 2016, 56(4): 767-774. DOI:10.1071/AN14945 |
| [4] |
COOKE R F, BOHNERT D W, MENEGHETTI M, et al. Effects of temperament on pregnancy rates to fixed-timed AI in Bos indicus beef cows[J]. Livestock Science, 2011, 142(1/2/3): 108-113. |
| [5] |
马燕芬, 杜瑞平, 高民. 热应激对奶山羊生产性能及瘤胃上皮细胞形态结构的影响[J]. 中国农业科学, 2013, 46(21): 4486-4495. DOI:10.3864/j.issn.0578-1752.2013.21.011 |
| [6] |
BLACHE D, BICKELL S L. Temperament and reproductive biology:emotional reactivity and reproduction in sheep[J]. Revista Brasileira de Zootecnia, 2010, 39: 401-408. DOI:10.1590/S1516-35982010001300044 |
| [7] |
CAVIGELLI S A, BENNETT J M, MICHAEL K C, et al. Female temperament, tumor development and life span:relation to glucocorticoid and tumor necrosis factor α levels in rats[J]. Brain, Behavior, and Immunity, 2008, 22(5): 727-735. DOI:10.1016/j.bbi.2007.10.014 |
| [8] |
MVLLER R, VON KEYSERLINGK M A G. Consistency of flight speed and its correlation to productivity and to personality in Bos taurus beef cattle[J]. Applied Animal Behaviour Science, 2006, 99(3): 193-204. |
| [9] |
CAFE L M, ROBINSON D L, FERGUSON D M, et al. Cattle temperament:persistence of assessments and associations with productivity, efficiency, carcass and meat quality traits[J]. Journal of Animal Science, 2011, 89(5): 1452-1465. DOI:10.2527/jas.2010-3304 |
| [10] |
NJISANE Y Z, MUCHENJE V. Farm to abattoir conditions, animal factors and their subsequent effects on cattle behavioural responses and beef quality-A review[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(6): 755-764. |
| [11] |
HAMMOND A C, OLSON T A, CHASE C C, J r., et al. Heat tolerance in two tropically adapted Bos taurus breeds, Senepol and Romosinuano, compared with Brahman, Angus, and Hereford cattle in Florida[J]. Journal of Animal Science, 1996, 74(2): 295-303. DOI:10.2527/1996.742295x |
| [12] |
王洪荣. 饲料检测与分析实验技术[M]. 南京: 东南大学出版社, 2014.
|
| [13] |
熊本海. 国际反刍动物饲料成分及营养价值表[M]. 北京: 中国农业科学技术出版社, 2013.
|
| [14] |
赵有璋, 王玉琴. 现代中国养羊[M]. 北京: 金盾出版社, 2005.
|
| [15] |
Subcommittee on dairy cattle nutrition. Nutrient requirements of dairy cattle[M]. 7th ed. Washington, D. C. : National Academies Press, 2001.
|
| [16] |
NKRUMAH J D, CREWS D H, BASARAB J A, et al. Genetic and phenotypic relationships of feeding behavior and temperament with performance, feed efficiency, ultrasound, and carcass merit of beef cattle[J]. Journal of Animal Science, 2007, 85(10): 2382-2390. DOI:10.2527/jas.2006-657 |
| [17] |
FRANCISCO C L, RESENDE F D, BENATTI J M B, et al. Impacts of temperament on Nellore cattle:physiological responses, feedlot performance, and carcass characteristics[J]. Journal of Animal Science, 2015, 93(11): 5419-5429. DOI:10.2527/jas.2015-9411 |
| [18] |
DHANDA J S. Evaluation of crossbred goat and sheep production in the typics[M]. London: Long Man Group Ltd., 2001: 56-59.
|
| [19] |
PRIOLO A, MICOL D, AGABRIEL J, et al. Effect of grass or concentrate feeding systems on lamb carcass and meat quality[J]. Meat Science, 2002, 62(2): 179-185. DOI:10.1016/S0309-1740(01)00244-3 |
| [20] |
赵彦光, 洪琼花, 谢萍, 等. 精料营养对云南半细毛羊屠宰性能及肉品质的影响[J]. 草业学报, 2014, 23(2): 277-286. DOI:10.11686/cyxb20140233 |
| [21] |
岳喜新. 蛋白水平及饲喂量对早期断奶羔羊生长性能及消化代谢的影响[D]. 硕士学位论文. 阿拉尔: 塔里木大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10757-1011079344.htm
|
| [22] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [23] |
LEE H J, JUNG J Y, OH Y K, et al. Comparative survey of rumen microbial communities and metabolites across one caprine and three bovine groups, using bar-coded pyrosequencing and 1H nuclear magnetic resonance spectroscopy[J]. Applied and Environmental Microbiology, 2012, 78(17): 5983-5993. DOI:10.1128/AEM.00104-12 |
| [24] |
李辉. 蛋白水平与来源对早期断奶犊牛消化代谢及胃肠道结构的影响[D]. 博士学位论文. 北京: 中国农业科学院, 2008. http://cdmd.cnki.com.cn/Article/CDMD-82101-2008130397.htm
|
| [25] |
LESMEISTER K E, TOZER P R, HEINRICHS A J. Development and analysis of a rumen tissue sampling procedure[J]. Journal of Dairy Science, 2004, 87(5): 1336-1344. DOI:10.3168/jds.S0022-0302(04)73283-X |
| [26] |
高艳霞, 王加启. 新生犊牛消化功能的发育及影响因素[J]. 中国奶牛, 2006(8): 6-9. |
| [27] |
BALDWIN R L, JESSE B W. Isolation and characterisation of sheep ruminal epithelial cells[J]. Journal of Animal Science, 1991, 69(9): 3603-3609. DOI:10.2527/1991.6993603x |
| [28] |
BEHARKA A A, NAGARAJA T G, MORRILL J L, et al. Effects of form of the diet on anatomical, microbial, and fermentative development of the rumen of neonatal calves1[J]. Journal of Dairy Science, 1998, 81(7): 1946-1955. DOI:10.3168/jds.S0022-0302(98)75768-6 |
| [29] |
HUYEN N T, WANAPAT M, NAVANUKRAW C. Effect of mulberry leaf pellet (MUP) supplementation on rumen fermentation and nutrient digestibility in beef cattle fed on rice straw-based diets[J]. Animal Feed Science and Technology, 2012, 175(1/2): 8-15. |




