2. 广州飞禧特生物科技有限公司, 广州 510640;
3. 广东省 畜禽育种与营养研究重点实验室, 广州 510640;
4. 农业部华南动物营养与饲料重点实验室, 广州 510640
2. Guangzhou Fishtech Biotechnology Co., Ltd., Guangzhou 510640, China;
3. Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China;
4. Key Laboratory of Animal Nutrition and Feed Science in South China of Ministry of Agriculture, Guangzhou 510640, China
鱼粉由于具有适口性好、容易被消化吸收等特点,是水产动物配合饲料主要的蛋白质来源,在饲料配方中所占比重较大。然而,由于气候变化、环境恶化、过渡捕捞等因素影响,全球渔业资源枯竭,鱼粉产量逐年下降,与此同时,全球水产养殖业在过去10年中稳步增长,养殖规模不断扩大,鱼粉需求量在逐年增加。鱼粉的供需矛盾已成为制约水产养殖可持续发展的主要瓶颈之一,因此,降低水产养殖对鱼粉的过度依赖,开发适宜的蛋白质替代资源成为亟待解决的问题。
昆虫是动物界中最大的类群,占据生态系统较小(不占用耕地、需要很少的水和能量),虫体富含氨基酸、脂类、维生素和矿物质,是地球上最具开发潜力的动物蛋白质资源[1-2]。黑水虻(Hermetia illucens L.)是双翅目水虻科昆虫,又名亮斑扁角水虻,幼虫在自然界以动物粪便、腐烂的有机物,如腐肉、瓜果蔬菜和植物性垃圾为食[3],将这些废弃物转化为自身生物量,生产高价值的蛋白质饲料,具有广阔前景。研究发现黑水虻的取食活动能够减少鸡粪和猪粪堆积,抑制家蝇滋生[4-5],在生物处置系统内大大降低人粪便中沙门氏菌(Salmonella spp.)的数量[6]以及猪粪氮的含量[7],得到的黑水虻预蛹含有40%左右的蛋白质和30%的脂肪[8-9]。已研究表明,黑水虻幼虫或预蛹可部分替代斑点叉尾(Ictalurus punctatus)[10]、罗非鱼(Oreochromis niloticus)[10-12]、非洲鲶鱼(Clarias gariepinus)[13]、虹鳟(Oncorhynchus mykiss)[9, 14-15]、大菱鲆(Psetta maxima)[16]、凡纳滨对虾(Litopenaeus vannamei)[17]、建鲤(Cyprinus carpio var. Jian)[18]、欧洲鲈鱼(Dicentrarchus labrax)[19]饲料中的鱼粉,其饲料化利用取得了较好的效果。
鲈鱼(Lateolabrax japonicus),俗名七星鲈、花鲈,属鲈形目,鳍科,花鲈属,因其具有生长迅速,对温度、盐度适应性广,肉质细嫩,味道鲜美,营养价值高等特点,已成为我国沿海地区一种重要的经济鱼类,养殖规模不断扩大。鲈鱼是肉食性鱼类,鱼粉依然是鲈鱼配合饲料的主要蛋白质来源,在基础饲料中占40%左右。目前昆虫替代源在鲈鱼饲料中的应用研究未见报道,因此,本试验拟开展黑水虻幼虫粉替代饲料中不同比例的鱼粉对鲈鱼幼鱼生长性能、体组成、血浆生化指标、组织结构影响的研究,以期为黑水虻幼虫粉在鲈鱼饲料中的应用提供借鉴。
1 材料与方法 1.1 黑水虻幼虫粉试验用黑水虻幼虫由广州飞禧特生物科技有限公司提供,采用天然气干燥设备烘干制得。在实验室用万能粉碎机将黑水虻幼虫粉碎,制得黑水虻幼虫粉,置于-20 ℃冰箱中保存备用。烘干的黑水虻幼虫呈淡黄色,粉碎后制得的黑水虻幼虫粉有香味,无霉变结块。经分析测定,黑水虻幼虫粉的水分、粗蛋白质、粗脂肪、粗灰分、钙、总磷含量分别为1.90%、34.00%、37.50%、14.80%、4.61%、1.14%,赖氨酸、蛋氨酸含量分别为1.76%、0.46%,以上测定结果均为风干基础。
1.2 试验饲料首先以鱼粉(水分、粗蛋白质、粗脂肪、粗灰分、钙、总磷含量分别为9.76%、67.50%、5.96%、16.06%、3.14%、2.46%,赖氨酸、蛋氨酸含量分别为5.19%、1.92%)、豆粕、花生粕为主要蛋白质源,鱼油、豆油、磷脂为脂肪源,高筋面粉为糖源配制基础饲料(含28.00%的鱼粉),然后用黑水虻幼虫粉等蛋白质替代基础饲料中0(对照)、10%、20%、30%、40%和50%的鱼粉,配制6种试验饲料,并分别记为G0、G10、G20、G30、G40、G50。6种试验饲料等氮(粗蛋白质含量为39.9%)等能(总能为17.9 MJ/kg),其组成及营养水平见表 1,必需氨基酸组成见表 2。所有饲料原料均粉碎并过60目筛,采用逐级扩大法将维生素和矿物质预混料等成分混匀,然后加入鱼油、豆油、卵磷脂和水混匀,用SLX-80型双螺旋杆挤压机将其制成直径为2.0 mm的颗粒饲料,50 ℃烘干,自然冷却后装入密封袋,于-20 ℃冰箱中保存备用。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 2 试验饲料必需氨基酸组成(干物质基础) Table 2 Essential amino acid composition of experimental diets (DM basis) |
试验用鲈鱼幼鱼购于福建诏安县英港育苗场,购回后暂养于广东省农业科学院动物科学研究所水产研究室的室内循环水养殖系统中,水体的初始盐度为3‰~0.5‰,每天用基础饲料饱食投喂2次(09:00、16:00),驯养2周,逐渐淡化至淡水养殖。养殖系统由18个容量为350 L(直径80 cm,高70 cm)的圆柱形玻璃纤维缸组成,养殖实际水容量为300 L。试验开始时,挑选出体格健壮、大小均匀、平均体重为5.2 g的鲈鱼幼鱼540尾,分配于18个养殖缸中,每缸放养30尾。将18个养殖缸随机分为6个组(每组3个重复),记为G0、G10、G20、G30、G40和G50组,分别投喂对应的试验饲料。每天饱食投喂2次(09:00和16:00)。每天记录投饲量、死亡情况以及水温和水质情况。全天(24 h)不间断曝气,光照为自然光源,水温25.0~30.0 ℃,pH 7.5~8.0,氨氮浓度< 0.1 mg/L,溶氧浓度>7 mg/L。试验期为56 d。
1.4 样品采集与分析试验开始时,挑选体重与试验用鲈鱼幼鱼的初始体重相近的鲈鱼幼鱼20尾,分析全鱼的常规营养成分。养殖试验结束时,禁食12 h后每缸试验鱼分别称重并统计数目。每缸随机取3尾鱼于-20 ℃冰箱中保存,用于全鱼常规营养成分分析。每缸另随机取9尾鱼,尾静脉取血,混合后于4 ℃下4 000 r/min离心10 min制备血浆样品,保存于-80 ℃冰箱中,用于血浆生化指标分析。每缸再随机取6尾鱼,用于形体指标测定。每缸取4尾鱼,分离出前肠、肝脏置于Bouin氏试液中固定,室温保存,用于肠道、肝脏组织切片制作。
饲料和全鱼样品中水分含量采用105 ℃常压干燥法(GB/T 6435—1986)、粗蛋白质含量采用凯氏定氮法(GB/T 6432—1994)、粗脂肪含量采用乙醚抽提法(GB/T 6432—1994)、粗灰分含量采用550 ℃灼烧法(GB/T 6438—1992)、钙含量采用乙二胺四乙酸(EDTA)滴定法(GB/T 6436—2002)、总磷含量采用钼黄比色法(GB/T6437—2002)进行测定。饲料中总能采用氧弹量热仪(IKA-C2000)进行测定。血浆葡萄糖(glucose,GLU)、白蛋白(albumin,ALB)、球蛋白(globulin,GLOB)、尿素氮(urea nitrogen,UN)、胆固醇(cholesterol,CHOL)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和甘油三酯(triglyceride,TG)含量采用日立全自动生化分析仪进行测定。原料、饲料及全鱼各氨基酸含量采用高效液相色谱仪(Agilent 1260,美国)测定。
1.5 指标计算

|
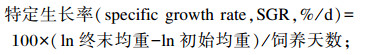
|
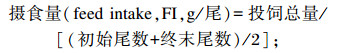
|

|

|

|

|

|

|
试验数据用平均值±标准误(n=3)表示。采用SPSS 11.5软件进行统计分析。首先对数据进行正态分布和方差齐性检验,若满足正态分布和方差齐性则采用单因素方差分析(one-way ANOVA),差异显著者再用Duncan氏法进行多重比较;若不满足方差齐性则采用Dunnett’s T3检验法进行多重比较。P < 0.05表示差异显著。
2 结果与分析 2.1 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼生长性能的影响由表 3可知,黑水虻幼虫粉替代不同比例的鱼粉对鲈鱼幼鱼的终末均重、增重率、特定生长率、摄食量、蛋白质效率、饲料系数、存活率均未产生显著影响(P > 0.05)。随着黑水虻幼虫粉替代鱼粉比例的增加,鲈鱼幼鱼的脏体比和肝体比升高,G50组显著高于G0组(P < 0.05)。
|
|
表 3 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼生长性能的影响 Table 3 Effects of fish meal replacement by black soldier fly larvae meal on growth performance of juvenile Lateolabrax japonicas |
由表 4可知,黑水虻幼虫粉替代不同比例的鱼粉对鲈鱼幼鱼全鱼粗蛋白质、粗灰分、水分、钙和总磷含量均未产生显著影响(P > 0.05),但全鱼粗脂肪含量随着黑水虻幼虫粉替代鱼粉比例的升高而升高,G20~G50组显著高于G0组(P < 0.05)。各组间鲈鱼幼鱼全鱼各必需氨基酸含量无显著差异(P > 0.05)。
|
|
表 4 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼体组成和必需氨基酸含量的影响 Table 4 Effects of fish meal replacement by black soldier fly larvae meal on body composition and essential amino acid contents of juvenile Lateolabrax japonicas |
由表 5可知,除G20组鲈鱼幼鱼血浆球蛋白含量显著高于G0组(P < 0.05)外,其他血浆生化指标各替代组(G10~G50组)与G0组相比无显著差异(P > 0.05)。
|
|
表 5 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼血浆生化指标的影响 Table 5 Effects of fish meal replacement by black soldier fly larvae meal on plasma biochemical indexes of juvenile Lateolabrax japonicas |
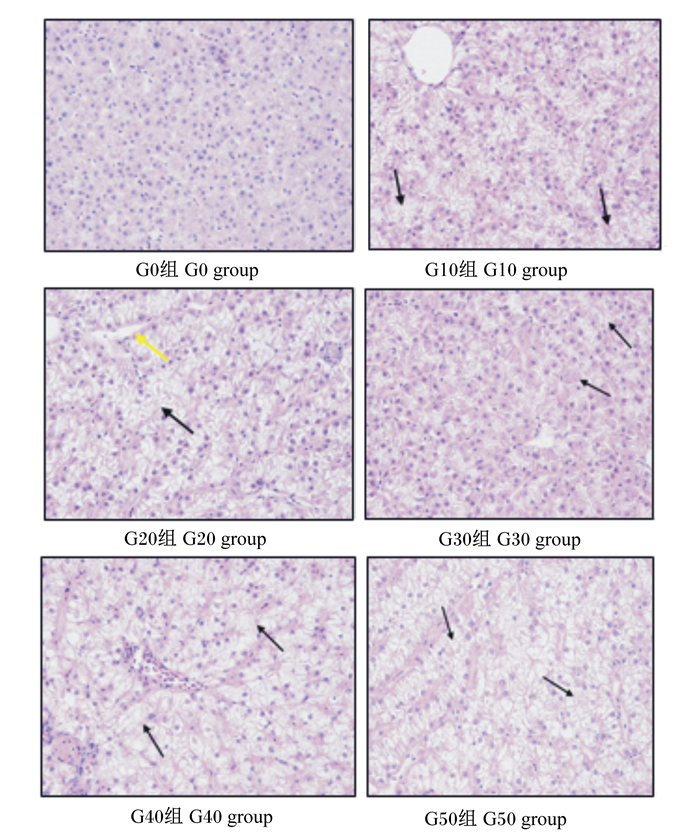
如图 1所示,G0组鲈鱼幼鱼肝细胞形态正常,无明显病变,但随着黑水虻幼虫粉替代鱼粉比例的增加,肝细胞出现广泛胞浆疏松、溶解或空泡状,部分或大部分胞核消失。
|
肝细胞广泛胞浆疏松、溶解或空泡状,部分胞核消失,细胞界限不清,如黑色箭头所示;肝窦扩张,如黄色箭头所示。 As indicated by the black arrow, the hepatic cells were loose, dissolved or vacuolated, and some of the nuclei disappeared; as indicated by the yellow arrow, the cell lines were not clear, hepatic sinus dilation. 图 1 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼肝脏组织结构的影响(苏木精-伊红染色) Figure 1 Effects of fish meal replacement by black soldier fly larvae meal on liver histological structure of juvenile Lateolabrax japonicas (HE staining, 400×) |
由表 6可知,G0组肠道绒毛长度高于各替代组,且与G10和G40组的差异达到显著水平(P < 0.05);与G0组相比,各替代组肠道绒毛宽度、固有层厚度以及杯状细胞数均未发生显著变化(P > 0.05),但有降低的趋势;除G20组外,各替代组肠道肌层厚度均显著低于G0组(P < 0.05)。
|
|
表 6 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼肠道组织结构的影响 Table 6 Effects of fish meal replacement by black soldier fly larvae meal on intestinal histological structure of juvenile Lateolabrax japonicas |
本试验结果表明,黑水虻幼虫粉替代基础饲料中50%的鱼粉(黑水虻幼虫粉在基础饲料中的添加量为27.8%,占饲料蛋白质的23.7%)未对鲈鱼幼鱼的终末均重、增重率、特定生长率、摄食量、蛋白质效率、饲料系数和存活率产生显著影响。但是当替代比例超过40%时,增重率、特定生长率和蛋白质效率最低,饲料系数最高,若在生产中以不影响生长性能为衡量指标,养殖8周时鲈鱼幼鱼对黑水虻幼虫粉的耐受量可以达到22.22%,占饲料蛋白质的19.0%。Magalhães等[19]研究发现,黑水虻预蛹粉可替代欧洲鲈鱼基础饲料中45%的鱼粉,在基础饲料中的适宜添加量为19.5%,占饲料蛋白质的22.5%,略高于本试验的结果。推测这可能与试验所用的2种虫粉的营养价值不同有关,Magalhães等[19]使用的黑水虻预蛹粉粗蛋白质含量为55.8%,而本试验所用黑水虻幼虫粉粗蛋白质含量为34.0%,略低于黑水虻预蛹粉。此外,本研究发现,除了黑水虻幼虫或预蛹粗蛋白质含量影响对鱼粉的替代量外,基础饲料配方中的鱼粉用量,黑水虻幼虫或预蛹中赖氨酸、蛋氨酸、色氨酸等必需氨基酸含量以及幼虫或预蛹的适口性、抗营养因子[16]等也会影响替代量的高低[19]。尽管Kroeckel等[16]在大菱鲆中使用的黑水虻预蛹粉的氨基酸组成与鱼粉相近,Magalhães等[19]等在欧洲鲈鱼利用黑水虻预蛹粉替代鱼粉时并未引起必需氨基酸的不足,但当替代比例超过适宜水平后,试验动物的正常生长均受到影响。
随着黑水虻幼虫粉替代鱼粉比例的增加,鲈鱼幼鱼的脏体比和肝体比升高,50%替代组显著高于对照组,而Li等[18]使用脱脂黑水虻虫粉替代鱼粉时并未发现对幼建鲤的肝体比和脏体比产生显著影响。Catacutan等[20]研究发现,鱼类肝体比和饲料脂肪水平呈显著正相关,因此,这可能与本试验使用的黑水虻幼虫粉未经脱脂处理,随着黑水虻幼虫粉添加量的增加,饲料粗脂肪含量增加有关。
3.2 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼体组成和必需氨基酸含量的影响研究表明,虹鳟和大菱鲆的体脂肪含量随着黑水虻预蛹粉添加量的增加而降低[9, 16],同样,Li等[18]使用脱脂黑水虻虫粉替代鱼粉时也发现幼建鲤肝脏中的脂肪含量显著降低。St-Hilaire等[9]认为黑水虻预蛹粉替代鱼粉时饲料鱼油和粗脂肪含量的下降导致虹鳟体脂肪沉积的减少,Kroeckel等[16]认为是由于采食量的降低引起了脂肪和能量的摄入不足,同时上述2个试验都发现饲料脂肪水平的变化引起饲料脂肪酸组成的差异,进而影响了试验动物肌肉脂肪酸的沉积[9, 16]。Li等[18]则认为是昆虫中的几丁质影响了幼建鲤肝脏脂肪酸的分解和合成。而在本试验中,随着黑水虻幼虫粉替代鱼粉比例的增加,饲料中粗脂肪含量升高,全鱼粗脂肪含量增加,这可能是由于本试验使用的黑水虻幼虫粉未经脱脂处理(粗脂肪含量高达37.5%),当黑水虻幼虫粉替代鱼粉比例的增加时饲料粗脂肪含量随之升高,从而导致鱼体脂肪沉积增加。研究发现饲料中的粗脂肪含量超过鲈鱼需要量(7.4%~9.9%)时,鲈鱼全鱼和肝脏脂肪含量随着饲料粗脂肪含量的升高而升高[21];同样,高脂饲料使大口黑鲈全鱼、肌肉、肝脏的脂肪蓄积明显增加[22]。因此,饲料粗脂肪含量的增加是引起鲈鱼体脂肪沉积增加的重要原因之一。黑水虻幼虫粉替代不同比例鱼粉对鲈鱼幼鱼全鱼粗蛋白质、粗灰分含量未产生显著影响,这与在虹鳟[9]、大菱鲆[16]和幼建鲤[18]中得到的研究结果一致。Magalhães等[19]发现黑水虻预蛹粉能够提高欧洲鲈鱼对饲料中精氨酸和组氨酸的消化率,但其未对欧洲鲈鱼肌肉氨基酸组成进行研究。Hu等[23]研究发现,当黑水虻幼虫粉替代鱼粉比例超过10%时,降低了黄颡鱼对饲料中精氨酸、赖氨酸、蛋氨酸等必需氨基酸的表观消化率,除蛋氨酸和苯丙氨酸外,黄颡鱼肌肉中其他必需氨基酸含量差异不显著。而Santos[24]在对虹鳟的研究中发现黑水虻替代鱼粉影响了饲料氨基酸组成,虹鳟鱼肌肉中赖氨酸、精氨酸、蛋氨酸含量出现显著差异。但本试验中黑水虻幼虫粉替代不同比例的鱼粉未对鲈鱼全鱼必需氨基酸组成产生显著影响。
3.3 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼血浆生化指标的影响已有研究发现黑水虻替代鱼粉降低了欧洲鲈鱼[19]和幼建鲤[18]血浆胆固醇的含量,但本试验中各组血浆胆固醇含量无显著差异。已有研究表明黑水虻预蛹中含有较高的几丁质多糖,几丁质多糖能够抑制胆固醇的吸收,增加肝内脂蛋白和甘油三酯的水解及胆汁酸的排泄[19, 25-27]。虽然在某些鱼类中发现了几丁质酶活性,但相对于大部分鱼类来说几丁质酶活性依然较低[16, 28],同时研究还推测黑水虻预蛹中胆固醇含量低于鱼粉导致替代饲料中胆固醇含量的降低也可能是引起幼建鲤[18]血浆胆固醇的含量低的原因,饲料中胆固醇含量直接影响养殖动物血液胆固醇含量[29-30]。文远红等[31]也发现蝇蛆粉替代鱼粉使黄颡鱼血清胆固醇含量降低。本试验中各替代组血浆中甘油三酯含量与对照组无显著差异,因此黑水虻幼虫中几丁质多糖或者是胆固醇含量是否如影响欧洲鲈鱼[19]和幼建鲤[18]一样会影响鲈鱼胆固醇和甘油三酯的代谢还需要进一步验证。当血浆白蛋白和球蛋白含量升高时,会增加机体免疫紊乱、肝功能障碍和肾功能受损相关疾病的发生率[24, 32]。Li等[18]发现幼建鲤血浆白蛋白和球蛋白含量不受黑水虻预蛹替代量的影响,黑水虻预蛹的使用可能不影响幼建鲤的免疫系统。本试验中,除20%替代组血浆白蛋白含量高于对照组外,其他替代组与对照组相比差异不显著。
3.4 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼肝脏和肠道组织结构的影响本试验中,增加黑水虻幼虫粉替代鱼粉的比例对鲈鱼肝脏细胞产生了一定的损伤。Li等[18]发现脱脂黑水虻虫粉使幼建鲤脂肪肝细胞数量减少,Belforti等[33]也发现随着黄粉虫粉含量的增加,虹鳟组织切片中脂肪含量下降,推测可能与昆虫含有较高的几丁质有关,几丁质影响了脂肪酸的合成[26-27]。但文远红等[31]发现,随着蝇蛆粉替代鱼粉比例的增加,黄颡鱼肝胰脏脂肪变性加重,认为是饲料中n-3系列多不饱和脂肪酸含量和n-3/n-6值的变化引起了肝脏组织结构的异常,随着蝇蛆粉替代鱼粉比例的增加,饲料中n-3系列多不饱和脂肪酸含量逐渐降低,n-3/n-6值逐渐降低。虽然本试验未对试验饲料的脂肪酸组成进行分析,但对黑水虻幼虫脂肪酸组成分析发现,黑水虻幼虫饱和脂肪酸和单不饱和脂肪酸含量较高[34]。Schiavone等[35]发现黑水虻通常会对肉类产品的脂肪酸组成产生负面影响,结果导致多不饱和脂肪含量降低或单不饱和脂肪含量增加。因此,饲料多不饱和脂肪酸组成的变化可能是引起鲈鱼肝脏细胞损伤的原因之一。
肠道是鱼类营养物质消化吸收的主要场所,正常的肠道黏膜形态结构是保证鱼类正常生长的基础。Li等[18]研究发现,当脱脂黑水虻虫粉替代鱼粉的量超过75%时,幼建鲤肠道的完整性遭到破坏;文远红等[31]利用蝇蛆粉替代鱼粉,当替代量超过80%时,黄颡鱼肠道的完整性和形态结构造出现明显损伤。本试验中,增加黑水虻幼虫粉替代鱼粉的比例对绒毛长度和肌层厚度产生了负面影响,说明增加黑水虻幼虫粉替代鱼粉的比例会对肠道造成损伤,昆虫体内存在的某些抗营养因子如几丁质等是影响肠道健康的主要因素。
4 结论经过8周养殖,黑水虻幼虫粉替代基础饲料中50%的鱼粉(在基础饲料中黑水虻幼虫粉的添加量为27.8%,占饲料蛋白质的23.7%)对鲈鱼幼鱼生长性能无显著影响,但高替代比例会使鱼体脂肪沉积增加,肝脏组织出现病变,肠道结构发育受损。
| [1] |
OONINCX D G A B, DE BOER I J M. Environmental impact of the production of mealworms as a protein source for humans-a life cycle assessment[J]. PLoS One, 2012, 7(12): e51145. DOI:10.1371/journal.pone.0051145 |
| [2] |
VAN HUIS A. Potential of insects as food and feed in assuring food security[J]. Annual Review of Entomology, 2013, 58(1): 563-583. DOI:10.1146/annurev-ento-120811-153704 |
| [3] |
MAY B M. The occurrence in New Zealand and the life-history of the soldier fly Hermetia illucens (L.) (Diptera:Stratiomyidae)[J]. New Zealand Journal of Science, 1961, 4: 55-65. |
| [4] |
SHEPPARD C. House fly and lesser fly control utilizing the black soldier fly in manure management systems for caged laying hens[J]. Environmental Entomology, 1983, 12(5): 1439-1442. DOI:10.1093/ee/12.5.1439 |
| [5] |
NEWTON L, SHEPPARD C, WATSON D S, et al. Using the black soldier fly, Hermetia illucens, as a value-added tool for the management of swine manure[R]. Animal and Poultry Raleigh, NC: Waste Management Center, North Carolina State University, 2005.
|
| [6] |
LALANDER C, DIENER S, MAGRI M E, et al. Faecal sludge management with the larvae of the black soldier fly (Hermetia illucens)-from a hygiene aspect[J]. Science of the Total Environment, 2013, 458-460: 312-318. DOI:10.1016/j.scitotenv.2013.04.033 |
| [7] |
SHEPPARD D C. Using soldier flies as a manure management tool for volume reduction, housefly control and feedstuff production[J]. Journal of French Language Studies, 1995, 24(4): f1-f4. |
| [8] |
NEWTON G L, SHEPPARD D C, WATSON D W, et al. The black soldier fly, Hermetia illucens, as a manure management/resource recovery tool[C]//Proceedings of the Symposium on the State of the Science of Animal Manure and Waste Management. San Antonio, Texas, USA, 2005.
|
| [9] |
ST-HILAIRE S, SHEPPARD C, TOMBERLIN J K, et al. Fly prepupae as a feedstuff for rainbow trout Oncorhynchus mykiss[J]. Journal of the World Aquaculture Society, 2007, 38(1): 59-67. DOI:10.1111/jwas.2007.38.issue-1 |
| [10] |
BONDARI K, SHEPPARD D C. Soldier fly larvae as feed in commercial fish production[J]. Aquaculture, 1981, 24: 103-109. DOI:10.1016/0044-8486(81)90047-8 |
| [11] |
RANA K M S, SALAM M A, HASHEML S, et al. Development of black soldier fly larvae production technique as an alternate fish feed[J]. International Journal of Research in Fisheries and Aquaculture, 2015, 5(1): 41-47. |
| [12] |
HEM S, TOURE S, SAGBLA C, et al. Bioconversion of palm kernel meal for aquaculture:experiences from the forest region (Republic of Guinea)[J]. African Journal of Biotechnology, 2008, 7(8): 1192-1198. |
| [13] |
ADENIYI, VICTORIA O, FOLORUNSHO, et al. Performance of Clarias gariepinus (Burchell, 1822) fed dietary levels of black soldier fly, Hermetia illucens (Linnaeus, 1758) prepupae meal as a protein[J]. International Journal of Research in Fisheries and Aquaculture, 2015, 5(3): 89-93. |
| [14] |
SEALEY W M, GAYLORD T G, BARROWS F T, et al. Sensory analysis of rainbow trout, Oncorhynchus mykiss, fed enriched black soldier fly prepupae, Hermetia illucens[J]. Journal of the World Aquaculture Society, 2011, 42(1): 34-45. DOI:10.1111/jwas.2011.42.issue-1 |
| [15] |
STAMER A, WESSLESS S, NEIDIGK R, et al. Black soldier fly (Hermetia illucens) larvae meal as an example for a new feed ingredients class in aquaculture diets[C]//Proceeding of the 4th Isofar Scientific Conference: Building Organic Bridges at the Organic World Congress. Islanbul, Turkey, 2014.
|
| [16] |
KROECKEL S, HARJES A G E, ROTH I, et al. When a turbot catches a fly:evaluation of a pre-pupae meal of the black soldier fly (Hermetia illucens) as fish meal substitute-growth performance and chitin degradation in juvenile turbot (Psetta maxima)[J]. Aquaculture, 2012, 364/365: 345-352. DOI:10.1016/j.aquaculture.2012.08.041 |
| [17] |
CUMMINS V C, J r, RAWLES S D, THOMPSON K R, et al. Evaluation of black soldier fly (Hermetia illucens) larvae meal as partial or total replacement of marine fish meal in practical diets for Pacific white shrimp (Litopenaeus vannamei)[J]. Aquaculture, 2017, 473: 337-344. DOI:10.1016/j.aquaculture.2017.02.022 |
| [18] |
LI S L, JI H, ZHANG B X, et al. Defatted black soldier fly (Hermetia illucens) larvae meal in diets for juvenile Jian carp (Cyprinus carpio var. Jian):growth performance, antioxidant enzyme activities, digestive enzyme activities, intestine and hepatopancreas histological structure[J]. Aquaculture, 2017, 477: 62-70. DOI:10.1016/j.aquaculture.2017.04.015 |
| [19] |
MAGALHÃES R, SÁNCHEZ-LÓPEZ A, LEAL R S, et al. Black soldier fly (Hermetia illucens) pre-pupae meal as a fish meal replacement in diets for European seabass (Dicentrarchus labrax)[J]. Aquaculture, 2017, 476: 79-85. DOI:10.1016/j.aquaculture.2017.04.021 |
| [20] |
CATACUTAN M R, COLOSO R M. Growth of juvenile Asian seabass, Lates calcarifer, fed varying carbohydrate and lipid levels[J]. Aquaculture, 1997, 149(1/2): 137-144. |
| [21] |
XU H G, DOU B SH, ZHENG K K, et al. Lipid Requirements in growing Japanese seabass (Lateolabrax japonicus) of two different sizes[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2015, 67: 1151. |
| [22] |
陈乃松, 肖温温, 梁勤朗, 等. 饲料中脂肪与蛋白质比对大口黑鲈生长、体组成和非特异性免疫的影响[J]. 水产学报, 2012, 36(8): 1270-1280. |
| [23] |
HU J R, WANG G X, HUANG Y H, et al. Effects of the substitution of fish meal with black soldier fly (Hermetia illucens) larvae meal in yellow catfish (Pelteobagrus fulvidraco) diets[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2017, 69: 1382. |
| [24] |
SANTOS A F B D. Evaluation of the potential of prepupae meal of black soldier fly (Hermetia illucens) as potential ingredient for Rainbow trout (Oncorhynchus mykiss): effect on flesh quality[D]. Firenze: Faculdade de Ciências da Universidade do Porto, Università degli Studi di Firenze, 2016.
|
| [25] |
KHOUSHAB F, YAMABHAI M. Chitin research revisited[J]. Marine Drugs, 2010, 8(7): 1988-2012. |
| [26] |
ZHANG J L, LIU J N, LI L, et al. Dietary chitosan improves hypercholesterolemia in rats fed high-fat diets[J]. Nutrition Research, 2008, 28(6): 383-390. DOI:10.1016/j.nutres.2007.12.013 |
| [27] |
LI Q P, GOONERATNE S R, WANG R L, et al. Effect of different molecular weight of chitosans on performance and lipid metabolism in chicken[J]. Animal Feed Science and Technology, 2016, 211: 174-180. DOI:10.1016/j.anifeedsci.2015.11.013 |
| [28] |
ABRO R, SUNDELL K, SANDBLOM E, et al. Evaluation of chitinolytic activities and membrane integrity in gut tissues of Arctic charr (Salvelinus alpinus) fed fish meal and zygomycete biomass[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2014, 175: 1-8. DOI:10.1016/j.cbpb.2014.06.003 |
| [29] |
KAUSHIK S J, CRAVEDE J P, LALLES J P, et al. Partial or total replacement of fish meal by soybean protein on growth, protein utilization, potential estrogenic or antigenic effects, cholesterolemia and flesh quality in rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 1995, 133(3/4): 257-274. |
| [30] |
GOULDING N J, GIBNEY M J, TAYLOR T G, et al. Reversible hypercholesterolaemia produced by cholesterol-free fish meal protein diets[J]. Atherosclerosis, 1983, 49(2): 127-137. DOI:10.1016/0021-9150(83)90190-9 |
| [31] |
文远红, 黄燕华, 王国霞, 等. 蝇蛆粉替代鱼粉对黄颡鱼抗氧化指标、消化酶活性及前肠、肝胰脏组织结构的影响[J]. 饲料工业, 2015, 36(4): 29-35. |
| [32] |
JOHN P J. Alteration of certain blood parameters of freshwater teleost Mystus vittatus after chronic exposure to Metasystox and Sevin[J]. Fish Physiology and Biochemistry, 2007, 33(1): 15-20. DOI:10.1007/s10695-006-9112-7 |
| [33] |
BELFORTI M, GAI F, LUSSIANA C, et al. Tenebrio molitor meal in rainbow trout (Oncorhynchus mykiss) diets:effects on animal performance, nutrient digestibility and chemical composition of fillets[J]. Italian Journal of Animal Science, 2015, 14(4): 670-676. |
| [34] |
胡俊茹, 何飞, 莫文艳, 等. 采食不同有机废弃物黑水虻幼虫饲料价值分析[J]. 中国饲料, 2017(15): 24-27. |
| [35] |
SCHIAVONE A, CULLERE M, DE MARCO M, et al. Partial or total replacement of soybean oil by black soldier fly larvae (Hermetia illucens L.) fat in broiler diets:effect on growth performances, feed-choice, blood traits, carcass characteristics and meat quality[J]. Italian Journal of Animal Science, 2017, 16(1): 93-100. DOI:10.1080/1828051X.2016.1249968 |




