脂多糖(lipopolysaccharide,LPS)是大肠杆菌等革兰氏阴性细菌外膜的主要成分,当细菌感染乳腺组织时,释放出来LPS能够导致乳腺组织损伤,进而产生炎症[1-2]。据报道,LPS能够提高奶牛乳腺上皮细胞内肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)等炎症因子的表达,降低抗氧化酶类活性,升高丙二醛(MDA)浓度和细胞膜的渗透性,进而促进细胞凋亡[3-4]。苜蓿素(Tricin)又称4′,5,7-三羟基-3′,5′-二甲氧基黄酮,是在感染锈病的小麦叶子中首次发现的一种黄酮类化合物,随后在苜蓿草、水稻、高粱和大麦等植物中亦发现[5]。有研究发现,苜蓿素能够抑制细菌、真菌和流感病毒的增殖,发挥抗菌和抗病毒作用[6-7];具有轻微的类雌激素活性,发挥抗氧化作用[8];苜蓿素能够抑制人直肠癌细胞的增殖,诱导细胞凋亡,发挥抗癌作用[9];苜蓿素能够抑制小鼠T和B淋巴细胞的增殖,具有一定的免疫抑制作用[10]。在LPS刺激下,黄芪苷、桑色素和葛根素均能够抑制乳腺上皮细胞的TNF-α、白细胞介素6(IL-6)的表达,降低核因子κB(NF-κB)活性和磷酸化核因子κB抑制蛋白(IκBα)、p38、细胞外信号调节激酶(ERK)和p65的合成[11-13]。结果说明,在LPS刺激下,黄酮类物质能够通过抑制NF-κB信号通路的活化来降低其下游炎性因子TNF-α等的表达,起到抗炎作用。目前,苜蓿素对LPS刺激下奶牛乳腺上皮细胞的影响尚未见报道。因此,本试验研究苜蓿素对LPS刺激下奶牛乳腺上皮细胞的影响,以此来探索苜蓿素是否能够发挥抗炎作用,为苜蓿素在动物生产中的应用提供科学的依据。
1 材料与方法 1.1 试验材料苜蓿素(经高效液相色谱分析得出纯度≥98%)来自于燕麦,由上海源叶生物科技有限公司提供;LPS(血清型O55:B5)来自于美国Sigma公司;试验所用奶牛乳腺上皮细胞由本实验室通过组织块培养法获得,奶牛乳腺上皮细胞的培养方法和鉴定见詹康等[14]的报道。
1.2 试验方法 1.2.1 细胞毒性检测苜蓿素对细胞毒性的检测采用CCK-8法。将奶牛乳腺上皮细胞分成8组,分别在基础培养基中加入0(对照)、2.5、5.0、7.5、10.0、15.0、25.0和40.0 μg/mL的苜蓿素,每组5个重复,其中苜蓿素用二甲基亚砜(DMSO)(北京索莱宝科技有限公司)完全溶解,培养基中的DMSO含量低于2‰。将乳腺上皮细胞接种在96孔板中,每孔数量为1×105个/mL,在37 ℃,5% CO2培养箱中进行培养。待细胞贴壁后,去除培养基,磷酸盐缓冲液(PBS)清洗后加入不同处理的培养基。在96孔板中,每孔接种乳腺上皮细胞数量为1×105个/mL,然后在37 ℃,5% CO2培养箱中进行培养。待细胞贴壁后,去除培养基,PBS清洗后加入配制好的各组的培养基。细胞培养24 h后,每孔中加入10 μL CCK-8溶液,在培养箱中孵育3 h后,用酶标仪测定450 nm处的吸光值,然后计算细胞相对增殖率,以此评断苜蓿素的细胞毒性。相对增殖率计算公式如下:
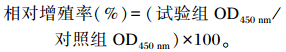
|
细胞活性也采用CCK-8法进行检测。将奶牛乳腺上皮细胞成分为6组,对照组采用基础培养基,试验组在基础培养基中分别加入1 μg/mL LPS(L组)、1 μg/mL LPS和2.5 μg/mL苜蓿素(L+2.5组)、1 μg/mL LPS和5.0 μg/mL苜蓿素(L+5组)、1 μg/mL LPS和10.0 μg/mL苜蓿素(L+10组)以及1 μg/mL LPS和15.0 μg/mL苜蓿素(L+15组),其他步骤同1.2.1。最终以细胞相对增殖率的高低判定细胞活性高低。
1.2.3 抗氧化性能的测定将奶牛乳腺上皮细胞成分为6组,分组方法同1.2.2,将细胞以5×105个/mL接种到6孔板。细胞培养24 h后,收集细胞培养液和细胞来检测一氧化氮(NO)和MDA浓度、乳酸脱氢酶(LDH)和超氧化物歧化酶(SOD)活性。检测方法参照试剂盒(南京建成生物工程研究所)中的说明书。
1.2.4 炎症相关基因的相对表达量将奶牛乳腺上皮细胞成分为6组,分组方法同1.2.2,将细胞以5×105个/mL接种到6孔板。细胞培养24 h后,去除细胞培养液,加入1 mL的Trizol,混匀静置10 min,然后参照天根生化科技有限公司提供的试剂盒说明书进行总RNA提取。提取出来的总RNA采用One Drop仪器进行浓度和纯度的检测,然后采用瑞士Roche公司的反转录试剂盒进行cDNA合成,操作方法、反应体系和反应液配制参照占今舜等[15]的报道。实时定量PCR试剂盒由瑞士Roche公司提供,PCR反应液配制和反应条件参照占今舜等[16]的报道。
根据GenBank中的基因序列,采用Primer 5.0软件设计引物,引物合成则由美国Invitrogen公司完成。甘油醛-3-磷酸脱氢酶为内参基因。引物序列见表 1。基因相对表达量采用2-△△Ct方法进行计算。
|
|
表 1 引物序列及参数 Table 1 Primer sequences and parameters |
试验数据先用Excel 2007进行整理,并在SPSS 21.0软件上进行ANOVA分析,采用LSD法进行多重比较。数据以平均值±标准误表示,以P < 0.01表示差异极显著,P < 0.05表示差异显著。
2 结果与分析 2.1 苜蓿素的细胞毒性从表 2中可知,苜蓿素浓度为2.5~15.0 μg/mL时,奶牛乳腺上皮细胞的相对增殖率随着苜蓿素浓度的升高呈升高趋势;苜蓿素浓度为15.0~40.0 μg/mL时,奶牛乳腺上皮细胞的相对增殖率随着苜蓿素浓度的升高而呈下降趋势。结果表明,在浓度一定范围内,苜蓿素提高细胞活性,而浓度过高则产生毒性。
|
|
表 2 苜蓿素对奶牛乳腺上皮细胞的毒性 Table 2 Toxicity of tricin on BMECs |
从表 3中可知,L组奶牛乳腺上皮细胞相对增殖率极显著低于其他各组(P < 0.01),L+2.5组和L+10组上皮细胞活性极显著高于对照组和L+15组(P < 0.01)。结果表明,在LPS刺激下,奶牛乳腺上皮细胞活性降低,而添加苜蓿素可以提高细胞活性。
|
|
表 3 苜蓿素对脂多糖刺激下奶牛乳腺上皮细胞活性的影响 Table 3 Effects of tricin on viability of BMECs stimulated by LPS |
从表 4中可知,与L+2.5组、L+5组、L+10组和L+15组细胞SOD活性显著高于其他各组(P < 0.05),L组的活性最低;L+10组细胞的MDA和NO浓度均显著低于L组(P < 0.05);L组细胞LDH活性最高,而L+2.5组、L+5组、L+10组、L+15组与之相比显著降低(P < 0.05)。结果表明,在LPS刺激下添加苜蓿素可以提高细胞的抗氧化性能。
|
|
表 4 苜蓿素对脂多糖刺激下奶牛乳腺上皮细胞抗氧化性能的影响 Table 4 Effects of tricin on antioxidant capacity of BMECs stimulated by LPS |
从表 5中可知,与对照组相比,其他各组细胞的白细胞介素8(IL-8)、IL-1β、IL-6和TNF-α的相对表达量均极显著升高(P < 0.01),而与L组相比,L+5组和L+10组细胞的IL-8、IL-1β和TNF-α的相对表达量均极显著降低(P < 0.01)。L组细胞Toll样受体2(TLR2)和Toll样受体4(TLR4)的相对表达量极显著高于其他各组(P < 0.01)。L组细胞髓样分化因子88(MyD88)的相对表达量显著或极显著高于对照组和L+5组(P < 0.05或P < 0.01)。各组细胞的转化生长因子1β(TGF-1β)和核苷酸结合寡聚域1(NOD1)相对表达量无显著性差异(P > 0.05)。结果表明,LPS能够提高奶牛乳腺上皮细胞炎症相关基因的表达,而添加苜蓿素能够抑制它们的表达。
|
|
表 5 苜蓿素对脂多糖刺激下奶牛乳腺上皮细胞炎症相关基因表达的影响 Table 5 Effects of tricin on expressions of genes related to inflammation of BMECs stimulated by LPS |
通过体外培养发现,添加100 ng/mL的大豆黄酮和染料木黄酮、10~1 000 mg/L大豆异黄酮以及50~100 μg/mL苜蓿黄酮均可显著提高奶牛乳腺上皮细胞增殖[17-19]。在本试验中,添加2.5~15.0 μg/mL苜蓿素提高奶牛乳腺上皮细胞的相对增殖率,结果与上述研究一致。然而,当苜蓿素浓度超过15.0 μg/mL时,相对增殖率有所下降,说明可能高浓度苜蓿素会对细胞产生毒性。因此,为了避免苜蓿素对细胞产生毒性影响试验,后续试验苜蓿素浓度就定在15.0 μg/mL以内。
在LPS的刺激下,奶牛乳腺上皮细胞的相对增殖率随LPS浓度增加而下降[20]。本试验也发现,LPS刺激下,奶牛乳腺上皮细胞的相对增殖率显著下降,说明LPS具有抑制细胞增殖的作用。刘立新等[21]研究发现,LPS刺激乳腺上皮细胞后,细胞相对增殖率显著降低,而在LPS刺激下,添加不同浓度的紫花苜蓿总黄酮能显著提高细胞的活性,并且浓度越大效果越明显。本试验所得结果与其一致。这说明在LPS刺激下,添加适宜浓度的苜蓿素能够促进奶牛乳腺上皮细胞的增殖。
3.2 苜蓿素对LPS刺激下细胞抗氧化性能的影响一般体内产生的自由基处于动态平衡状态,当体内产生的自由基过多,会导致细胞中的不饱和脂肪酸产生MDA,而MDA能够促使细胞解体,导致细胞死亡[15]。在LPS刺激下,猪空肠上皮细胞和奶牛乳腺上皮细胞内的SOD和过氧化氢酶(CAT)活性降低,而MDA浓度升高[3, 22]。LDH是糖酵解过程中的一种氧化还原类酶,当细胞受到损伤时,LDH释放出来。LPS能够增加奶牛乳腺上皮细胞内的LDH释放率,且细胞培养上清液中LDH活性随着LPS浓度的增加而增加[19]。NO是细胞内和细胞间的重要信号分子,在炎症反应中发挥重要的作用。在LPS诱导下,导致细胞NO浓度会升高,进而激活环氧化酶2(COX-2),诱导细胞凋亡[23]。以上结果说明,LPS能够降低抗氧化酶类的活性,增加细胞内自由基浓度,导致细胞损伤,进而抑制细胞增殖。在LPS刺激下,柚苷能够提高小鼠心脏SOD活性和降低MDA浓度[24];茶多酚能够提高人支气管上皮细胞SOD活性,降低LDH活性和MDA浓度[25]。另外,苜蓿素、异甘草素、甘草素和柚皮素可以抑制LPS诱导的RAW264.7细胞NO的释放[26-27]。本试验结果与这些研究相似,说明添加适量的苜蓿素可以通过提高奶牛乳腺上皮细胞的抗氧化性能来保护细胞免受氧化损伤,提高细胞活性。
3.3 苜蓿素对LPS刺激下细胞炎症相关基因表达的影响转化生长因子-β(TGF-β)在调节组织炎症和修复方面具有重要作用,LPS能够明显增加大鼠腹膜间皮细胞分泌TGF-β1[28]。NOD1在全身各种组织细胞中均有分布,在天然免疫和炎症反应中发挥重要作用。在LPS刺激下,仔猪的肝脏和下丘脑垂体肾上腺中NOD1的表达量显著升高[29-30]。从本试验结果来看,LPS刺激下,奶牛乳腺上皮中TGF-β1和NOD1的相对表达量升高,添加苜蓿素对其无显著影响。这说明苜蓿素不能通过调节TGF-β和核苷酸结合寡聚域(NOD)信号通路来发挥抗炎症作用。LPS是一种重要的炎症因子,能够诱导TNF-ɑ、IL-1β、IL-6等细胞因子参与炎症反应。研究发现,苜蓿素能够显著下调LPS刺激下人外周血单核细胞TNF-α和IL-6的生成,抑制TLR4、MyD88和TIR结构域衔接蛋白(TRIF)的活性;通过调节丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3激酶/丝氨酸、苏氨酸蛋白激酶(PI3K/Akt)通路,抑制NF-κB信号,降低COX-2和TNF-α浓度,提高人脐静脉血管内皮细胞的抗炎症作用[31-33]。另外,苜蓿素能够显著降低哮喘小鼠支气管肺泡灌洗液TNF-α和IL-1β浓度以及肺泡巨噬细胞的TLR4、MyD88和NF-κB p65相对表达量和蛋白质浓度[34]。本试验结果也发现,在LPS刺激下,苜蓿素能够抑制奶牛乳腺上皮细胞TNF-α、IL-8、IL-6、IL-1β、TLR4、TLR2和MyD88的表达。这说明苜蓿素提高奶牛乳腺上皮细胞抗炎症作用可能与其调控TLR/MyD88/NF-κB通路有关。
4 结论① 苜蓿素能够提高LPS刺激下奶牛乳腺上皮细胞的抗氧化性能,提高细胞相对增殖率。
② 苜蓿素可能通过调控TRL/MyD88/NF-κB通路,降低炎症因子的表达和NO的生成,进而发挥抗炎症作用。
| [1] |
MORITA-TAKEMURA S, NAKAHARA K, TATSUMI K, et al. Changes in endothelial cell proliferation and vascular permeability after systemic lipopolysaccharide administration in the subfornical organ[J]. Journal of Neuroimmunology, 2016, 298: 132-137. DOI:10.1016/j.jneuroim.2016.06.011 |
| [2] |
SUN Y, LI L, WU J, et al. Bovine recombinant lipopolysaccharide binding protein (BRLBP) regulated apoptosis and inflammation response in lipopolysaccharide-challenged bovine mammary epithelial cells(BMEC)[J]. Molecular Immunology, 2015, 65(2): 205-214. DOI:10.1016/j.molimm.2015.01.026 |
| [3] |
SHI H Y, GUO Y M, LIU Y, et al. The in vitro effect of lipopolysaccharide on proliferation, inflammatory factors and antioxidant enzyme activity in bovine mammary epithelial cells[J]. Animal Nutrition, 2016, 2(2): 99-104. DOI:10.1016/j.aninu.2016.03.005 |
| [4] |
朱丽萍, 杨文浩, 任婷婷, 等. 脂多糖诱导奶牛乳腺上皮细胞中炎性因子和核转录子-κB的表达[J]. 中国兽医杂志, 2016, 52(5): 14-17, 49. |
| [5] |
ZHOU J M, IBRAHIM R K. Tricin-a potential multifunctional nutraceutical[J]. Phytochemistry Reviews, 2010, 9(3): 413-424. DOI:10.1007/s11101-009-9161-5 |
| [6] |
CHUNG I M, HAHN S J, AHMAD A. Confirmation of potential herbicidal agents in hulls of rice, Oryza sativa[J]. Journal of Chemical Ecology, 2005, 31(6): 1339-1352. DOI:10.1007/s10886-005-5290-5 |
| [7] |
YAZAWA K, KUROKAWA M, OBUCHI M, et al. Anti-influenza virus activity of tricin, 4', 5, 7-trihydroxy-3', 5'-dimethoxyflavone[J]. Antiviral Chemistry & Chemotherapy, 2011, 22(1): 1-11. |
| [8] |
BICHOFF E M, LIVINGSTON A L, BOOTH A N. Tricin from alfalfa:isolation and physiological activity[J]. Journal of Pharmaceutical Sciences, 1964, 53(11): 1411-1412. DOI:10.1002/jps.2600531131 |
| [9] |
陈艳, 姚宏, 林新华. 苜蓿素对人直肠癌SW1116细胞增殖和凋亡的作用及其机制[J]. 天然产物研究与开发, 2013, 25(1): 31-35. |
| [10] |
刘利艳, 殷玉婷, 陈力, 等. 苜蓿素对小鼠免疫功能的影响[J]. 广东医学, 2016, 37(8): 1118-1121. |
| [11] |
LI F Y, WANG W, CAO Y G, et al. Inhibitory effects of astragalin on lipopolysaccharide-induced inflammatory response in mouse mammary epithelial cells[J]. Journal of Surgical Research, 2014, 192(2): 573-581. DOI:10.1016/j.jss.2014.05.059 |
| [12] |
WANG J J, GUO C M, WEI Z K, et al. Morin suppresses inflammatory cytokine expression by downregulation of nuclear factor-κB and mitogen-activated protein kinase (MAPK) signaling pathways in lipopolysaccharide-stimulated primary bovine mammary epithelial cells[J]. Journal of Dairy Science, 2016, 99(4): 3016-3022. DOI:10.3168/jds.2015-10330 |
| [13] |
任婷婷, 张东君, 朱丽萍, 等. 葛根素对奶牛乳腺上皮细胞炎症模型中NF-κB信号通路的影响[J]. 农业生物技术学报, 2016, 24(1): 44-51. |
| [14] |
詹康, 贡笑笑, 左晓昕, 等. 奶牛乳腺上皮细胞系的培养与鉴定[J]. 动物营养学报, 2015, 27(8): 2544-2550. |
| [15] |
占今舜, 魏明吉, 苏效双, 等. 苜蓿黄酮对热应激下体外培养奶牛乳腺上皮细胞凋亡的影响[J]. 草业学报, 2016, 25(4): 159-165. DOI:10.11686/cyxb2015317 |
| [16] |
占今舜, 刘明美, 詹康, 等. 苜蓿黄酮对奶牛乳腺上皮细胞乳蛋白、乳脂和乳糖合成的影响[J]. 中国畜牧杂志, 2017, 53(1): 91-95. |
| [17] |
刘春龙, 李忠秋, 张帆, 等. 大豆黄酮和染料木素对体外培养奶牛乳腺上皮细胞增殖及抗氧化水平的影响[J]. 畜牧兽医学报, 2008, 39(11): 1517-1522. DOI:10.3321/j.issn:0366-6964.2008.11.011 |
| [18] |
穆莹, 江连洲. 大豆异黄酮对奶牛乳腺上皮细胞增殖及泌乳性能的影响[J]. 中国畜牧兽医, 2013, 40(1): 187-190. |
| [19] |
苏效双, 占今舜, 詹康, 等. 苜蓿黄酮对体外培养的奶牛乳腺上皮细胞增殖与抗氧化的影响[J]. 草业学报, 2015, 24(12): 139-145. DOI:10.11686/cyxb2015030 |
| [20] |
刘立新, 林叶, 张莉, 等. 脂多糖对奶牛乳腺上皮细胞毒性作用及乳蛋白合成的影响[J]. 东北农业大学学报, 2015, 46(6): 61-66. |
| [21] |
刘立新, 张羽男, 张磊, 等. 紫花苜蓿总黄酮对LPS诱导乳腺上皮细胞炎性因子的抑制作用[J]. 黑龙江医药科学, 2016, 39(4): 1-3. |
| [22] |
肖定福, 钟佳, 刘进辉, 等. 壳寡糖对脂多糖诱导猪空肠上皮细胞氧化损伤的作用[J]. 动物营养学报, 2016, 28(7): 2090-2095. |
| [23] |
NGUYEN D H, ZHAO B T, LE D D, et al. Phenolic constituents and their anti-inflammatory activity from Echinochloa utilis grains[J]. Natural Product Sciences, 2016, 22(2): 140-145. DOI:10.20307/nps.2016.22.2.140 |
| [24] |
LIU X C, ZHENG L, Li Q F, et al. Naringin protects against lipopolysaccharide-induced cardiac injury in mice[J]. Environmental Toxicology and Pharmacology, 2016, 48: 1-6. DOI:10.1016/j.etap.2016.09.005 |
| [25] |
刘翠翠, 赵龙, 石晓岚, 等. 茶多酚对脂多糖诱导的支气管上皮细胞损伤的保护作用及其机制[J]. 中国儿童保健杂志, 2017, 25(10): 1015-1018. DOI:10.11852/zgetbjzz2017-25-10-11 |
| [26] |
汪娟, 蒋维, 王毅. 降香中黄酮类化合物对脂多糖诱导的RAW264.7细胞抗炎作用研究[J]. 细胞与分子免疫学杂志, 2013, 29(7): 681-684. |
| [27] |
KANG B M, AN B K, JUNG W S, et al. Anti-inflammatory effect of tricin isolated from Alopecurus aequalis Sobol. on the LPS-induced inflammatory response in RAW 264.7 cells[J]. International Journal of Molecular Medicine, 2016, 38(5): 1614-1620. DOI:10.3892/ijmm.2016.2765 |
| [28] |
王秀梅, 姚菲菲, 孙立秋, 等. 麦冬对脂多糖作用下大鼠腹膜间皮细胞TNF-α和TGF-β1表达分泌的影响[J]. 中医药学报, 2012, 40(2): 17-20. |
| [29] |
王海波, 刘玉兰, 李权, 等. 脂多糖对仔猪下丘脑-垂体-肾上腺轴内应激基因和NOD信号通路关键基因表达的影响[J]. 中国畜牧杂志, 2015, 51(1): 20-24. |
| [30] |
涂治骁, 刘玉兰, 吴欢听, 等. 脂多糖刺激对仔猪肠道、肝脏和肌肉组织NODs信号通路关键基因及其负调控因子mRNA表达的影响[J]. 中国畜牧杂志, 2016, 52(11): 35-38, 54. DOI:10.3969/j.issn.0258-7033.2016.11.008 |
| [31] |
SHALINI V, BHASKAR S, KUMAR K S, et al. Molecular mechanisms of anti-inflammatory action of the flavonoid, tricin from Njavara rice (Oryza sativa L.)in human peripheral blood mononuclear cells:possible role in the inflammatory signaling[J]. International Immunopharmacology, 2012, 14(1): 32-38. DOI:10.1016/j.intimp.2012.06.005 |
| [32] |
SHALINI V, JAYALEKSHMY A, HELEN A. Mechanism of anti-inflammatory effect of tricin, a flavonoid isolated from Njavara rice bran in LPS induced hPBMCs and carrageenan induced rats[J]. Molecular Immunology, 2015, 66(2): 229-239. DOI:10.1016/j.molimm.2015.03.004 |
| [33] |
SHALINI V, PUSHPAN C K, SINDHU G, et al. Tricin, flavonoid from Njavara reduces inflammatory responses in hPBMCs by modulating the p38MAPK and PI3K/Akt pathways and prevents inflammation associated endothelial dysfunction in HUVECs[J]. Immunobiology, 2016, 221(2): 137-144. DOI:10.1016/j.imbio.2015.09.016 |
| [34] |
殷玉婷, 刘丽丽, 刘利艳. 苜蓿素对哮喘小鼠肺泡巨噬细胞TLR4/MyD88/NF-κB通路的抑制作用[J]. 中成药, 2017, 39(3): 450-454. |




