2. 福建省海洋渔业资源与生态环境重点实验室, 厦门 361021
2. Fujian Provincial Key Laboratory of Marine Fishery Resources and Eco-Environment, Xiamen 361021, China
花鲈(Lateolabrax japonicus),又称七星鲈,属硬骨鱼纲(Osteichsthyes),鲈形目(Perciformes),科(Servanidate),花鲈属(Lateolabrax),主要分布在朝鲜半岛、中国沿海及越南沿海。花鲈具有广温广盐性,肉质鲜美,因此养殖范围广泛。花鲈作为我国水产品中主要的养殖品种,其安全性受到广泛的关注。随着集约化养殖发展,抗生素等药物的滥用带来耐药性和药物残留等问题。许多科研人员致力于寻求替代抗生素的物质。益生元不被消化酶消化,但在肠道中发酵后能被肠道有益菌利用,产生的代谢产物和微量营养物质为机体提供能量和营养,并且能降低肠道pH,促进有益菌增殖和抑制有害菌繁殖。目前一些益生元,如果寡糖、甘露寡糖,作为生长促进剂代替抗生素的使用,已广泛应用于家禽饲粮中。低聚木糖(XOS)又称木寡糖,通过木聚糖酶水解木聚糖中β-1, 4糖苷键获得,主要是以木二糖、木三糖为主的低聚木糖混合物。低聚木糖能促进肠道中乳酸菌和双歧杆菌等有益菌的增殖[1-4]。有研究表明,低聚木糖促进双歧杆菌数量增加的幅度要大于其他寡糖[5]。另外,低聚木糖原料广泛来源于价格便宜且木聚糖含量较高的一些农副产物中,如玉米芯、蔗渣、棉籽壳等[6]。由于具有独特的性能,低聚木糖作为益生元改善动物的健康和生长性能备受人们关注。研究表明,低聚木糖对刺参、欧洲海鲈、草鱼、白鱼、奥尼罗非鱼等水产养殖动物具有促进生长、免疫和改善肠道菌群的作用[7-11]。因此,本研究是通过检测花鲈幼鱼的生长性能、血清生化和免疫指标及肠道菌群组成来探讨不同水平的低聚木糖对花鲈幼鱼机体的影响,从而为低聚木糖作为绿色添加剂在水产饲料中运用提供理论基础。
1 材料与方法 1.1 试验设计和基础饲料在满足花鲈幼鱼基本营养的前提下,以鱼粉(粗蛋白质含量74.35%,粗脂肪含量8.43%)、豆粕(粗蛋白质含量48.25%,粗脂肪含量1.06%)为主要蛋白质源,以鱼油、大豆油为主要脂肪源,用面粉配平以保持配方总量的平衡,配制基础饲料,基础饲料组成及营养水平见表 1。采用单因子试验设计,选用360尾规格一致[(19.37±0.20) g]的花鲈幼鱼,随机分为6组,每组3个重复,每个重复20尾鱼。各组分别饲喂在基础饲料中添加0(对照组)、200(D200组)、400(D400组)、600(D600组)、800 (D800组)和1 000 mg/kg低聚木糖(D1000组)的饲料。低聚木糖购自江苏康维生物有限公司。原料粉碎后60目筛后逐级混匀,并且用小型挤条机制成大小2.5 mm的配合饲料,放入55 ℃烘箱中烘干,自然冷却后保存于-20 ℃下备用。
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
养殖试验在集美大学海水试验场进行。花鲈幼鱼(购自福建省漳浦县锦兴育苗场)暂养于循环过滤桶(1 200 L)。暂养阶段投喂自制饲料,并逐级淡化至纯淡水养殖。纯淡水暂养2周后试验鱼准备就绪。
1.3 饲养管理暂养结束后选用360尾健康、规格一致的花鲈幼鱼随机分配到18个循环水系统玻璃鱼缸(80 cm×45 cm×45 cm)中进行试验,每缸20尾。养殖试验阶段每日定时投喂2次(08:00—08:30、18:00—18:30),及时收集残饵和清除粪便,每天换水2次,每次换水1/3。试验期45 d。试验期间不断充气增氧,溶氧含量≥7 mg/L、水温(28±1) ℃,pH 7.3~8.1。每天观察花鲈摄食情况、死亡情况等并及时记录下来。
1.4 样品采集与处理45 d养殖结束后,进行24 h饥饿处理。用丁香油水门汀对鱼进行麻醉后对各试验缸鱼进行整体称重和计数。每缸随机取5尾鱼测体重和体长,并用1 mL无菌注射器对其尾部取血,并置于1.5 mL离心管中,放在4 ℃下静置12 h,4 ℃、3 500 r/min条件下离心10 min收集上清液(即血清),这5尾鱼的血清混合并保存于-80 ℃下,用于血清生化和免疫指标检测。每缸再随机取10尾鱼,进行解剖,快速取肠(在生理盐水下剔除表面脂肪),其中5尾鱼肠道组织在液氮中速冻,运回实验室于-80 ℃冷藏,以备肠道消化酶的测定,另外5尾鱼肠道两端用细绳绑住,拿回实验室在无菌操作台上取出内容物用于肠道菌群组成的测定。
1.5 指标检测 1.5.1 生长性能指标及计算公式

|
式中:W0为初体重(g);Wt为末体重(g);d为养殖天数(d);N0为初始尾数;Nt为成活尾数;L为鱼体长度(cm)。
1.5.2 血清生化和免疫指标测定血清生化和免疫指标包括:甘油三酯(TG)、总胆固醇(TC)、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、丙二醛(MDA)、总蛋白(TP)、过氧化氢酶(CAT)、高密度脂蛋白胆固醇(HDL-C)、溶菌酶(LZM)。以上所测指标均由南京建成生物研究所提供试剂盒,按试剂盒说明书进行检测。主要使用的仪器有酶标仪(Biotek)、UV-1200型紫外分光光度计、组织破碎仪。
1.5.3 肠道菌群组成的测定称取肠道内容物0.5 g,按1 : 9(质量:体积)加入4.5 mL无菌生理盐水中,振荡离心制得浓度为10-1原液,取0.5 mL上清液加入到4.5 mL无菌生理盐水中进行10倍稀释,并依次进行稀释,稀释到10-5。每个稀释梯度设3个平行,每板涂100 μL菌液。厌氧菌要在无氧环境下进行以上操作,厌氧菌置于自制的厌氧箱(箱中放置三菱AnaeroPackTM-Anaero厌氧产气袋)中培养72 h。培养结束后,挑选菌落30~300的培养皿进行平板计数。计算方法采用每克肠道菌落形成单位的对数值即lg(CFU/g)。培养基均购于青岛高科园海博生物科技有限公司。
1.6 数据统计与分析试验数据采用SPSS 19.0软件进行单因素方差分析,若有差异显著,采用Duncan氏多重比较法检验,P < 0.05为显著性差异。试验结果用平均值±标准差(mean±SD)表示。
2 结果 2.1 低聚木糖对花鲈幼鱼生长性能的影响由表 2可知,与对照组相比,D200、D400、D600、D800和D1000组的WGR和SGR有先升高后降低的趋势,D200、D400、D600组的WGR和SGR均有所提高(P>0.05),D800(P>0.05)和D1000组(P < 0.05)的WGR和SGR均降低。各组间FCR、CF和SR无显著差异(P>0.05)。
|
|
表 2 细菌培养的培养基及培养条件 Table 2 Culture medium and culture condition for bacterial culture |
通过回归方程计算得到增重率(Y,%)与低聚木糖添加量(X,mg/kg)的关系:
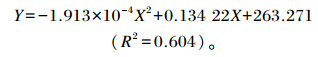
|
由上述公式计算得出,低聚木糖添加量为350.8 mg/kg时增重率最大。
2.2 低聚木糖对花鲈幼鱼血清生化指标的影响由表 3可知,与对照组相比,D200、D400、D600、D800和D1000组的血清TP含量均显著提高(P < 0.05);D200(P < 0.05)、D400组(P>0.05)的血清TC含量降低,但D600(P>0.05)、D800(P < 0.05)、D1000组(P>0.05)的血清TC含量均提高;D200(P>0.05)、D400组(P < 0.05)的血清TG含量降低,但D600(P>0.05)、D800(P < 0.05)、D1000组(P>0.05)的血清TG含量均提高;D200(P>0.05)、D400(P < 0.05)、D600(P>0.05)、D800(P < 0.05)和D1000组(P>0.05)的血清HDL-C含量均提高。
|
|
表 3 低聚木糖对花鲈幼鱼生长性能的影响 Table 3 Effects of xylooligosaccharide on growth performance of juvenile Japanese seabass (Lateolabrax japonicus) |
由表 4可知,与对照组相比,D200(P>0.05)、D400(P < 0.05)、D600(P < 0.05)、D800(P < 0.05)和D1000组(P < 0.05)的血清SOD活性均降低;D200(P < 0.05)、D400(P < 0.05)、D600(P>0.05)、D800(P>0.05)和D1000组(P>0.05)的血清CAT活性均降低;D200(P>0.05)、D400(P < 0.05)、D600(P>0.05)、D800(P < 0.05)和D1000组(P>0.05)的血清LZM活性均提高;D200组的血清MDA含量降低(P>0.05),D400(P < 0.05)、D600(P>0.05)、D800(P < 0.05)和D1000组(P < 0.05)的血清MDA含量均提高。各组间血清AKP活性无显著差异(P>0.05)。
|
|
表 4 低聚木糖对花鲈幼鱼血清生化指标的影响 Table 4 Effects of xylooligosaccharide on serum biochemical indices of juvenile Japanese seabass (Lateolabrax japonicus) |
通过回归方程计算得到血清LZM活性(Y,U/mL)与低聚木糖添加量(X,mg/kg)的关系:
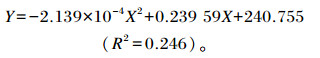
|
由上述公式计算得出,低聚木糖添加量为560 mg/kg时血清LZM活性最佳。
2.4 低聚木糖对花鲈幼鱼肠道菌群组成的影响由表 5可知,与对照组相比,D200、D400、D600、D800和D1000组的肠道中沙门氏菌数量显著降低(P < 0.05);D200(P < 0.05)、D400(P < 0.05)、D600(P>0.05)和D1000组(P < 0.05)的肠道中大肠杆菌数量均降低,D800组的肠道中大肠杆菌数量显著增加(P < 0.05);肠道中双歧杆菌数量随着低聚木糖添加量的增加呈先增加后降低的趋势,D200、D400和D600组的肠道中双歧杆菌数量显著增加(P < 0.05),D800、D1000组的肠道中双歧杆菌数量降低(P>0.05)。
|
|
表 5 低聚木糖对花鲈幼鱼血清免疫指标的影响 Table 5 Effects of xylooligosaccharide on serum immune indices of juvenile Japanese seabass (Lateolabrax japonicus) |
通过回归方程计算得肠道中双歧杆菌数量[(Y,lg(CFU/g)]与低聚木糖添加量(X,mg/kg)的关系:
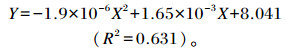
|
由上述公式计算得出,低聚木糖添加量为434.2 mg/kg时肠道中双歧杆菌数量最多。
3 讨论 3.1 低聚木糖对花鲈幼鱼生长性能及肠道菌群组成的影响低聚木糖作为益生元,已有研究表明其具有促生长的作用。本试验中,低聚木糖添加量为200~600 mg/kg时,花鲈幼鱼WGR有所提高,这与Li等[12]在大比目鱼和Xu等[13]在异育银鲫上的研究相近,而当添加量超过800 mg/kg时,对花鲈幼鱼WGR的影响呈现出了抑制作用,这与Li等[12]和Xu等[13]的研究结果存在偏差。对于这些结论的差异性,其可能的原因为:1)低聚木糖作为非营养性物质,过量添加起到抗营养因子的作用。并且饲料组成不同结果会有很大差异,Guerreiro等[9]报道,欧洲海鲈饲料中添加1%低聚木糖,以植物蛋白质源为主则促进生长,以鱼粉蛋白质源为主则抑制生长。2)寡糖类具有促进肠道有益菌的作用,本试验肠道中双歧杆菌数量就呈先增加后降低趋势,过量添加是否会降低肠道有益菌数量还有待做进一步研究。3)动物肠组织和菌群结构在各动物之间存在巨大差异,消化道长短、消化液性质及肠道内优势菌群也存在较大差异。到目前为止,低聚木糖对水产动物的报道很有限,尤其是对花鲈的促生长作用还有待进一步研究。
沙门氏菌和大肠杆菌是一种严重威胁人类及动物生命健康的病原菌,饲料生产过程中很容易感染大肠杆菌和沙门氏菌,鱼食用饲料以后其有害菌易定植在肠道中,有报道表明,银鲫感染沙门氏菌后导致肠充血、肝肥大而死[14]。双歧杆菌是众所周知的有益菌,对促进吸收和改善肠道环境有很重要的作用。低聚木糖作为一种功能性寡糖,在动物肠道内不能被消化吸收,但在肠道内发酵后,被有益菌吸收利用,促进双歧杆菌增殖的同时抑制有害菌的繁殖[15-16]。本试验结果表明,添加低聚木糖降低了肠道中沙门氏菌和大肠杆菌的数量,同时增加了双歧杆菌的数量,添加量为200、400 mg/kg时效果最好。人服用低聚木糖可增加肠道中双歧杆菌数量[17]。Petersen等[18]报道,果寡糖和低聚木糖有效增加小鼠肠道菌双歧杆菌的数量,并且抑制沙门氏菌生长。本试验结果与之相近,添加低聚木糖有效增加花鲈幼鱼肠道中双歧杆菌的数量,并且抑制沙门氏菌和大肠杆菌的生长。由表 3和表 6可知,低聚木糖添加量在200~600 mg/kg时对改善花鲈幼鱼肠道菌群效果最佳,此添加量相对应的WGR也最高。从本文的试验数据来看,花鲈幼鱼的生长性能与肠道菌群的改善存在正相关性。其原因可能是低聚木糖在肠道内发酵被有益菌利用产生短链脂肪酸和降低肠道pH[19],为肠黏膜细胞提供能量,促进细胞代谢、生长和防止肠功能紊乱[20],从而促进肠黏膜对营养物质的吸收和利用。低pH环境下有害菌生长受到抑制,却有助于双歧杆菌等有益菌增殖。同时,低pH有助于钙溶解和吸收。Zafar等[21]证实,寡糖可以增加钙的生物利用度和保持力。非消化性寡糖能提高一些矿物质的吸收和骨骼的形成,对骨代谢有一定的影响[22]。由此可知,添加适量的低聚木糖不仅可以促进生长性能,改善花鲈幼鱼肠道微生态环境,而且可以促进双歧杆菌的增殖,降低大肠杆菌和沙门氏菌的数量,可以大大提高肉质的安全系数,减少食用感染大肠杆菌和沙门氏菌水产品的机率。
|
|
表 6 低聚木糖对花鲈幼鱼肠道菌群组成的影响 Table 6 Effects of xylooligosaccharide on intestinal microflora composition of juvenile Japanese seabass (Lateolabrax japonicus) |
非特异性免疫在鱼类免疫防御方面发挥重要作用。SOD是生物体内氧自由基的天然去除剂。LZM的作用主要是破坏细菌细胞壁,其活性增强说明巨噬细胞、多型核白细胞的吞噬活性加强。MDA是油脂酸败的重要有害物质之一,间接反映了动物细胞损伤程度。庞丽姣等[23]报道,低聚木糖有效提高了草鱼血清SOD和LZM活性。低聚木糖降低了大菱鲆幼鱼血清SOD、CAT和AKP活性[24]。徐磊等[25]报道,甘露寡糖降低了异育银鲫血清MDA含量。欧洲海鲈摄食添加1%低聚木糖的饲料,结果肝脏中的SOD和CAT活性受到抑制[9]。低聚木糖提高了草鱼和鲤鱼免疫功能,尤其有效增强血清LZM活性[23, 26]。本试验结果与上述研究结果基本一致。本试验结果发现,血清MDA含量与SOD活性在一定程度上具有负相关性。血清MDA含量增加说明了衰老自由基含量的增加,从而导致血清SOD活性降低。D200组血清MDA含量低于对照组,说明低剂量低聚木糖可降低血清MDA含量,此观点还有待进一步论证。本试验中,添加低聚木糖有效提高了血清LZM活性,反映了免疫细胞吞噬细胞增强,因此,本试验中低聚木糖提高花鲈幼鱼的非特异性免疫力主要是通过增强血清LZM活性来提高的。
3.3 低聚木糖对花鲈幼鱼血清生化指标的影响鱼类血脂水平的变化反映鱼脂类代谢水平。HDL-C的主要作用是将血液中的胆固醇脂运输到肝脏中,其含量较高对机体的健康比较有利。血清TP来自肝脏合成和肠道的吸收。有研究表明,TP对动物的生长发育至关重要,并且其含量的高低能反映动物机体的免疫应激状态,处于应激状态下鱼类中的血清TP含量会下降[27-29]。添加低聚木糖降低了欧洲海鲈的血清中TG和TC含量[9],Gobinath等[30]研究表明,添加10%低聚木糖降低了大鼠胆固醇含量。低聚木糖还可有效降低肉鸡血清中TG含量[31]。Yang等[32]研究显示,壳寡糖能提高断奶仔猪血清TP含量。黄鑫玮等[33]报道,壳寡糖可有效提高幼建鲤血清HDL-C含量。本试验中,添加低聚木糖提高了血清TP和HDL-C含量,添加量低于600 mg/kg时降低了血清TG和TC含量,与上述研究相似,但随着添加量超过600 mg/kg,血清TG和TC含量高于对照组。这说明低剂量的低聚木糖可以降低血清中TG和TC含量。其原因可能是少量的低聚木糖可促进肠道有益菌的增殖,降低肠道pH,促使胆固醇排出体外,降低血液中胆固醇的含量,并且血清TP和HDL-C含量增加对降低血脂也具有促进作用。
4 结论① 添加200~600 mg/kg的低聚木糖可提高花鲈幼鱼生长性能,抑制血清中SOD、CAT活性,提高LZM活性。
② 添加200~400 mg/kg的低聚木糖能较好改善花鲈幼鱼血脂;降低花鲈幼鱼肠道中沙门氏菌和大肠杆菌数量,增加双歧杆菌数量。
③ 综合本试验中各指标结果及线性回归方程计算,建议花鲈幼鱼饲料中低聚木糖添加量为350~560 mg/kg。
| [1] |
WANG T H, LU S. Production of xylooligosaccharide from wheat bran by microwave assisted enzymatic hydrolysis[J]. Food Chemistry, 2013, 138(2/3): 1531-1535. |
| [2] |
JAIN I, KUMAR V, SATYANARAYANA T. Xylooligosaccharides:an economical prebiotic from agroresidues and their health benefits[J]. Indian Journal of Experimental Biology, 2015, 53(3): 131-142. |
| [3] |
YANG J P, SUMMANEN P, HENNING S M, et al. Xylooligosaccharide supplementation alters gut bacteria in both healthy and prediabetic adults:a pilot study[J]. Frontiers in Physiology, 2015, 6: 216. |
| [4] |
SAMANTA A K, JAYAPAL N, JAYARAM C, et al. Xylooligosaccharides as prebiotics from agricultural by-products:production and applications[J]. Bioactive Carbohydrates and Dietary Fibre, 2015, 5(1): 62-71. DOI:10.1016/j.bcdf.2014.12.003 |
| [5] |
RYCROFT C E, JONES M R, GIBSON G R, et al. A comparative in vitro evaluation of the fermentation properties of prebiotic oligosaccharides[J]. Journal of Applied Microbiology, 2001, 91(5): 878-887. DOI:10.1046/j.1365-2672.2001.01446.x |
| [6] |
杨瑞金, 许时婴, 王璋. 低聚木糖的功能性质与酶法生产[J]. 中国食品添加剂, 2000(2): 89-93. |
| [7] |
陈晓瑛, 曹俊明, 黄燕华, 等. 饲料中添加低聚木糖对凡纳滨对虾幼虾生长性能、非特异性免疫力、抗氧化功能及抗对虾白斑综合征病毒能力的影响[J]. 动物营养学报, 2014, 26(8): 2397-2407. |
| [8] |
李君华, 刘佳亮, 曹学彬, 等. 饲料中添加低聚木糖对仿刺参幼参生长性能、肠道消化酶活力和免疫力的影响[J]. 动物营养学报, 2016, 28(8): 2534-2541. |
| [9] |
GUERREIRO I, OLIVA-TELES A, ENES P. Improved glucose and lipid metabolism in European sea bass (Dicentrarchus labrax) fed short-chain fructooligosaccharides and xylooligosaccharides[J]. Aquaculture, 2015, 441: 57-63. DOI:10.1016/j.aquaculture.2015.02.015 |
| [10] |
HOSEINIFAR S H, SHARIFIAN M, VESAGHI M J, et al. The effects of dietary xylooligosaccharide on mucosal parameters, intestinal microbiota and morphology and growth performance of Caspian white fish (Rutilus frisii kutum) fry[J]. Fish & Shellfish Immunology, 2014, 39(2): 231-236. |
| [11] |
张荣斌, 曹俊明, 黄燕华, 等. 低聚木糖对奥尼罗非鱼肠道形态、菌群组成和抗嗜水气单胞菌感染的影响[J]. 上海海洋大学学报, 2012, 21(2): 233-240. |
| [12] |
LI Y, WANG Y J, WANG L, et al. Influence of several non-nutrient additives on nonspecific immunity and growth of juvenile turbot, Scophthalmus maximus L.[J]. Aquaculture Nutrition, 2008, 14(5): 387-395. DOI:10.1111/anu.2008.14.issue-5 |
| [13] |
XU B H, WANG Y B, LI J R, et al. Effect of prebiotic xylooligosaccharides on growth performances and digestive enzyme activities of allogynogenetic crucian carp (Carassius auratus gibelio)[J]. Fish Physiology and Biochemistry, 2009, 35(3): 351-357. DOI:10.1007/s10695-008-9248-8 |
| [14] |
王玉佩, 韩英俊, 李军, 等. 沙门氏菌对鱼类的致病作用及治疗试验观察[J]. 动物科学与动物医学, 2002, 19(7): 27-30. |
| [15] |
HSU C K, LIAO J W, CHUNG Y C, et al. Xylooligosaccharides and fructooligosaccharides affect the intestinal microbiota and precancerous colonic lesion development in rat[J]. The Journal of Nutrition, 2004, 134(6): 1523-1528. DOI:10.1093/jn/134.6.1523 |
| [16] |
OKAZAKI M, FUJIKAWA S, MATSUMOTO N. Effect of xylooligosaccharide on the growth of bifidobacteria[J]. Bifidobacteria and Microflora, 1990, 9(2): 77-86. DOI:10.12938/bifidus1982.9.2_77 |
| [17] |
FINEGOLD S M, LI Z P, SUMMANEN P H, et al. Xylooligosaccharide increases bifidobacteria but not lactobacilli in human gut microbiota[J]. Food & Function, 2014, 5(3): 436-445. |
| [18] |
PETERSEN A, BERGSTRÖM A, ANDERSEN J B, et al. Analysis of the intestinal microbiota of oligosaccharide fed mice exhibiting reduced resistance to Salmonella infection[J]. Beneficial Microbes, 2010, 1(3): 271-281. DOI:10.3920/BM2010.0016 |
| [19] |
张晓萍, 勇强, 余世袁. 青春双歧杆菌体外代谢低聚木糖的研究[J]. 南京林业大学学报(自然科学版), 2010, 34(1): 5-8. |
| [20] |
王子花, 申瑞玲, 李文全. 短链脂肪酸的产生及作用[J]. 畜牧兽医科技信息, 2007(2): 12-13. |
| [21] |
ZAFAR T A, WEAVER C M, ZHAO Y D, et al. Nondigestible oligosaccharides increase calcium absorption and suppress bone resorption in ovariectomized rats[J]. The Journal of Nutrition, 2004, 134(2): 399-402. DOI:10.1093/jn/134.2.399 |
| [22] |
黄纪明, 白树民, 朱德兵, 等. 低聚异麦芽糖对模拟失重大鼠肠道益生菌以及钙代谢和骨矿盐密度影响的初步研究[J]. 中国微生态学杂志, 2002, 14(4): 3-5. |
| [23] |
庞丽姣, 吴志新, 熊娟, 等. 低聚木糖对草鱼非特异性免疫功能的影响[J]. 动物营养学报, 2010, 22(6): 1687-1693. |
| [24] |
蔡胜昌, 张利民, 张德瑞, 等. 壳寡糖与低聚木糖对大菱鲆(Scophthalmus maximus)幼鱼生长、体组成和血液生化指标的影响[J]. 渔业科学进展, 2015, 36(6): 29-36. DOI:10.11758/yykxjz.20150605 |
| [25] |
徐磊, 刘波, 谢骏, 等. 甘露寡糖对异育银鲫生长性能、免疫及HSP70基因表达的影响[J]. 水生生物学报, 2012, 36(4): 656-664. |
| [26] |
王俊丽, 单金峰, 朱浩拥, 等. 饲料中添加低聚木糖对鲤鱼免疫力和生长性能的影响[J]. 水产科学, 2014, 30(10): 611-615. DOI:10.3969/j.issn.1003-1111.2014.10.003 |
| [27] |
WHITE W B, BIRD H R, SUNDE M L, et al. Viscosity of β-glucan as a factor in the enzymatic improvement of barley for chicks[J]. Poultry Science, 1983, 62(5): 853-862. DOI:10.3382/ps.0620853 |
| [28] |
畅雅萍, 徐奇友, 王常安, 等. 几种诱食剂对施氏鲟(Acipenser schrencki)生长性能、体成分和血液生化指标的影响[J]. 水产学杂志, 2009, 22(3): 23-27, 46. |
| [29] |
MAGNADÓTTIRA B, CRISPIN M, ROYLE L, et al. The carbohydrate moiety of serum IgM from Atlanticcod (Gadus morhua L.)[J]. Fish & Shellfish Immunology, 2002, 12(3): 209-227. |
| [30] |
GOBINATH D, MADHU A N, PRASHANT G, et al. Beneficial effect of xylo-oligosaccharides and fructo-oligosaccharides in streptozotocin-induced diabetic rats[J]. British Journal of Nutrition, 2010, 104(1): 40-47. DOI:10.1017/S0007114510000243 |
| [31] |
LI D D, DING X M, ZHANG K Y, et al. Effects of dietary xylooligosaccharides on the performance, egg quality, nutrient digestibility and plasma parameters of laying hens[J]. Animal Feed Science and Technology, 2017, 225: 20-26. DOI:10.1016/j.anifeedsci.2016.12.010 |
| [32] |
YANG H S, XIONG X, LI J Z, et al. Effects of chito-oligosaccharide on intestinal mucosal amino acid profiles and alkaline phosphatase activities, and serum biochemical variables in weaned piglets[J]. Livestock Science, 2016, 190: 141-146. DOI:10.1016/j.livsci.2016.06.008 |
| [33] |
黄鑫玮, 杨莎莎, 刘毅, 等. 壳寡糖对幼建鲤生长性能、脂肪代谢、非特异性免疫功能和肠道健康的影响[J]. 动物营养学报, 2015, 27(7): 2106-2114. |




