2. 国家海洋局第三海洋研究所, 厦门 361005;
3. 厦门海博金生物技术有限公司, 厦门 361000
2. Third Institute of Oceanography, State Oceanic Administration, Xiamen 361005, China;
3. Xiamen Hopegene Bioinformatics Technology Co., Ltd., Xiamen 361000, China
罗非鱼(Oreochromis mossambicus)为热带鱼,原产于非洲和中东,现已经在全世界100多个国家和地区广泛养殖。我国于20世纪50年代初从东南亚引进莫桑比克罗非鱼,现为我国加工出口的主要水产品之一,养殖总量约占全球总量的55%[1]。罗非鱼以其营养价值高、肉质鲜嫩、价廉物美而广受欢迎。随着物质生活水平的不断提高,人们对包括罗非鱼在内水产品的脂肪酸含量及风味也提出了更高的要求。人们期望罗非鱼等水产品能有更丰富的不饱和脂肪酸(polyunsaturated fatty acids,PUFA)种类和含量,因为这些不饱和脂肪酸,尤其是n-3 PUFA,具有调节机体免疫、改善心血管系统健康、抗炎、抗过敏等重要生理功能[2-3]。
此外,一些水产品会产生令人生厌的腥臭味,影响消费者的食用感受。鱼类中的腥味物质组成比较复杂,主要由低分子质量的醛、酮、醇物质和含硫化合物等挥发性物质组成。鱼腥味的形成有多方面的原因,一方面,在鱼类产品养殖、贮藏等过程中,外界会有一些具有挥发性的有机物质在某种物理机械作用下吸附到鱼类表面,从而使自身的臭腥味变得更大;另一方面,在不适宜的外部条件下,容易产生以鱼体为基质的微生物繁殖、酶促等反应,鱼体内的脂肪酸等前体物质因此被降解,产生腥臭类物质[4]。
龙须菜(Gracilaria lemaneiformis)是红藻的一种,含有丰富的多糖、蛋白质、纤维素和矿物质等成分,是食物、饲料、药物的重要来源。龙须菜琼胶降解之后产生2~10个分子单糖的低聚糖,包括琼寡糖和新琼寡糖;琼寡糖以3,6-内醚-α-L-半乳糖残基为还原性末端,主要为琼三糖;新琼寡糖以β-D-半乳糖残基为还原性末端,主要为新琼二糖、新琼四糖、新琼六糖和新琼八糖[5-6]。已有研究表明海藻寡糖具有抗氧化、抗肿瘤、免疫调节、抗菌消炎等生理活性,极具开发潜力[5]。然而,目前未见龙须菜寡糖对罗非鱼生理特性影响的报道。因此,本试验利用生物降解方法制备龙须菜寡糖,随后运用气相色谱-质谱联用(GC-MS)、顶空固相微萃取-气相色谱-质谱联用技术(HS-SPME-GC-MS)等技术研究龙须菜寡糖对罗非鱼脂肪酸及挥发性腥味物质组成的影响,以期推进龙须菜寡糖在鱼饲料方面的应用。
1 材料与方法 1.1 试验材料与仪器罗非鱼鱼苗购于厦门农家发养殖科技有限公司;基础饲料购于厦门福星生物饲料有限公司;龙须菜购于福建莆田海水养殖场;色谱级甲醇、脂肪酸甲酯混标购于美国Sigma公司;寡糖标准品购于青岛博智汇力生物有限公司;其他试剂均为分析纯。
气相质谱联用仪(GCMS-QP2010 plus),日本岛津公司;SPME萃取头(65 μm PDMS/DVB),美国Supelco公司;电子天平(PL4002),梅特勒-托利多仪器上海有限公司;电热恒温水槽(XMTD-8222),上海精宏实验设备有限公司;高速匀浆机(T10),德国IKA集团广州仪器设备有限公司;离子色谱仪(DIONEX),美国Thermo-Fisher公司。
1.2 龙须菜寡糖的制备与鉴定将龙须菜经完全干燥后碾磨成粉,溶于海水[3%(质量体积分数)龙须菜粉末],配制成龙须菜降解培养基。将处于对数生长期(OD600 nm=0.6~0.8)的细菌Flammeovirga pacifica WPAGA1以1 : 50(体积比)的稀释比例接种于龙须菜降解培养基中,37 ℃、200 r/min条件下连续培养42 h[7-8]。培养结束后,4 ℃、12 000×g离心20 min,取上清液用3 ku的滤膜过滤去除水溶性蛋白质和多糖,再与3倍体积的无水乙醇混合,4 ℃过夜静置8 h后,于4 ℃、12 000×g条件下离心10 min。将上清液在旋转蒸发仪上除去乙醇后冷冻干燥获得龙须菜寡糖粉末[9]。
采用离子色谱法鉴定龙须菜寡糖的主要组分:将龙须菜寡糖样品溶于双蒸水,上样离子色谱柱(250 mm×4 mm IonPac)进行分离。色谱柱流动相(100 mmol/L NaOH、150 mmol/L NaAc)以0.25 mL/min的流速冲洗50 min。利用电导率检测洗脱组分的含量,并与寡糖标准品比较确定龙须菜寡糖的主要组分。
1.3 动物试验含龙须菜寡糖饲料制备:所用基础饲料为淡水鱼配合颗粒饲料,将基础饲料充分粉碎过80目筛,按照1%(质量分数)比例添加龙须菜寡糖粉末到基础饲料中,充分搅拌均匀,加适量水在搅拌机中搅拌均匀,制成条状,制粒机制成颗粒饲料,40 ℃烘干,自然冷却后放入密封袋中。
对照饲料:基础饲料充分粉碎过80目筛,不添加任何物质,按照含龙须菜寡糖饲料制备过程的相同条件重新制成大小一致的颗粒。
养殖管理:养殖池为1 m×1 m的水泥养殖池,使用之前经生石灰、高锰酸钾浸泡消毒,清水清洗。将罗非鱼鱼苗经基础饲料喂养3个月后,挑选初始体重为(12.20±0.23) g的大小均匀、健康活跃的罗非鱼随机分为2组(每组3个重复,每个重复20尾),养殖期间水深80~100 cm,温度(29±2) ℃,pH 7.5±0.1,充气泵充氧,自然光照。2组试验鱼分别投喂对照饲料(对照组)和含龙须菜寡糖饲料(龙须菜寡糖组),日投喂量为鱼体重的4%,于每日09:00和17:00时各投喂1次,投喂1 h后清理残余饲料及粪便等,每3 d更换1/3体积的养殖水,每1周更换全部的养殖水,以保持期间养殖水体清澈、水质良好。连续养殖7个月。
1.4 脂肪酸组成的检测总脂提取及其甲酯化[10]:养殖试验结束后,每组各取6尾罗非鱼,在冰上进行解剖获取新鲜的罗非鱼腹部鱼肉样品各8 g,磷酸盐缓冲液(PBS)洗净,剪碎后加入300 mL氯仿-甲醇(2 : 1,体积比)混合液,匀浆破碎,然后冰上超声2次,每次30 min,浸提24 h。过滤后,分液漏斗中静置分层,收集氯仿层,真空离心浓缩得到总脂肪酸样品。称取10 mg脂肪酸样品溶于1 mL 10%浓硫酸-甲醇溶液中,60 ℃水浴条件下甲酯化15 min,冷却后加入1 mL正己烷混合振荡,静置分层后吸取上层溶液进行GC-MS分析。
GC-MS条件[11]:DB-Wax毛细管柱(60 m×0.25 mm,0.25 μm),载气氦气,流速1.0 mL/min,恒压40 kPa。进样口温度和检测器温度为250 ℃。起始柱温50 ℃保持1 min,以20 ℃/min升至180 ℃,再以3 ℃/min升至230 ℃,保持15 min。GC/MS接口温度和离子源温度分别设为250和230 ℃,电子电离(EI)离子源电离能量设为70 eV,质量扫描范围质荷比(m/z)值为50~500 u,扫描频率为2次/s。
1.5 挥发性腥味物质组成的检测采用HS-SPME-GC-MS技术检测投喂不同饲料后罗非鱼鱼肉中挥发性腥味物质的种类及其含量[12-13]。
样品处理及固相萃取:取剪碎洗净的罗非鱼腹部鱼肉2 g,加入8 mL 0.1 g/mL的NaCl溶液,用匀浆机匀浆破碎后转移到15 mL顶空瓶中,穿过瓶口顶端的橡胶密封塞插入固相微萃取针头,50 ℃水浴条件下顶空萃取30 min。萃取结束后,立即将萃取针头插入气相色谱进样口中,250 ℃解析10 min上样。
GC-MS条件:DB-5MS毛细管柱(30 m×0.25 mm,0.25 μm),载气氦气,流速1.0 mL/min,不分流模式进样。进样口温度为250 ℃,柱初温40 ℃,保持3 min,以8 ℃/min升温至250 ℃,保持10 min。GC/MS接口温度和离子源温度分别设为270和230 ℃,EI离子源电离能量设为70 eV,质谱扫描范围m/z值为35~350 u,扫描频率为2次/s。
1.6 数据统计分析GC-MS获得的质谱数据采用岛津质谱分析软件附带的NIST05质谱数据库和Willey谱库做自动检索,只列举所得结果与谱库中化合物相似度大于80%的组分。基于样品峰面积,利用面积归一化确定各组分的相对含量[14]。
使用Excel 2007软件进行数据整理,采用SPSS 22.0软件进行数据的统计分析。利用SPSS中的独立样本t检验[15](independent-sample t-test)对不同处理的组分含量进行显著性检验。
2 结果 2.1 龙须菜寡糖的制备与鉴定根据龙须菜发酵制备的寡糖样品与寡糖标准品的离子色谱峰匹配情况(图 1-A),可知通过微生物发酵制备的龙须菜寡糖主要成分为新琼寡糖(新琼二糖、新琼四糖、新琼六糖)和琼寡糖(琼三糖)(图 1-B)。
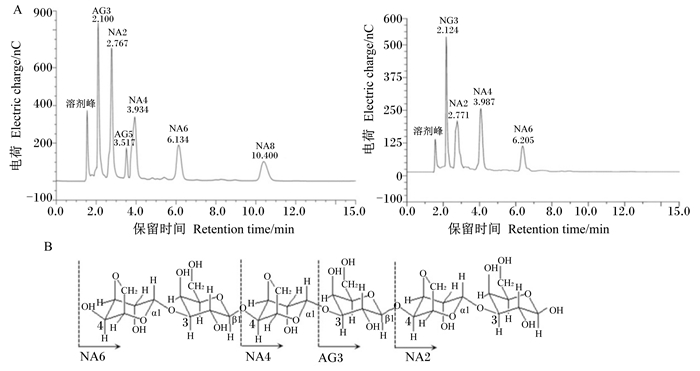
|
图 1 龙须菜寡糖的鉴定 Figure 1 Identification of Gracilaria lemaneiformis oligosaccharides |
在基础饲料的基础上,添加1%的龙须菜寡糖,制备成含龙须菜寡糖饲料,投喂罗非鱼长达7个月。试验结束后,利用GC-MS技术分别检测对照组和寡糖组罗非鱼腹肉中脂肪酸的种类及含量,详见表 1。
|
|
表 1 龙须菜寡糖对罗非鱼脂肪酸组成的影响 Table 1 Effects of Gracilaria lemaneiformis oligosaccharides on fatty acid composition of tilapia (n=3) |
从脂肪酸种类上来看,2组罗非鱼腹肉中共鉴定出28种脂肪酸,分布范围为C12~C24,主要以饱和脂肪酸(saturated fatty acids, SFA)为主,其次为PUFA和单不饱和脂肪酸(monounsaturated fatty acids, MUFA)(表 1)。与对照组相比(12种),寡糖组(6种)能有效地降低检测到的SFA种类,减少的SFA种类为C12 : 0、C13 : 0、C21 : 0、C22 : 0、C23 : 0和C24 : 0。2组之间不饱和脂肪酸的种类没有差异。
从脂肪酸含量上来看,2组罗非鱼腹肉中的SFA的相对含量最高,其次为PUFA和MUFA。2组罗非鱼腹肉中SFA均以C16 : 0为主,C18 : 0次之。龙须菜寡糖组罗非鱼腹肉中C14 : 0的相对含量较对照组显著降低(P<0.05),但总体而言,饲料中添加龙须菜寡糖对罗非鱼腹肉中绝大部分SFA的相对含量影响不显著(P>0.05)。
另外,从表 1中可以看出,饲料中添加龙须菜寡糖能够显著提高罗非鱼腹肉中多种PUFA的相对含量(P<0.05),包括n-3 PUFA中的C20 : 5n-3(EPA)、C22 : 6n-3(DHA)和n-6 PUFA中的C20 : 4n-6(ARA)。饲料中添加龙须菜寡糖能显著提高罗非鱼腹肉中DHA/EPA值(P<0.05),同时C18 : 2n-6的相对含量显著降低(P<0.05)。
2.3 龙须菜寡糖对罗非鱼挥发性腥味物质组成的影响本试验利用HS-SPME-GC-MS技术分别检测对照组和寡糖组罗非鱼腹肉中挥发性腥味物质的种类及含量,详见表 2。
|
|
表 2 龙须菜寡糖对罗非鱼挥发性腥味物质组成的影响 Table 2 Effects of Gracilaria lemaneiformis oligosaccharides on volatile odor substance composition of tilapia (n=3) |
对照组罗非鱼腹肉中共检测到挥发性腥味物质31种,龙须菜寡糖组罗非鱼腹肉中共检测到挥发性腥味物质25种。检测出的挥发性腥味物质主要成分为烷烃类、酸类和酮类化合物,这3类化合物总数占测得化合物总数的64.5%。总体来看,龙须菜寡糖组的绝大多数挥发性腥味物质相对含量较对照组显著降低(P<0.05)。
对照组中检出的烃类化合物包含10种烷烃和1种烯烃,龙须菜寡糖组检测出8种烷烃和1种烯烃。2组中相对含量最高的烷烃均为1-氯十二烷,对照组中相对含量较高的其余3种烷烃分别为十二烷、2, 6, 10, 15-四甲基十七烷和二十四烷,这3种主要烷烃类化合物的相对含量在龙须菜寡糖组中均显著降低(P<0.05)。
对照组检出的酸类化合物有6种,龙须菜寡糖组检出的酸类化合物有5种,均以苯甲酸的相对含量最高。龙须菜寡糖组中苯甲酸相对含量较对照组有所降低,但差异不显著(P>0.05)。对照组中共检出酮类化合物4种,龙须菜寡糖组中共检出酮类化合物3种。在对照组中,相对含量最高的酮类化合物为5-异丙基-2, 4-咪唑烷二酮,而该化合物在龙须菜寡糖组中未检测到。其他2种酮类物质2, 2, 3-三甲基-1-苯基-3-丁烯基-1-酮和4, 4, 5, 6-四甲基-1, 3-四氢恶嗪-2-硫酮在龙须菜寡糖组中的相对含量较对照组显著降低(P<0.05)。
其他挥发性腥味物质还有为醛类、胺类、酚类以及酯类。2组罗非鱼腹肉中均检测到了2种醛类化合物,分别为戊醛和十七醛。从表 2可以看出,龙须菜寡糖组罗非鱼腹肉中含有的酚类2, 4-二叔丁基苯酚、2, 6-二叔丁基-4-丙酰基苯酚等物质以及醛类物质的相对含量显著低于对照组(P<0.05)。同时,对照组中测得胺类化合物N, N-二甲基癸胺(9.35%),龙须菜寡糖组中未测出该胺类化合物。
3 讨论 3.1 龙须菜寡糖的制备与鉴定目前通用的海藻寡糖制备方法主要为酸解法[16]和生物降解法[17-18]。相比于酸解法,生物降解法具有多种优势,如成本低、环境友好、过程简单、效率高等。此外,生物降解法获得的寡糖种类丰富,具有良好的应用前景。在本研究中,我们采用1株从深海分离获得的琼胶降解细菌Flammeovirga pacifica WPAGA1[7, 19]对龙须菜进行生物降解,以获得用于投喂罗非鱼的龙须菜寡糖样品。
在探索龙须菜寡糖的生物学功能之前,我们首先采用离子色谱法分析鉴定龙须菜寡糖的组成情况,Flammeovirga pacifica WPAGA1菌株能够降解龙须菜生成新琼寡糖和琼寡糖。根据文献报道,琼胶寡糖和新琼寡糖分别是由α-琼胶酶或β-琼胶酶切割琼胶分子的α-1, 3糖苷键或β-1, 4糖苷键后产生[18-19]。目前已有大量文献报道寡糖具有抗肿瘤、抗炎、抗氧化等多种生物活性[20-21],而其添加于鱼饲料中对鱼肉品质、风味等方面影响的研究却未见报道。本试验首次将龙须菜寡糖添加于饲料饲喂罗非鱼,对罗非鱼腹肉中脂肪酸、挥发性腥味物质组成方面的影响进行了分析研究,为寡糖饲料的开发提供新的思路。
3.2 龙须菜寡糖对罗非鱼脂肪酸组成的影响C14 : 0和C18 : 0都是罗非鱼体内的常见饱和脂肪酸。本试验中,2组罗非鱼腹肉中SFA均以C16 : 0为主,这与在其他淡水鱼类中的研究结果[19, 22]是一致的。2组罗非鱼腹肉中都含有较丰富的C16 : 0和C18 : 0,说明这2种脂肪酸是罗非鱼许多组织中主要的能源来源[23]。有研究指出,C14 : 0与肝脏合成胆固醇呈正相关[24],因此其含量的增加可能会导致罗非鱼胆固醇含量的升高,而投喂含龙须菜寡糖饲料的罗非鱼腹肉中C14 : 0相对含量较对照组显著降低,表明龙须菜寡糖有助于降低罗非鱼的胆固醇含量。
由于PUFA、MUFA具有不饱和或多不饱和键,容易受到自由基的攻击,从而影响细胞膜的结构和流动性以及细胞和组织的生理状态[25]。高超[6]发现,琼胶寡糖体外清除二苯基苦基苯肼自由基(DPPH·)的半数抑制量(IC50)值为0.89 mg/mL;而且,低浓度琼胶寡糖可以抑制百草枯产生的超氧阴离子自由基(O2-·),并可提高果蝇对百草枯的耐受能力,尤其是雌性果蝇。陈海敏等[26]发现,聚合度为2、4、6、8、10的琼胶寡糖对体外清除O2-·、羟自由基(·OH)和DPPH·都具有明显效果。刘燕[27]发现,龙须菜寡糖能显著提高黑鲷肝脏谷胱甘肽过氧化物酶、超氧化物歧化酶、碱性磷酸酶、过氧化氢酶活性及总抗氧化能力,这些酶在鱼体的生长过程中发挥着重要的免疫、抗氧化防护作用。而周继术等[28]认为高不饱和脂肪酸(HUFA)可能通过降低脂质的合成或者抑制脂质向肝胰脏的转运而减少鲤肝胰脏脂肪含量。由此得出,寡糖可以通过直接参与清除O2-·、·OH和DPPH·,或者通过提高抗氧化酶的活性等途径发挥其抗氧化功能[6],从而起到保护鱼体内PUFA、MUFA等的稳定存在,调控肝脏脂肪酸的合成,对鱼体脂肪酸组成产生影响。
ARA是水产动物特别是罗非鱼体内重要的不饱和脂肪酸之一,它是水产动物卵巢、精子及卵母细胞中重要的组成成分,能够对水产动物受精率、卵黄囊的体积及孵化率等产生显著的影响[29]。Tian等[30]发现ARA能够显著降低脂肪组织和肝胰脏过氧化物酶体增殖物激活受体γ(PPARγ)、脂肪酸合成酶(FAS)等脂肪合成相关关键基因的表达,在转录水平上影响草鱼的脂质代谢。DHA和EPA对鱼类生长、存活和正常的生理功能都起到重要的作用,两者的比值不同同样会对鱼类生长、存活和正常的生理功能、免疫功能产生影响[31]。Wu等[32]研究表明,与低DHA/EPA值(0.3~0.7)相比,高DHA/EPA值(2.0~3.0)提高了石斑鱼头肾白细胞吞噬和呼吸爆发活力。Belayev等[33]和Rossmeisl等[34]均发现DHA衍生物具有抗炎和降脂的作用,如其降解产物10,7s-docosatrienes多核白细胞浸润和促炎基因表达的强抑制剂同时起到神经保护作用[35]。本试验中,饲料中添加龙须菜寡糖能显著提高罗非鱼腹肉中ARA的相对含量和DHA/EPA值。可知,龙须菜寡糖可能通过影响这些PUFA含量的增加或降低,来对鱼体免疫力以及特定组织功能的发挥产生很大影响。
PUFA对人体具有降血脂、抑制血小板聚集、降血压、抗肿瘤和免疫调节作用,能显著降低心血管疾病的发病率[36],并且对维持大脑正常的结构和功能起着重要作用[37]。大脑的DHA含量可直接影响细胞膜的特性、突触的生成和可塑性,直接影响大脑学习记忆的功能[38]。而MUFA能调节血脂代谢,降低低密度脂蛋白胆固醇的氧化敏感性,保护血管内皮和降低血凝状态[39]。罗非鱼是我国重要的淡水养殖种类和优势出口水产品种,是人们获取蛋白质、不饱和脂肪酸等营养物质的重要来源之一[40]。本试验中,饲料中添加龙须菜寡糖能显著提高罗非鱼腹肉中ARA、DHA、EPA的相对含量,可见龙须菜寡糖能够提高罗非鱼的营养成分含量。
3.3 龙须菜寡糖对罗非鱼挥发性腥味物质组成的影响蔡原等[41]对虹鳟体内挥发性物质的研究表明,虹鳟背肉挥发性成分较少,腹肉中较多,因此本研究中用于分析的2组罗非鱼肉均取自罗非鱼腹肉。通过本试验可知,罗非鱼腹肉中挥发性腥味物质中主要为烷烃类、醛类和酮类,其中对照组分别含有49.39%、1.77%、7.62%;寡糖组分别含有52.0%、0.95%、2.73%。因此,罗非鱼的腥味可能主要由挥发性的烷烃类和醛、酮类物质产生[42]。
烷烃类物质主要由脂肪酸烷氧自由基均裂产生,感觉阈值较高,气味相对较温和,一般认为对鱼肉的风味贡献不大[43]。2组罗非鱼腹肉中相对含量最高的烷烃均为1-氯十二烷,氯代烷烃曾被报道存在于鱼油的挥发性提取物中,其气味被形容为青草味[44]。相关研究表明卤代烷烃可能是兔肉特殊气味的重要组成成分[45]。而卤代烷烃是否是罗非鱼特殊气味的重要组成成分以及在腥味中所起的作用有待进一步研究。
醛、酮等二级脂肪氧化产物的形成,都是鱼肉中特殊气味的主要成因,尤其是鱼腥味[46]。酮类化合物是鱼肉风味物质重要的组成部分,一般呈现脂肪味和焦燃味[47],很多烯酮可以与醛类物质等相互作用,使鱼腥味增强[48]。低级醛类常常呈现出鱼腥味、土霉味等不同的刺激性气味特征,如戊醛就具有强烈的刺激性气味[49-50],这类物质一般嗅觉阈值较低,即使在非常低的浓度下,也很容易被人们感知,因此对鱼肉风味影响很大[51]。在本试验中,酮类物质5-异丙基-2, 4-咪唑烷二酮、2, 2, 3-三甲基-1-苯基-3-丁烯基-1-酮、4, 4, 5, 6-四甲基-1, 3-四氢恶嗪-2-硫酮这3类物质在龙须菜寡糖组中的相对含量较对照组显著减少,其中5-异丙基-2, 4-咪唑烷二酮未被检出,而2, 2, 3-三甲基-1-苯基-3-丁烯基-1-酮、4, 4, 5, 6-四甲基-1, 3-四氢恶嗪-2-硫酮的相对含量分别是对照组中的46.4%、42.9%;而醛类物质中,表 2可见龙须菜寡糖组罗非鱼腹肉中戊醛、十七醛的相对含量均显著少于对照组。可见,龙须菜寡糖能够有效降低罗非鱼腹肉中酮类物质的种类和含量,醛类物质的含量。很多学者认为鱼肉中脂质氧化生成的过氧化不稳定中间产物进一步降解成醛、酮等小分子质量的次级产物是造成鱼类腥味加重的重要因素[52-53]。而目前大量研究表明龙须菜寡糖成分具有清除过氧化物自由基的功效,维持体内自由基产生和清除的动态平衡[54-55]。因此,我们认为龙须菜寡糖可能通过直接参与清除自由基或氧化物,或提高抗氧化酶活性等抗氧化作用达到分解过氧化物,阻断过氧化链,消除自由基和活性氧以免引发脂质过氧化的目的,从而减少醛、酮类脂肪酸氧化产物的形成。
鱼类死后散发出腐败酸臭味,主要是因为鱼体内的含氮物质被分解,生成一些胺类物质,如氨、三甲胺、组胺等[56]。在对照组罗非鱼腹肉中测得1个胺类化合物N, N-二甲基癸胺,其相对含量高达9.35%,而在龙须菜寡糖组罗非鱼腹肉中未测得该胺类化合物。大多数胺类化合物阈值都较低且带有鱼腥味,且易使鱼肉散发出具有腐败特征的恶臭味[57],因此胺类化合物相对含量的降低可以改善罗非鱼肉的总体风味。
4 结论综上,采用深海降解细菌Flammeovirga pacifica WPAGA1降解龙须菜产生的龙须菜寡糖所制备的含龙须菜寡糖饲料能有效减少罗非鱼腹肉中SFA的种类,提高PUFA中ARA、DHA、EPA的含量及DHA/EPA值;此外,还能够有效减少罗非鱼腹肉中挥发性腥味物质的种类,并降低气味较大、感觉阈值较低,如酮类、胺类和醛类等挥发性腥味物质的相对含量。
| [1] |
包特力根白乙. 中国罗非鱼养殖产业发展及市场前景[J]. 安徽农业科学, 2014, 42(33): 11956-11958. DOI:10.3969/j.issn.0517-6611.2014.33.121 |
| [2] |
FUKUI M, KANG K S, OKADA K, et al. EPA, an omega-3 fatty acid, induces apoptosis in human pancreatic cancer cells:role of ROS accumulation, caspase-8 activation, and autophagy induction[J]. Journal of Cellular Biochemistry, 2013, 114(1): 192-203. DOI:10.1002/jcb.v114.1 |
| [3] |
王新颖, 黎介寿. ω-3多不饱和脂肪酸影响炎症和免疫功能的基础研究[J]. 肠外与肠内营养, 2007, 14(1): 54-58. |
| [4] |
王国超. 罗非鱼腥味物质成分检测及脱除方法的研究[D]. 硕士学位论文. 青岛: 中国海洋大学, 2012.
|
| [5] |
刘美英, 梅建凤, 易喻, 等. 琼胶寡糖生物活性的研究进展[J]. 药物生物技术, 2008, 15(6): 493-496. |
| [6] |
高超. 龙须菜降解产物的活性研究及降解菌Flammeovirga pacifica中硫酸酯酶基因的克隆表达[D]. 硕士学位论文. 厦门: 国家海洋局第三海洋研究所, 2013.
|
| [7] |
XU H, FU Y Y, YANG N, et al. Flammeovirga pacifica sp.nov.isolated from deep-sea sediment[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(4): 937-941. |
| [8] |
刘胜龙. 深海菌株Flammeovirga pacifica酶解龙须菜产糖的条件优化及相关基因的克隆表达[D]. 硕士学位论文. 厦门: 集美大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10390-1014358857.htm
|
| [9] |
刘海凤. 龙须菜海藻寡糖纯化及其对昆明鼠酒精肝损伤保护作用的研究[D]. 硕士学位论文. 厦门: 厦门大学, 2016.
|
| [10] |
樊燕, 孙晨阳, 王博, 等. GC/MS分析俄罗斯鲟鱼不同部位脂肪酸组成[J]. 现代食品科技, 2015, 31(1): 231-235. |
| [11] |
楼乔明, 王玉明, 杨文鸽, 等. 南极磷虾粉脂质及脂肪酸组成分析[J]. 水产学报, 2012, 36(8): 1256-1262. |
| [12] |
江健, 王锡昌, 陈西瑶. 顶空固相微萃取与GC-MS联用法分析淡水鱼肉气味成分[J]. 现代食品科技, 2006, 22(2): 219-222. |
| [13] |
陈俊卿, 王锡昌. 固相微萃取与气质联用法分析鱼肉中气味成分[J]. 现代食品科技, 2004, 20(3): 117-118. |
| [14] |
DOMÍNGUEZ R, GÓMEZ M, FONSECA S, et al. Effect of different cooking methods on lipid oxidation and formation of volatile compounds in foal meat[J]. Meat Science, 2014, 97(2): 223-230. DOI:10.1016/j.meatsci.2014.01.023 |
| [15] |
査如琴. 基于SPSS的双总体(σ12σ22未知, n ≤ 30)配对样本t检验与独立样本t检验[J]. 读与写:教育教学刊, 2016(7): 44-45. |
| [16] |
CHEN H M, YAN X J, PENG Z, et al. Antioxidant activity and hepatoprotective potential of agaro-oligosaccharides in vitro and in vivo[J]. Nutrition Journal, 2006, 5(1): 31. DOI:10.1186/1475-2891-5-31 |
| [17] |
CHEN X L, HOU Y P, JIN M, et al. Expression and characterization of a novel thermostable and pH-stable β-agarase from deep-sea bacterium Flammeovirga sp. OC4[J]. Journal of Agricultural and Food Chemistry, 2016, 64(38): 7251-7258. DOI:10.1021/acs.jafc.6b02998 |
| [18] |
HOU Y P, CHEN X L, CHAN Z H, et al. Expression and characterization of a thermostable and pH-stable β-agarase encoded by a new gene from Flammeovirga pacifica WPAGA1[J]. Process Biochemistry, 2015, 50(7): 1068-1075. DOI:10.1016/j.procbio.2015.04.005 |
| [19] |
GAO B L, JIN M, LI L, et al. Genome sequencing reveals the complex polysaccharide-degrading ability of novel deep-sea bacterium Flammeovirga pacifica WPAGA1[J]. Frontiers in Microbiology, 2017, 8: 600. |
| [20] |
王淑茹, 王丁刚. 茶叶多糖的抗凝血及抗血栓作用[J]. 中草药, 1992, 23(5): 254-256. |
| [21] |
付学鹏, 杨晓杰. 蒲公英多糖的提取及含量测定[J]. 现代食品科技, 2007, 23(5): 37-39. |
| [22] |
麻艳群, 黄凯, 陈涛, 等. 饲料磷脂水平对巴丁鱼体组织脂肪酸组成的影响[J]. 水产科学, 2015(8): 476-484. |
| [23] |
FRANKS J S, WARREN J R, BUCHANAN M V. Age and growth of cobia, Rachycentron canadum, from the northeastern Gulf of Mexico[J]. Fishery Bulletin, 1999, 97(3): 459-471. |
| [24] |
陈洁文. 高血压患者血清磷脂脂肪酸谱与血脂的相关性研究[D]. 硕士学位论文. 杭州: 浙江大学, 2006.
|
| [25] |
吉红, 田晶晶. 高不饱和脂肪酸(HUFAs)在淡水鱼类中的营养作用研究进展[J]. 水产学报, 2014, 38(9): 1650-1665. |
| [26] |
陈海敏, 严小军, 王峰, 等. 琼胶寡糖抑制血管形成作用的研究[J]. 营养学报, 2007, 29(4): 405-407, 410. |
| [27] |
刘燕. 龙须菜的发酵及发酵龙须菜对黑鲷生长、免疫和抗氧化能力的影响[D]. 硕士学位论文. 广州: 华南农业大学, 2016.
|
| [28] |
周继术, 吉红, 王建华, 等. 鱼油对鲤生长及脂质代谢的影响[J]. 中国海洋大学学报:自然科学版, 2008, 38(2): 275-280. |
| [29] |
韩涛, 王骥腾, 王勇, 等. 饲料中不同水平鱼蛋白水解物对军曹鱼稚鱼生长及体组成的影响[J]. 水生生物学报, 2010, 34(1): 94-100. |
| [30] |
TIAN J J, JI H, OKU H, et al. Effects of dietary arachidonic acid (ARA) on lipid metabolism and health status of juvenile grass carp, Ctenopharyngodon idellus[J]. Aquaculture, 2014, 430: 57-65. DOI:10.1016/j.aquaculture.2014.03.020 |
| [31] |
谭肖英. 黄颡鱼脂类营养生理研究[D]. 博士学位论文. 武汉: 华中农业大学, 2012.
|
| [32] |
WU F C, TING Y Y, CHEN H Y. Docosahexaenoic acid is superior to eicosapentaenoic acid as the essential fatty acid for growth of grouper, Epinephelus malabaricus[J]. The Journal of Nutrition, 2002, 132(1): 72-79. DOI:10.1093/jn/132.1.72 |
| [33] |
BELAYEV L, MARCHESELLI V L, KHOUTOROVA L, et al. Docosahesaenoic acid complexed to albumin elicits high-grade ischemic neuroprotection[J]. Stroke, 2005, 36(1): 118-123. DOI:10.1161/01.STR.0000149620.74770.2e |
| [34] |
ROSSMEISL M, JELENIK T, JILKOVA Z, et al. Prevention and reversal of obesity and glucose intolerance in mice by DHA derivatives[J]. Obesity, 2009, 17(5): 1023-1031. DOI:10.1038/oby.2008.602 |
| [35] |
MARCHESELLI V L, HONG S, LUKIW W J, et al. Novel Docosanoids inhibit brain ischemia-reperfusion-mediated leukocyte infiltration and pro-inflammatory gene expression[J]. Journal of Biological Chemistry, 2003, 278(44): 43807-43817. DOI:10.1074/jbc.M305841200 |
| [36] |
任衍开. 多不饱和脂肪酸的研究进展[J]. 健康导报:医学版, 2015, 20(4): 270. |
| [37] |
KURATKO C N, BARRETT E C, NELSON E B, et al. The relationship of docosahexaenoic acid (DHA) with learning and behavior in healthy children:a review[J]. Nutrients, 2013, 5(7): 2777-2810. |
| [38] |
HENNEBELLE M, CHAMPEIL-POTOKAR G, LAVIALLE M, et al. Omega-3 polyunsaturated fatty acids and chronic stress-induced modulations of glutamatergic neurotransmission in the hippocampus[J]. Nutrition Reviews, 2014, 72(2): 99-112. DOI:10.1111/nure.12088 |
| [39] |
史敬, 马依彤. n-3多不饱和脂肪酸对心血管疾病的临床应用[J]. 心血管病学进展, 2016, 37(3): 278-282. |
| [40] |
王玮, 丁建乐, 房金岑. 罗非鱼产业标准化现状及分析[J]. 上海海洋大学学报, 2012, 21(6): 976-981. |
| [41] |
蔡原, 刘哲, 宋明伟, 等. 虹鳟不同部位鱼肉挥发性风味物质组成比较[J]. 食品科学, 2011, 32(16): 269-273. |
| [42] |
卢春霞, 翁丽萍, 王宏海, 等. 3种网箱养殖鱼类的主体风味成分分析[J]. 食品与发酵工业, 2010(10): 163-169. |
| [43] |
TOLDRA F. Proteolysis and lipolysis in flavour development of dry-cured meat products[J]. Meat Science, 1998, 49(Suppl.1): S101-S110. |
| [44] |
UMEDA M, MANABE Y, UCHIMIYA H. Phosphorylation of the C2 subunit of the proteasome in rice (Oryza sativa L.)[J]. FEBS Letters, 1997, 403(3): 313-317. DOI:10.1016/S0014-5793(97)00073-2 |
| [45] |
姜颖. 兔肉腥味物质的鉴定及其形成机理初探&人胎肝磷酸化蛋白质表达谱的构建[D]. 博士学位论文. 南京: 南京农业大学, 2003. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y558582
|
| [46] |
IGLESIAS J, MEDINA I. Solid-phase microextraction method for the determination of volatile compounds associated to oxidation of fish muscle[J]. Journal of Chromatography A, 2008, 1192(1): 9-16. DOI:10.1016/j.chroma.2008.03.028 |
| [47] |
裘迪红, 欧昌荣, 苏秀榕, 等. 植物乳杆菌发酵草鱼肉挥发性成分的变化规律[J]. 食品科学, 2015, 36(20): 174-180. DOI:10.7506/spkx1002-6630-201520033 |
| [48] |
杨华, 娄永江, 杨震峰. GC-MS法分析养殖大黄鱼脱腥前后挥发性成分的变化[J]. 中国食品学报, 2008, 8(3): 147-151. |
| [49] |
杜国伟, 夏文水. 鲢鱼糜脱腥前后及贮藏过程中挥发性成分的变化[J]. 食品工业科技, 2007, 28(9): 76-80. |
| [50] |
冯倩倩. 罗非鱼腥味形成机理及脱除技术研究[D]. 硕士学位论文. 广州: 华南理工大学, 2013.
|
| [51] |
VARLET V, PROST C, SEROT T. Volatile aldehydes in smoked fish:analysis methods, occurence and mechanisms of formation[J]. Food Chemistry, 2007, 105(4): 1536-1556. DOI:10.1016/j.foodchem.2007.03.041 |
| [52] |
THIANSILAKUL Y, BENJAKUL S, RICHARDS M P. Changes in heme proteins and lipids associated with off-odour of seabass (Lates calcarifer) and red tilapia (Oreochromis mossambicus×O.niloticus) during iced storage[J]. Food Chemistry, 2010, 121(4): 1109-1119. DOI:10.1016/j.foodchem.2010.01.058 |
| [53] |
王国超, 李来好, 郝淑贤, 等. 水产品腥味物质形成机理及相关检测分析技术的研究进展[J]. 食品工业科技, 2012, 33(5): 401-404. |
| [54] |
ENOKI T, TOMINAGA T, TAKASHIMA F, et al. Anti-tumor-promoting activities of agaro-oligosaccharides on two-stage mouse skin carcinogenesis[J]. Biological and Pharmaceutical Bulletin, 2012, 35(7): 1145-1149. DOI:10.1248/bpb.b12-00188 |
| [55] |
侯艳平. Flammeovirga pacifica WPAGA1中琼胶酶基因的克隆表达、酶学性质分析及降解产物的初步研究[D]. 硕士研究生论文. 厦门: 国家海洋局第三海洋研究所, 2015.
|
| [56] |
CHUNG H Y, YEUNG C W, KIM J S, et al. Static headspace analysis-olfactometry (SHA-O) of odor impact components in salted-dried white herring (Ilisha elongata)[J]. Food Chemistry, 2007, 104(2): 842-851. DOI:10.1016/j.foodchem.2006.08.036 |
| [57] |
郭大钧, 奚印慈. 测定鱼类鲜度指标之二——三甲胺[J]. 中国水产, 1983(12): 23-23. |




