畜牧业的重要目标之一在于为人类提供更多优质的畜产品。在同样的营养和饲养管理水平下,猪的生长速率主要受到内分泌系统相关激素的调节[1]。半胱胺(cysteamine,CS)可以特异性地与生长抑素(somatostatin,SS)的二硫键结合,破坏生长抑素的生物学活性,通过调节动物的内分泌系统,提高动物的生长速率。此外,CS还参与体内重要的生物活性物质如半胱氨酸、谷胱甘肽(GSH)、亚牛磺酸和牛磺酸等的合成代谢,参与维护机体的抗氧化防御系统。因此,CS作为一种新型饲料添加剂在动物生产领域具有重要意义。
1 CS的理化性质CS,又称2-巯基己胺,熔点99 ℃,易溶于水和乙醇。CS是动物体内辅酶A降解过程中的天然产物。辅酶A在降解过程中产生泛酰巯基乙胺,泛酰巯基乙胺经过泛酰巯基乙胺酶的水解,进而产生CS和泛酸[2-3](图 1)。
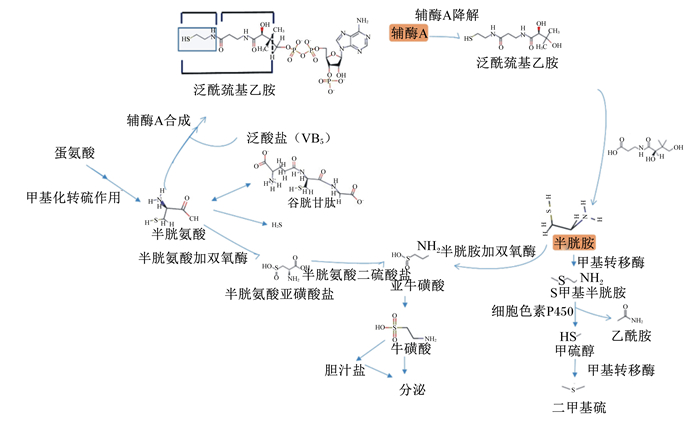
|
图 1 半胱胺在体内的代谢过程 Figure 1 The metabolite process of cysteamine in vivo |
CS既可以从动物体内提取,也可以化学合成。其在空气、碱性环境和金属离子存在条件下易被氧化为胱胺。在动物体内,外源性CS极易与血浆蛋白结合或是被自由基氧化降解[4]。因此生产中一般将CS制成半胱胺盐酸盐或进行包被,使其在体内更好地发挥生理作用。研究表明,经包被的CS可以免受胃液的影响,同时具有缓释效果,避免了CS对胃黏膜的损伤[5]。
2 CS在猪营养上的研究进展 2.1 CS对猪生长性能的影响CS目前已经在猪生产中作为一种饲料添加剂,用于改善仔猪和育肥猪的生长性能、饲料转化率、机体蛋白质沉积、肌肉生长及母猪的繁殖性能。欧洲药品评估局(The European Agency for the Evaluation of Medicinal Products, EMEA)已将其归为“无需制定最大残留量的有机物”,可用于生产畜产品的哺乳动物[6]。
在仔猪的研究方面,Du等[7]的研究表明,饲粮添加36 mg/kg CS(有效剂量)饲喂15~35日龄仔猪,可以显著增加仔猪的采食量和体增重。在生长育肥猪的研究方面,其应用剂量不尽相同。Liu等[8]研究发现,饲粮添加70 mg/kg CS饲喂育肥猪47 d,能显著提高育肥猪的生长性能;但有部分研究表明,当CS的有效剂量达到200 mg/kg时才具有促生长效果[9-10]。其原因可能与养殖过程中使用的饲粮、饲养管理水平等因素有关。此外,CS中游离巯基的不稳定性,可能使部分CS氧化失活,导致有效剂量降低;部分CS粗制品可能含有不良气味,影响了动物的采食,因此产生了不同的饲喂效果。研究表明,在育肥期不同阶段,CS的最适剂量也应随着猪体重的增加而适量提高[11]。
CS在动物体内发挥促生长作用的机制主要是通过抑制生长抑素的活性来实现的。生长抑素是一种由下丘脑合成并释放的脑肠肽激素,广泛分布于胃肠道、中枢神经系统及淋巴组织中,生长抑素能够抑制生长激素(growth hormone,GH)的分泌、胃肠道中消化酶的分泌、肽激素的释放、平滑肌的收缩等,从而阻碍动物的生长发育,影响胃肠道对营养物质的消化吸收[12-14]。CS在体内可以与生长抑素特异性结合,破坏生长抑素的二硫键,从而破坏生长抑素的生物学活性,解除生长抑素对生长激素和消化酶等分泌的抑制作用,从而促进营养物质的吸收,促进机体生长[15-19]。另外,CS的代谢产物——牛磺酸,能增强淀粉酶(AMY)、胰朊酶等消化酶的活性,因此CS也能通过其代谢产物的作用间接促进机体对营养物质的吸收[20]。但有研究表明,CS的促生长效果具有剂量和时间依赖性,随着时间的延长,其效应逐渐减弱。无论是通过口服还是瘤胃瘘管、十二指肠瘘管灌注CS,CS对动物体内生长抑素活性的抑制作用均会随时间推移逐渐降低,且在1周左右生长抑素的活性恢复至处理前水平[21]。因此,部分学者建议采用5~7 d给生长育肥猪饲喂1次CS的方式,但是这种方法在生产实际中操作较为繁琐[22]。有学者对CS持续性添加和间隔性添加所产生的效果进行了对比。在生长性能的研究方面,有报道表明,商品猪育肥阶段全程持续添加有效剂量为18.22 mg/kg的低剂量CS 56 d,其改善生长性能的效果优于分别在2个阶段递增(1~28 d添加有效剂量为21.87 mg/kg、29~56 d添加有效剂量为29.16 mg/kg)添加CS的方式,其投入产出比、经济效益更高,且与生产实践更符合,更具推广意义[23]。另有报道对CS在肥育后期猪生长性能上的影响进行了研究,结果发现在饲喂周期均为20 d的情况下,每天饲喂1次有效剂量为20 mg/kg CS组比每5 d饲喂1次同样剂量CS组的日增重提高效果更好[24]。
在母猪的研究方面,有报道表明,在妊娠后期母猪饲粮中添加CS,可促进胎儿在母猪体内的生长发育,提高窝产活仔数、初生均匀度和仔猪初生重,降低仔猪弱仔率[25-26]。其原因可能在于,CS可以通过性腺轴调节相关性激素的分泌,改善了母猪体内的代谢水平,从而影响对胎儿营养的供给。另外,在泌乳期添加CS还能够提高母猪对营养物质的利用率,减少因泌乳引起的体重损失,缩短母猪发情间隔,还可以通过提高初乳中免疫球蛋白的含量,进而提高仔猪的育成率[27]。
2.2 CS对猪胴体品质和肉品质的影响目前,对CS在猪胴体品质和肉品质的相关研究主要集中在生长育肥猪上。研究表明,饲粮添加70 mg/kg的CS饲喂育肥猪47 d可显著提高育肥猪的蛋白质沉积[8]。另外,在育肥后期饲喂含180 mg/kg半胱胺盐酸盐(有效剂量)的饲粮35 d,可以显著提高胴体瘦肉率和胴体骨骼率,降低脂肪率和改善肉色[28]。饲粮中添加70 mg/kg的半胱胺盐酸盐饲喂生长育肥猪21 d,可以显著降低猪P2点(最后肋骨处)背膘厚[29]。饲粮中添加9.45 mg/kg的CS(有效剂量)29 d还能显著增加猪肉内脱氧肌红蛋白含量,显著降低高铁肌红蛋白含量,延迟屠宰后猪肉氧化变色的时间[30]。
CS提高胴体品质、减少猪体脂肪沉积的原因可能有以下几个方面。首先,CS能够调节生长激素、甲状腺激素、胰高血糖素等激素的分泌[31-32, 43],促进营养物质在体内的重分配,减少脂肪细胞的脂质合成,促进肌肉细胞的蛋白质合成和脂肪分解[33]。其次,还与其调节了甲状腺素和胰高血糖素等激素的分泌,从而促进了肌肉组织的生长发育以及脂肪组织的分解有关[33]。另外,CS还可以通过提高激素敏感脂酶的活性,降低苹果酸脱氢酶、葡萄糖-6-磷酸脱氢酶和异柠檬酸脱氢酶的表达,减少体脂肪沉积[34-35]。
2.3 CS对猪营养物质代谢的影响饲粮中添加CS能够改善机体对营养物质的代谢。研究表明,饲粮添加CS能够提高猪血清中的总蛋白(TP)含量,降低血清中的尿素氮(UN)含量[34, 36]。血清总蛋白含量是反映蛋白质在体内代谢状况的重要指标,在维持血浆渗透压、缓冲血液酸碱度和营养供给等方面具有重要功能[37],同时也可反映机体的免疫力情况。血清尿素氮是通过机体内的蛋白质和氨基酸经过精氨酸循环形成的代谢产物,其含量与体内氮沉积率、蛋白质(或氨基酸)利用率呈显著负相关[38]。当血清总蛋白含量较高、尿素氮含量较低时,表明氨基酸代谢稳定,机体内蛋白质合成代谢较强,饲粮中氮利用率高。因此,CS能够促进蛋白质的代谢,提高氮的利用率。
在脂质代谢和糖代谢的指标方面,CS有降低血清总胆固醇(TC)、甘油三酯(TG)及葡萄糖(GLU)含量的作用[39-40]。由于糖类、蛋白质和脂类三大营养物质代谢均受到内分泌激素的调控,而CS可通过提高胰岛素活性从而促进组织对血液中葡萄糖的利用。CS还加快了脂肪组织分解,使血液的胆固醇和甘油三酯运回肝脏分解供能以节约葡萄糖,这样就使血液中总胆固醇和甘油三酯的含量降低,其相关机制是CS能够与肝脏中合成胆固醇和甘油三酯相关催化酶中的含硫氨基酸结合,抑制含硫氨基酸的活性,从而抑制胆固醇和甘油三酯的合成,促进其分解[41]。
此外,不同饲喂模式对猪营养物质代谢的作用也有所不同。研究表明,给育肥猪持续饲喂37.5 mg/kg(有效剂量)的CS,其血清中谷丙转氨酶(GPT)、谷草转氨酶(GOT)、碱性磷酸酶(AKP)和淀粉酶活性高于每隔6 d饲喂相同剂量的CS组,谷丙转氨酶和谷草转氨酶反映蛋白质合成代谢情况,碱性磷酸酶参与脂肪代谢,淀粉酶参与糖代谢,这几种酶活性均与动物对营养物质的消化吸收呈正相关。结果提示,持续饲喂CS改善猪体内营养物质代谢的效果更优[42]。
2.4 CS对猪肠道健康和营养物质吸收的影响小肠是营养物质消化和吸收的主要场所,因此,研究CS对肠道的作用对猪生产的指导具有重要意义。研究表明,饲粮中添加CS能够改善生长猪对饲粮干物质、无氮浸出物、粗蛋白质、粗脂肪、粗纤维、钙和总磷等营养物质的表观消化吸收率[43]。CS还能够显著提高猪小肠内容物中的蛋白酶、脂肪酶和淀粉酶的活性,提高胰蛋白酶的活性[44]。其原因可能在于,CS能够解除生长抑素对促胰液素和胆囊收缩素的抑制作用,进而促进胰酶的合成与分泌[45]。此外,CS能够提高仔猪小肠内钠-葡萄糖共转运载体1(SGLT1)的表达量,促进了小肠对葡萄糖的吸收利用[46]。
肠道抗氧化防御系统和免疫系统对于维护肠道健康具有重要作用。肠道黏膜内谷胱甘肽、谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)是肠道抗氧化防御系统的重要组成成分,分泌型的免疫球蛋白A(IgA)、免疫球蛋白M(IgM)和免疫球蛋白G(IgG)含量一定程度上反映了肠道免疫系统的防御能力。研究表明,在育肥猪饲粮中添加CS可以使空肠黏膜内的谷胱甘肽含量增加,谷胱甘肽过氧化物酶活性提高,超氧化物歧化酶活性降低;空肠黏膜分泌型的免疫球蛋白A、免疫球蛋白M和免疫球蛋白G含量显著增加[47]。结果表明,CS能够维护肠道抗氧化防御系统及免疫系统,促进了肠道的健康。
此外,CS能够显著增强空肠黏膜紧密连接蛋白occludin、claudin-1和闭锁小带蛋白1(ZO-1)的表达[47]。因此,CS对于改善紧密连接蛋白对于维护肠道屏障的完整性,促进肠上皮组织的发育具有重要作用。
2.5 CS对缓解仔猪应激的作用在现代养猪生产中,仔猪早期断奶通常会引发严重的断奶应激,进而产生腹泻和生长迟滞等负面影响。其中,胃酸分泌不足是断奶仔猪发生生长迟滞和腹泻的重要原因[48]。研究表明,CS能够通过耗竭生长抑素,促进仔猪胃黏膜内胃泌素、生长激素释放肽的分泌,来增加仔猪内源性胃酸的分泌[7, 49]。Shi等[50]的研究发现,CS可以提高胃组织中氢钾ATP酶(H+-K+-ATPase)的mRNA表达,促进断奶仔猪胃酸分泌。此外,断奶应激会导致血清皮质醇、三碘甲腺原氨酸(T3)和甲状腺素(T4)含量显著提高[51]。而添加CS可以使断奶仔猪血清中皮质醇含量显著下降,三碘甲腺原氨酸和甲状腺素含量保持稳定,减少机体动用更多的能量应对应激,缓解了断奶应激[52]。
除了通过调控胃酸及体内激素的分泌来缓解应激之外,CS还能通过发挥抗氧化作用来缓解应激反应。超氧化物歧化酶和谷胱甘肽过氧化物酶是机体内抗氧化防御系统的重要组成成分。研究表明,给仔猪饲喂CS可以显著提高血清中超氧化物歧化酶和谷胱甘肽过氧化物酶活性[53]。因此CS的添加提高了仔猪应对外界应激的抗氧化防御能力。CS发挥抗氧化作用的机制可能与以下几个方面有关:首先,CS的活性巯基可以使溶酶体内过多的胱氨酸转化半胱氨酸[54],进而合成谷胱甘肽,通过增加体内谷胱甘肽的含量而间接发挥抗氧化作用[30];其次,另有报道指出CS对半乳糖胺、四氯化碳(CCl4)和对乙酰氨基酚诱导的多种肝脏氧化损伤具有缓解作用,在肝脏中是一种比谷胱甘肽更有效的氧自由基清除剂[55];此外,CS还能转化为牛磺酸,增强过氧化氢酶以及谷胱甘肽代谢相关抗氧化酶的活性[56-57]。
2.6 CS的免疫调节功能CS能够在一定程度上调节猪的免疫功能。刘智等[58]报道表明,CS可以显著提高断奶仔猪血清免疫球蛋白A、免疫球蛋白G含量及白细胞吞噬率和T-淋巴细胞转化率,提高机体的免疫力。刘巧婷等[59]报道,CS与N-氨甲酰谷氨酸的互作还有利于断奶仔猪体内口蹄疫抗体水平的恢复,有效避开母源抗体的干扰,提高了仔猪机体的免疫力。另外,在母猪妊娠后期饲粮中添加CS还可以提高母猪初乳中免疫球蛋白G的含量,间接提高仔猪的免疫机能[27]。常文环等[60]报道表明,饲喂半胱胺盐酸盐制剂的仔猪,其猪瘟病毒抗体阻断率显著高于对照组,因此半胱胺盐酸盐制剂对于增强猪场猪瘟疫苗免疫效果也具有一定的作用。另外,CS还能提高育肥猪血液中的补体3水平[61],而补体系统是机体非特异性免疫的组成部分,具有协助抗体吞噬病原微生物的作用[62]。
CS发挥免疫调节作用的机制与抑制生长抑素的活性有关。生长抑素能够抑制免疫球蛋白和细胞因子的合成[63]。其中,生长抑素对免疫球蛋白A的合成抑制作用可达20%~50%[58]。而CS可以通过耗竭体内生长抑素水平,促进生长激素、胰岛素样生长因子-1等激素的释放,而生长激素、胰岛素样生长因子-1水平的提高有利于促进葡萄糖和氨基酸小分子进入淋巴细胞中,从而促进免疫球蛋白的合成[64]。
3 CS应用中存在的问题虽然CS具有促生长功能,但是不恰当的剂量及使用方式也会引起负面问题。研究表明,高剂量的CS能够导致大鼠十二指肠溃疡和穿孔[65-66]。此外,CS还可以通过促进内皮素的释放,减缓大鼠十二指肠黏膜的血流量,造成局部组织缺血和缺氧,降低机体的防御机能[67]。另外,高剂量的CS还会造成氧化应激,造成直接性和坏死性的细胞毒性[68]。
4 小结饲粮中适量添加CS能够有效改善猪的生长性能、胴体品质、肉品质、营养物质代谢、肠道健康、应激反应和免疫调节功能等。然而,目前CS在动物生产中的使用效果并不一致,不同的研究报道所使用的CS纯度、有效剂量、饲喂时间及试验所用猪的生长阶段、生长环境和品种都有所不同,因此,对于各生长阶段的最适添加量和添加方式还需要进一步的研究。此外,虽然通过促进生长激素的分泌提高生长性能是一种很有效的方式,但是这种直接促进体内生长激素分泌的方式的安全性仍未被部分国家接受认可,其在畜牧生产中的效果及潜在的毒副作用仍需进一步评估。目前,大部分的试验还存在试验周期短、试验动物群体小的缺陷,还需要有更多长期、大规模的饲养试验来评估CS的持续作用效果。此外,对CS加工工艺的完善以减轻异味、增强化学稳定性,使其更好地在体内发挥生理作用,以及CS在体内的作用机理也有待进一步研究。
| [1] |
ETHERTON T D, WIGGINS J P, CHUNG C S, et al. Stimulation of pig growth performance by porcine growth hormone and growth hormone-releasing factor[J]. Journal of Animal Science, 1986, 63(5): 1389-1399. |
| [2] |
KHOMENKO T, SZABO S, DENG X, et al. Role of iron in the pathogenesis of cysteamine-induced duodenal ulceration in rats[J]. American Journal of physiology.Gastrointestinal and Liver Physiology, 2009, 296(6): 1277-1286. DOI:10.1152/ajpgi.90257.2008 |
| [3] |
GALLEGO-VILLAR L, HANNIBAL L, H BERLE J, et al. Cysteamine revisited:repair of arginine to cysteine mutations[J]. Journal of Inherited Metabolic Disease, 2017, 40(4): 555-567. |
| [4] |
BARNETT M C, HEGARTY R S. Cysteamine:a human health dietary additive with potential to improve livestock growth rate and efficiency[J]. Animal Production Science, 2016, 56(8): 1330-1338. DOI:10.1071/AN15339 |
| [5] |
RIOUX P, ZANKEL T C. Use of cysteamine and derivatives thereof to treat mitochondrial diseases: USA, US2014/064336[P]. 2015-05-14.
|
| [6] |
刘光芒. 半胱胺对动物生产性能及其营养生理效应研究[D]. 博士学位论文. 雅安: 四川农业大学, 2010: 18.
|
| [7] |
DU G, SHI Z, XIA D, et al. Cysteamine improves growth performance and gastric ghrelin expression in preweaning piglets[J]. Domestic Animal Endocrinology, 2012, 42(4): 203-209. |
| [8] |
LIU G M, WANG Z S, WU D, et al. Effects of dietary cysteamine supplementation on growth performance and whole-body protein turnover in finishing pigs[J]. Livestock Science, 2009, 122(1): 86-89. |
| [9] |
DUNSHEA F R. Porcine somatotropin and cysteamine hydrochloride improve growth performance and reduce back fat in finisher gilts[J]. Australian Journal of Experimental Agriculture, 2007, 47(7): 796-800. DOI:10.1071/EA06243 |
| [10] |
ZHOU P, ZHANG L, LI J, et al. Effects of dietary crude protein levels and cysteamine supplementation on protein synthetic and derivative signaling in skeletal muscle of finishing pigs[J]. Plos One, 2015, 10(9): e0139393. |
| [11] |
宋延飞. 不同剂量半胱胺对生长育肥猪生长性能的影响[J]. 饲料工业, 2016, 37(6): 43-46. |
| [12] |
YANG W, WANG J, LIU L, et al. Effect of high dietary copper on somatostatin and growth hormone-releasing hormone levels in the hypothalami of growing pigs[J]. Biological Trace Element Research, 2011, 143(2): 893-900. |
| [13] |
RAM REZ J L, TORRONTERAS R, CASTA O J P, et al. Somatostatin plays a dual, stimulatory/inhibitory role in the control of growth hormone secretion by two somatotrope subpopulations from porcine pituitary[J]. Journal of Neuroendocrinology, 1997, 9(11): 841-848. |
| [14] |
RAM REZ J L, CASTA O J P, GRACIANAVARRO F. Somatostatin at low doses stimulates growth hormone release from intact cultures of porcine pituitary cells[J]. Hormone & Metabolic Research, 1998, 30(4): 175-177. |
| [15] |
SZABO S, REICHLIN S. Somatostatin in rat tissues is depleted by cysteamine administration[J]. Endocrinology, 1981, 109(6): 2255-2257. |
| [16] |
MCLEOD K R, HARMON D L, SCHILLO K K, et al. Cysteamine-induced depletion of somatostatin in sheep:time course of depletion and changes in plasma metabolites, insulin, and growth hormone[J]. Journal of Animal Science, 1995, 73(1): 77-87. |
| [17] |
XIAO D, LIN H R. Effects of cysteamine-a somatostatin-inhibiting agent-on serum growth hormone levels and growth in juvenile grass carp (Ctenopharyngodon idellus)[J]. Comparative Biochemistry & Physiology Part A Molecular & Integrative Physiology, 2003, 134(1): 93-99. |
| [18] |
HALL T R, CHEUNG A, HARVEY S, et al. Somatostatin immunoneutralization affects plasma metabolite concentrations in the domestic fowl[J]. Comparative Biochemistry & Physiology Part A:Physiology, 1986, 85(3): 489-494. |
| [19] |
MILLARD W J, SAGAR S M, MARTIN J B. Cysteamine-induced depletion of somatostatin and prolactin[J]. Federation proceedings, 1985, 44(9): 2546-2550. |
| [20] |
SALZE G, MCLEAN E, CRAIG S R. Dietary taurine enhances growth and digestive enzyme activities in larval cobia[J]. Aquaculture, 2012, 362-363(5): 44-49. |
| [21] |
黄瑞林. 半胱胺的生理作用及其在养殖业中的应用[J]. 饲料广角, 2002(3): 22-24. |
| [22] |
唐好文, 李辉, 李婷. 半胱胺的动物营养研究进展[J]. 中国畜牧兽医, 2008, 35(1): 33-36. |
| [23] |
张晓峰, 柘丽, 余荣, 等. 包膜半胱胺对生长育肥猪生长性能的影响[J]. 饲料博览, 2017(3): 1-5. |
| [24] |
向德标, 姚元枝, 伍福. 半胱胺对宁乡猪肥育后期生产性能的影响[J]. 怀化学院学报, 2005, 24(2): 76-78. |
| [25] |
陈丛亮, 杨磊, 吕维远. 半胱胺盐酸盐对妊娠后期和泌乳母猪生产性能的影响[J]. 饲料研究, 2009(2): 25-27, 34. |
| [26] |
徐金先, 杨磊, 陆天水, 等. 强化保生灵在断奶母猪饲料中的应用效果[J]. 饲料研究, 2005, 2005(7): 18-20. |
| [27] |
田春庄, 肖成林, 黄飞若, 等. β-CD-半胱胺对母猪繁殖性能和仔猪生长性能的影响[J]. 动物营养学报, 2007, 19(5): 559-566. |
| [28] |
韦习会, 夏东, 高勤学, 等. 半胱胺对育肥后期猪胴体性状和肉质性状的影响[J]. 南京农业大学学报, 2003, 26(3): 73-75. |
| [29] |
MILLER D W, PROSSER Z, CHEE E Y W, et al. Dietary stimulation of the endogenous somatotropic axis in weaner and grower-finisher pigs using medium chain triglycerides and cysteamine hydrochloride[J]. Journal of Animal Science and Biotechnology, 2016, 7(1): 61. DOI:10.1186/s40104-016-0121-9 |
| [30] |
BAI M, LIU H, XU K, et al. Effects of dietary coated cysteamine hydrochloride on pork color in finishing pigs[J]. Journal of the Science of Food and Agriculture, 2017, 48(1): 96-100. |
| [31] |
ETHERTON T D, WIGGINS J P, EVOCK C M, et al. Stimulation of pig growth performance by porcine growth hormone:determination of the dose-response relationship[J]. Journal of Animal Science, 1987, 64(2): 433-443. |
| [32] |
EBERT K M, LOW M J, OVERSTROM E W, et al. A Moloney MLV-rat somatotropin fusion gene produces biologically active somatotropin in a transgenic pig[J]. Molecular Endocrinology, 1988, 2(3): 277-283. |
| [33] |
YANG C B, LI A K, YIN Y L, et al. Effects of dietary supplementation of cysteamine on growth performance, carcass quality, serum hormones and gastric ulcer in finishing pigs[J]. Journal of the Science of Food and Agriculture, 2005, 85(11): 1947-1952. |
| [34] |
陈安国, 洪奇华, 吴林友. 半胱胺对生长肥育猪胴体品质的影响及其机理探讨[J]. 中国畜牧杂志, 2004, 40(2): 11-13. |
| [35] |
洪奇华, 吴林友, 陈安国. 半胱胺不同添加方式对生长肥育猪生产性能的影响[J]. 养猪, 2003(3): 22-23. |
| [36] |
朱宇旌, 王浩然, 李方方, 等. 半胱胺螯合锌对仔猪生长性能、血清生化指标、养分消化率及粪中微生物菌群的影响[J]. 动物营养学报, 2015, 27(10): 3225-3232. DOI:10.3969/j.issn.1006-267x.2015.10.030 |
| [37] |
CAI D, JIA Y, LU J, et al. Maternal dietary betaine supplementation modifies hepatic expression of cholesterol metabolic genes via epigenetic mechanisms in newborn piglets[J]. British Journal of Nutrition, 2014, 112(9): 1459-1468. DOI:10.1017/S0007114514002402 |
| [38] |
MAO X, ZENG X, HUANG Z, et al. Leptin and leucine synergistically regulate protein metabolism in C2C12 myotubes and mouse skeletal muscles[J]. British Journal of Nutrition, 2013, 110(2): 256-264. |
| [39] |
张建斌, 杨升. 半胱胺和酵母铬对育肥猪内分泌激素和脂类代谢的影响[J]. 天津农学院学报, 2006, 13(2): 7-10. |
| [40] |
黄所含. 半胱胺、酵母铬对生长肥育猪和良凤肉鸡生长性能、胴体品质及血清生化指标的影响[D]. 硕士学位论文. 南宁: 广西大学, 2006: 40. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y985862
|
| [41] |
MCCARTY M F. Inhibition of acetyl-CoA carboxylase by cystamine may mediate the hypotriglyceridemic activity of pantethine[J]. Medical Hypotheses, 2001, 56(3): 314-317. DOI:10.1054/mehy.2000.1155 |
| [42] |
陶勇, 任善茂, 周春宝. 半胱胺不同添加方式对育肥猪胴体品质及血液生化指标的影响[J]. 中国畜牧兽医文摘, 2006, 26(1): 39-40. |
| [43] |
夏中生, 仵天培, 农志坚, 等. 半胱胺和酵母铬对生长猪饲粮养分消化代谢的影响[J]. 粮食与饲料工业, 2012, 12(2): 53-55. |
| [44] |
徐雪松, 吴金节, 李健, 等. 半胱胺对仔猪生长性能及小肠内容物消化酶活性的影响[J]. 中国兽医学报, 2008, 28(9): 1088-1091. |
| [45] |
洪奇华, 杨彩梅, 吴林友. 半胱胺对猪十二指肠内容物中消化酶活性和生产性能的影响[J]. 中国饲料, 2003(16): 13-14. DOI:10.3969/j.issn.1004-3314.2003.16.008 |
| [46] |
张磊, 王丽娜, 石志敏, 等. 断奶前后仔猪十二指肠空肠和回肠SGLT1 mRNA表达的变化及半胱胺的影响[J]. 农业生物技术学报, 2006, 14(6): 850-854. |
| [47] |
ZHOU P, LUO Y, ZHANG L, et al. Effects of cysteamine supplementation on the intestinal expression of amino acid and peptide transporters and intestinal health in finishing pigs[J]. Animal Science Journal, 2016, 88(2): 314-321. |
| [48] |
NABUURS M J A. Weaning piglets as a model for studying pathophysiology of diarrhea[J]. Veterinary Quarterly, 1998, 20(3): 42-45. |
| [49] |
刘皙洁, 韩正康, 杨玉焕, 等. 半胱胺对香猪胃液分泌、血液胃泌素和生长抑素水平的影响[J]. 畜牧与兽医, 1998(3): 9-11. |
| [50] |
SHI Z M, DU G M, WEI X H, et al. Cysteamine increases expression and activity of H+-K+-ATPase of gastric mucosal cells in weaning piglets[J]. World Journal of Gastroenterology, 2005, 11(42): 6707-6712. |
| [51] |
CARROLL J A, VEUM T L, MATTERI R L. Endocrine responses to weaning and changes in post-weaning diet in the young pig[J]. Domestic Animal Endocrinology, 1998, 15(3): 183-194. |
| [52] |
石志敏, 张磊, 韦习会, 等. 半胱胺对断奶前后仔猪血清皮质醇、T3、T4和IL-2水平的影响[J]. 动物学研究, 2005, 26(3): 317-321. |
| [53] |
刘智. 半胱胺对仔猪免疫机能的影响及其机理研究[D]. 硕士学位论文. 合肥: 安徽农业大学, 2007: 6.
|
| [54] |
WILMER M J, KLUIJTMANS L A J, VAN D V, THEA J, et al. Cysteamine restores glutathione status in cultured cystinotic proximal tubular epithelial cells[J]. Biochimica et Biophysica Acta, 2011, 1812(6): 643-651. |
| [55] |
FERREIRA D W, NAQUET P, MANAUTOU J E. Influence of vanin-1 and catalytic products in liver during normal and oxidative stress conditions[J]. Current Medicinal Chemistry, 2015, 22(20): 2407-2416. DOI:10.2174/092986732220150722124307 |
| [56] |
SUMIZU K. Oxidation of hypotaurine in rat liver[J]. Biochimica et Biophysica Acta, 1962, 63(1): 210-212. |
| [57] |
SMITH L L, SHARMA R, KODAVANTI U P, et al. The uptake and metabolism of cystamine and taurine by isolated perfused rat and rabbit lungs[J]. International Journal of Biochemistry & Cell Biology, 1995, 27(7): 655-664. |
| [58] |
刘智, 徐雪松, 刘丽, 等. 半胱胺对仔猪免疫机能的调节作用[J]. 中国畜牧兽医, 2007, 34(5): 18-21. |
| [59] |
刘巧婷. 半胱胺、N-氨甲酰谷氨酸对不同阶段生长育肥猪生长性能、血清生理化指标及免疫机能的影响[D]. 硕士学位论文. 南宁: 广西大学, 2015.
|
| [60] |
常文环, 江勇, 蔡辉益, 等. 免疫再生素对仔猪生产性能及免疫指标的研究[J]. 饲料研究, 2007(2): 31-33. |
| [61] |
李慧. 包膜半胱胺对肥育猪生长、胴体品质、肉质和消化的影响及其机理研究[D]. 硕士学位论文. 杭州: 浙江大学, 2014. https://max.book118.com/html/2016/0225/35855503.shtm
|
| [62] |
RICKLIN D, HAJISHENGALLIS G, YANG K, et al. Complement:a key system for immune surveillance and homeostasis[J]. Nature Immunology, 2010, 11(9): 785-797. |
| [63] |
TEN BOKUM A M, HOFLAND L J, VAN HAGEN P M. Somatostatin and somatostatin receptors in the immune system:a review[J]. European Cytokine Network, 2000, 11(2): 161-176. |
| [64] |
FUKUHARA S, SUZUKI H, MASAOKA T, et al. Enhanced ghrelin secretion in rats with cysteamine-induced duodenal ulcers[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2005, 289(1): 138-145. |
| [65] |
PRABHA T, DORABABU M, GOEL S, et al. Effect of methanolic extract of Pongamia pinnata Linn seed on gastro-duodenal ulceration and mucosal offensive and defensive factors in rats[J]. Indian Journal of Experimental Biology, 2009, 47(8): 649-659. |
| [66] |
DAS P K, PILLAI S, KAR D, et al. Pharmacological efficacy of Argemone mexicana plant extract, against cysteamine-induced duodenal ulceration in rats[J]. Indian Journal of Medical Research, 2011, 65(3): 92-99. |
| [67] |
KHOMENKO T, DENG X, SANDOR Z, et al. Cysteamine alters redox state, HIF-1alpha transcriptional interactions and reduces duodenal mucosal oxygenation:novel insight into the mechanisms of duodenal ulceration[J]. Biochemical and Biophysical Research Communications, 2004, 317(1): 121-127. DOI:10.1016/j.bbrc.2004.03.017 |
| [68] |
HUA L L, HALLIWELL B. Oxidation and generation of hydrogen peroxide by thiol compounds in commonly used cell culture media[J]. Biochemical and Biophysical Research Communications, 2001, 286(5): 991-994. |




