2. 华中农业大学水产学院, 武汉 430070
2. College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China
维生素B6是水溶性的B族维生素,包含吡哆醇、吡哆醛和吡哆胺3种物质,因此也被称为吡哆素。维生素B6在体内以磷酸酯形式存在,是生物体内140多种酶的辅酶因子,参与氨基酸的生物合成与分解代谢以及糖代谢和脂类代谢,具有重要的生理功能。水产动物缺乏维生素B6会出现厌食、运动失调、生长受阻及其他神经功能紊乱的症状[1-2]。有关水产动物对饲料中维生素B6需要量的研究国内外已有相关报道,如斑点叉尾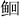
吉富罗非鱼(genetically improved farmed tilapia,GIFT,Oreochromis niloticus)是经遗传改良后的罗非鱼,其生长速度快、抗病力强、适应力强,已成为我国重要的养殖品种。罗非鱼对维生素B6的需要量国外已有部分报道,根据饲料蛋白质水平的不同,奥尼罗非鱼(Oreochromis niloticus×O.aureus)对饲料中维生素B6的需要量有所差异,分别为1.7~9.5 mg/kg(28%蛋白质水平)和15.0~16.5 mg/kg(36%蛋白质水平)[10];红罗非鱼(Oreochromis mossambicus×O. niloticus)对饲料中维生素B6的需要量为3 mg/kg[11]。由于吉富罗非鱼生长速度比其他品系快,而生长速度的不同会造成生理代谢的差异,对营养素的需要量也有差异,因此有必要评估吉富罗非鱼对饲料中维生素B6的需要量。本试验以吉富罗非鱼为研究对象,考察饲料中维生素B6含量对吉富罗非鱼生长性能、全鱼和肌肉营养组成及血清和肝脏生化指标的影响,以确定吉富罗非鱼对饲料中维生素B6的需要量。
1 材料与方法 1.1 试验饲料以酪蛋白和明胶为蛋白质源,以玉米油和豆油为脂肪源,以糊精为糖源,配制基础饲料,其组成及营养水平见表 1。维生素B6的设计水平分别为0(对照组)、2.5、5.0、10.0、20.0和40.0 mg/kg,共配制6种纯化饲料。先将维生素B6与纤维素混合配制成一定浓度的维生素B6预混料,再根据设计水平向饲料中添加不同质量的预混料,每组均以纤维素的增减来平衡维生素B6预混料的不同。饲料配制时先将干性饲料原料粉碎后过60目筛,按配制表准确称取一定质量后逐级混匀,加玉米油和豆油混合均匀,再加适量水用制粒机加工成直径2.0 mm条状,电风扇吹干后,破碎成长约4.0 mm圆柱形颗粒料,置于-20 ℃冰柜中保存备用。采用微生物法(德国拜发公司生产的试剂盒)测得6种纯化饲料中维生素B6含量分别为0.3、2.7、5.4、10.1、20.5和39.8 mg/kg。
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验鱼由广西罗非鱼国家级育种试验场提供,运回武汉市江夏区山坡乡养殖基地网箱中暂养,暂养期间投喂未添加维生素B6的基础饲料,2周后挑选体质健壮、规格均匀、初始平均体质量为(56.3±1.8) g的吉富罗非鱼360尾,随机分成6个组,每组3个重复,每个重复20尾鱼。各重复随机分配于18个网箱(1.0 m×1.0 m×1.5 m)中,每个网箱20尾鱼。各组分别饲喂维生素B6含量分别为0.3(对照组)、2.7、5.4、10.1、20.5和39.8 mg/kg的6种纯化饲料,进行10周的养殖试验。
每天投喂2次(09:00、16:00),表观饱食投喂,每2周称重1次,养殖试验持续10周。每日观察记录水温、试验鱼摄食及死亡情况。养殖期间的水温为27~33 ℃,pH为7.2~7.5,溶解氧浓度>5.0 mg/L,总氨氮浓度<0.05 mg/L。
1.3 样品采集养殖10周后,将试验鱼饥饿24 h后称取每个网箱的试验鱼总重并记录尾数。从每个网箱随机选取3尾鱼,测量其体长、体重,从尾静脉采血后进行解剖,迅速分离内脏和肝脏,并称其重量,计算脏体比和肝体比;保存肝脏样品,用于肝脏生化指标测定;解剖并保存肌肉样品,用于营养组成的测定。将装有血液的离心管静置于4 ℃冰箱中2 h,3 000 r/min离心10 min,取上层血清,用于部分血清生化指标的检测。每个网箱另外取3尾鱼用于全鱼营养组成的测定。肝脏、肌肉、血清和全鱼样品置-40 ℃冰箱中保存待测。
1.4 测定方法 1.4.1 生长性能生长性能指标的计算公式如下:
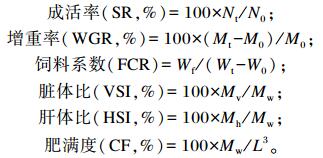
|
式中:N0和Nt分别为试验鱼的初始尾数和终末尾数;M0和Mt分别为试验鱼的初始均重和终末均重(g);Wf为摄食饲料总量(g);W0和Wt分别为试验鱼的初始总重和终末总重(g);Mv为样品鱼内脏重(g);Mh为样品鱼肝脏重(g);Mw和L分别为样品鱼体重(g)和体长(cm)。
1.4.2 全鱼和肌肉营养组成全鱼和肌肉的营养组成分析采用AOAC(2000)[12]的方法。水分含量的测定采用105 ℃恒温干燥失重法,粗蛋白质含量的测定采用凯氏定氮法,粗脂肪含量的测定采用索氏抽提法,粗灰分含量的测定采用马福炉灰分法。
1.4.3 血清和肝脏生化指标称取1 g肝脏样本(精确到0.01 g),按照重量(g)加入9倍体积(mL)的生理盐水,置于冰上机械匀浆,3 000 r/min离心10 min,取上清液用于肝脏生化指标的检测。血清碱性磷酸酶(ALP)活性,葡萄糖(GLU)、总蛋白(TP)和尿素氮(UN)含量,肝脏谷草转氨酶(AST)和谷丙转氨酶(ALT)活性采用Sysmex Chemix-800全自动生化分析仪测定。另用南京建成生物工程研究所的考马斯亮蓝试剂盒检测肝脏匀浆液的蛋白浓度。肝脏谷草转氨酶和谷丙转氨酶活性计算方法如下:
肝脏谷草转氨酶、谷丙转氨酶活性(U/g prot)=生化分析仪检测的谷草转氨酶、谷丙转氨酶活性(U/L)/肝脏匀浆液蛋白浓度(g/L prot)。
1.5 统计分析采用SPSS 19.0统计软件中单因素方差分析(one-way ANOVA)和Duncan氏多重比较法进行统计分析,试验结果用平均值±标准差表示,差异显著水平为P<0.05。利用折线(broken-line)回归分析得出吉富罗非鱼对饲料中维生素B6的需要量[13]。
2 结果 2.1 饲料中维生素B6含量对吉富罗非鱼生长性能的影响由表 2可知,随着饲料中维生素B6含量的增加,吉富罗非鱼的增重率呈现先显著增加(P < 0.05)后趋于稳定的趋势,2.7、5.4、10.1、20.5和39.8 mg/kg组均显著高于对照组(P < 0.05);10.1、20.5和39.8 mg/kg组显著高于其他各组(P < 0.05),但这3组之间并无显著差异(P>0.05)。吉富罗非鱼的饲料系数呈下降趋势,5.4、10.1、20.5和39.8 mg/kg组显著低于对照组和2.7 mg/kg组(P < 0.05)。5.4、20.5 mg/kg组吉富罗非鱼的肝体比显著高于对照组(P < 0.05),其他各组之间无显著差异(P>0.05)。0.3、2.7、5.4、10.1、20.5 mg/kg组之间吉富罗非鱼的肥满度无显著差异(P>0.05);39.8 mg/kg组肥满度最高,显著高于2.7和5.4 mg/kg组(P < 0.05)。各组之间吉富罗非鱼的脏体比无显著差异(P>0.05)。
|
|
表 2 饲料中维生素B6含量对吉富罗非鱼生长性能的影响 Table 2 Effects of dietary vitamin B6 content on growth performance of GIFT |
由图 1可见,通过折线回归分析得知,吉富罗非鱼获得最大增重率时,对饲料中维生素B6的需要量为9.22 mg/kg。
|
图 1 吉富罗非鱼增重率与饲料中维生素B6含量的折线回归关系 Figure 1 Broken-line analysis of relationship between dietary vitamin B6 content and weight gain rate of GIFT |
由表 3可知,2.7、5.4、10.1、20.5和39.8 mg/kg组全鱼粗蛋白质和粗灰分含量显著高于对照组(P < 0.05),而2.7、5.4、10.1、20.5和39.8 mg/kg组之间无显著差异(P>0.05)。2.7 mg/kg组的全鱼水分含量最低,显著低于对照组和10.1、20.5 mg/kg组(P < 0.05)。全鱼的粗脂肪含量以10.1 mg/kg组最低,显著低于除了20.5 mg/kg组以外的其余各组(P < 0.05)。各组肌肉的水分和粗脂肪含量无显著差异(P>0.05),但5.4、10.1和20.5 mg/kg组的肌肉粗蛋白质含量显著高于对照组(P < 0.05)。
|
|
表 3 饲料维生素B6含量对吉富罗非全鱼和肌肉营养组成的影响 Table 3 Effects of dietary vitamin B6 content on nutritional composition in whole body and muscle of GIFT |
由表 4可知,随着饲料中维生素B6含量的增加,血清碱性磷酸酶活性和尿素氮含量呈上升趋势,其中,20.5和39.8 mg/kg组血清碱性磷酸酶活性显著高于对照组(P < 0.05),这2组之间无显著差异(P>0.05);10.1、39.8 mg/kg组血清尿素氮含量显著高于对照组(P < 0.05),其他各组之间无显著差异(P>0.05)。各组之间血清总蛋白、葡萄糖含量无显著差异(P>0.05)。各组之间肝脏谷草转氨酶活性无显著差异(P>0.05)。10.1、20.5和39.8 mg/kg组肝脏谷丙转氨酶活性显著高于对照组和2.7、5.4 mg/kg组(P < 0.05),5.4 mg/kg组显著高于对照组和2.7 mg/kg组(P < 0.05)。
|
|
表 4 饲料中维生素B6含量对吉富罗非鱼血清和肝脏生化指标的影响 Table 4 Effects of dietary vitamin B6 content on serum and liver biochemical indices of GIFT |
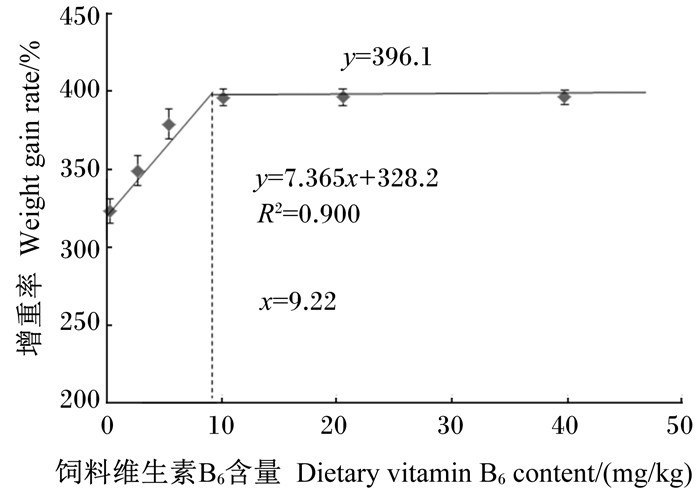
由图 2可见,以肝脏谷丙转氨酶活性为评价指标时,通过折线回归分析得到吉富罗非鱼对饲料中维生素B6的需要量为10.11 mg/kg。
|
图 2 吉富罗非鱼肝脏谷丙转氨酶活性与饲料中维生素B6含量的折线回归关系 Figure 2 Broken-line analysis of relationship between dietary vitamin B6 content and liver ALT activity of GIFT |
维生素B6在动物体内以辅酶或辅基的形式参与神经递质、糖原、血红素等的合成与代谢反应,且主要参与和氨基酸代谢相关的反应,因此缺乏维生素B6时会影响水产动物的正常生长及其体内一系列生理生化反应,最终出现缺乏症。异育银鲫缺乏维生素B6会出现厌食、萎靡不振、狂游以及死亡率增高等症状[8]。点带石斑鱼(Epinephelus coioides)缺乏维生素B6则出现食欲不振、存活率低、惊厥、螺旋状游泳等缺乏症[14]。奥尼罗非鱼摄食缺乏维生素B6的饲料3周后出现厌食和运动失调的症状,死亡率上升,并且死亡的鱼出现水肿[10]。本试验对照组的鱼除了生长缓慢以外,未观察到其他明显的缺乏症。这可能是因为试验鱼初始体重为50 g左右,在其生长的前期阶段体内已积累了一定量的维生素B6,因此在养殖周期内未出现在幼鱼阶段易观察到的缺乏症;另外一个原因是养殖试验主要在网箱中进行,水环境中的微生物可能利于吉富罗非鱼合成部分维生素B6。吉富罗非鱼的增重率随着饲料中维生素B6含量的增加而升高,直到10.1 mg/kg后趋于稳定,说明维生素B6对吉富罗非鱼的生长是必需的,这种变化趋势在奥尼罗非鱼[10]和草虾(Penaeus monodon)[15]中也观察到,说明维生素B6在一定范围内可以满足养殖动物的生长,但过量时并未用于生长,可能用于其他生理活动。
脏体比、肝体比和肥满度反映了机体的营养状况。异育银鲫摄食未添加维生素B6的饲料后,肝体比显著低于其他维生素B6添加组[8]。本试验中,随着饲料中维生素B6含量的升高,肝体比呈上升趋势,肥满度也在39.8 mg/kg组达到最高。虽然对照组的吉富罗非鱼未出现其他肉眼可见的缺乏症,但肝体比的降低说明维生素B6不足可能造成了营养不良,对吉富罗非鱼的生理造成了不良影响。
3.2 饲料中维生素B6含量对吉富罗非鱼全鱼和肌肉营养组成的影响本试验中维生素B6添加组的全鱼粗蛋白质含量显著高于对照组,肌肉粗蛋白质含量也呈升高趋势,说明维生素B6促进了蛋白质的利用与合成。以往研究表明,摄食添加维生素B6饲料的异育银鲫蛋白质含量高于对照组[8],对红罗非鱼的研究也有相似结果[11]。维生素B6的辅酶形式包括磷酸吡哆醛和磷酸吡哆胺,作为辅酶参与氨基酸代谢反应,包括转氨作用、去氨作用和脱硫作用,对氨基酸的吸收与合成是必需的,有利于机体蛋白质的合成[16]。维生素B6作为辅酶还参与不饱和脂肪酸的代谢。大鼠缺乏维生素B6时,肝脏微粒体△6去饱和酶活性降低,必需脂肪酸代谢受阻,代谢起始物蓄积会增多[17]。本试验中,饲料中10.1 mg/kg的维生素B6可以降低罗非鱼全鱼粗脂肪含量,这与对乌醴(Channa argus)的研究结果[18]一致。在草鱼(Ctenopharyngodon idella)研究中也发现维生素B6有助于脂肪的代谢,避免在体组织沉积[19]。
3.3 饲料中维生素B6含量对吉富罗非鱼血清和肝脏生化指标的影响转氨酶是催化氨基转移的一类酶,参与氨基酸的分解和合成,在机体的生长代谢中发挥重要作用,尤以谷草转氨酶和谷丙转氨酶更为重要。维生素B6是转氨酶的辅酶,同时也与蛋白质代谢密切相关,因此会影响转氨酶的活性。例如,维生素B6能显著提高皱纹盘鲍(Haliotis discus hannai Ino )内脏团和肌肉中谷草转氨酶和谷丙转氨酶的活性[20];草虾肝脏谷草转氨酶活性随着饲料维生素B6含量的升高呈先升高后下降的趋势[15]。本研究中,随着饲料中维生素B6含量的升高,肝脏谷丙转氨酶活性显著上升,在维生素B6含量达到10.1 mg/kg后趋于稳定。肝脏谷草转氨酶活性呈上升趋势未出现显著差异,血清总蛋白含量也有相同趋势。维生素B6虽能影响转氨酶的活性,调节蛋白质代谢,但可能由于本试验的养殖周期不够长,因此各组间未出现显著差异;也可能氨基酸代谢增强后,通过血液循环进入到组织中的氨基酸含量增多,主要影响全鱼和肌肉蛋白质含量,因而血清总蛋白含量并未显著上升。
血清尿素氮是非蛋白质类含氮物,反映了鱼体内蛋白质的代谢状况。本试验中随着饲料中维生素B6含量的升高,罗非鱼血清尿素氮含量上升,说明维生素B6影响了鱼体的蛋白质代谢。但也有研究认为尿素氮含量增加表明蛋白质代谢负担加重[21],这也提示饲料中维生素B6含量并非越高越好,含量过高可能会加重鱼体的代谢负担。关于维生素B6对碱性磷酸酶活性影响的相关报道比较少,本试验中,血清碱性磷酸酶升高应该主要还是受蛋白质代谢的影响。碱性磷酸酶是一种磷酸单脂酶,是生物体内与蛋白质有关的代谢调控酶,同时也是溶酶体标志性酶,可以评价动物的免疫功能。血清碱性磷酸酶活性的升高提示着维生素B6可能增强了鱼体的免疫功能,但要结合其他免疫指标才能客观评价,这还需要进一步研究。
3.4 吉富罗非鱼对饲料中维生素B6的需要量本试验利用折线回归分析得出吉富罗非鱼获得最大增重率时对饲料中维生素B6的需要量为9.22 mg/kg,这一结果要高于虹鳟的2 mg/kg[5],斑点叉尾
Cowey[24]认为评价养殖鱼类营养素的需要量可以参考一些生化指标,如某些特定的酶活性。由于许多维生素自身或者以改良的形式作为辅酶发挥生理功能,测定一些组织的酶活性通常被用于补充评价养殖动物对维生素的需要量。谷丙转氨酶主要存在于肝细胞浆内,参与氨基酸的分解和合成,并且需要磷酸吡哆醛作为辅酶,因此肝脏谷丙转氨酶活性常被用来评价鱼类体内维生素B6状态。本试验中以肝脏谷丙转氨酶活性为评价指标时,吉富罗非鱼对饲料中维生素B6的需要量为10.11 mg/kg,这要略高于以增重率为评价指标得出的9.22 mg/kg。在对奥尼罗非鱼的研究中发现,在饲料蛋白质水平为28%时,以生长为评价指标时,初始体重为(0.73±0.01) g的奥尼罗非鱼幼鱼对饲料中维生素B6需要量为1.7 mg/kg;以肝脏谷丙转氨酶活性为评价指标时,对饲料中维生素B6的需要量为9.5 mg/kg;而当饲料蛋白质水平为36%时,这2个需要量结果分别为16.5和15.0 mg/kg[10]。这主要是由于维生素B6与氨基酸代谢密切相关,所以饲料蛋白质含量会影响维生素B6的需要量。关于不同品系罗非鱼对维生素B6需要量是否存在差异,应该在相同试验条件下,选取初始体重相当的鱼,并投喂相同饲料,然后进行比较分析。
4 结论综合以上结果,以增重率和肝脏谷丙转氨酶活性为评价指标,通过折线回归分析得到初始体重为(56.3±1.8) g的吉富罗非鱼对饲料中维生素B6的需要量分别为9.22和10.11 mg/kg。
| [1] |
MURAI T, ANDREWS J W. Pantothenic acid requirements of channel catfish fingerlings[J]. Journal of Nutrition, 1979, 109(7): 1140-1142. DOI:10.1093/jn/109.7.1140 |
| [2] |
HALVER J E. The vitamins[M]//HALVER J E. Fish Nutrition. New York: Academic Press, 1972: 29-103.
|
| [3] |
ANDREWS J W, MURAI T. Pyridoxine requirements of channel catfish[J]. Journal of Nutrition, 1979, 109(4): 533-537. DOI:10.1093/jn/109.4.533 |
| [4] |
LALL S P, WEERAKOON D E M. Vitamin B6 requirement of Atlantic salmon (Salmo salar)[J]. FASEB Journal, 1990, 4: 3749. |
| [5] |
WOODWARD B. Dietary vitamin B6 requirement of young rainbow trout (Oncorhynchus mykiss)[J]. FASEB Journal, 1990, 4: 3748. |
| [6] |
MOHAMED J S. Dietary pyridoxine requirement of the Indian catfish, Heteropneustes fossilis[J]. Aquaculture, 2001, 194(3/4): 327-335. |
| [7] |
HE W, ZHOU X Q, FENG L, et al. Dietary pyridoxine requirement of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. Aquaculture Nutrition, 2009, 15(4): 402-408. DOI:10.1111/anu.2009.15.issue-4 |
| [8] |
王锦林, 朱晓鸣, 雷武, 等. 异育银鲫幼鱼对饲料中维生素B6需求量的研究[J]. 水生生物学报, 2011, 35(1): 98-104. |
| [9] |
ZEHRA S, KHAN M A. Dietary thiamin and pyridoxine requirements of fingerling Indian major carp, Cirrhinus mrigala (Hamilton)[J]. Aquaculture Research, 2017, 48(9): 4945-4957. DOI:10.1111/are.2017.48.issue-9 |
| [10] |
SHIAU S Y, HSIEH H L. Vitamin B6 requirements of tilapia Oreochromis niloticus×O. aureus fed two dietary protein concentrations[J]. Fisheries Science, 1997, 63(6): 1002-1007. DOI:10.2331/fishsci.63.1002 |
| [11] |
LIM C, LEAMASTER B R, BROCK J R. Pyridoxine requirement of fingerling red hybrid tilapia growth in seawater[J]. Journal of Applied Aquaculture, 1995, 5(2): 49-60. DOI:10.1300/J028v05n02_05 |
| [12] |
Association of Official Analytical Chemists (AOAC). Official methods of analysis of AOAC International[S]. 17th ed. Gaithersburg, MD: AOAC International, 2000.
|
| [13] |
ROBBINS K R, SAXTON A M, SOUTHERN L L. Estimation of nutrient requirements using broken-line regression analysis[J]. Journal of Animal Science, 2006, 84(13S): E155-E165. |
| [14] |
HUANG J W, TIAN L X, DU Z Y, et al. Pyridoxine deficiency of grouper, Epinephelus coioides:physiological and biochemical alteration[J]. Fish Physiology and Biochemistry, 2005, 31(4): 331-337. DOI:10.1007/s10695-005-2832-2 |
| [15] |
SHIAU S Y, WU M H. Dietary vitamin B6 requirement of grass shrimp, Penaeus monodon[J]. Aquaculture, 2003, 225(1/2/3/4): 397-404. |
| [16] |
GIRI I N A, TESHIMA S, KANAZAWA A, et al. Effects of dietary pyridoxine and protein levels on growth, vitamin B6 content, and free amino acid profile of juvenile Penaeus japonicas[J]. Aquaculture, 1997, 157(3/4): 263-275. |
| [17] |
黄龙全, 张剑韵. 缺乏VB6对大鼠必需脂肪酸代谢的影响[J]. 食品科学, 2006, 27(7): 228-230. |
| [18] |
王桂芹, 李子平, 闫先春, 等. 饲料蛋白质与维生素B6对乌鳢生长和体组成的影响[J]. 上海交通大学学报(农业科学版), 2010, 28(2): 113-118. |
| [19] |
黄世蕉, 沈竑. 维生素B6对草鱼脂肪代谢的影响[J]. 水生生物学报, 1992, 16(4): 313-321. |
| [20] |
冯秀妮, 张文兵, 麦康森, 等. 饲料中维生素B6对皱纹盘鲍幼鲍蛋白质代谢的影响[J]. 海洋科学, 2006, 30(10): 52-60. DOI:10.3969/j.issn.1000-3096.2006.10.012 |
| [21] |
李彬, 梁旭方, 刘立维, 等. 饲料蛋白水平对大规格草鱼生长、饲料利用和氮代谢相关酶活性的影响[J]. 水生生物学报, 2014, 38(2): 233-240. DOI:10.7541/2014.35 |
| [22] |
SHIMENO S. Yellowtail, Seriola quinqueradiata[M]//WILSON R P. Handbook of nutrient requirements of finfish. Boca Raton, Florida: Chemical Rubber Company Press, 1991: 181-191.
|
| [23] |
强俊, 杨弘, 何杰, 等. 3种品系尼罗罗非鱼生长及高密度胁迫后生理响应变化的比较[J]. 中国水产科学, 2014, 21(1): 142-152. |
| [24] |
COWEY C B. Use of synthetic diets and biochemical criteria in the assessment of nutrient requirements of fish[J]. Journal of the Fisheries Research Board of Canada, 1976, 33(4): 1040-1045. DOI:10.1139/f76-132 |




