2. 内蒙古农牧业科学院动物营养与饲料研究所, 呼和浩特 010031
2. Research Institute of Animal Nutrition, Inner Mongolia Academy of Animal Sciences, Hohhot 010031, China
反刍动物瘤胃上皮为多层鳞片状(stratified squamous epithelium,SSE),从黏膜层到浆膜层依次为角质层(stratum corneum,SC)、颗粒层(stratum granulosum,SG)、棘突层(stratum spinosum,SS)和基底层(stratum basale,SB)[1],颗粒层细胞间存在紧密连接(tight junction,TJ),紧密连接是维持黏膜屏障的重要结构[2]。瘤胃上皮不仅为瘤胃微生物附着、生长提供有利环境,也是动物机体营养物质消化吸收、转运代谢的主要场所。在集约化养殖的今天,反刍动物极易发生亚急性瘤胃酸中毒(SARA),发病后瘤胃渗透压升高、瘤胃内产生大量的有害物质或不稳定环境因素[脂多糖(lipopolysaccharides,LPS)[1]、组胺(histamine,HIS)[2]、高pH[3]等],这些有害物质被血液吸收,损伤紧密连接结构,直接导致上皮屏障功能被破坏,从而干扰了瘤胃上皮对营养物质的吸收,及对毒害物质的抵御功能[4]。可见,紧密连接结构的完整是保证瘤胃健康的前提。以往对紧密连接的研究多集中在医学领域。有报道显示人为的烧伤小鼠后,烧伤部位上皮的紧密连接功能失调,细胞间紧密连接受损,形成细胞间隙,破坏上皮通透性[2]。也有研究报道称,肠道上皮细胞紧密连接蛋白zonula occludens-1(ZO-1)、Occludin、Claudin等能与骨架肌动蛋白相互作用,可能在肠上皮屏障功能损害的发生中起到重要作用[5]。从20世纪50年代初Ussing等[6]提出将尤斯灌流仪器(Ussing chamber)运用到上皮组织离子转运开始,相继有学者将该技术拓展到反刍动物瘤胃上皮通透性的研究中[7]。瘤胃上皮通透性的改变可准确反映瘤胃上皮的损伤程度,其通透性增加表明上皮完整性被破坏,屏障功能受损。Klenvenhusen等[8]采用Ussing chamber系统研究得出高精粗比饲粮下山羊瘤胃上皮的通透性显著增加。随后,杨淑青[11]通过递增饲粮非纤维性碳水化合物/中性洗涤纤维(NFC/NDF)诱导奶山羊发生SARA,结果测得瘤胃上皮紧密连接蛋白Claudin-1、ZO-1和Occludin mRNA表达量显著降低;同时该研究还采用Ussing chamber测定瘤胃上皮的通透性,发现SARA显著升高了瘤胃上皮的短路电流(short-circuit current,Isc)、组织导电性(tissue conductance,Gt),表明瘤胃上皮通透性增加。程萌[12]在此基础上,增大了NFC/NDF范围进一步诱导SARA,结果SARA组瘤胃上皮紧密连接蛋白Claudin-4 mRNA表达量显著升高。间隙连接(gap junction,GJ)蛋白Connexin-43、桥粒芯蛋白Desmoglein-1 mRNA表达量显著降低,同时,该团队不仅测得SARA显著降低瘤胃内pH,还增加了瘤胃内和血浆中的异常代谢产物(LPS、HIS等)含量。以上研究表明,反刍动物发生SARA后,瘤胃内环境紊乱,进一步降低了瘤胃内pH,同时,LPS、HIS都表现出显著增加[9-10],瘤胃上皮细胞紧密连接蛋白mRNA的表达量改变,使瘤胃上皮细胞间隙向着增大的方向改变,破坏了瘤胃上皮的完整性增加通透性。而这些异常代谢产物究竟是如何影响瘤胃上皮通透性的,是单因素pH,抑或是多因素pH与LPS或HIS共同作用的结果,有待深入研究。为此,本试验采用Ussing chamber在体外研究pH与LPS或HIS对奶山羊瘤胃上皮紧密连接蛋白mRNA表达量的交互影响,从分子层面揭示pH与LPS或HIS对影响奶山羊瘤胃上皮通透性的机制。
1 材料与方法 1.1 试验动物与饲养管理选用8只体况良好、体重(43.58±2.77) kg、泌乳量相近的经产萨能奶山羊为试验动物,饲养在内蒙古农牧业科学院动物试验基地。试验动物采取单笼饲养,每天06:00和18:00等量饲喂。自由饮水,试验期30 d。
1.2 基础饲粮基础饲粮参照NRC(2007)[11],并结合国内《奶山羊饲养标准》[12]配制,为以玉米、豆粕、麦麸、苜蓿、青干草为主要原料设计的NFC/NDF为1.40的饲粮。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
本试验采用3×3双因素试验设计。向Ussing chamber(6通道)黏膜侧添加配制好的不同处理的缓冲液。试验1:因子1为pH,设7.4(对照)、5.5、5.2 3个水平,因子2为LPS浓度,分别为0、30、60 kEU/mL;试验2:因子1为pH,设7.4(对照)、5.5、5.2 3个水平,因子2为HIS浓度,分别为0、0.5、10.0 ng/mL。试验共15个组(2项试验pH为7.4、未添加LPS或HIS的组共用),每组3个重复,每屠宰1只羊得到的瘤胃上皮用于2组试验。Ussing chamber培养时长为80 min(前20 min为平衡期)。pH及HIS和LPS浓度的设置是根据本课题组前期研究结果与国内外相关研究结论[3, 12, 13-14]。
1.4 主要仪器与试剂主要仪器:Ussing chamber系统(EM-CSYS-4,PI公司,美国)、电泳仪(BG-Power600,北京百晶生物技术有限公司)、高速冷冻离心机(1730R,耐士科技有限公司)、PCR仪[毅新兴业(北京)科技有限公司]、实时定量PCR仪(Illuminer公司, 美国)、凝胶成像仪(Snap Gene公司,美国)、漩涡振荡器(ST-T256,其林贝尔仪器制造有限公司)、酶标仪(Bio Tek公司,美国)、掌上离心机(CX-200,国华电器有限公司)、酶标仪(MultiSkan 3,Thermo公司, 美国)、低温冷冻离心机(Fresco,Thermo公司, 美国)、电泳槽(Mini P-4,北京凯元信瑞仪器有限公司)、电泳仪(Bio-Rad公司, 美国)、电动组织匀浆器(Fluka公司,德国)、湿转电泳槽(北京凯元信瑞仪器有限公司)。
主要试剂:Ussing chamber系统缓冲液、3 mol/L KCl溶液、琼脂、KH2PO4-NaHPO4缓冲液、H2O2溶液、3, 3′, 5, 5′-四甲基联苯胺溶液(TMB)、LPS、HIS、乙酸、丙酸、丁酸、乳酸。
1.5 试验方法 1.5.1 瘤胃上皮采集与处理首先安装好Ussing chamber半室和夹片,按顺序分别安装电压电极和电流电极。之后在Ussing chamber系统每个半室中加入5 mL预热的缓冲液,通入95% O2和5% CO2混合气体,点开软件运行系统,平衡大约10 min并且待电脑显示曲线稳定后,进行试验动物屠宰,打开腹腔立即采集新鲜的瘤胃腹囊上皮组织2 cm×3 cm,用预热好的缓冲液反复冲洗干净,将瘤胃上皮样品迅速剥离肌层后剪成1 cm×1 cm,将固定环夹片取下后固定样品(黏膜侧朝左),插入到Ussing chamber半室中央。分别在浆膜侧半室加入5 mL缓冲液,黏膜侧加入配制好的不同组的培养液5 mL,每组3个重复。瘤胃上皮经过80 min的培养后,使用消毒的镊子夹入无菌无酶的冻存管中,立刻放于液氮中,随后转入-80 ℃冰箱冻存待测瘤胃上皮紧密连接蛋白Claudin-1、Claudin-4、Claudin-7、Occludin、ZO-1 mRNA表达量。
1.5.2 缓冲液及不同培养液的配制Ussing chamber缓冲液的配制参照Klenvenhusen等[10]和程萌[12],具体成分及浓度如下:NaCl 80.00 mmol/L,KCl 5.00 mmol/L,NaH2PO4·H2O 0.40 mmol/L,Na2HPO4·2H2O 2.40 mmol/L,C3H5NaO210.00 mmol/L,C2H3NaO2·3H2O 25.00 mmol/L,C4H7NaO2 5.00 mmol/L,MgCl2·6H2O 1.20 mmol/L,CaCl2·2H2O 1.20 mmol/L,NaHCO3 25.00 mmol/L。将配制好的缓冲液置于4 ℃保存。
调整培养液pH所用试剂添加量见表 2。按表中添加量在缓冲液中添加,配制不同pH的缓冲液。按照试验设计的添加量添加LPS或HIS。
|
|
表 2 调整培养液pH所用试剂添加量 Table 2 Supplemental levels of agents adjusting pH of culture medium |
Ussing chamber电极套管结构如图 1所示。先称取2 g琼脂放于50 mL离心管内,加入3 mol/L KCl溶液50 mL,放入100 ℃水浴锅中静止加热直至离心管中液体成透明黏稠状,无气泡后取出。用5 mL注射器吸取适量KCl-琼脂溶液,向电极套管尖部注射0.5~1.0 cm的KCl-琼脂。选出电极套管中KCl-琼脂部分无气泡并且长度适宜的备用,并将制作好的电极套管存放于3 mol/L KCl溶液中。
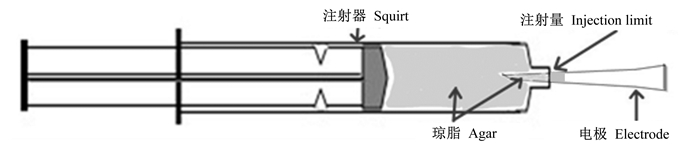
|
图 1 尤斯灌流仪器电极套管结构 Figure 1 Structure ofelectrode casing of Ussing chamber |
取冻存的奶山羊瘤胃上皮组织50~100 mg放入已装满液氮的研钵中研磨成粉末,将粉末移至1.5 mL离心管中。参照RNAprep Pure Tissue Kit说明书提取总RNA,并用酶标仪测总RNA浓度,用1%的琼脂糖凝胶电泳检测总RNA样品质量。将总RNA参照TIANScript RT Kit说明书进行反转录。最后把反转录所得cDNA产物放入冰箱-20 ℃保存备用。
1.6.2 PCR引物设计及合成根据GenBank中相应的cDNA序列,用Primer Premier 5.0软件设计实时定量PCR(RT-PCR)扩增特异性引物,由生工生物工程(上海)股份有限公司合成。引物参数见表 3。
|
|
表 3 RT-PCR引物参数 Table 3 Parameters of primers for RT-PCR |
本试验用SuperReal PreMix Plus (SYBR Green)(天根生化科技公司)进行实时定量PCR扩增。PCR反应体系(20 μL)如下:2×SuperReal PreMix Plus 10.00 μL,正向引物(10 μmol/L)0.60 μL,反向引物(10 μmol/L)0.60 μL,cDNA模板2.00 μL,RNase-free ddH2O 6.80 μL。
经反复试验优化后得到的反应程序如下:1)预变性,95 ℃30 s。2)PCR反应,95 ℃10 s,60 ℃30 s,72 ℃30 s,40个循环。3)熔解曲线分析,95 ℃15 s,60 ℃15 s,95 ℃15 s。在扩增完成后分析各个基因的熔解曲线,来确保RT-PCR产物的专一性,操作重复3次。最后,将β肌动蛋白(β-actin)设为内参使用2-△△Ct法计算基因mRNA的表达量。
1.7 数据统计采用SAS 8.0对所有数据进行分析,采用MIXED程序进行双因素方差分析,差异显著的采用Duncan氏法进行多重比较,混合模型包括主效应LPS、HIS、pH,pH与LPS的交互作用,pH与HIS的交互作用。P<0.05为差异显著判断标准,P>0.05为差异不显著判断标准。
2 结果 2.1 总RNA质量将提取完毕的瘤胃上皮总RNA经过1%琼脂糖凝胶电泳检测,结果如图 2所示,18S和28S条带清晰,经酶标仪检测260 nm吸光度值/280 nm吸光度值(OD260 nm/OD280 nm)在1.8~2.2,没有蛋白质和DNA的污染,总RNA质量完好。
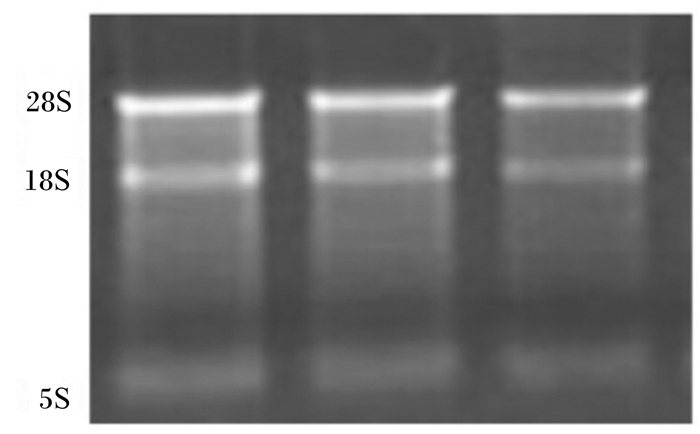
|
图 2 奶山羊瘤胃上皮总RNA电泳图 Figure 2 Electrophotogram of total RNA of rumen epithelium of dairy goats |
β-actin、Claudin-1、Claudin-4、Claudin-7、Occludin与ZO-1的PCR扩增产物分别在158、186、132和89 bp处呈现1条特异性条带,对其进行纯化、克隆和菌液PCR鉴定后,送至生工生物工程(上海)股份有限公司进行测序,将测序所得序列同GenBank中登录号为NM_001009784、XM_005697785.1、HM_117762.1、XM_013972136.1、XM_004016906.1和XM_004018080.1的基因进行对比,同源性为100%。
2.3 pH和LPS对瘤胃上皮紧密连接蛋白基因mRNA表达量的影响如表 4所示,以LPS为主效应时,60 kEU/mL LPS组Claudin-7 mRNA表达量显著高于30 kEU/mL LPS组(P<0.05),这2组均显著低于0 kEU/mL LPS组(P<0.05);60 kEU/mL LPS组ZO-1 mRNA表达量与0、30 kEU/mL LPS组相比显著升高(P<0.05);60 kEU/mL LPS组Occludin mRNA表达量与0、30 kEU/mL LPS组相比,显著降低(P<0.05)。
|
|
表 4 pH和LPS对奶山羊瘤胃上皮紧密连接蛋白mRNA表达量的影响 Table 4 Effects of pH and LPS on mRNA expression levels of TJ proteins in ruminal epithelium of dairy goats |
以pH为主效应时,pH 5.2组Claudin-1、Claudin-7与ZO-1 mRNA表达量显著高于pH 7.4组(P<0.05)。与pH 7.4组相比,pH 5.5组Claudin-7 mRNA表达量显著升高(P<0.05)。
pH与LPS的交互作用对Claudin-1、Claudin-7、ZO-1 mRNA表达量影响显著(P<0.05)。多重比较发现:与pH 7.4×0 kEU/mL LPS组相比,降低pH或添加LPS均显著降低了Claudin-1、Claudin-7 mRNA表达量(P<0.05)。ZO-1 mRNA表达量变化趋势不规律,在pH5.2×60 kEU/mL LPS组最高,显著高于pH 7.4×0 kEU/mL LPS组(P<0.05)。
2.4 pH和HIS对瘤胃上皮紧密连接蛋白mRNA表达量的影响如表 5所示,以HIS为主效应时,0.5 ng/mL HIS组Claudin-1、Claudin-7 mRNA表达量显著低于0、10.0 ng/mL HIS组(P<0.05);10.0 ng/mL HIS组ZO-1 mRNA表达量显著高于0、0.5 ng/mL HIS组(P<0.05),0.5 ng/mL HIS组显著高于0 ng/mL HIS组(P<0.05)。
|
|
表 5 pH和HIS对奶山羊瘤胃上皮紧密连接蛋白mRNA表达量的影响 Table 5 Effects of pH and HIS on mRNA expression levels of TJ proteins in ruminal epithelium of dairy goats |
以pH为主效应时,与pH 7.4组相比,pH 5.2组和pH 5.5组Claudin-1 mRNA表达量均显著降低(P<0.05),pH 5.2组最低(P<0.05);pH 5.2组和pH 5.5组Claudin-7 mRNA表达量显著升高(P<0.05),pH 5.5组最高;pH 5.5组ZO-1 mRNA表达量显著低于pH 5.2组和pH 7.4组(P<0.05),pH 5.2组显著高于pH 5.5组和pH 7.4组(P<0.05)。
pH与HIS的交互作用对Claudin-1、Claudin-7与ZO-1 mRNA表达量有显著影响(P<0.05)。多重比较发现:与pH 7.4×0 ng/mL HIS组相比,降低pH或添加HIS均显著降低了Claudin-1 mRNA表达量(P<0.05),以pH 7.4×10.0 ng/mL HIS组最低。pH 5.5×10.0 ng/mL HIS组Claudin-7 mRNA表达量最低,显著低于pH 7.4×0 ng/mL HIS组(P<0.05)。与pH 7.4×0 ng/mL HIS组相比,降低pH或添加HIS整体上提高了ZO-1 mRNA表达量,以pH 5.2×10.0 ng/mL HIS组最高,显著高于其他各组(P<0.05)。
3 讨论 3.1 pH对瘤胃上皮紧密连接蛋白mRNA表达量的影响瘤胃上皮的细胞连接主要分为紧密连接、桥粒连接(desmosome junction,DJ)、黏着连接(adhesion junction,AJ)和间隙连接,而紧密连接是细胞间最重要的连接方式。瘤胃中的紧密连接位于颗粒层细胞之间,是维持瘤胃黏膜屏障的重要结构基础,是决定细胞间通透性大小的主要因素。紧密连接作为动态的通透性屏障,具有双重功能,不仅能够阻止潜在的有害物质或病原体入侵瘤胃上皮,维持瘤胃上皮的完整性,还可以允许营养物质、离子和水的出入,保证了瘤胃上皮的通透性。紧密连接这种特殊的生理功能在胃肠道黏膜屏障的维护中起着举足轻重的作用。但病理状态下,紧密连接若被破坏,细胞间隙就会增大,细菌与毒素等大分子物质便趁机移位,黏膜的选择性屏障作用丧失。当紧密连接发生变异、减少或缺失时,紧密连接再分配和基因表达就会下调,使上皮细胞受损、萎缩,屏障功能下降,细胞间紧密连接被破坏,进而使上皮细胞通透性增加[15]。但是从分子水平研究影响瘤胃上皮屏障功能的相关机制的报道甚少,有学者提出瘤胃上皮中存在的紧密连接膜内蛋白有Claudin-1、Claudin-4、Claudin-7和Occludin,GJ蛋白有Connexin-43及桥粒芯蛋白Desmoglein-1。采用免疫印迹定位发现Claudin-1、ZO-1和Connexin-43存在于瘤胃黏膜颗粒层,从颗粒层到棘突层和基底层逐渐减少[16]。
瘤胃酸中毒根据pH的大小和持续时间长短分为急性瘤胃酸中毒和SARA。通常认为pH<5.5并超过3h即为SARA,而pH<5.2基本判定为急性酸中毒[20]。pH是瘤胃内一项重要的生理指标,可以反映瘤胃发酵生理。但是对瘤胃发生SARA的临界pH仍然说法不一,有学者提出瘤胃内pH5.5~5.8属于正常生理状态,但是pH 5.0~5.5则属于SARA状态,pH在5.2~5.5属于中度酸中毒[21]。近年来常以pH 5.2作为衡量急性酸中毒的临界值,以pH低于5.5持续3h以上判定为SARA发生的标志。
本试验中pH是参照国内外研究结果设定为7.4、5.5、5.2。由结果看出,随着pH的降低,Claudin-1、Claudin-4 mRNA表达量下调,与王娟[22]研究结果相似。Claudin-7 mRNA在pH 5.5时表达量最低,可能说明pH 5.5时瘤胃上皮紧密连接功能部分受到破坏,所以pH 5.5作为公认的SARA界定标准比较合理,而当pH为5.2时,Claudin-1、Claudin-4 mRNA表达量下调可能说明发生了急性酸中毒。此时对瘤胃上皮紧密连接的破坏程度加深。Occludin随pH降低表现上调趋势,但变化不显著。这与王娟[22]的报道不同,即Occludin mRNA的表达量主要受到pH的影响并且随pH降低而降低。可能是由于培养方式不同所致,Ussing chamber的环境是模拟瘤胃环境,为保证短时间内瘤胃上皮组织不失活。而多数学者是采用培养瘤胃上皮细胞为研究对象[23-24]。
3.2 pH和LPS对瘤胃上皮紧密连接蛋白mRNA表达量的影响研究表明,饲粮NFC/NDF增加后,血浆LPS浓度升高,并引发奶山羊内毒素血症[25]。也有资料显示,高谷物诱导反刍动物发生SARA时往往会伴随血浆或者瘤胃液中LPS浓度的增加[26]。本课题组研究发现,饲粮NFC/NDF由1.40增加到3.23时,血浆中LPS浓度也逐渐增加,由15.76×103 EU/mL显著增加到85.55×103 EU/mL,与前人报道[13]相符。Chin等[27]对小肠上皮细胞研究发现,随着LPS浓度的增加会一氧化氮(NO)的生成增加,减少ZO-1,改变紧密连接蛋白的结构和功能。此外,本课题组前期研究是体外通过Ussing chamber测定pH与HIS或LPS组合后,研究瘤胃上皮的电生理参数的变化,进而得出对于瘤胃上皮通透性,pH与HIS或LPS的交互作用大于单因素pH、HIS或LPS浓度[23]。结合以上试验结果,探索损伤瘤胃上皮紧密连接的分子机制。
本试验结果看出,这些紧密连接蛋白mRNA表达量有很大变化。pH与LPS处理对瘤胃上皮紧密连接蛋白mRNA的表达量的影响有所不同,其中以LPS为主效应时,60 kEU/mL LPS的添加降低了Claudin-7 mRNA表达量,增加了ZO-1 mRNA表达量,降低了Occludin mRNA表达量。以pH为主效应,与pH 7.4相比,pH 5.2显著增加了Claudin-1、Claudin-7、ZO-1 mRNA表达量。pH与LPS的交互作用降低了Claudin-1、Claudin-7 mRNA表达量,且随着pH的降低和LPS浓度的升高而呈现作用增强趋势。
王娟[22]采用体外培养的瘤胃上皮细胞,通过设定培养液不同pH与短链脂肪酸(SCFA)浓度组合处理,发现对瘤胃上皮细胞Occludin mRNA表达量与对照组比无显著差异;SCFA的添加显著下调ZO-1 mRNA表达量。但SCFA的添加和低pH(<6.8)均显著上调Claudin-1和Claudin-4 mRNA表达量。当反刍动物发生SARA后,瘤胃内SCFA浓度增加,进一步降低了瘤胃内pH,可见pH与SCFA能够影响瘤胃上皮细胞紧密连接蛋白的表达。刘军花[20]试验发现,高谷物饲粮显著降低了Claudin-4、Occludin和ZO-1 mRNA表达量。而本研究采用不同浓度的SCFA来配制的3个梯度的pH,在Ussing chamber中培养后测得ZO-1 mRNA表达量随pH降低而先降低后升高。通过以上研究可以看出,在短期内将瘤胃上皮置于不同pH的体外瘤胃模拟环境中,与正常pH相比,降低pH下调了紧密连接蛋白Claudin-1 mRNA表达量,综合来看,且在pH 5.5处理下,对瘤胃上皮通透性的影响最严重。
3.3 pH和HIS对瘤胃上皮紧密连接蛋白mRNA表达量的影响HIS是重要的生物活性物质之一,也是Ⅰ型变态反应的重要介质,参与变态反应、过敏反应、血管收缩和舒张;同时也是炎症反应和免疫损伤的重要介质。当发生SARA时,瘤胃内环境发生紊乱,瘤胃内长期处于低pH状态,组氨酸脱羧形成HIS,异常代谢产物HIS等增多[24],造成瘤胃黏膜损伤,破坏了瘤胃屏障功能。反刍动物瘤胃上皮的屏障功能对维护瘤胃吸收、消化和代谢功能非常关键,上皮细胞可以通过细胞间隙的紧密连接蛋白调控小分子电中性溶质和离子被动扩散。因此,紧密连接的健康是实现屏障功能所必需的[28]。程萌[12]的研究表明,当山羊瘤胃发生SARA时,其通透性发生改变,与对照组相比,SARA组瘤胃上皮紧密连接Claudin-4 mRNA的表达量显著升高,且比对照组升高了38.61%。本研究对山羊瘤胃上皮紧密连接蛋白Claudin-1、Claudin-4、Claudin-7、Occludin和ZO-1 mRNA表达量进行研究。加入HIS后,瘤胃上皮紧密连接蛋白Claudin-1 mRNA表达量下调,而随HIS浓度增加,Claudin-4 mRNA表达量先升高后降低。pH 5.5时的Claudin-1 mRNA表达量与pH 5.2时差异不显著。Claudin-7 mRNA表达量有降低趋势,且在pH 5.5×10.0 ng/mL HIS处显著低于其他组。各组Occludin mRNA表达量无显著差异。这与杨淑青[11]的研究不完全一致,杨淑青[11]指出发生SARA后紧密连接蛋白Occludin、ZO-1 mRNA表达量显著降低,分别下降了51.3%和51.8%,这一研究的方法是诱导奶山羊发生SARA后屠宰,采集新鲜的瘤胃上皮样本测定紧密连接蛋白mRNA表达量,而本研究是在Ussing chamber内短期模拟诱导,这可能是造成差异的原因。
郭鹏等[29]指出血液中HIS含量随饲粮NFC/NDF增加而表现增加趋势。Aschenbach等[4]调查显示,HIS诱导细胞凋亡,或增加细胞脱落,或干涉细胞核分裂和细胞成熟,这些变化意味着在SARA过程中异常代谢产物HIS能干扰上皮细胞的再生,进而造成细胞损伤,引发炎症反应。而在本试验结果看出,pH与HIS交互作用对瘤胃上皮紧密连接蛋白mRNA的表达量的影响有所不同。降低pH或添加HIS均能显著降低瘤胃上皮Claudin-1、Claudin-7 mRNA表达量。以HIS为主效应,添加10.0 ng/mL HIS的ZO-1 mRNA表达量显著高于添加0.5 ng/mL HIS,而这2者均显著高于不添加HIS;以pH为主效应,与pH 7.4相比,pH 5.5和pH 5.2时的Claudin-1 mRNA表达量均显著降低,并且在pH 5.2时达最低。Claudin-7 mRNA表达量有降低趋势。pH与HIS的交互作用对Claudin-1、Claudin-7与ZO-1 mRNA表达量有显著影响。pH 5.5×0.5 ng/mL HIS组Claudin-1 mRNA表达量最低,但与pH 5.2×0.5 ng/mL HIS组差异不显著,pH 7.4×10.0 ng/mL HIS组Claudin-7 mRNA显著低于pH 7.4×0 ng/mL HIS组,但与pH 5.5×10.0 ng/mL HIS组差异不显著。与pH 7.4×0 ng/mL HIS组相比,降低pH或添加HIS整体上提高了ZO-1 mRNA表达量,且pH 5.2×10.0 ng/mL HIS组时显著高于其他组。以上研究可见,瘤胃内pH与HIS的交互影响下,显著降低了部分紧密连接蛋白基因mRNA表达量,破坏瘤胃上皮结构与功能,是引起SARA的主要诱因之一。
4 结论SARA发生后,pH与LPS或HIS交互作用于瘤胃上皮,降低瘤胃上皮紧密连接蛋白mRNA表达量,进而增大瘤胃上皮黏膜通透性。
| [1] |
HARHA N S, ANTONETTI D A. Regulation of tight junctions and loss of barrier function in pathophysiology[J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(7): 1206-1237. |
| [2] |
STEELE M A, CROOM J, KAHLER M, et al. Bovine rumen epithelium undergoes rapid structural adaptation during grain-induced subacute ruminal acidosis[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2011, 300(6): R1515-R1523. DOI:10.1152/ajpregu.00120.2010 |
| [3] |
EMMANUEL D G V, MADSEN K L, CHURCHILL T A, et al. Acidosis and lipopolysaccharide from Escherichia coli B:055 cause hyperpermeability of rumen and colon tissues[J]. Journal of Dairy Science, 2007, 90(12): 5552-5557. |
| [4] |
ASCHENBACH J R, FÜRLL B, GÄBEL G. Histamine affects growth of sheep ruminal epithelial cells kept in primary culture[J]. Zentralblatt Fur Veterinarmdizin Reihe A, 1998, 45(6/7): 411-416. |
| [5] |
PENNER G B, TANIGUCHI M, GUAN L L, et al. Effect of dietary forage to concentrate ratio on volatile fatty acid absorption and the expression of genes related to volatile fatty acid absorption and metabolism in ruminal tissue[J]. Journal of Dairy Science, 2009, 92(6): 2767-2781. |
| [6] |
BARTOLOVIC S, GRACNER G G, BEDRICA L, et al. Subacute ruminal acidosis in dairy cows[J]. The Veterinal Journal, 2012(1): 32-38. |
| [7] |
何雯. 缺氧对LIMK1介导的cofilin磷酸化的影响及其在肠上皮屏障功能损害中的作用研究[D]. 硕士学位论文. 重庆: 第三军医大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-90031-1015632042.htm
|
| [8] |
USSING H H, ZERAHN K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin[J]. Acta physiologica Scandinavica, 1951, 23(2/3): 110-127. |
| [9] |
杨淑青, 胡红莲, 欧阳效晴, 等. 瘤胃上皮机械屏障的评定方法[J]. 中国畜牧兽医, 2014, 41(1): 136-140. |
| [10] |
KLENVENHUSEN F, HOLLMANN M, PODSTATZKY-LICHTENSTEIN L, et al. Feeding barley grain-rich diets altered electrophysiological properties and permeability of the ruminal wall in a goat model[J]. Journal of Dairy Science, 2013, 96(4): 2293-2302. |
| [11] |
杨淑青. 亚急性瘤胃酸中毒对奶山羊瘤胃上皮屏障功能影响机制的研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10129-1014375617.htm
|
| [12] |
程萌. 亚急性瘤胃酸中毒对奶山羊瘤胃上皮通透性及细胞连接蛋白表达的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016249858.htm
|
| [13] |
孙燕勇, 胡红莲, 高民, 等. 亚急性瘤胃酸中毒对奶山羊血浆异常代谢产物及生化指标的影响[J]. 动物营养学报, 2017, 29(3): 1046-1055. |
| [14] |
章森. 不同日粮模式对奶牛血浆内毒素、代谢产物和激素含量的影响[D]. 硕士学位论文. 重庆: 西南大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10635-1013268430.htm
|
| [15] |
NRC. Nutrient requirements of goats: angora, dairy, and meat goats in temperate and tropical countries[S]. Washington, D. C. : National Academy Press, 1989.
|
| [16] |
金公亮. 奶山羊饲养标准[J]. 畜牧兽医杂志, 1989, 8(2): 7-12. |
| [17] |
KHAFIPOUR E, KRAUSE D O, PLAIZIER J C. Alfalfa pellet-induced subacute ruminal acidosis in dairy cows increases bacterial endotoxin in the rumen without causing inflammation[J]. Journal of Dairy Science, 2009, 92(4): 1712-1724. |
| [18] |
胡红莲, 卢德勋, 刘大程, 等. 日粮不同NFC/NDF比对奶山羊瘤胃pH、挥发性脂肪酸及乳酸含量的影响[J]. 动物营养学报, 2010, 22(3): 595-601. |
| [19] |
ASCHENBACH JR, GABEL G. Effect and absorption of histamine in sheep rumen:significance of acidotic epithelial damage[J]. Journal of Animal Science, 2000, 78(2): 464-470. |
| [20] |
刘军花. 亚急性瘤胃酸中毒对山羊瘤胃上皮屏障功能的影响及其机制[D]. 博士学位论文. 南京: 南京农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016040143.htm
|
| [21] |
KOERS W C, BRITTON R, KLOPFENSTEIN T J, et al. Ruminal histamine, lactate and animal performance[J]. Journal of Animal Science, 1976, 43(3): 684-691. |
| [22] |
王娟. 不同精粗比日粮对奶牛和山羊瘤胃上皮屏障的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013283027.htm
|
| [23] |
孙燕勇. 亚急性瘤胃酸中毒对奶山羊瘤胃上皮通透性的影响及其机制研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2017.
|
| [24] |
胡红莲. 奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10129-2008131944.htm
|
| [25] |
赵培厅. 日粮不同NFC/NDF比对奶山羊瘤胃发酵功能和微生物区系变化的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10129-1011178625.htm
|
| [26] |
GOZHO G N, KRAUSE D O, PLAIZIER J C. Ruminal lipopolysaccharide concentration and inflammatory response during grain-induced subacute ruminal acidosis in dairy cows[J]. Journal of Dairy Science, 2007, 90(2): 856-866. |
| [27] |
CHIN A C, FLYNN A N, FEDWICH J P, et al. The role of caspase-3 in lipopolysaccharide-mediated disruption of intestinal epithelial tight junctions[J]. Canadian Journal of Physiology and Pharmacology, 2006, 84(10): 1043-1050. DOI:10.1139/y06-056 |
| [28] |
RADOSTITS O M, BLOOD D C, GAY C C. Diseases of the alimentary tract-Ⅱ[M]//RADOSTITS O M, BLOOD D C, GAY C C. Veterinary medicine: a textbook of the diseases of cattle, sheep, pigs, goats and horses. 8th ed. London: Baillière Tindall, 1994.
|
| [29] |
郭鹏, 刘大程, 赵培厅, 等. 不同NFC/NDF比日粮对奶山羊瘤胃细菌及瘤胃和血浆中内毒素及组胺含量的影响[J]. 畜牧兽医学报, 2015, 46(1): 96-103. |




