黄曲霉毒素(aflatoxin,AF)是一类化学结构类似的化合物,主要由黄曲霉(Aspergillus flavus)、寄生曲霉(Aspergillus parasiticus)等真菌生物合成的次级代谢产物组成[1-4],属剧毒物质,具有强烈的致畸、致癌、致突变作用[5-6]。黄曲霉毒素分解酶(aflatoxin detoxification enzyme,ADTZ)是特异性分解黄曲霉毒素的活性物质,近年来微生物酶降解黄曲霉毒素的方法被广泛关注,但天然ADTZ由于含量低、活性差,很难从自然界中大量分离[7]。利用分子生物学和基因工程技术将ADTZ基因克隆并在不同宿主中进行表达,可以提高ADTZ的产量和活性,对减轻黄曲霉毒素污染状况有巨大的开发应用价值。ADTZ基因来源于真菌假密环菌(Armillariellatabescens),表达产物为假密环菌的胞内酶[8],具有降解天然黄曲霉毒素的能力,为一个完整的基因序列,在大肠杆菌和酵母菌中均能表达出活性特异蛋白[9-11],但在动物益生菌枯草芽孢杆菌中的表达并无报道[12]。枯草芽孢杆菌表达系统是原核生物中重要的表达系统,具备完整的分泌表达机制,被广泛应用于工业发酵领域,是多种酶制剂的主要生产菌种和表达宿主[13]。本研究通过前期构建的枯草芽孢杆菌整合表达载体和克隆的ADTZ基因,构建ADTZ基因枯草芽孢杆菌整合表达载体,并转化到枯草芽孢杆菌基因组中进行整合表达,并通过发酵试验验证其对黄曲霉毒素的降解能力,旨在为后续的霉菌毒素降解酶的开发和饲料的脱毒研究积累经验和数据。
1 材料与方法 1.1 试验材料 1.1.1 质粒、菌种和引物本试验所用生物材料及特征如表 1所示,其中引物由上海生工生物科技有限公司合成。
|
|
表 1 本试验所用生物材料及特征 Table 1 Biological materials and characteristics used in this experiment |
预染蛋白Marker(MP203)、细菌基因组DNA提取试剂盒(DP302)、1 kb DNA Ladder(MD111),购于北京天根生化科技有限公司;非预染预染蛋白marker(SM0431)、DNA marker(SM0331),购于赛默飞世尔科技(中国)有限公司;限制性内切酶SacⅡ、BamHⅠ,购于美国Promega公司;溶菌酶(L8120),购于北京所莱宝(Solarbio)生物科技有限公司;黄曲霉毒素B1(AFB1)酶联免疫吸附测定(ELISA)检测试剂盒,购于北京华安麦科生物技术有限公司;L-色氨酸(L-Trp)、水解酪蛋白、琼脂糖等试剂,购于洛阳博冠商贸有限公司。
1.2 试验方法 1.2.1 ADTZ基因整合载体的构建对质粒PGEM-Kmpgmt和质粒Pm-ADTZ分别用SacⅡ、BamHⅠ进行双酶切,凝胶电泳回收,用T4 DNA连接酶16 ℃连接12 h。将连接产物转化到大肠杆菌(E.coli DH5α)感受态细胞中,挑取阳性克隆单菌落在液体溶菌肉汤(LB)培养基上扩大培养,提取质粒,对重组质粒进行SacⅡ、BamHⅠ酶切鉴定后,测序。并将重组质粒命名为PTM1M2-ADTZ。
1.2.2 野生型枯草芽孢杆菌(B.subtilis LN)感受态的制备野生型B.subtilis LN感受态的制备参照文献[16]进行制备。
1.2.3 重组菌B.subtilis ADTZ的构建取出野生型B.subtilis LN感受态细胞500 μL,加入10 μg的PTM1M2-ADTZ质粒混匀,37 ℃、200 r/min振荡培养60 min,加入500 μL的LB液体培养基,37 ℃、200 r/min培养30 min使菌体复苏。取100 μL菌液均匀涂布于含LB固体培养基上,37 ℃恒温培养箱中倒置培养14~16 h。观察野生型B.subtilis LN菌落形态,用革兰氏染色进行初步检测。从平板上挑取重组菌单菌落,进行扩大培养,提取菌株全基因组,以材料中引物为模板,利用PCR技术进行检测,将含有ADTZ的枯草芽孢杆菌阳性菌记作B.subtilis ADTZ。
1.2.4 重组菌B.subtilis ADTZ菌液的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测将重组菌B.subtilis ADTZ菌液按1:50比例接种于50 mL的LB培养基中,37 ℃、220 r/min培养约18 h;以野生型B.subtilis LN为对照组。菌液低速离心5 min,分别收集上清液和菌体。向菌体中加入5 mL的溶菌酶,用移液器重新制成混悬液,37 ℃培养30 min后取出,将溶液用超声波破碎仪破碎10 min。分别取B.subtilis ADTZ菌液上清液、菌体破碎样品以及对照上清、菌体沉淀样品,进行SDS-PAGE凝胶电泳,观察试验结果。
1.2.5 重组菌对发霉玉米的脱毒试验将500 g左右玉米加水至水分含量20%,室温(25 ℃)放至能看到部分玉米胚有黑色霉变即为发霉玉米,将该玉米在65 ℃条件下烘干、粉碎,充分混合均匀后测定其AFB1含量为63 μg/kg,均匀称取发霉玉米样品9份,每份50 g,分别置于500 mL的锥形瓶中,加入450 mL的蒸馏水,121 ℃灭菌20 min后,将9个锥形瓶随机分为3组,分别为对照组、试验1组和试验2组,分别将50 mL灭菌LB液体培养基、野生型B.subtilis LN菌液(活菌计数法测定活菌数为5.0×109 CFU/mL)、B.subtilis ADTZ菌液(活菌计数法测定活菌数为4.5×109 CFU/mL)接种于上述发霉玉米中,35 ℃恒温200 r/min发酵培养48 h,每组3个重复。试验结束将试验样品用黄曲霉毒素ELISA检测试剂盒在酶标仪上检测AFB1的含量,并计算相应结果。
1.3 数据统计试验数据通过SPSS 11.5进行单因素方差分析(one-way ANOVA),数据均采用“平均值±标准误”表示,P<0.05表示差异显著。
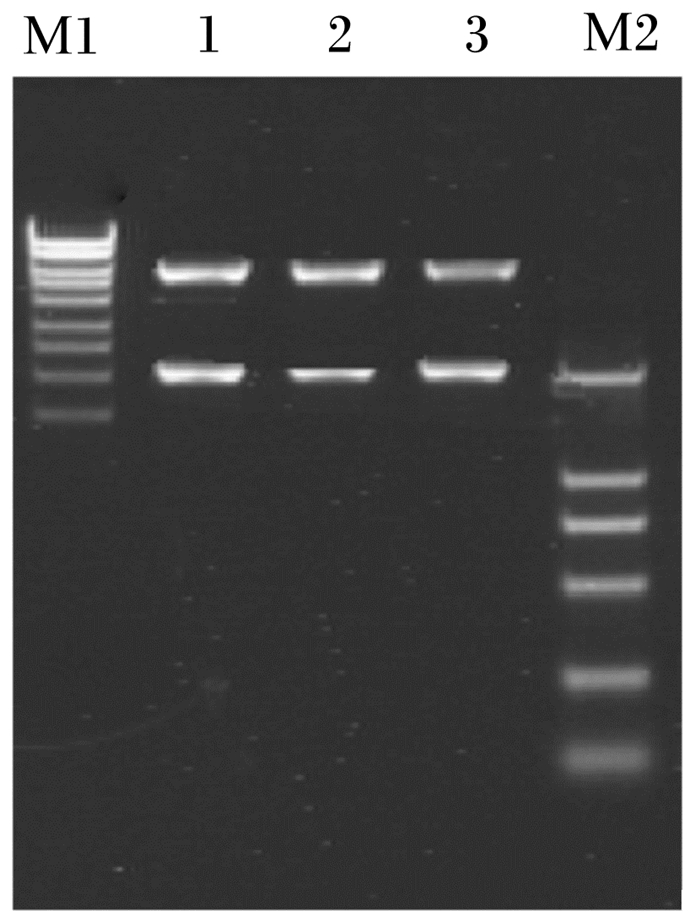
2 结果与分析 2.1 整合载体PTM1M2-ADTZ的分析及鉴定对提取到的整合载体PTM1M2-ADTZ进行检测,采用SacⅡ、BamHⅠ双酶鉴定,结果如图 1所示。酶切后,其中2段大小均为2 000 bp左右,与ADTZ基因大小一致;另一段大小为6 000 bp左右,与质粒PGEM-Kmpgmt的载体部分大小一致。
|
M1为1 kb marker,由上到下分别为10、9、8、7、6、5、4、3、2、1 kb;M2为DL2000 marker,由上到下分别为2 000、1 000、750、500、250、100 bp;泳道1、2、3为PTM1M2-ADTZ的双酶切鉴定。 M1 is 1 kb marker, from up to bottom are 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 kb, respectively; M2 is DL2000 marker, from up to bottom are 2 000, 1 000, 750, 500, 250, 100 bp, respectively; lanes 1, 2 and 3 are double enzyme di-gestion identification of PTM1M2-ADTZ 图 1 整合载体PTM1M2-ADTZ的双酶切电泳图 Figure 1 Double digestion digestion electrophoresis pattern of integrated vector PTM1M2-ADTZ |
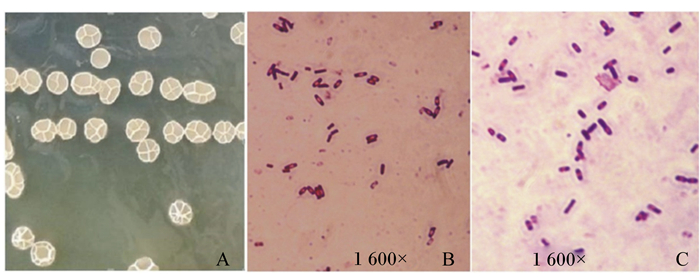
对整合构建的重组菌B.subtilis ADTZ的菌落进行观察,结果为菌落表面粗糙呈微乳白色,边缘不齐,中间突起后平铺,有不规则的褶皱,与枯草芽孢杆菌菌落形态一致。通过革兰氏染色,显微镜下镜检结果为,在1 600×油镜下观察,菌体呈蓝紫色,短杆状,有芽孢,和野生型B.subtilis LN显微镜下的形态相符(图 2)。
|
A为B.subtilis ADTZ菌落形态;B为B.subtilis LN染色图;C为B.subtilis ADTZ染色图。 A is B.subtilis ADTZ colony morphology; B is Gram staining result of B.subtilis LN; C is Gram staining result of B.subtilis ADTZ. 图 2 重组菌的菌落形态和革兰氏染色结果 Figure 2 Colony morphology and Gram staining results of recombinant bacteria |
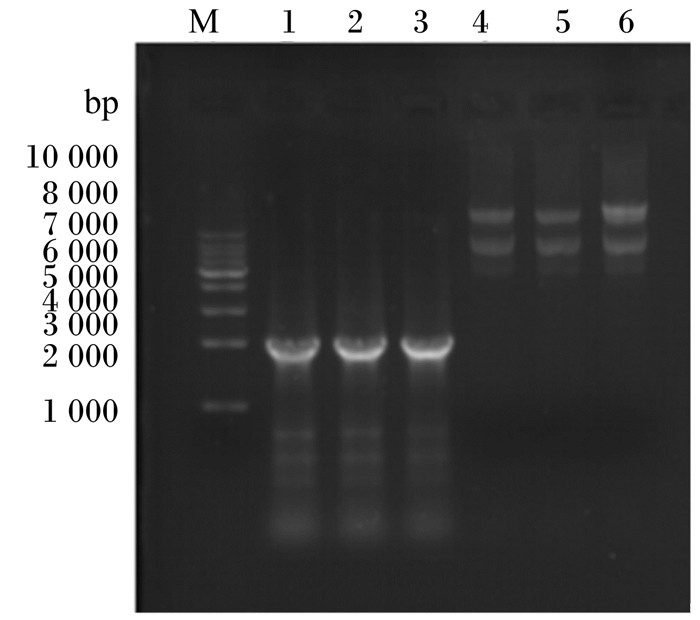
提取重组菌B.subtilis ADTZ的全基因组,以全基因组为模板,ADTZ基因上下游引物扩增目的基因。将提取和扩增结果用琼脂糖凝胶电泳检测。检测结果如图 3所示,其中泳道4、5、6为重组菌B.subtilis ADTZ全基因电泳结果,电泳发现明显的全基因组亮带,表明成功提取重组菌B.subtilis ADTZ全基因组;泳道1、2、3分别为重组菌B.subtilis ADTZ的全基因PCR结果,扩增出来的片段大小为2 000 bp左右,与ADTZ基因片段大小(2 088 bp)相一致,初步验证ADTZ基因整合到重组菌B.subtilis ADTZ基因组中。将PCR扩增产物进行序列测定,测定的结果与ADTZ基因序列完全一致。说明ADTZ基因完全整合到野生型B.subtilis LN基因组中,成功构建了重组菌B.subtilis ADTZ。
|
M为10 000 bp Marker(MD111);泳道1 ~ 3为B.subtilis ADTZ的基因组目的基因PCR扩增结果电泳图;泳道4 ~ 6为B.subtilis ADTZ全基因组电泳图。 M is DNA Marker (MD111); lanes 1 to 3 are target gene PCR product electrophoresis of B.subtilis ADTZ; lanes 4 to 6 are electrophoresis of B. subtilis ADTZ whole genome. 图 3 重组菌B.subtilis ADTZ的全基因组及目的基因电泳图 Figure 3 Electrophoresis result of whole genome and target gene of recombined B.subtilis ADTZ |
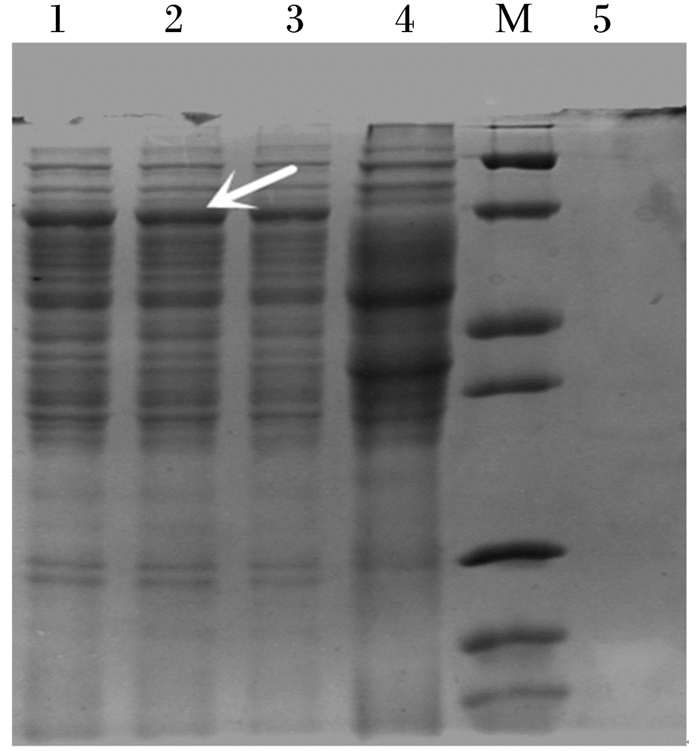
对重组菌B.subtilis ADTZ进行摇瓶培养,收集菌液和菌体,对菌体进行破碎后和野生型B.subtilis LN进行SDS-PAGE电泳检测,结果如图 4所示。在重组菌B.subtilis ADTZ上清液中发现了约70 ku的蛋白条带,与ADTZ基因的表达产物大小一致。而在野生型B.subtilis LN的发酵液样品中没有这个大小的蛋白条带出现。在重组菌B.subtilis ADTZ菌体的破碎液样品中没有发现较明显的蛋白条带。符合枯草芽孢杆菌胞外分泌表达的特点。根据SDS-PAGE电泳检测结果,初步判定ADTZ基因在重组菌B.subtilis ADTZ中表达,表达产物分泌到发酵液中。
|
泳道1 ~ 3为B.subtilis ADTZ发酵上清液,泳道4为野生型B.subtilis LN发酵上清液,M为Protein Marker(由上到下分别为116、66、45、35、25、18、14 ku),泳道5为B.sub-tilis ADTZ菌体破碎样品。 Lanes 1 to 3 are fermentation supernatant of B.subtilis ADTZ, lane 4 is fermentation supernatant of B.subtilis LN, M is Protein Marker (from top to bottom are 116, 66, 45, 35, 25, 18, and 14 ku, respectively), lane 5 is bacteria body protein of B.subtilis ADTZ. 图 4 重组菌B.subtilis ADTZ发酵液SDS-PAGE图 Figure 4 The SDS-PAGE picture of recombined B.subtilis ADTZ fermentation broth |
按照试剂盒的要求将发酵试验的各样品进行处理,酶标仪检测结果通过ELISA分析软件分析并整理计算后,如表 2所示。从表中可以看出,通过微生物发酵发霉玉米样品中的AFB1含量均降低,用重组菌B.subtilis ADTZ菌种发酵的试验1组AFB1含量显著低于其他2组(P<0.05),AFB1降解率显著高于试验2组(P<0.05)。用野生型B.subtilis LN菌种发酵也能降解一部分AFB1,但与重组菌B.subtilis ADTZ发酵相比AFB1含量和AFB1降解率均差异显著(P<0.05)。
|
|
表 2 重组菌B.subtilis ADTZ对发霉玉米AFB1的降解 Table 2 Degradation of AFB1 in moldy corn by recombined B.subtilis ADTZ |
ADTZ基因来源于真菌假密环菌(Armillariellatabescens),已有报道ADTZ基因与载体pMAL-c2x重组,导入到大肠杆菌BL21(DE3)细胞中实现了黄曲霉毒素在大肠杆菌中的异源融合表达,并检测出活性蛋白[10]。随后成功克隆并重组表达了一种具有AFB1转化功能的黄曲霉毒素氧化酶(aflatoxin-oxidase,AFO)[17],进一步验证了ADTZ基因的完整性,使ADTZ基因能够在真核细胞毕赤酵母菌中进行表达[11]。本试验通过构建整合表达载体使ADTZ基因在动物益生菌枯草芽孢杆菌中进行了表达,在对动物饲料的处理上更具可行性。
3.2 枯草芽孢杆菌表达系统的优势本试验利用的表达宿主野生型B.subtilis LN[15],是从羚牛的新鲜粪便中分离筛选得到,进行了详细的鉴定,可作为动物益生菌添加剂使用。野生型B.subtilis LN作为一种益生菌,不产生细胞内毒素,可改善饲料品质,调节动物肠道的微生物平衡,改善饲料的适口性[18-19]。枯草芽孢杆菌可将外源基因表达的蛋白质,通过细胞的分泌通道直接分泌到细胞外,简化了大肠杆菌表达系统的破壁、纯化及回收过程,作用更直接。本试验通过SDS-PAGE检测,发现重组菌B.subtilis ADTZ菌液中有特异性蛋白条带,且与文献报道的ADTZ蛋白条带大小一致[20],而在对照组野生型B.subtilis LN和菌体样品中未发现特异性蛋白条带,说明试验结果符合芽孢杆菌胞外分泌表达的特性。这种特性有利于重组蛋白正确折叠,有效减少包涵体形成,简化纯化工序[13, 21],从而更有利于ADTZ蛋白的表达。与真核生物表达系统相比,枯草芽抱杆菌具有发酵条件简单、发酵周期短、无明显的密码子偏好性、生产成本低等优点[22]。
3.3 降解黄曲霉毒素的微生物及酶国内外对降解黄曲霉毒素的微生物及酶做了很多研究。Doyle等[23]发现,寄生曲霉在生长14 h后,菌丝能产生一种乳过氧化物酶降解AFB1,其产物为黄曲霉毒素B2a(AFB2a)的衍生物和另一种水溶性衍生物,该产物的毒性远低于AFB1。Motomura等[24]从平菇中分离获得蛋白大小约为90 ku的降解黄曲霉毒素的酶,通过荧光含量的测定,表明这种酶是从真菌假密环菌的胞内提取的一种氧化酶。雷元培等[25]对枯草芽孢杆菌进行降解黄曲霉毒素的生物活性、抗菌性及抗逆性的研究,结果表明,发酵后的上清液中存在解毒活性组分,对解毒活性物质进行加热和蛋白酶K变性处理后,解毒活性显著降低,表明起解毒作用的活性物质是其分泌的一种胞外酶。陆续的报道介绍枯草芽孢杆菌发酵液对AFB1标准液的降解率达到70%~80%[26-28]。本试验中采用发霉玉米作为脱毒对象,其毒素含量和存在方式较标准液有很大区别。重组菌B.subtilis ADTZ与野生型B.subtilis LN对黄曲霉毒素均有降解作用,但差异显著。这说明枯草芽孢杆菌具备降解黄曲霉毒素的能力,但是会随着菌株特性不同有较大差异。通过基因工程的重组表达会极大提高野生菌种的降解黄曲霉毒素的能力。
4 结论ADTZ基因可成功整合到野生型B.subtilis LN中,并进行了胞外分泌表达,表达产物具有生物活性,能有效地降解AFB1。
| [1] |
REDDY K, SALLEH B, SAAD B, et al. An overview of mycotoxin contamination in foods and its implications for human health[J]. Toxin Reviews, 2010, 29(1): 3-26. DOI:10.3109/15569541003598553 |
| [2] |
KURTZMAN C P, HORN B W, HESSELTINE C W. Aspergillus nomius, a new aflatoxin-producing species related to Aspergillus flavus and Aspergillus tamarii[J]. Antonie van Leeuwenhoek, 1987, 53(3): 147-158. DOI:10.1007/BF00393843 |
| [3] |
ITO Y, PETERSON S W, WICKLOW D T, et al. Aspergillus pseudotamarii, a new aflatoxin producing species in Aspergillus section Flavi[J]. Mycological Research, 2001, 105(2): 233-239. DOI:10.1017/S0953756200003385 |
| [4] |
ZHI Q Q, XIE Y Y, HE Z M. Genome mining for aflatoxin biosynthesis[J]. Fungal Genomics and Biology, 2013, 3(1): 108-110. |
| [5] |
YIANNIKOURIS A, JOUANY J P. Mycotoxins in feeds and their fate in animals:a review[J]. Animal Research, 2002, 51(2): 81-99. DOI:10.1051/animres:2002012 |
| [6] |
YU J J. Current Understanding on aflatoxin biosynthesis and future perspective in reducing aflatoxin contamination[J]. Toxins, 2012, 4(11): 1024-1057. DOI:10.3390/toxins4111024 |
| [7] |
计成, 赵丽红. 黄曲霉毒素生物降解的研究及前景展望[J]. 动物营养学报, 2010, 22(2): 241-245. |
| [8] |
LIU D L, YAO D S, LIANG R, et al. Detoxification of aflatoxin B1 by enzymes isolated from Armillariella tabescens[J]. Food and Chemical Toxicology, 1998, 36(7): 563-574. DOI:10.1016/S0278-6915(98)00017-9 |
| [9] |
胡丽莎, 谢春芳, 刘大岭. 黄曲霉毒素氧化酶的酶动力学研究[J]. 暨南大学学报(自然科学与医学版), 2012, 33(5): 496-500. |
| [10] |
胡熔, 刘大岭, 谢春芳, 等. 黄曲霉毒素解毒酶在大肠杆菌中的可溶性表达、纯化及其圆二色谱分析[J]. 中国生物工程杂志, 2011, 31(4): 71-76. |
| [11] |
左振宇, 刘大岭, 胡亚冬, 等. 密码子优化的重组黄曲霉毒素解毒酶(rADTZ)在毕氏酵母中组成型分泌表达的研究[J]. 中国农业科技导报, 2007, 9(5): 87-94. |
| [12] |
计成, 贾如, 赵丽红. 基因工程技术在黄曲霉毒素生物降解中的应用[J]. 中国农业科学, 2017, 50(17): 3422-3428. DOI:10.3864/j.issn.0578-1752.2017.17.016 |
| [13] |
余小霞, 田健, 刘晓青, 等. 枯草芽孢杆菌表达系统及其启动子研究进展[J]. 生物技术通报, 2015, 31(2): 35-44. |
| [14] |
聂利波, 王占彬, 史敦胜, 等. 枯草芽孢杆菌纤维素酶基因整合载体的构建[J]. 食品科学, 2017, 38(10): 31-36. DOI:10.7506/spkx1002-6630-201710006 |
| [15] |
LI W, HUAN X J, ZHOU Y, et al. Simultaneous cloning and expression of two cellulase genes from Bacillus subtilis newly isolated from Golden Takin (Budorcas taxicolor Bedfordi)[J]. Biochemical and Biophysical Research Communications, 2009, 383(4): 397-400. DOI:10.1016/j.bbrc.2009.04.027 |
| [16] |
李春艳, 冯凤兆, 冯露, 等. 野生型枯草芽孢杆菌N4的spizizen转化法优化[J]. 东北农业大学学报, 2015(2): 78-82, 108. |
| [17] |
温思霞, 管敏, 周涛, 等. 假蜜环菌黄曲霉毒素氧化酶的基因克隆、表达、纯化及酶学性质分析(英文)[J]. 微生物学报, 2011, 51(9): 1212-1221. |
| [18] |
冯江鑫, 孙焕林, 王朝阳, 等. 枯草芽孢杆菌发酵棉籽粕对黄羽肉鸡营养物质代谢率、生产性能的影响[J]. 粮食与饲料工业, 2015(7): 43-46. |
| [19] |
陈国营, 詹凯, 朱由彩, 等. 枯草芽孢杆菌及其发酵豆粕对蛋鸡肠道菌群和粪便中N、S含量的影响[J]. 中国家禽, 2012, 34(6): 10-15. |
| [20] |
姚冬生, 黄辉, 赵龙, 等. 假密环菌cDNA文库的构建及其阿拉伯糖苷酶基因的克隆(英文)[J]. 中国生物工程杂志, 2005, 25(6): 65-70. |
| [21] |
王靖瑶, 王天女, 卢磊, 等. 大肠杆菌Ⅰ型分泌表达系统研究进展及提高蛋白表达量的策略[J]. 中国生物工程杂志, 2014, 34(6): 98-104. |
| [22] |
孙宏, 姚晓红, 吴逸飞, 等. 产纤维素酶枯草芽孢杆菌的培养条件优化及发酵模型构建[J]. 中国食品学报, 2012, 12(5): 76-81. |
| [23] |
DOYLE M P, MARTH E H. Degradation of aflatoxin by lactoperoxidase[J]. Zeitschrift für Lebensmittel-Untersuchung und Forschung, 1978, 166(5): 271-273. DOI:10.1007/BF01127651 |
| [24] |
MOTOMURA M, TOYOMASU T, MIZUNO K, et al. Purification and characterization of an aflatoxin degradation enzyme from Pleurotus ostreatus[J]. Microbiological Research, 2003, 158(3): 237-242. DOI:10.1078/0944-5013-00199 |
| [25] |
雷元培, 赵丽红, 马秋刚, 等. 降解黄曲霉毒素枯草芽孢杆菌的解毒性、抗菌性及抗逆性研究[J]. 饲料工业, 2011, 32(24): 23-27. DOI:10.3969/j.issn.1001-991X.2011.24.008 |
| [26] |
马芳芬. 枯草芽孢杆菌BS-02降解玉米黄曲霉毒素的研究[D]. 硕士学位论文. 郑州: 河南工业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10463-1016127319.htm
|
| [27] |
孙玲玉, 李超, 郝海玉, 等. 泰山枯草芽孢杆菌的分离鉴定及其对黄曲霉毒素B1的降解研究[J]. 中国畜牧兽医, 2014, 41(8): 246-250. |
| [28] |
FARZANEH M, SHI Z Q, GHASSEMPOUR A, et al. Aflatoxin B1 degradation by Bacillus subtilis UTBSP1 isolated from pistachio nuts of Iran[J]. Food Control, 2012, 23(1): 100-106. DOI:10.1016/j.foodcont.2011.06.018 |




