2. 北京农学院动物科学技术学院, 北京 102206
2. College of Animal Science and Technology, Beijing University of Agriculture, Beijing 102206, China
霉菌毒素(mycotoxins)是由镰刀菌属(Fusarium)、曲霉菌属(Aspergillus)和青霉菌属(Penicillium)等真菌产生的次级代谢产物[1-2],常见且对畜牧业危害较大的霉菌毒素包括黄曲霉毒素(aflatoxins, AFs)、单端孢霉烯族毒素[trichothecenes,如T-2毒素和脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)]、玉米赤霉烯酮(zearalenone, ZEN)、赭曲霉毒素A(ochratoxin A, OTA)及烟曲霉毒素等[3]。霉菌毒素广泛存在于食品和饲料中,是全球畜牧业生产、畜产品质量安全及食品安全所面临的一个重要问题[4]。Iqbal等[5]对115份鸡肉和80份鸡蛋样品中AFs、OTA和ZEN进行检测,分别从35%鸡肉和28%鸡蛋中检出了AFs,从41%鸡肉和35%鸡蛋中检出了OTA,从52%鸡肉和32%鸡蛋中检出了ZEN。龚阿琼等[6]对2015年国内市场上65份玉米样品中黄曲霉毒B1(aflatoxin B1, AFB1)、ZEN和DON进行了检测,发现南方区域3种霉菌毒素的检出率均在90%以上。杜妮[7]的研究表明,饲粮和原料中多种霉菌毒素共存现象很普遍,高达96.48%的饲粮和原料受到2种及以上霉菌毒素污染。人类和动物长期暴露于霉菌毒素会对健康造成严重的影响,如霉菌毒素诱导癌症、引发肾毒性和免疫抑制等[8]。目前,大量利用细胞模型对霉菌毒素毒性进行研究的文献表明,霉菌毒素会抑制细胞增殖、具有细胞毒性甚至诱导细胞凋亡等[9-11]。
根据国际癌症研究机构(international agency for research on cancer, IARC)对致癌物的分类,AFB1被列为1类致癌物,黄曲霉毒M1(aflatoxin M1, AFM1)和OTA被列为2B类,而ZEN和DON则被列为3类,即致癌作用尚不清楚。我国现行《食品安全国家标准》GB 2761—2011规定了食品中AFB1、AFM1、DON、展青霉素(patulin, PAT)、OTA及ZEN 6种毒素的限量指标,其中谷物及其制品中ZEN的残留限量为60 μg/kg,高于除DON(残留限量为1 000 μg/kg)以外的其他4种毒素。近年来,有学者报道较低剂量的霉菌毒素有促进癌细胞增殖的作用,如T-2毒素(<0.009 6 nmol/L)和OTA(<0.003 2 nmol/L)能显著促进Myc基因转染的人胚肺成纤维细胞(MRC-5 Myc)增殖[12]。有关霉菌毒素,特别是ZEN和DON的致癌特性尚不明确,有待进一步研究。
癌细胞的增殖、迁移和侵袭是研究肿瘤恶性程度的重要指标,上皮间质转化(epithelial to mesenchymal transition, EMT)是癌细胞获得转移能力的关键事件[13]。何颖等[14]在干扰素调节因子4结合蛋白(IBP)对结肠癌细胞EMT发生的研究中,主要观察了结肠癌细胞的增殖和迁移情况。Abassi等[15]的研究发现,ZEN对结肠癌细胞有促增殖和促迁移作用,表明ZEN具有潜在致癌性。因此本研究拟利用人结直肠腺癌细胞(HCT116细胞)、人肺癌细胞(A549细胞)、人肝癌细胞(HepG2细胞)这3种癌细胞模型,以OTA为阳性对照组,研究ZEN和DON对癌细胞的促增殖和促迁移作用。
1 材料与方法 1.1 试验材料HCT116、A549、HepG2细胞系购自国家实验细胞资源共享平台中国医学科学院基础医学研究所基础医学细胞中心(http://www.crcpumc.com)。
OTA、ZEN、DON、噻唑蓝(MTT)和二甲基亚砜(DMSO)均购自美国Sigma-Aldrich公司。OTA、ZEN、DON均用甲醇溶解成贮存液(20 mmol/L)于-20 ℃储存,使用时再用培养基稀释为工作浓度。IMDM培养基、McCoy’s 5A培养基、DMEM培养基、胎牛血清(FBS)、L-谷氨酰胺(200 mmol/L)、青霉素(100 IU/mL)-链霉素(100 μg/mL)双抗均购自美国Gibco公司。
1.2 试验方法 1.2.1 细胞培养HCT116、A549和HepG2细胞分别用IMDM培养基、McCoy’s 5A培养基和DMEM培养基在37 ℃、5%饱和湿度的CO2培养箱(美国Nuaire公司)内培养,培养基均含有10% FBS、1% L-谷氨酰胺、1%青霉素-链霉素双抗。
1.2.2 细胞活力测定分别取处于对数生长期的HCT116、A549和HepG2细胞,用0.05%胰蛋白酶-乙二胺四乙酸(EDTA)溶液消化后,加入相应的完全培养基以终止消化,1 000 r/min离心5 min,弃去上清,用培养基调整细胞浓度为1×104个/mL,以100 μL/孔接种于96孔培养板中,于37 ℃、5%饱和湿度的CO2培养箱中孵育24 h。霉菌毒素浓度设置参考文献[15-16],试验组分别加入100 μL含不同浓度(0.016、0.080、0.400、2.000、10.000、50.000 μmol/L)霉菌毒素(OTA、ZEN、DON)的完全培养基,空白对照组霉菌毒素浓度为0 μmol/L(每组设6个复孔,重复3次),继续孵育24 h。弃培养基,每孔加入0.5 mg/mL MTT溶液100 μL,于37 ℃继续培养4 h后,弃去上清液,每孔加100 μL DMSO,振荡10 min,用Sunrise酶标仪(奥地利Tecan公司)测492 nm波长处吸光度(A492)值。按公式计算细胞活力:
细胞活力(%)=(试验组A492值/空白对照组A492值)×100。
1.2.3 细胞迁移能力测定取处于对数生长期的HepG2细胞,用0.05%胰蛋白酶-EDTA溶液消化后,分别加入相应的完全培养基以终止消化,1 000 r/min离心5 min,弃去上清,用培养基调整细胞浓度为3×105个/mL,以2 mL/孔接种于背面做好标记的培养皿(直径为35 mm)中,于37 ℃、5%饱和湿度的CO2培养箱中孵育24 h。用10 μL枪头垂直于底面的横线制造划痕,吸弃上清,加入1 mL磷酸盐缓冲液清洗细胞3次,洗去划痕产生的细胞碎片。试验组分别加入1、10、100 nmol/L OTA、DON和ZEN,空白对照组只加培养基(每组设3个复孔,重复3次),在显微镜下拍照。根据收集的图片数据分析试验结果,按公式计算细胞划痕愈合率:
细胞划痕愈合率(%)=[(T0时划痕宽度值-Tt时划痕宽度值)/T0时划痕宽度值]×100。
1.3 数据统计分析试验数据用平均值±标准差表示,采用GraphPad Prism 6.0软件进行单因素方差分析(one-way ANOVA),差异显著时进行LSD各组间多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析 2.1 霉菌毒素种类和浓度对细胞活力的影响 2.1.1 3种霉菌毒素对HCT116细胞活力的影响3种霉菌毒素对HCT116细胞活力的影响见图 1。不同浓度的OTA对HCT116细胞活力的影响有差异,与空白对照组相比,OTA在浓度较低(0.080、0.400 μmol/L)时能显著或极显著增强HCT116细胞活力(P<0.05或P<0.01),表现出明显的促增殖作用;而OTA在浓度较高(10.000、50.000 μmol/L)时能极显著降低HCT116细胞活力(P<0.01),表现出明显的细胞毒性。10.000 μmol/L OTA使HCT116细胞活力降低为空白对照组的83.78%,50.000 μmol/L使HCT116细胞活力降低为空白对照组的75.06%。与空白对照组相比,DON在中高浓度(≥0.400 μmol/L)时能极显著降低HCT116细胞活力(P<0.01),ZEN只在浓度为0.400和50.000 μmol/L时能极显著降低HCT116细胞活力(P<0.01)。其中,0.400 μmol/L DON和ZEN分别使HCT116细胞活力降低为空白对照组的80.56%和85.22%。由此可见,低浓度(0.016、0.080 μmol/L)DON和ZEN对HCT116细胞不具有与OTA相似的促增殖作用。
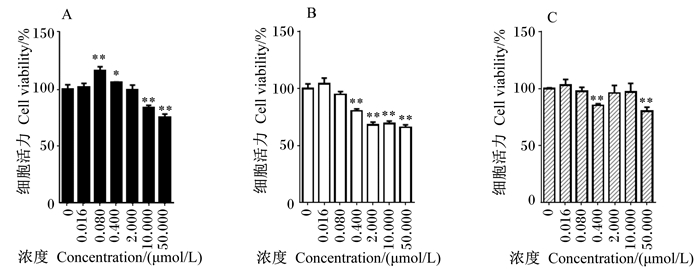
|
A:OTA,B:DON,C:ZEN。*表示与空白对照组相比差异显著(P < 0.05),**表示与空白对照组相比差异极显著(P < 0.01)。图 2、图 3、图 4同。 A: OTA, B: DON, C: ZEN. * indicated significant difference compared with the blank control group (P < 0.05), and ** indicated significant difference compared with the blank control group (P < 0.01). The same as Fig. 2, Fig. 3 and Fig. 4. 图 1 3种霉菌毒素对HCT116细胞活力的影响 Figure 1 Effects of three kinds of mycotoxins on cell viability of HCT116 |
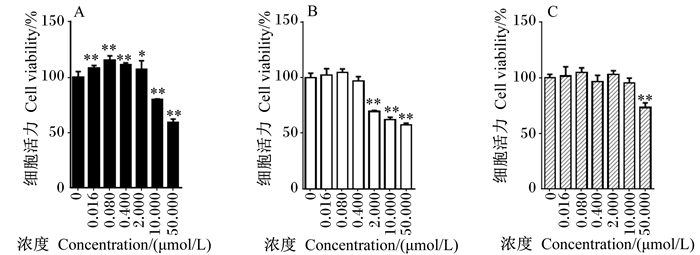
|
图 2 3种霉菌毒素对A549细胞活力的影响 Figure 2 Effects of three kinds of mycotoxins on cell viability of A549 |
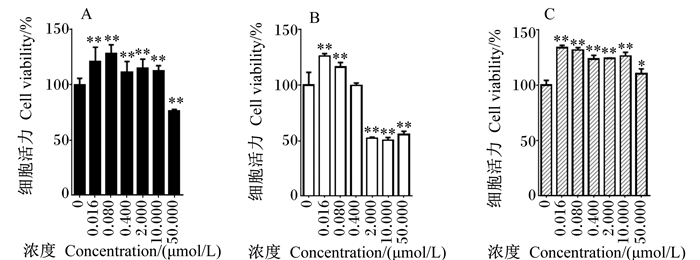
|
图 3 3种霉菌毒素对HepG2细胞活力的影响 Figure 3 Effects of three kinds of mycotoxins on cell viability of HepG2 |
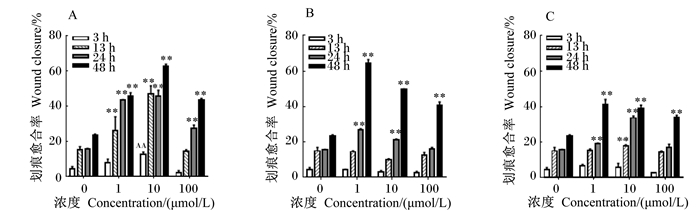
|
图 4 OTA、DON和ZEN分别处理HepG2细胞3、13、24、48 h的迁移率测定 Figure 4 Migration assays of HepG2 cells treated with OTA, DON and ZEN for 3, 13, 24 and 48 h |
3种霉菌毒素对A549细胞活力的影响见图 2。与空白对照组相比,OTA在中低浓度(≤2.000 μmol/L)时能显著或极显著增强A549细胞活力(P<0.05或P<0.01),表现出明显的促增殖作用;OTA在浓度较高(10.000、50.000 μmol/L)时则能极显著降低A549细胞活力(P<0.01),10.000 μmol/L OTA使A549细胞活力降低为空白对照组的79.81%,表现出明显的细胞毒性。与空白对照组相比,DON在中高浓度(2.000、10.000、50.000 μmol/L)时能极显著降低A549细胞活力(P<0.01),其中,2.000 μmol/L DON使A549细胞活力降低为空白对照组的69.59%。与空白对照组相比,ZEN只在浓度为50.000 μmol/L时能极显著降低A549细胞活力(P<0.01),降低为空白对照组的73.25%。由此可见,OTA、DON和ZEN 3种霉菌毒素对A549有细胞毒性的最小浓度分别10.000、2.000、50.000 μmol/L,则3者毒性强弱顺序为:DON>OTA>ZEN。在A549细胞上,低浓度的OTA表现出促增殖作用,而浓度的DON和ZEN则无明显促增殖作用。
2.1.3 3种霉菌毒素对HepG2细胞活力的影响3种霉菌毒素对HepG2细胞活力的影响见图 3。与空白对照组相比,OTA、DON、ZEN在浓度较低(0.016、0.080 μmol/L)时均能极显著增强HepG2细胞活力(P<0.01),表现出明显的促增殖作用。与空白对照组相比,DON在中高浓度(≥2.000 μmol/L)时能极显著降低HepG2细胞活力(P<0.01),表现出明显的细胞毒性,OTA在浓度为50.000 μmol/L时才能极显著降低HepG2细胞活力(P<0.01),表现出明显的细胞毒性,即DON毒性强于OTA。与空白对照组相比,ZEN浓度在0.016~50.000 μmol/L时均能显著或极显著的增强HepG2细胞活力(P<0.05或P<0.01),表现出明显的促增殖作用。由此可见,3种霉菌毒素对HepG2细胞毒性由强到弱依次为DON、OTA、ZEN,而低浓度的DON和ZEN具有与OTA相似的促增殖作用。
2.2 霉菌毒素对HepG2细胞迁移能力的影响采用细胞划痕愈合试验评价1~100 nmol/L的OTA、DON、ZEN对HepG2细胞迁移能力的影响,结果见图 4、图 5。结果表明,与空白对照组相比,1、10 nmol/L OTA作用13、24、48 h后能极显著促进HepG2细胞迁移(P<0.01),100 nmol/L OTA作用24、48 h能极显著促进HepG2细胞迁移(P<0.01);1、10 nmol/L DON和ZEN作用24、48 h能极显著促进HepG2细胞迁移(P<0.01),且均在1 nmol/L处理48 h时促进HepG2细胞迁移的效果最明显。

|
图 5 OTA、DON和ZEN分别对HepG2细胞划痕愈合的影响s Figure 5 Effects of OTA, DON and ZEN on wound healing of HepG2 cells |
霉菌毒素具有肾毒性[9]、肝毒性[11, 16]、免疫毒性[17],并有致畸、致突变和致癌[18-19]等危害,其中一部分研究通过建立细胞模型,在细胞水平上研究霉菌毒素的毒性及其毒性机理。霉菌毒素的浓度在研究其对细胞的毒性及机理中存在不可忽视的影响。大多研究表明,霉菌毒素浓度相对较高时具有明显的细胞毒性。OTA浓度为15 μmol/L时能诱导HeLa细胞凋亡[20],OTA浓度高于15 μmol/L对人淋巴细胞有显著的细胞毒性[21]。Abassi等[12]的研究中,高浓度OTA对野生型人结直肠癌细胞(HCT116 WT)、FLIP蛋白过表达的人结直肠癌细胞(HCT116 FLIP)和MRC-5 Myc细胞均有明显的细胞毒性,其半抑制浓度(IC50)分别为170、120、20 μmol/L。Dai等[22]的研究表明,DON在100~1 600 ng/mL的浓度内对小鼠肠上皮细胞(ESCs)的毒性随毒素剂量的增加或作用时间的延长而增强。ZEN浓度超过5 μmol/L时,能显著降低小鼠睾丸间质瘤细胞(MLTC-1)的活力[23]。50 μmol/L ZEN对张氏肝细胞(CCL 13)无明显的毒性作用,而100 μmol/L ZEN能显著降低CCL 13细胞活力。本研究首先采用MTT法检测OTA、DON和ZEN分别对HCT116、A549、HepG2细胞活力,结果表明OTA(>10.000 μmol/L)和ZEN(50.000 μmol/L)均能极显著降低HCT116、A549细胞活力,具有明显细胞毒性;同时DON(>2.000 μmol/L)对HCT116、A549和HepG2这3种细胞均有较强的细胞毒性,且毒性呈剂量依赖性。
此外,目前人们在研究霉菌毒素对细胞毒性作用时,其考察的低浓度霉菌毒素一般无细胞毒性,如Kang等[16]的研究表明,高浓度ZEN(100 μmol/L)能显著降低CCL 13细胞活力,而低浓度ZEN(50 μmol/L)无明显的毒性作用。但也有报道表明低浓度的ZEN(1~1 000 nmol/L)促进人结肠癌细胞HCT116增殖,可能具有致癌性[15]。本研究对低浓度霉菌毒素的促增殖作用进行研究,结果表明IARC确定的2B类致癌物OTA在低浓度范围内(<0.400 μmol/L)对3种癌细胞都有促增殖作用,而DON(≤2.000 μmol/L)和ZEN(≤50.000 μmol/L)对HCT116、A549细胞无促进增值作用,但对于HepG2细胞有显著的促增殖作用,0.016 μmol/L的DON和ZEN分别使HepG2细胞活力比空白对照组增长了26.2%和33.8%,均高于OTA的21.3%。
细胞迁移参与多种生理活动,如胚胎发育、伤口愈合、组织再生等,同时,也是某些疾病发生的基本过程,如肿瘤的形成,在肿瘤发生过程中,细胞迁移起着核心作用,它是细胞扩散并侵袭组织的关键环节[24]。Abassi等[15]研究表明,ZEN能促进人结肠癌细胞HCT116迁移,其可能具有致癌性。本研究进一步采用细胞划痕愈合试验分别研究了DON和ZEN对HCT116、A549和HepG2细胞迁移能力的影响,以OTA作为阳性对照,结果显示,1 nmol/L DON作用于HepG2细胞48 h促迁移作用与10 nmol/L OTA相似,ZEN促迁移作用稍弱。
后续应进一步完善试验模型,通过多种毒理学机理研究手段,全面评估DON和ZEN在低浓度下可能存在的致癌性,为相关霉菌毒素的毒理学研究提供细胞水平试验支撑。进一步研究上述2种霉菌毒素的毒性机理,更全面地了解其毒性特别是致癌性,对于预测和预防霉菌毒素对人体和动物健康的有害影响意义重大。
4 结论本试验条件下,阳性对照OTA在3种细胞体系内,均表现出促进癌细胞增殖的作用,而DON和ZEN仅对HepG2细胞有显著的促增殖作用,同时DON和ZEN在HepG2细胞上表现出与OTA相似的促细胞迁移的作用,这表明DON和ZEN在HepG2细胞系上具有潜在的致癌性。
| [1] |
HUSSEIN H S, BRASEL J M. Toxicity, metabolism, and impact of mycotoxins on humans and animals[J]. Toxicology, 2001, 167(2): 101-134. DOI:10.1016/S0300-483X(01)00471-1 |
| [2] |
庄振宏, 张峰, 李燕云, 等. 黄曲霉毒素致癌机理的研究进展[J]. 湖北农业科学, 2011, 50(8): 1522-1525. |
| [3] |
谢晓鹏, 易卫, 庄智明, 等. 饲料中的霉菌毒素及其防制措施[J]. 动物营养与饲料科学, 2013, 40(5): 101-106. |
| [4] |
邹忠义, 贺稚非, 李洪军, 等. 单端孢霉烯族毒素及其脱毒微生物国外研究进展[J]. 食品工业科技, 2012, 33(8): 384-389. |
| [5] |
IQBAL S Z, NISAR S, ASI M R, et al. Natural incidence of aflatoxins, ochratoxin a and zearalenone in chicken meat and eggs[J]. Food Control, 2014, 43: 98-103. DOI:10.1016/j.foodcont.2014.02.046 |
| [6] |
龚阿琼, 李文华, 戴晋军. 2015年国内市场玉米霉菌毒素污染情况分析[J]. 中国饲料, 2016(4): 42-44. |
| [7] |
杜妮. 2014年我国部分地区饲料及原料霉菌毒素污染调查报告[J]. 猪业科学, 2015(5): 82-84. |
| [8] |
WEN J K, MU P Q, DENG Y Q. Mycotoxins:cytotoxicity and biotransformation in animal cells[J]. Toxicology Research, 2016, 5(2): 377-387. DOI:10.1039/C5TX00293A |
| [9] |
ROTTKORD U, RÖHL C, FERSE I, et al. Structure-activity relationship of ochratoxin a and synthesized derivatives:importance of amino acid and halogen moiety for cytotoxicity[J]. Archives of Toxicology, 2016, 91(3): 1461-1471. |
| [10] |
ZHU L, YUAN H, GUO C Z, et al. Zearalenone induces apoptosis and necrosis in porcine granulosa cells via a caspase-3-and caspase-9-dependent mitochondrial signaling pathway[J]. Journal of Cellular Physiology, 2012, 227(5): 1814-1820. DOI:10.1002/jcp.22906 |
| [11] |
GAZZAH A C, CAMOIN L, ABID S, et al. Identification of proteins related to early changes observed in human hepatocellular carcinoma cells after treatment with the mycotoxin zearalenone[J]. Experimental and Toxicologic Pathology, 2013, 65(6): 809-816. DOI:10.1016/j.etp.2012.11.007 |
| [12] |
ABASSI H, AYED-BOUSSEMA I, SHIRLEY S, et al. Ochratoxin a and T-2 toxin induce clonogenicity and cell migration in human colon carcinoma and fetal lung fibroblast cell lines[J]. Journal of Biochemical and Molecular Toxicology, 2016, 30(3): 128-135. DOI:10.1002/jbt.2016.30.issue-3 |
| [13] |
THEIR J P. Epithelial-mesenchymal transitions in tumor progression[J]. Nature Reviews Cancer, 2002, 2(6): 442-454. DOI:10.1038/nrc822 |
| [14] |
何颖, 张竹君. IBP通过上皮间质转化促进结肠癌细胞迁移和侵袭[J]. 第三军医大学学报, 2016, 38(11): 1281-1285. |
| [15] |
ABASSI H, AYED-BOUSSEMA I, SHIRLEY S, et al. The mycotoxin zearalenone enhances cell proliferation, colony formation and promotes cell migration in the human colon carcinoma cell line HCT116[J]. Toxicology Letters, 2016, 254: 1-7. DOI:10.1016/j.toxlet.2016.04.012 |
| [16] |
KANG C, LEE H, YOO Y S, et al. Evaluation of oxidative DNA damage using an alkaline single cell gel electrophoresis (SCGE) comet assay, and the protective effects of N-acetylcysteine amide on zearalenone-induced cytotoxicity in chang liver cells[J]. Toxicological Research, 2013, 29(1): 43-52. DOI:10.5487/TR.2013.29.1.043 |
| [17] |
STRASSER A, CARRA M, GHAREEB K, et al. Protective effects of antioxidants on deoxynivalenol-induced damage in murine lymphoma cells[J]. Mycotoxin Research, 2013, 29(3): 203-208. DOI:10.1007/s12550-013-0170-2 |
| [18] |
PFOHL-LESZKOWICZ A, MANDERVILLE R A. Ochratoxin a:an overview on toxicity and carcinogenicity in animals and humans[J]. Molecular Nutrition and Food Research, 2007, 51(1): 61-99. DOI:10.1002/(ISSN)1613-4133 |
| [19] |
EL KHOURY A E, ATOUI A. Ochratoxin a:general overview and actual molecular status[J]. Toxins, 2010, 2(4): 461-493. DOI:10.3390/toxins2040461 |
| [20] |
BOUAZIZ C, EL DEINs O S, MARTEL C, et al. Molecular events involved in ochratoxin a induced mitochondrial pathway of apoptosis, modulation by Bcl-2 family members[J]. Environmental Toxicology, 2011, 26(6): 579-590. DOI:10.1002/tox.v26.6 |
| [21] |
GONZÁLEZ-ARIAS C A, BENITEZ-TRINIDAD A B, SORDO M, et al. Low doses of ochratoxin a induce micronucleus formation and delay DNA repair in human lymphocytes[J]. Food and Chemical Toxicology, 2014, 74: 249-254. DOI:10.1016/j.fct.2014.10.006 |
| [22] |
DAI Y J, XIE H Q, XU Y X. Evaluation of deoxynivalenol-induced toxic effects on mouse endometrial stromal cells:cell apoptosis and cell cycle[J]. Biochemical and Biophysical Research Communications, 2017, 483(1): 572-577. DOI:10.1016/j.bbrc.2016.12.103 |
| [23] |
LI Y Z, ZHANG B Y, HUANG K L, et al. Mitochondrial proteomic analysis reveals the molecular mechanisms underlying reproductive toxicity of zearalenone in MLTC-1 cells[J]. Toxicology, 2014, 324: 55-67. DOI:10.1016/j.tox.2014.07.007 |
| [24] |
PALM D, LANG K, BRANDT B, et al. In vitro and in vivo imaging of cell migration:two interdepending methods to unravel metastasis formation[J]. Seminars in Cancer Biology, 2005, 15(5): 396-404. DOI:10.1016/j.semcancer.2005.06.008 |




