2. 山西省右玉县畜牧局, 右玉 037200
2. Animal Husbandry Bureau of Youyu County, Youyu 037200, China
山西省是胡麻的主要产区之一,总产量6.3万t,胡麻饼(oil cake of flax seed,OCFS)是胡麻籽榨油的主要副产物,合理利用胡麻饼可以减少资源浪费。胡麻饼中含有丰富的多不饱和脂肪酸(PUFA),如α-亚麻酸可以影响瘤胃微生物氢化途径,调控瘤胃发酵模式,改变发酵终产物的形成[1-2];此外,PUFA可以通过参与瘤胃内纤维消化和抑制产氢微生物的毒性作用来降低瘤胃甲烷生成[3-4]。武晓东等[5]研究表明,胡麻饼可以代替豆粕作为绵羊育肥期的蛋白质饲料来源,提高绵羊肉品质和机体抗氧化能力。胡麻饼中含有的亚麻籽胶是一种具有保健作用的膳食纤维[6]。除此之外,胡麻饼中矿物质、维生素和抗病氨基酸[7]等含量也较为丰富。
然而,胡麻饼也含有亚麻氰苷、抗维生素B6因子和植酸等抗营养因子。动物采食胡麻,其受损组织细胞中的β-葡萄糖苷酶和α-羟氰裂解酶接触亚麻氰苷,使其降解并释放有毒物质氰化氢(HCN)[8],此物质对瘤胃的正常代谢和发育产生不利的影响。因此,研究胡麻饼对瘤胃代谢及发育的影响,对胡麻饼在反刍动物生产中的合理利用有重要意义。
本试验以杜泊×小尾寒羊杂交F1代公羔为研究对象,通过测定瘤胃发酵、瘤胃液消化酶活性以及挥发性脂肪(VFA)吸收相关基因表达量,探讨胡麻饼代替豆粕对绵羊瘤胃代谢的影响,并确定最适添加比例,为胡麻饼在反刍动物生产中的合理利用提供科学依据。
1 材料与方法 1.1 试验动物及设计本试验选取24只5月龄、体重为(26.0±1.0) kg、健康状况良好的杜泊×小尾寒羊杂交F1代公羔为试验动物,采用完全随机分组试验设计,将试验羊随机分为4组[对照(CK)、Ⅰ、Ⅱ和Ⅲ组],每组6只羊,分别饲喂胡麻饼代替豆粕的饲粮,胡麻饼添加比例分别为0、6%、12%和18%。
1.2 试验饲粮本试验选用右玉某公司的胡麻饼,自然风干后贮存备用,其营养成分见表 1。基础饲粮参考NRC(2007)绵羊营养需要中体重25 kg、日增重300 g公羔的营养需要设计。试验饲粮均为全混合日粮(TMR)颗粒,其组成及营养水平见表 2。
|
|
表 1 胡麻饼营养成分(干物质基础) Table 1 Nutrient components of oil cake of flax seed (DM basis) |
|
|
表 2 试验饲粮组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of experimental diets (DM basis) |
本试验于2016年5月至2016年8月在山西省右玉县宏宇种羊养殖基地进行。预试期10 d,正试期60 d。试验羊分别于每天08:00和16:00进行2次饲喂。所有试验羊单栏饲养,自由采食,自由饮水。
1.4 样品的采集与测定 1.4.1 饲粮营养水平的测定胡麻饼和试验饲粮的干物质(DM)、粗灰分(Ash)、粗脂肪(EE)和粗蛋白质(CP)含量参考张丽英[9]方法测定;酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)含量参考Van Soest等[10]方法并结合ANKOM滤袋技术利用ANKOM A200i型半自动分析仪测定;钙(Ca)含量采用原子吸收分光光度计(EWAI,AA-7020)测定[11],磷(P)含量采用紫外分光光度计(Mapada, UV-1800PC)测定[12]。消化能(DE)为计算值,计算公式为:
DE=19.509-0.170×NDF-0.006×(DM-Ash)-0.097×CP (R2=0.973,P<0.001)[13]。
1.4.2 生长性能的测定平均日采食量(ADFI):在整个试验期每天准确称量记录每只试验羊的喂料量和剩料量,计算ADFI(非干物质条件下)。平均日增重(ADG):所有试验羊在正试期第1天进行空腹称重,每隔30 d空腹称重1次,计算ADG。根据ADG和ADFI计算料重比(F/G):
F/G=ADFI/ADG。
1.4.3 样品的采集试验期结束的当天20:00时对所有试验羊进行禁食禁水12 h,次日08:00空腹屠宰。屠宰后,取出瘤胃,用剪刀沿瘤胃冠状沟将其剥开,迅速用无菌烧杯从瘤胃不同部位采集瘤胃液,用4层无菌纱布过滤,利用PHS-3G型pH计实时测定pH。同时取10 mL瘤胃液于15 mL离心管内,液氮速冻,-20 ℃保存备用。清空瘤胃内容物并用生理盐水将瘤胃壁冲洗干净,采集1块1 cm2左右的瘤胃左侧背囊,液氮速冻,-80 ℃保存备用。
1.4.4 瘤胃发酵指标的测定准确称量25 g偏磷酸和0.646 4 g巴豆酸定容于100 mL容量瓶中配制成去蛋白质溶液。取1.5 mL瘤胃液,10 621×g离心10 min,然后取1 mL上清液加入0.2 mL的去蛋白质溶液,混合均匀,30 min冰水浴后15 294×g离心5 min,利用气相色谱仪(Thermo Fisher,Trace GC)测定VFA浓度[14]。参照亚硝基铁氰化钠-次氯酸钠比色法并利用紫外分光光度计测定氨态氮(NH3-N)浓度[15]。利用乳酸检测试剂盒(南京建成生物工程研究所)测定乳酸浓度。取1 mL瘤胃液,430×g离心5 min,去除原虫和饲粮颗粒后,参照Makkar等[16]的比色法测定瘤胃微生物蛋白(MCP)浓度。
瘤胃液消化酶活性测定:按照Agarwal等[17]的方法测定瘤胃液羟甲基纤维素酶、β-葡萄糖苷酶、木聚糖酶和果胶酶的活性。α-淀粉酶和蛋白酶活性分别采用α-淀粉酶检测试剂盒和胃蛋白酶检测试剂盒(南京建成生物工程研究所)测定。
1.4.5 瘤胃背囊组织VFA吸收相关基因mRNA相对表达量的测定将采集的瘤胃背囊组织在液氮环境下利用直径为8 cm的陶瓷研钵迅速磨成粉末状,取35~70 mg置于装有750 μL Trizol的1.5 mL的EP管中,用匀浆仪(Polytron,PT 1200E)匀浆处理,提取总RNA[18]。提取的总RNA利用TaKaRa公司的PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒反转录合成cDNA,并检测cDNA浓度。在NCBI上查找目的基因单羧酸转运蛋白1(mono-carboxylate transporters 1,MCT1)、单羧酸转运蛋白4(mono-carboxylate transporters 4,MCT4)、阴离子交换蛋白2(anion exchanger 2,AE2)、腺瘤下调蛋白(down regulated in adenoma,DRA)、Na+/H+交换蛋白(Na+/H+ exchange,NHR3)以及内参基因核糖体大亚基蛋白L13(ribosomal protein L13,RpL13)的序列[15],利用Primer3在线设计引物(表 3),由北京六合华大基因科技股份有限公司合成。采用荧光定量PCR仪,以合成的cDNA为模板进行定量分析,结果根据2-△△CT法计算。
|
|
表 3 基因引物序列 Table 3 Primer sequences of genes |
本试验数据用Excel 2010进行初步整理,采用SPSS 22.0进行单因素方差分析,并用Duncan氏法进行多重比较,结果表示为平均值±标准差。P<0.05表示差异显著。
2 结果 2.1 饲粮中胡麻饼代替豆粕对绵羊生长性能的影响由表 4可见,与CK组相比,Ⅰ和Ⅱ组的ADG和ADFI无显著差异(P>0.05),但Ⅲ组ADFI显著降低(P<0.05)。Ⅱ组的料重比显著低于CK组(P<0.05),Ⅰ和Ⅲ组与CK组无显著差异(P>0.05)。
|
|
表 4 饲粮中胡麻饼代替豆粕对绵羊生长性能的影响 Table 4 Effects of replacement of soybean meal by oil cake of flax seed in diets on growth performance of sheep |
由表 5可见,胡麻饼代替豆粕对绵羊瘤胃液α-淀粉酶活性无显著影响(P>0.05)。Ⅱ和Ⅲ组的瘤胃液羟甲基纤维素酶、β-葡萄糖苷酶和蛋白酶活性显著高于CK组(P<0.05)。Ⅲ组的瘤胃液木聚糖酶活性显著高于CK和Ⅰ组(P<0.05)。Ⅲ组的瘤胃液果胶酶活性显著高于其他组(P<0.05),且其他组之间无显著差异(P>0.05)。
|
|
表 5 饲粮中胡麻饼代替豆粕对绵羊瘤胃液中消化酶活性的影响 Table 5 Effects of replacement of soybean meal by oil cake of flax seed in diets on rumen digestion enzyme activity of sheep |
由表 6可见,胡麻饼代替豆粕对绵羊瘤胃液pH无显著影响(P>0.05)。Ⅱ组的瘤胃液乙酸、丁酸和总挥发性脂肪酸(TVFA)浓度显著高于CK、Ⅰ和Ⅲ组(P<0.05),且这3组之间无显著差异(P>0.05);不同胡麻饼添加比例对瘤胃液丙酸浓度和乙丙比均无显著影响(P>0.05)。与CK组相比,3个胡麻饼添加组的瘤胃液NH3-N浓度显著降低(P<0.05),MCP浓度显著升高(P<0.05),且这3组之间无显著差异(P>0.05);不同胡麻饼添加比例对瘤胃液乳酸浓度无显著影响(P>0.05)。
|
|
表 6 饲粮中胡麻饼代替豆粕对绵羊瘤胃发酵的影响 Table 6 Effects of replacement of soybean meal by oil cake of flax seed in diets on rumen fermentation of sheep |
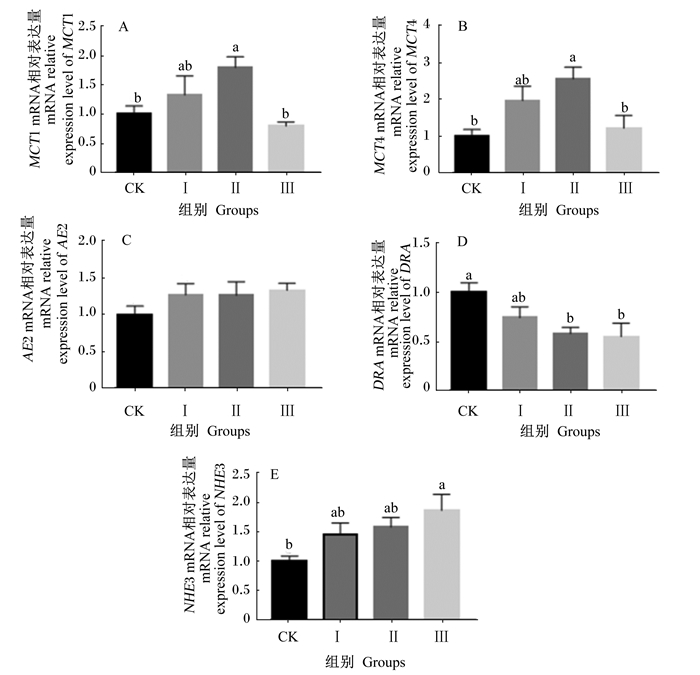
由图 1-A和图 1-B所示,Ⅱ组的MCT1和MCT4的mRNA相对表达量显著高于CK和Ⅲ组(P<0.05),但与Ⅰ组无显著差异(P>0.05)。胡麻饼代替豆粕对AE2的mRNA相对表达量无显著影响(P>0.05)(图 1-C)。CK和Ⅰ组的DRA的mRNA相对表达量无显著差异(P>0.05),但Ⅱ和Ⅲ组显著低于CK组(P<0.05)(图 1-D)。Ⅲ组NHE3的mRNA相对表达量显著高于CK组(P<0.05),CK、Ⅰ和Ⅱ组之间无显著差异(P>0.05)(图 1-E)。
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 1 饲粮中胡麻饼代替豆粕对绵羊瘤胃上皮组织中VFA吸收相关基因表达mRNA相对表达量的影响 Figure 1 Effects of replacement of soybean meal by oil cake of flax seed in diets on mRNA relative expression level of genes related to VFA absorption in rumen epithelial tissue of sheep |
饲粮在瘤胃内的消化需要多种消化酶协同完成,羧甲基纤维素酶、β-葡萄糖苷酶、木聚糖酶及果胶酶活性能够反映瘤胃对饲粮中纤维的降解能力;淀粉酶和蛋白酶活性能够显示瘤胃对饲粮中淀粉和蛋白质的降解能力。大部分的消化酶是由瘤胃微生物分泌的胞内酶和胞外酶[15],本试验所研究的是胞外酶活性。胡麻饼中植酸磷含量在0.02%~0.24%,而豆粕中植酸磷含量高达0.43%,植酸磷可以同淀粉酶和胃蛋白酶相结合,从而影响瘤胃液消化酶活性[19]。本试验研究显示,随着胡麻饼代替豆粕比例的增加,瘤胃液羟甲基纤维素酶、β-葡萄糖苷酶酶、木聚糖酶、果胶酶和蛋白酶活性显著升高,这与王蕾等[20]研究一致。一方面,胡麻饼中含有丰富的α-亚麻酸,其可以作为前体物质影响瘤胃微生物的属性[1],而且胡麻饼含有丰富的B族维生素,两者都有利于瘤胃微生物的生长,从而提高消化酶的产量;同时B族维生素还可作为辅酶或是辅酶的主要成分,起到催化作用。另一方面,亚麻籽胶可以提高瘤胃微生物黏附饲粮的能力[21],亚麻籽胶吸水膨胀,有利于微生物在饲粮表面附着,促进瘤胃微生物的生长,增加消化酶的分泌。
3.2 饲粮中胡麻饼代替豆粕对绵羊瘤胃发酵的影响瘤胃液pH是反映瘤胃发酵水平和瘤胃内环境状况的一项综合性指标[22],受食入饲粮在瘤胃内的发酵产物VFA和乳酸等指标影响[23]。本研究中各组瘤胃液pH无显著差异,且均在正常范围(5.5~7.5)之内[24],这与Benchaar等[25]研究一致。
饲粮中的碳水化合物通过瘤胃微生物发酵产生的VFA,其不仅是瘤胃利用饲粮碳水化合物的终产物,而且是反刍动物能量利用的主要形式[26],瘤胃VFA的产量和组成比例是评述瘤胃发酵方式和能量转化的直接指标。本试验中,添加12%胡麻饼显著提高了瘤胃液乙酸、丁酸和TVFA浓度,这主要是因为适量胡麻饼增加了纤维消化酶的分泌,提高纤维消化酶活性,从促进瘤胃液中的乙酸和丁酸的生成。但胡麻饼18%添加组的瘤胃液乙酸、丁酸和TVFA浓度却显著低于12%添加组,可能是因为随着胡麻饼添加比例增加,PUFA堆积程度超过了部分瘤胃微生物对PUFA的氢化能力,从而影响瘤胃发酵[27]。胡麻饼的添加并没有对乙丙比产生显著的影响,即没有改变瘤胃内的发酵类型,这与Martin等[2]研究的亚麻籽可以改变瘤胃发酵类型并不矛盾:一方面,在本试验条件下,随着胡麻饼的添加,CP含量逐渐降低,却能为发酵碳水化合物的瘤胃微生物提供充足的氮源,是因为胡麻饼蛋白质具有更好的持水性和乳化性[21];同时胡麻饼提供的CP几乎不含动物无法利用的醇溶蛋白,而其富含的清蛋白、谷蛋白和球蛋白都能够很好地被瘤胃微生物消化利用[28];胡麻饼的添加同样能为瘤胃发酵提供配合平衡的瘤胃降解蛋白(RDP)和瘤胃非降解蛋白(RUP)[29];而大豆中含有的植酸磷、胰蛋白酶抑制剂和大豆凝血素等抗营养因子降低了大豆蛋白的利用率[30]。另一方面,胡麻饼相对于亚麻籽,脂肪的含量和种类发生一定的变化,而饲粮中添加植物油对瘤胃VFA的影响与脂肪添加量和种类等有关[31]。
瘤胃液中NH3-N浓度是反映瘤胃氮代谢的重要指标,主要受瘤胃壁的吸收、食糜的排空速度及MCP合成效率等综合影响[32]。Murphy等[33]指出,瘤胃微生物生长的适宜NH3-N浓度为6.3~27.5 mg/dL。本试验中胡麻饼代替豆粕显著降低了NH3-N在瘤胃液中的浓度,这与Jalc等[34]研究一致。一方面胡麻饼中的亚麻籽胶可以有效地促进瘤胃壁的吸收和食糜的排空速度[35],另一方面可能是胡麻饼促进了瘤胃液中NH3-N合成MCP。瘤胃能氮同步释放的理论基础是瘤胃内微生物对食入饲粮中氮和能量的选择性、依赖性和时效性,而MCP浓度是能氮同步性最直接的表现结果[36]。MCP能氮同步说明饲粮底物在瘤胃内的可发酵有机物(FOM)被发酵的速度和可降解氮(RDN)被降解的速度相互同步。本研究显示,饲粮中胡麻饼代替豆粕显著提高了瘤胃液MCP浓度,可能是因为胡麻饼能够代替豆粕为瘤胃液提供更为合适的FOM/RDN比例,同时也与胡麻饼促进NH3-N合成MCP的结果相符。NH3-N浓度的降低和MCP浓度的升高,是否能说明胡麻饼代替豆粕促进了NH3-N向MCP的转化,还需要进一步的研究。
3.3 饲粮中胡麻饼代替豆粕对绵羊瘤胃上皮组织VFA吸收相关基因表达的影响瘤胃发酵不断产生VFA,为瘤胃微生物维持一个适宜生长发育的弱酸环境。但如果大量的VFA在瘤胃内堆积,会导致瘤胃pH下降,引起酸中毒[37],从而降低瘤胃微生物的纤维降解能力以及瘤胃上皮的吸收功能[38]。瘤胃内一少部分VFA被唾液中的碳酸盐中和,一部分随食糜进入肠道,而85%左右的VFA被瘤胃壁吸收进入血液[39]。瘤胃VFA通常以非解离形式(HSCFA)被动扩散或以解离形式(SCFA-)与HCO3-离子交换等途径被上皮细胞有效吸收[39-40]。VFA在瘤胃上皮通过被动扩散进入血液时,亲脂性分子HSCFA通过被动扩散进入瘤胃上皮细胞后,迅速解离成H+和SCFA-,胞内H+浓度升高,激活瘤胃上皮基底层细胞浆膜面单羧酸转运蛋白(MCTs)或Na+/H+交换蛋白(NHE)等转运载体,参与H+、乳酸和酮体的排出[41-42]。VFA在瘤胃上皮通过离子交换进入血液时,SCFA-依赖位于瘤胃上皮细胞基顶膜的阴离子交换蛋白(AE)或位于基底膜的DRA介导SCFA-与HCO3-进行交换[43],从而达到转运VFA的目的。通过离子交换途径转运吸收VFA的速率随着瘤胃中HSCFA浓度的增加和pH的降低而显著增加,随着基底膜或基顶膜内侧的HCO3-的浓度降低而降低[44]。有研究指出,改变山羊饲喂水平可以改变瘤胃上皮细胞与VFA吸收相关基因的mRNA表达量和活性[45-47]。本研究显示,胡麻饼12%添加组的MCT1和MCT4的mRNA相对表达量显著高于CK组,是因为12%添加量显著增加了丁酸浓度,丁酸可以刺激瘤胃上皮细胞的增殖[48],同时丁酸具有较高亲脂性,且多数以非解离状态存在[18],因此HSCFA浓度升高促进其被动运输,提高了MCT1和MCT4的mRNA相对表达量,这与Yan[45]和Yang等[49]研究结果一致。但与胡麻饼12%添加组相比,18%添加组显著降低了MCT1和MCT4 mRNA的相对表达量,是因为胡麻饼中含有抗营养因子亚麻氰苷,亚麻氰苷在瘤胃内产生有毒物HCN[8],过多的CN-抑制细胞内的呼吸酶活性,组织细胞缺氧,从而影响MCT1和MCT4 mRNA的表达。本研究还显示,添加12%和18%胡麻饼均显著降低了DRA mRNA的相对表达量,可能是因为胡麻饼中的α-亚麻酸可以减少瘤胃液中CO2的产量[50],从而降低了HCO3-的浓度,减弱了离子交换途径,降低了DRA mRNA的表达。但胡麻饼中的α-亚麻酸和亚麻氰苷是否直接影响VFA吸收基因的表达,还需要进一步研究。
4 结论饲喂胡麻饼添加比例为12%的饲粮降低了绵羊的料重比,提高了瘤胃乙酸、丁酸和TVFA的浓度,降低NH3-N的浓度,同时提高MCP浓度;增强了羟甲基纤维素酶、β-葡萄糖苷酶和蛋白酶的活性;同时也提高了VFA吸收相关基因(MCT1、MCT4和NHE3)的相对表达量,降低DRA的mRNA相对表达量。综上,在本研究条件下,绵羊饲粮中胡麻饼代替一定比例的豆粕能够改善瘤胃的代谢,且饲粮中胡麻饼适宜添加比例为12%。
| [1] |
VAN NEVEL C J, DEMEYER D I. Control of rumen methanogenesis[J]. Environmental Monitoring and Assessment, 1996, 42(1/2): 73-97. |
| [2] |
MARTIN C, ROUEL J, JOUANY J P, et al. Methane output and diet digestibility in response to feeding dairy cows crude linseed, extruded linseed, or linseed oil[J]. Journal of Animal Science, 2008, 86(10): 2642-2650. DOI:10.2527/jas.2007-0774 |
| [3] |
WOODWARD S L, WAGHORN G C, THOMSON N A. Supplementing dairy cows with oils to improve performance and reduce methane-Does it work?[J]. Proceedings of the New Zealand Society of Animal Production, 2006, 66: 176-181. |
| [4] |
GRAINGER C, CLARKE T, BEACHEMIN K A, et al. Supplementation with whole cottonseed reduces methane emissions and can profitably increase milk production of dairy cows offered a forage and cereal grain diet[J]. Australian Journal of Experimental Agriculture, 2008, 48(1/2): 73-76. |
| [5] |
武晓东, 赵俊星, 刘文忠, 等. 日粮中胡麻饼代替豆粕对绵羊生产性能、肉品质、脂肪酸含量及血液生化指标的影响[J]. 畜牧兽医学报, 2017, 48(7): 1260-1270. |
| [6] |
孙健. 亚麻籽胶对肉制品保水性、乳化性、淀粉糊化和老化特性影响及其应用[D]. 博士学位论文. 南京: 南京农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012271383.htm
|
| [7] |
GIRGIH A T, NWACHUKWU I D, HASAN F, et al. Kinetics of the inhibition of renin and angiotensin Ⅰ-converting enzyme by cod (Gadus morhua) protein hydrolysates and their antihypertensive effects in spontaneously hypertensive rats[J]. Food & Nutrition Research, 2015, 59(1): 29788. |
| [8] |
纪云晶. 实用毒理学手册[M]. 北京: 中国环境科学出版社, 1991.
|
| [9] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007: 1212-1235.
|
| [10] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [11] |
朱宇旌, 郑兰宇, 张勇, 等. 饲料中钙含量测定方法的比较[J]. 畜牧与兽医, 2009, 41(9): 51-53. |
| [12] |
李会娟. 2种植物磷含量的检测方法比较研究[J]. 现代农业科技, 2012(11): 16-17. DOI:10.3969/j.issn.1007-5739.2012.11.007 |
| [13] |
ZHAO J X, MA X H, JIN Y Q, et al. Energy requirements for the maintenance and growth of Dorper-Jinzhong crossbred ram lambs[J]. Italian Journal of Animal Science, 2016, 15(1): 94-102. DOI:10.1080/1828051X.2016.1147336 |
| [14] |
张莹莹. 菌糠饲料对肉牛消化代谢和生产性能的影响[D]. 硕士学位论文. 晋中: 山西农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10113-1017021506.htm
|
| [15] |
金亚倩, 赵俊星, 刘文忠, 等. 酿酒葡萄皮渣对绵羊瘤胃代谢及发育的影响[J]. 畜牧兽医学报, 2017, 48(9): 1683-1693. |
| [16] |
MAKKAR H P S, SHARMA O P, DAWRA R K, et al. Simple determination of microbial protein in rumen liquor[J]. Journal of Dairy Science, 1982, 65(11): 2170-2173. DOI:10.3168/jds.S0022-0302(82)82477-6 |
| [17] |
AGARWAL N, KAMRA D N, CHAUDHARY L C, et al. Microbial status and rumen enzyme profile of crossbred calves fed on different microbial feed additives[J]. Letters in Applied Microbiology, 2002, 34(5): 329-336. DOI:10.1046/j.1472-765X.2002.01092.x |
| [18] |
翁秀秀. 饲喂不同日粮奶牛瘤胃发酵和VFA吸收特性及其相关基因表达的研究[D]. 博士学位论文. 兰州: 甘肃农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10733-1014012284.htm
|
| [19] |
翟双双, 李孟孟, 冯佩诗, 等. 四川白鹅、樱桃谷肉鸭对不同产地亚麻饼粕养分利用率的影响[J]. 动物营养学报, 2016, 28(7): 2147-2153. |
| [20] |
王蕾, 王加启, 卜登攀, 等. 奶牛日粮添加共轭亚油酸和二十二碳六烯酸对瘤胃纤维素酶活性的影响[J]. 东北农业大学学报, 2009, 40(4): 65-68. |
| [21] |
DECK D K, QUENSEL E. Preparation and functional properties of linseed protein products containing differing levels of mucilage[J]. Journal of Food Science, 1988, 53(6): 1834-1837. DOI:10.1111/jfds.1988.53.issue-6 |
| [22] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2006.
|
| [23] |
GUERRA-RIVAS C, GALLARDO B, MANTECÍN Á R, et al. Evaluation of grape pomace from red wine by-product as feed for sheep[J]. Journal of the Science of Food and Agriculture, 2016, 97(6): 1885-1893. |
| [24] |
KRAUSE K M, OETZEL G R. Understanding and preventing subacute ruminal acidosis in dairy herds:A review[J]. Animal Feed Science and Technology, 2006, 126(3/4): 215-236. |
| [25] |
BENCHAAR C, ROMERO-PÉREZ G A, CHOUINARD P Y, et al. Supplementation of increasing amounts of linseed oil to dairy cows fed total mixed rations:effects on digestion, ruminal fermentation characteristics, protozoal populations, and milk fatty acid composition[J]. Journal of Dairy Science, 2012, 95(8): 4578-4590. DOI:10.3168/jds.2012-5455 |
| [26] |
BERGMAN E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J]. Physiological Reviews, 1990, 70(2): 567-590. DOI:10.1152/physrev.1990.70.2.567 |
| [27] |
双金. 富含α-亚麻酸油籽对肉羊血清生化指标及瘤胃微生物区系和体脂脂肪酸组成的影响[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2014.
|
| [28] |
POLIT P F, SGARBIERI V C. Some physicochemical and nutritional properties of castor bean (Ricinus communis) protein[J]. Journal of Agricultural and Food Chemistry, 1976, 24(4): 795-798. DOI:10.1021/jf60206a041 |
| [29] |
张民. 饲料蛋白质组分对泌乳奶牛瘤胃发酵和乳成分影响的研究[D]. 博士学位论文. 北京: 中国农业科学院, 2006. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y880441
|
| [30] |
高美云, 张通, 刘宾, 等. 豆粕抗营养因子及其生物改性的研究[J]. 中国饲料, 2010(3): 37-41. |
| [31] |
杨舒黎. 日粮添加豆油和胡麻油对奶牛瘤胃细菌及发酵参数的影响[D]. 博士学位论文. 北京: 中国农业科学院, 2007. http://cdmd.cnki.com.cn/Article/CDMD-82101-2007156340.htm
|
| [32] |
BENCHAAR C, CALSAMIGLIA S, CHAVES A V, et al. A review of plant-derived essential oils in ruminant nutrition and production[J]. Animal Feed Science and Technology, 2008, 145(1/2/3/4): 209-228. |
| [33] |
MURPHY J J, KENNELLY J J. Effect of protein concentration and protein source on the degradability of dry matter and protein in situ[J]. Journal of Dairy Science, 1987, 70(9): 1841-1849. DOI:10.3168/jds.S0022-0302(87)80223-0 |
| [34] |
JALC D, CERTIK M, KUNDRIKOVA K, et al. Effect of unsaturated C18 fatty acids (oleic, linoleic and α-linolenic acid) on ruminal fermentation and production of fatty acid isomers in an artificial rumen[J]. Veterinární Medicína, 2007, 52(3): 87-94. |
| [35] |
刘勇, 刘惠军, 刘宏. 新的天然植物胶——亚麻籽胶[J]. 内蒙古石油化工, 2001, 27(4): 180-181. |
| [36] |
申军士. 日粮能氮释放同步性对奶牛瘤胃代谢、生产效率与性能的影响研究[D]. 博士学位论文. 杭州: 浙江大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10335-1013186929.htm
|
| [37] |
BEAUCHEMIN K, PENNER G. New developments in understanding ruminal acidosis in dairy cows. [C]//Proceedings of the 18th Tri-State Dairy Nutrition Conference, Fort Wayne, Indiana: Ohio State University, 2009. http://www.cabdirect.org/abstracts/20093223310.html
|
| [38] |
BANNINK A, FRANCE J, LOPEZ S, et al. Modelling the implications of feeding strategy on rumen fermentation and functioning of the rumen wall[J]. Animal Feed Science and Technology, 2008, 143(1/2/3/4): 3-26. |
| [39] |
ASCHENBACH J R, PENNER G B, STUMPFF F, et al. Ruminant Nutrition Symposium:Role of fermentation acid absorption in the regulation of ruminal pH[J]. Journal of Animal Science, 2011, 89(4): 1092-1107. DOI:10.2527/jas.2010-3301 |
| [40] |
LEONHARDMAREK S, STUMPFF F, MARTENS H. Transport of cations and anions across fore stomach epithelia:conclusions from in vitro studies[J]. Animal an International Journal of Animal Bioscience, 2010, 4(7): 1037-1056. DOI:10.1017/S1751731110000261 |
| [41] |
MVLLER F, HUBER K, PFANNKUCHE H, et al. Transport of ketone bodies and lactate in the sheep ruminal epithelium by monocarboxylate transporter 1[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2002, 283(5): G1139-G1146. DOI:10.1152/ajpgi.00268.2001 |
| [42] |
KIRAT D, MASUOKA J, HAYASHI H, et al. Monocarboxylate transporter 1(MCT1) plays a direct role in short-chain fatty acids absorption in caprine rumen[J]. Journal of Physiology, 2010, 576(2): 635-647. |
| [43] |
BILK S, HUHN K, HONSCHA K U, et al. Bicarbonate exporting transporters in the ovine ruminal epithelium[J]. Journal of Comparative Physiology B, 2005, 175(5): 365-374. DOI:10.1007/s00360-005-0493-1 |
| [44] |
DENGLER F, RACKWITZ R, BENESCH F, et al. Bicarbonate-dependent transport of acetate and butyrate across the basolateral membrane of sheep rumen epithelium[J]. Acta Physiologica, 2014, 210(2): 403-414. DOI:10.1111/apha.2014.210.issue-2 |
| [45] |
YAN L, ZHANG B, SHEN Z M. Dietary modulation of the expression of genes involved in short-chain fatty acid absorption in the rumen epithelium is related to short-chain fatty acid concentration and pH in the rumen of goats[J]. Journal of Dairy Science, 2014, 97(9): 5668-5675. DOI:10.3168/jds.2013-7807 |
| [46] |
ETSCHMANN B, SUPLIE A, MARTENS H. Change of ruminal sodium transport in sheep during dietary adaptation[J]. Archives of Animal Nutrition, 2009, 63(1): 26-38. DOI:10.1080/17450390802506885 |
| [47] |
KUZINSKI J, RÖNTGEN M. The mRNA and protein expression of ruminal MCT1 is increased by feeding a mixed hay/concentrate diet compared with hay ad libitum diet[J]. Archiv Fur Tierzucht, 2011, 54(3): 280-286. |
| [48] |
SAKATA T, TAMATE H. Rumen epithelial cell proliferation accelerated by rapid increase in intraruminal butyrate[J]. Journal of Dairy Science, 1978, 61(8): 1109-1113. DOI:10.3168/jds.S0022-0302(78)83694-7 |
| [49] |
YANG W, SHEN Z, MARTENS H. An energy-rich diet enhances expression of Na+/H+ exchanger isoform 1 and 3 messenger RNA in rumen epithelium of goat[J]. Journal of Animal Science, 2012, 90(1): 307-317. DOI:10.2527/jas.2011-3854 |
| [50] |
周薇. α-亚麻酸对瘤胃微生物生物氢化中间产物的影响[D]. 硕士学位论文. 延边: 延边大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10184-1014358325.htm
|




