2. 中国农业科学院特产研究所, 长春 130123;
3. 安徽科技学院动物科学学院, 蚌埠 233003
2. Institute of Special Animal and Plant Sciences, Chinese Academy of Agricultural Sciences, Changchun 130123, China;
3. College of Animal Science, Anhui Science and Technology University, Bengbu 233003, China
铜是动物必需的微量元素之一,具有维持铁的正常代谢、促进骨骼的发育、参与细胞内能量代谢等诸多生理作用,动物长期缺铜会导致生长受阻、骨骼发育异常以及共济失调等症状,严重影响动物的生长性能和经济价值[1]。目前硫酸铜(CuSO4)是配制动物饲粮时最常用到的铜源,具有补铜效果良好、价格便宜、容易获得等特点,因此在生产中广泛使用。此外在断奶仔猪上研究表明,饲粮中添加一定水平(125~250 mg/kg)的硫酸铜对于仔猪有显著的促进生长作用[2]。前期对育成期蓝狐的研究表明,饲粮中铜水平为40 mg/kg(铜源为硫酸铜)时可提高育成期蓝狐的生长速度和饲料转化率[3]。然而硫酸铜在实际使用过程仍存在许多问题,研究表明动物对无机铜的利用率较低,饲粮中大部分的硫酸铜并未被机体利用,经由粪便排出体外,这不仅造成铜的浪费,更会对环境产生重金属污染[4]。此外,高铜会降低饲粮中其他金属元素如锌、铁的吸收,加速饲粮中的抗氧化物质和油脂的氧化变质[5]。有机铜具有生物学利用率高、适口性好、矿物质元素间拮抗小、对饲料中的还原性物质破坏小等特点[6],使用有机铜替代硫酸铜可有效提高铜的利用率,降低铜的排放,在环保压力日益增大的背景下,有机铜的优势更加明显,因此有机铜已经逐渐被越来越多饲料生产者认可和采用。蛋氨酸铜(Met-Cu)是蛋氨酸与铜的螯合产物,可以通过氨基酸胞饮的方式被机体吸收,缓解微量元素之间竞争性拮抗作用,大大提高铜离子的吸收利用率,并能够降低铜对饲料中还原性物质如维生素C、硒等的破坏和油脂的氧化酸败[7]。邓伏清等[8]将蛋氨酸铜与硫酸铜的效果进行比较发现,仔猪对蛋氨酸铜的利用率较高。吴学壮[9]比较了水貂对硫酸铜、蛋氨酸铜和碱式氯化铜3种铜源的生物学利用率,结果表明育成期阶段蛋氨酸铜相较于硫酸铜的生物学利用率为124.35%。目前不同铜源生物学利用率的研究主要集中在猪和禽类,蓝狐对有机铜的利用情况尚未开展系统研究。因此,本试验以蛋氨酸铜作为有机铜的代表,研究蛋氨酸铜和硫酸铜对育成期蓝狐生长性能、营养物质消化率及血清指标的影响,为有机铜在蓝狐生产实践科学应用提供理论指导。
1 材料与方法 1.1 试验饲粮鉴于蓝狐目前还没有统一的营养需要量标准,本研究参照NRC[10]蓝狐营养需要量标准及近年来国内外蓝狐营养的相关文献报道[11-13],设计出育成期蓝狐的基础饲粮,基础饲粮组成及营养水平见表 1。经实测基础饲粮铜含量为14.44 mg/kg干物质(DM)。试验饲粮由基础饲粮额外添加0、50、100 mg/kg(以铜计)的五水硫酸铜(CuSO4·5H2O)或蛋氨酸铜配制而成。由于蛋氨酸铜在添加铜的同时会引入不同剂量的蛋氨酸,这会导致各组试验饲粮蛋氨酸含量出现差异,因此本试验以“蛋氨酸铜最高组”中引入的蛋氨酸量为基准,其他各组中补充额外的蛋氨酸到此水平,以维持各组试验饲粮蛋氨酸水平一致性。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验选择(55±5)日龄健康蓝狐100只,随机分成5个组,每个组20个重复(公母各10只),每个重复1只蓝狐。5组蓝狐分别饲喂在基础饲粮中添加0、50或100 mg/kg的五水硫酸铜或蛋氨酸铜的试验饲粮,2种铜源共用0添加组为对照组。预试期为7 d,正试期为60 d。试验蓝狐均为单笼(105 cm×80 cm×70 cm)饲养,试验开始前,对蓝狐进行常规免疫接种,每日08:00与15:00各饲喂1次,自由采食,自由饮水,每日记录实际采食量。
1.3 消化代谢试验正式试验期开始后30 d,每组随机挑选8只健康蓝狐进行为期5 d的消化代谢试验。试验采用全收粪法,采用粪尿可分离式接粪盘收集蓝狐每日的粪便及尿液。代谢试验期间饲养管理与日常饲养管理完全相同。每天收集饲料样品、粪便和尿液并详细记录每只蓝狐的采食量与剩料量,粪便称重后按鲜重的5%加入10%的硫酸溶液,并加入少量甲苯防腐,于-20 ℃保存备用;尿液按每100 mL加入10 mL 10%硫酸溶液,滴加4滴甲苯防腐,于-20 ℃保存备用。
1.4 测定指标及方法 1.4.1 生长性能试验正试期开始第1天早晨对蓝狐进行空腹称重,为试验动物的初重,以后每隔15 d称重1次,记录蓝狐的体重,并计算出蓝狐的平均日增重和料重比。记录每只蓝狐每天的给料量和剩料量,计算蓝狐的平均日采食量。
1.4.2 营养物质消化率饲粮及粪便中的干物质含量采用65 ℃烘干法测定,参照GB/T 6435—2006;粗蛋白质含量采用凯氏定氮法测定,参照GB/T 6432—1994;粗脂肪含量采用索氏抽提法测定,参照GB/T 6433—2006。采用火焰原子吸收法(GB/T 13885—2003)测定饲粮、肝脏及排泄物中铜的含量。
干物质消化率(%)=[(干物质采食量-干物质排出量)/干物质采食量]×100;
粗蛋白质消化率(%)=[(粗蛋白质摄入量-粪中粗蛋白质含量)/粗蛋白质摄入量]×100;
粗脂肪消化率(%)=[(粗脂肪摄入量-粪中粗脂肪含量)/粗脂肪摄入量]×100;
氮沉积(g/d)=食入氮-粪氮-尿氮。
1.4.3 血清指标采用日立7020型全自动生化分析仪测定血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、尿素氮(UN)、铜(Cu)、铁(Fe)含量及天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)活性,试剂盒购自中生北控生物科技股份有限公司,测定过程严格参照试剂盒说明书。采用紫外/可见光分光光度计(德国耶拿)测定血清铜蓝蛋白(Cp)、铜锌超氧化物歧化酶(Cu-Zn SOD)活性,试剂盒购自南京建成生物工程研究所,测定过程严格参照试剂盒说明书。
1.5 数据处理与统计分析试验数据以平均值±标准差表示。采用SAS 9.1.3软件GLM程序进行数据分析,以铜源、铜水平以及铜源及铜水平的互作效应进行2×3双因素方差分析(two-way ANOVA)。模型如下:
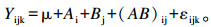
|
式中:Yijk是观测值;μ是平均值;Ai是铜源的主效应;Bj是铜水平的主效应;(AB)ij是铜源与铜水平的交互作用;εijk是随机误差。对差异显著主效应进行Duncan氏法多重比较,检验差异显著性,铜源及铜水平互作效应显著时采用LSMEANS程序PDIFF方法进行显著性分析。
2 结果 2.1 不同铜源及铜水平对育成期蓝狐生长性能的影响不同铜源及铜水平对育成期蓝狐生长性能的影响见表 2。由表可知,饲粮铜水平对育成期蓝狐平均日增重有极显著影响(P < 0.01),50、100 mg/kg铜添加组平均日增重显著高于对照组(P < 0.05);饲粮铜水平对育成期蓝狐料重比有显著影响(P < 0.05),50、100 mg/kg铜添加组料重比显著低于对照组(P < 0.05)。饲粮铜源对育成期蓝狐平均日采食量、平均日增重和料重比均无显著影响(P>0.05)。各组育成期蓝狐的平均日采食量、平均日增重和料重比均未观测到铜源及铜水平的互作效应(P>0.05)。
|
|
表 2 不同铜源及铜水平对育成期蓝狐生长性能的影响 Table 2 Effects of different Cu sources and levels on growth performance of growing blue foxes |
不同铜源及铜水平对育成期蓝狐营养物质消化率的影响见表 3。由表可知,饲粮铜水平对育成期蓝狐粗蛋白质消化率和粪铜含量有极显著影响(P < 0.01),对干物质消化率、粗脂肪消化率有显著影响(P < 0.05),100 mg/kg铜添加组干物质消化率、粗蛋白质消化率显著高于对照组(P < 0.05),50、100 mg/kg铜添加组粗脂肪消化率、粪铜含量显著高于对照组(P < 0.05)。饲粮铜源对育成期蓝狐粪铜含量有显著影响(P < 0.05),蛋氨酸铜组的粪铜含量显著低于硫酸铜组(P < 0.05);饲粮铜源对育成期蓝狐干物质消化率、粗脂肪消化率、粗蛋白质消化率和氮沉积均无显著影响(P>0.05)。各组育成期蓝狐的干物质消化率、粗脂肪消化率、粗蛋白质消化率、氮沉积和粪铜含量均未观测到铜源与铜水平的互作效应(P>0.05)。
|
|
表 3 不同铜源及铜水平对育成期蓝狐营养物质消化率的影响 Table 3 Effects of different Cu sources and levels on nutrient digestibility of growing blue foxes |
不同铜源及铜水平对育成期蓝狐血清指标的影响见表 4和表 5。由表 4可知,饲粮铜水平对育成期蓝狐血清UN含量有极显著影响(P < 0.01),50、100 mg/kg铜添加组的血清UN含量极显著高于对照组(P < 0.01)。饲粮铜源对育成期蓝狐血清UN含量有极显著影响(P < 0.01),蛋氨酸铜组的血清UN含量极显著高于硫酸铜组(P < 0.01)。饲粮铜源及铜水平对育成期蓝狐血清TP、ALB、GLO、Cu、Fe含量及ALT、AST活性均无显著影响(P>0.05)。各组育成期蓝狐的血清TP、ALB、GLO、UN、Cu、Fe含量及ALT、AST活性均未观测到铜源与铜水平的互作效应(P>0.05)。
|
|
表 4 铜源及铜水平对育成期蓝狐血清生化指标的影响 Table 4 Effects of different Cu sources and levels on serum biochemical indices of growing blue foxes |
|
|
表 5 铜源及铜水平对育成期蓝狐血清Cp和Cu-Zn SOD活性的影响 Table 5 Effects of different Cu sources and levels on activities of Cp and Cu-Zn SOD in serum of growing blue foxes |
由表 5可知,饲粮铜源及铜水平对育成期蓝狐血清Cp和Cu-Zn SOD活性均无显著影响(P>0.05)。各组育成期蓝狐的血清Cp和Cu-Zn SOD活性均未观测到铜源与铜水平的互作效应(P>0.05)。
3 讨论 3.1 不同铜源及铜水平对育成期蓝狐生长性能的影响研究表明,饲粮中添加适量铜对幼龄单胃动物如断奶仔猪等有明显的促生长效果。在本试验中,饲粮中添加外源铜提高了育成期蓝狐的生长性能,这与刘志等[3]对育成蓝狐的研究结果一致。白玉妍等[14]对乌苏里貉的研究表明,饲粮中使用蛋氨酸铜作为铜源能够提高貉的生长速度,增加体长。李道林[15]研究表明,高剂量铜(40~80 mg/kg)对獭兔有促生长效果,且添加蛋氨酸铜的效果明显优于硫酸铜。本研究发现,在相同添加水平下蛋氨酸铜的促生长效果略好于硫酸铜,这与上述报道一致。氨基酸铜是氨基酸与铜的螯合反应产物,它可以通过氨基酸胞饮的方式被机体吸收,缓解微量元素之间竞争性拮抗作用,提高铜离子的吸收利用率,并能够降低铜离子对饲料中维生素的氧化破坏和油脂的酸败。铜对蓝狐的促生长机理目前尚不清楚,推测可能与消化酶活性的提高和生长相关激素分泌增多等有关。杜冰[16]研究表明,适宜的铜离子浓度能提高机体多种消化酶的活性,进而提高饲料中营养物质的吸收率。Luo等[17]的研究证明,高铜可以提高断奶仔猪脂肪酶的活性。毛皮动物饲粮的一个重要特点是富含高油脂,因此铜对脂肪消化率的提升在蓝狐饲粮所起的效果更加突出。罗绪刚等[18]报道,铜能通过促进垂体生长激素的基因表达而促进幼猪的生长,甘氨酸铜比硫酸铜更有效地提高了断奶仔猪垂体生长激素mRNA的合成。高铜饲粮对育成期蓝狐生长相关激素水平的影响目前尚不清楚,需要进一步研究验证。
3.2 不同铜源及铜水平对饲粮营养物质消化率的影响研究表明,高剂量铜可以通过改善肠黏膜形态、提高消化酶活性以及改善肠道内菌群结构提高机体对饲粮中营养物质的利用[19]。Radecki等[20]研究表明,高铜可以通过使空肠变薄、十二指肠绒毛变短、减缓空肠等组织更新速度从而降低了它们维持的能量需要,相应地增加了用于生产的能量。Shurson等[21]报道,饲粮中添加高铜能够增加小肠隐窝的深度。Dove[22]研究发现,仔猪饲粮中添加高铜能够显著提高干物质、蛋白质以及脂肪等营养物质的消化率。Luo等[17]进一步研究揭示了高铜对消化酶的影响,高铜能够促进消化道内肠脂肪酶和磷脂酶A的活性,此外铜的体外试验还证实了高铜能够提高胰脂肪酶的活性。吴学壮[9]报道饲粮中添加铜能够促进水貂胆汁的分泌,饲粮中脂肪得到更充分的乳化,进而提高了饲粮脂肪的消化率。Kirchgessner等[23]报道,适宜的铜离子浓度可以激活胃蛋白酶原,提高胃蛋白酶活性,促进食物蛋白质的分解和吸收。高铜能够提高仔猪血液中胃泌素的水平,胃泌素能刺激盐酸、胰液和胆汁的分泌,此外还能刺激主细胞分泌胃蛋白酶原,促进蛋白质的消化。本研究中,随着饲粮铜水平的升高,干物质、粗蛋白质和粗脂肪的消化率显著提升,出现这种情况的原因可能是铜的添加提高了消化酶活性并改善了肠黏膜的形态结构,使得饲粮中营养物质更容易被吸收。Turnlund等[24]采用同位素失踪法研究饲粮铜水平与机体吸收率的关系,结果表明随着饲粮铜水平的升高,铜的吸收率逐渐降低。本研究中发现,饲喂高铜饲粮的蓝狐粪铜含量极显著高于饲喂低铜饲粮的蓝狐。蛋氨酸铜可以通过氨基酸的胞吞方式被机体吸收,因此机体蛋氨酸铜的吸收率要高于硫酸铜。在铜添加水平一致的情况下,添加蛋氨酸铜的蓝狐粪铜含量更低。
3.3 不同铜源及铜水平对育成期蓝狐血清生化指标的影响血清ALT和AST是检测人和动物肝功能的重要指标,研究表明高铜会造成动物肝脏损伤,肝细胞被破坏,致使血清AST和ALT活性升高[25-26]。本试验表明,饲粮中添加100 mg kg硫酸铜或蛋氨酸铜形式的铜均为未引起蓝狐肝脏的明显损伤。血清蛋白是维持机体渗透压和保持水平衡的重要物质,主要由ALB和GLO组成。ALB在机体铜的转运过程中发挥着重要作用,由肠道吸收进入门静脉的铜离子会与先于血清中的ALB或组蛋白结合,经血液循环最终到达肝脏。随着饲粮铜水平的升高,被肠道吸收的铜离子会随之增多,这就需要更多的ALB来负责转运,这可能是血清ALB含量随饲粮铜水平升高有升高趋势的原因。李道林[15]研究发现,獭兔血清UN含量会随着饲粮中铜水平的升高而降低,这与本试验的结果并不一致,差异的来源可能是蓝狐与獭兔不同的生理特性造成的。动物血浆中铜的含量受到的机体严格调控,然而当体内铜的含量超过调控范围后,血浆中铜的含量会明显升高,严重时会产生高铜血症[27]。铜可以提高铁的利用,因此蓝狐血清铁的含量会随着饲粮铜水平的升高有增大的趋势。
3.4 不同铜源及铜水平对育成期蓝狐血清Cp和Cu-Zn SOD活性的影响Cu-Zn SOD和Cp是动物机体2种重要的含铜酶,在机体起至关重要的氧化作用,可以有效保护机体,抵御由自由基引起氧化应激。Feng等[28]研究发现,断奶仔猪饲粮添加250 mg/kg硫酸铜和100 mg/kg蛋白铜能够提高血清Cp的活性,此外添加100 mg/kg蛋白铜还能提高红细胞内Cu-Zn SOD的活性。吴学壮[9]对水貂的研究发现,饲粮添加铜能够提高血清Cp和Cu-Zn SOD的活性。本研究中,虽然血清Cu-Zn SOD的活性各组间差异不显著,但是血清Cp的活性随着饲粮铜水平的升高而升高,这与上述在水貂和猪上的研究一致。
4 结论在含14.44 mg/kg铜的育成期蓝狐基础饲粮中再添加50 mg/kg蛋氨酸铜或者硫酸铜形式的铜均能获得较好的促生长效果; 此外, 蛋氨酸铜可以显著降低粪铜的排放,是一种更高效、环保的铜源。
| [1] |
NRC. Mineral tolerance of animals[M]. 2nd rev ed. Washington, D.C.: National Academy Press, 2005.
|
| [2] |
CROMWELL G L, STAHLY T S, MONEGUE H J. Effects of source and level of copper on performance and liver copper stores in weanling pigs[J]. Journal of Animal Science, 1989, 67(11): 2996-3002. DOI:10.2527/jas1989.67112996x |
| [3] |
刘志, 张铁涛, 郭强, 等. 饲粮铜水平对育成期蓝狐生长性能、营养物质消化率及氮代谢的影响[J]. 动物营养学报, 2013, 25(7): 1497-1503. |
| [4] |
段有刚, 施杏芬, 朱五文, 等. 猪饲料中添加高铜的危害及控制对策[J]. 畜牧兽医科技信息, 2006(8): 91-92. |
| [5] |
徐运杰, 方热军. 养猪业中高铜的应用及其危害[J]. 饲料博览(技术版), 2008(4): 27-30. |
| [6] |
晏家友. 有机铜在养猪生产中的研究应用[J]. 猪业科学, 2011, 28(3): 72-73. |
| [7] |
何河, 方热军, 高凤仙, 等. 蛋氨酸铜对猪血清铜锌含量及粪铜锌排泄量的影响[J]. 家畜生态学报, 2008, 29(3): 44-47. |
| [8] |
邓伏清, 廖阳华, 王勇, 等. 不同铜源对生长肥育猪生产性能的影响[J]. 饲料研究, 2012(2): 42-44. |
| [9] |
吴学壮. 水貂饲粮适宜铜源及铜水平研究[D]. 博士学位论文. 北京: 中国农业科学院, 2015.
|
| [10] |
NRC. Nutrient requirements of mink and foxes[M]. 2nd rev ed. Washington, D.C.: National Academy Press, 1982.
|
| [11] |
耿业业. 育成期蓝狐脂肪消化代谢规律的研究[D]. 博士学位论文. 北京: 中国农业科学院, 2011.
|
| [12] |
崔虎. 日粮蛋白质和蛋氨酸水平对蓝狐生产性能及营养物质代谢的影响[D]. 硕士学位论文. 北京: 中国农业科学院, 2012.
|
| [13] |
郭永佳, 佟煜人. 养狐实用新技术[M]. 北京: 金盾出版社, 2008.
|
| [14] |
白玉妍, 张浩, 叶纯子, 等. 蛋氨酸铜、蛋氨酸锌对乌苏里貉冬毛生长期体重及毛皮质量的影响[J]. 黑龙江畜牧兽医, 2009(13): 113-114. |
| [15] |
李道林. 铜源和铜水平对生长獭兔的生长性能、毛皮品质及理化指标的影响[D]. 硕士学位论文. 长春: 中国人民解放军军需大学, 2002.
|
| [16] |
杜冰. 添加高剂量铜和锌对断奶仔猪生产性能、养分消化率和酶活性的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2010.
|
| [17] |
LUO X G, DOVE C R. Effect of dietary copper and fat on nutrient utilization, digestive enzyme activities, and tissue mineral levels in weanling pigs[J]. Journal of Animal Science, 1996, 74(8): 1888-1896. DOI:10.2527/1996.7481888x |
| [18] |
罗绪刚, 邝霞, 李清宏, 等. 饲粮铜源和水平对断奶仔猪垂体生长激素mRNA水平的影响[C]//中国畜牧兽医学会动物营养学分会第六届全国会员代表大会暨第八届学术研讨会论文集. 哈尔滨: 黑龙江人民出版社, 2000: 710-711.
|
| [19] |
何河, 方热军. 高铜在猪生产中的应用及促生长机理研究进展[J]. 湖南饲料, 2007(2): 6-8. |
| [20] |
RADECKI S V, KU P K, BENNINK M R, et al. Effect of dietary copper on intestinal mucosa enzyme activity, morphology, and turnover rates in weanling pigs[J]. Journal of Animal Science, 1992, 70(5): 1424-1431. DOI:10.2527/1992.7051424x |
| [21] |
SHURSON G C, KU P K, WAXLER G L, et al. Physiological relationships between microbiological status and dietary copper levels in the pig[J]. Journal of Animal Science, 1990, 68(4): 1061-1071. DOI:10.2527/1990.6841061x |
| [22] |
DOVE C R. The effect of copper level on nutrient utilization of weanling pigs[J]. Journal of Animal Science, 1995, 73(1): 166-171. DOI:10.2527/1995.731166x |
| [23] |
KIRCHGESSNER M, BEYER M G, STEINHART H. Activation of pepsin (EC 3.4.4.1) by heavy-metal ions including a contribution to the mode of action of copper sulphate in pig nutrition[J]. The British Journal of Nutrition, 1976, 36(1): 15-22. DOI:10.1079/BJN19760054 |
| [24] |
TURNLUND J R. Bioavailability of dietary minerals to humans:the stable isotope approach[J]. Critical Reviews in Food Science and Nutrition, 1991, 30(4): 387-396. DOI:10.1080/10408399109527549 |
| [25] |
HWANG D F, WANG L C, CHENG H M. Effect of taurine on toxicity of copper in rats[J]. Food and Chemical Toxicology, 1998, 36(3): 239-244. DOI:10.1016/S0278-6915(97)00146-4 |
| [26] |
SUGAWARA N, LI D, SUGAWARA C, et al. Response of hepatic function to hepatic copper deposition in rats fed a diet containing copper[J]. Biological Trace Element Research, 1995, 49(2/3): 161-169. |
| [27] |
DANZEISEN R, ARAYA M, HARRISON B, et al. How reliable and robust are current biomarkers for copper status?[J]. British Journal of Nutrition, 2007, 98(4): 676-683. |
| [28] |
FENG J, MA W, GU Z, et al. Effects of dietary copper (Ⅱ) sulfate and copper proteinate on performance and blood indexes of copper status in growing pigs[J]. Biological Trace Element Research, 2007, 120(1/2/3): 171-178. |




