2. 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室, 畜禽养殖污染控制与资源化技术国家工程实验室, 湖南省畜禽健康养殖工程技术中心, 农业部中南动物营养与饲料科学观测实验站, 长沙 410125;
3. 湖南农业大学动物科技学院, 长沙 410128;
4. 湖南畜禽安全生产协同创新中心, 长沙 410128
2. Key Laboratory for Agro-Ecological Processes in Subtropical Region, National Engineering Laboratory for Pollution Control and Waste Utilization in Livestock and Poultry Production, South-Central Experimental Station of Animal Nutrition and Feed Science in Ministry of Agriculture, Hunan Research Center of Livestock & Poultry Sciences, Institute of Subtropical Agriculture, The Chinese Academy of Sciences, Changsha 410125, China;
3. College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China;
4. Hunan Co-Innovation Center of Safety Animal Production, Changsha, Hunan 410128, China
畜禽在氧化应激的状态下,细胞内会产生大量的氧自由基(OFR),OFR破坏生物膜,影响细胞正常功能,导致细胞膜磷脂过氧化,蛋白质(受体和酶)过氧化以及DNA的氧化损伤。脂质、蛋白质和DNA的氧化会对生物体造成不同程度的危害,从而影响机体的生长、发育、衰老等过程。急性和慢性的应激都能通过产生自由基诱导胃肠道的氧化应激[1]。长期应激会导致动物体内自由基进一步增加,造成具有抗氧化能力的维生素和微量元素等的消耗,免疫受限,畜禽抵抗疾病能力下降,从而诱发一系列疾病,甚至死亡[2-3]。试验证实,许多类型的胃肠溃疡与活性氧有关[4-5]。并且过氧化氢(H2O2)是胃黏膜细胞氧化损伤的主要活性氧[6]。
目前许多文献表明,重金属(砷、铅、汞等)、真菌毒素、杀虫剂、过高的能量和蛋白质[7-9]、过高的铁和铜[10-11]等催化剂、饲喂氧化的脂肪[12-13]、外伤、缺乏抗氧化物质(硒,维生素A、维生素E、维生素C、玉米黄素等)[14-16]等因素都可能导致氧化应激的发生,并可诱发消化道损伤[17],从而影响机体对营养物质的消化吸收[18]。幼龄动物的食物结构和环境发生变化,也会导致氧化应激的发生。特别是当动物遭受外伤等应激后,引起肠缺血,产生大量超氧自由基,伴随着黏膜中黄嘌呤及其底物次黄嘌呤聚集,再次被转换成其他毒性更强的羟自由基。张燕辉等[19]证实缺血再灌注影响肠道通透性、电解质分泌、黏液释放,通常导致肠炎的发生。
L-茶氨酸是绿茶中的呈味物质,是一种天然的氨基酸,在食品行业已被广泛应用。L-茶氨酸作为茶科植物中的主要活性成分,在细胞和组织内主要通过氨基酸转载系统进行转运,对脑组织[20-21]和肝组织损伤[22-23]具有积极的保护作用;同时,在免疫细胞、神经细胞和癌细胞中具有特有的作用机制和作用靶点[24-25]。
H2O2是一种重要的活性氧成分,过量的H2O2因氧化应激损伤可以导致许多类型的细胞发生凋亡[26-27]。有研究表明,L-茶氨酸具有抗氧化活性,它能保护神经细胞免受各种刺激引起的凋亡[28-29]。L-茶氨酸能否抑制瘤胃上皮细胞的凋亡,从而拮抗氧化应激对瘤胃上皮细胞的损伤,对于反刍家畜胃肠道发育具有十分重要的意义。且L-茶氨酸的保护机制与其抗氧化活性和抑制凋亡等相关。试验表明,Bcl-2家族在哺乳动物的细胞调亡中发挥了重要的作用,主要定位在不可逆细胞损伤的上游,在线粒体水平上起作用[30]。Bcl家族可以分为2类:一类是抗调亡蛋白,如Bcl-2;另一类是促调亡蛋白如Bax。Bax可与Bcl-2形成异二聚体,对Bcl-2产生阻抑作用,它们通过激活下游一系列基因发挥调节调亡的作用[31]。本研究以H2O2刺激的瘤胃上皮细胞氧化应激模型来研究L-茶氨酸对H2O2诱导的瘤胃上皮细胞损伤的保护作用,为阐明L-茶氨酸的瘤胃上皮保护作用机理提供理论依据。
1 材料与方法 1.1 主要试剂胎牛血清、DMEM/F12培养基、0.25%胰蛋白酶+0.02%乙二胺四乙酸(EDTA)、青-链霉素均购自美国Gibco公司;两性霉素B、庆大霉素购自美国Thermo Fisher Scientific(R-015-10);L-茶氨酸(CAS:3081-61-6,纯度≥99%)、噻唑蓝(MTT)购自美国Sigma公司;Bax、β-肌动蛋白(β-actin)一抗购自美国Cell Signaling Technology公司;Bcl-2一抗购自美国Signaling Antibody Biotechnology公司;二抗均购自美国Calbiochem公司;细胞周期检测试剂盒购自南京凯基生物科技发展有限公司;琼脂糖购自上海麦克林生化科技有限公司;逆转录试剂盒购自北京康为世纪生物科技有限公司;DEPC、EB试剂购自北京赛百盛基因技术有限公司;TRIZOL购自美国Invitrogen公司;Taq酶、DNA分子质量标准(DL2000 DNA Marker)、dNTP购自美国MBI Fermntas公司;引物购自上海生工生物工程技术服务有限公司;SYBGreen PCR Mix购自日本TaKaRa公司;常规化学试剂购自北京化学试剂公司。
1.2 试验方法 1.2.1 山羊瘤胃上皮细胞的分组选择4只42日龄、体重为(6.4±0.8) kg、健康的湘东黑山羊为试验动物。颈静脉放血致死,取出瘤胃组织,去掉内容物后用生理盐水反复冲洗干净,待用于样品采集[32]。钝性剥离瘤胃上皮,浸泡于4 ℃含1 000 U/mL青-链霉素、125 μg/mL庆大霉素的DMEM-F12培养基中,转移至细胞培养室;组织用含500 U/mL青-链霉素的磷酸盐缓冲液(PBS)液清洗3~5次;将组织尽量剪碎,加入0.25%胰蛋白酶消化液;37 ℃空气浴振荡消化,收集酶解液,加入适量完全培养基(含100 U/mL青-链霉素、25 μg/mL庆大霉素、2.5 μg/mL两性霉素B、0.25 U/mL胰岛素、10 ng/mL表皮生长因子)重悬细胞,经100 μm孔径筛网过滤,收集滤液,1 000 r/min离心5 min,去上清,将细胞重悬于DMEM/F12培养基中,并调整细胞浓度为1×107个/mL,置于CO2培养箱,37 ℃ 5% CO2培养。
当山羊瘤胃上皮原代细胞长满培养皿的80%~90%时,弃去培养基,用PBS洗涤细胞1~2次后,加入1 mL的含0.25%胰蛋白酶+0.02% EDTA的消化液,放入含5% CO2的37 ℃培养箱中消化2~3 min。放在倒置显微镜下观察细胞开始变亮、变圆时,迅速用完全培养基终止消化。将贴壁的细胞吹打为悬液,转移到15 mL离心管中,4 ℃ 1 000 r/min离心5 min,弃去上清液,加入1 mL的完全培养基重悬细胞,以1 : 2的比例进行传代。在含5% CO2的37 ℃培养箱中培养30 min后,转移含细胞的培养基至培养皿中继续培养,重复1次,进一步纯化[33]。纯化后的山羊瘤胃上皮细胞继续培养于含5%胎牛血清的DMEM/F12培养基中,待细胞密度达到60%~70%时,分为5组,对照组采用完全培养基,Ⅰ、Ⅱ、Ⅲ、Ⅳ组分别在完全培养基中添加800 μmol/L H2O2、4 mmol/L L-茶氨酸+800 μmol/L H2O2、8 mmol/L L-茶氨酸+800 μmol/L H2O2和16 mmol/L L-茶氨酸+800 μmol/L H2O2,每组3个重复。
1.2.2 MTT法检测瘤胃上皮细胞存活率将纯化后的山羊瘤胃上皮细胞按1×106个/mL的密度接种于96孔板中,待细胞密度达到60%~70%时,分为6组,对照组采用完全培养基,阳性对照组在完全培养基中添加8 mmol/L L-茶氨酸,Ⅰ、Ⅱ、Ⅲ、Ⅳ组分别在完全培养基中添加800 μmol/L H2O2、4 mmol/L L-茶氨酸+800 μmol/L H2O2、8 mmol/L L-茶氨酸+800 μmol/L H2O2和16 mmol/L L-茶氨酸+800 μmol/L H2O2,每组12个重复。按照设计剂量先加入L-茶氨酸预孵育1 h,再加入H2O2。培养12 h后,将96孔板中的培养基吸弃,用无菌PBS洗涤3次后,每孔加5 mg/mL MTT溶液20 μL,放置37 ℃温箱继续培养4 h,弃上清液。每孔加150 μL二甲基亚砜(DMSO),振荡10 min,酶标仪上在570 nm波长处测定各孔的吸光度(OD)值,以对照组为参比计算细胞存活率(%),公式如下:
细胞存活率(%)=100×阳性对照组或试验组OD570 nm/对照组OD570 nm。
1.2.3 流式细胞仪检测山羊瘤胃上皮细胞周期和凋亡将纯化后的山羊瘤胃上皮细胞按1×106个/mL的密度接种于6孔板中,待细胞密度达到60%~70%时,分为5组,对照组采用完全培养基,Ⅰ、Ⅱ、Ⅲ、Ⅳ组分别在完全培养基中添加800 μmol/L H2O2、4 mmol/L L-茶氨酸+800 μmol/L H2O2、8 mmol/L L-茶氨酸+800 μmol/L H2O2和16 mmol/L L-茶氨酸+800 μmol/L H2O2,每组6个重复。按照设计剂量先加入L-茶氨酸预孵育1 h, 再加入H2O2。培养12 h后,应用流式细胞术(flow cytometry,FCM)中碘化丙啶(propidium iodide,PI)染色法检测细胞周期[34]。
1.2.4 瘤胃上皮细胞凋亡基因的表达分组及操作与1.2.3相同。培养12 h后,采用TRIZOL一步法抽提各组样品中总RNA,整个过程戴口罩和一次性手套[32];总RNA样品的DNase Ⅰ处理参考文献[35-36]进行,逆转录参考文献[37-38]及试剂盒说明书进行。
1.2.5 引物设计与合成根据新基因的测序结果,利用分子生物学软件Primer premier 5、Primer 3.0、Oligo 6.71设计引物,并用Blast工具进行引物特异性分析。运用实时定量PCR检测其组织特异性,所用引物如表 1所示,引物由上海生工基因技术有限公司合成。
|
|
表 1 引物信息 Table 1 Primer information |
分组及操作与1.2.3相同,各组样品总蛋白质的提取和Western blot试验操作流程参照文献[39-40]。
1.3 数据统计与分析采用SAS 9.2 GLM模型对细胞周期数据进行统计[41],应用contrast语句分别进行组间的显著性比较。通过运用LSMEANS方法来计算平均值。运用正交多项式对比来检查P值的相关效应(线性或者二次)。在正交多项式分析之前,使用SAS 9.2的IML程序来校正系数[42]。P < 0.05定义为差异显著。
2 结果与分析 2.1 L-茶氨酸对H2O2损伤的瘤胃上皮细胞存活率的影响由表 2可知, 与对照组相比,Ⅰ组瘤胃上皮细胞存活率显著降低(P < 0.05),Ⅲ、Ⅳ组分别为(65.28±9.10)%和(77.17±7.39)%,显著高于Ⅰ组(P < 0.05)。结果提示,H2O2能显著降低瘤胃上皮细胞存活率,当L-茶氨酸在8 mmol/L以上时可以拮抗H2O2的作用。
|
|
表 2 L-茶氨酸对H2O2损伤的瘤胃上皮细胞存活率的影响 Table 2 Effects of L-theanine on SR of rumen epithelial cells injured by H2O2 |
由图 1和表 3可知,与对照组相比,Ⅰ组G0/G1期细胞比例显著增加(P<0.05),S期细胞比例显著减少(P<0.05),同时G2期细胞比例显著增加(P<0.05),说明H2O2可将细胞周期阻滞在G0/G1期。与Ⅰ相比,Ⅱ组S期细胞比例差异不显著(P>0.05),而G2期细胞比例显著增加(P<0.05),由此说明400 mmol/L L-茶氨酸+H2O2可将细胞阻滞在G2期。而与Ⅰ相比,Ⅲ和Ⅳ组G0/G1期细胞比例显著降低(P<0.05),S期细胞比例显著增加(P<0.05),说明高于800 mmol/L L-茶氨酸+H2O2可将细胞周期阻滞在S期。由此说明,在H2O2诱导的氧化应激情况下,L-茶氨酸可以对瘤胃上皮细胞形成S期阻滞,又能形成G2期阻滞,最终缓解细胞凋亡。
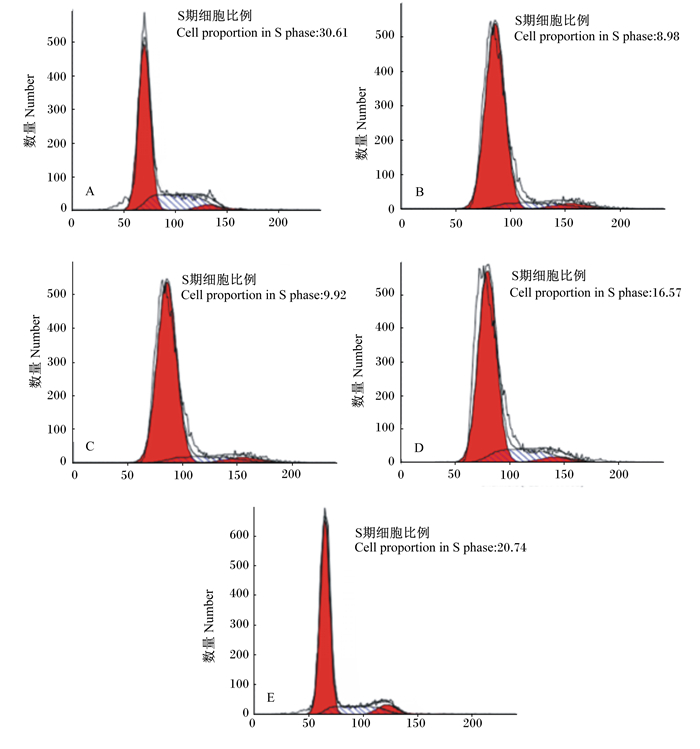
|
A、B、C、D、E分别为对照组及Ⅰ、Ⅱ、Ⅲ、Ⅳ组。 A, B, C, D and E represented control group and groups Ⅰ, Ⅱ, Ⅲ and Ⅳ, respectively. 图 1 L-茶氨酸对H2O2诱导瘤胃上皮细胞周期的影响 Figure 1 Effects of L-theanine on cell cycle of rumen epithelial cells induced by H2O2 |
|
|
表 3 L-茶氨酸对H2O2诱导瘤胃上皮细胞不同细胞周期细胞比例的影响 Table 3 Effects of L-theanine on proportions of cells at different cell cycles of rumen epithelial cells injured by H2O2 |
由表 4可知,与对照组比较,试验组Bax、Bcl-2基因表达量分别升高和降低,Ⅰ、Ⅱ组变化显著(P<0.05)。与Ⅰ组比较,对照组及Ⅱ、Ⅲ和Ⅳ组Bax基因表达量均显著降低(P<0.05);对照组及Ⅳ组Bcl-2基因表达量均显著增加(P<0.05)。与对照组比较,Ⅰ、Ⅱ、Ⅲ、Ⅳ组Bcl-2/Bax均显著降低(P<0.05)。
|
|
表 4 L-茶氨酸对H2O2诱导山羊瘤胃上皮细胞凋亡基因表达量的影响 Table 4 Effect of L-theanine on expression levels of apoptosis genes of ruminal epithelial cells injured by H2O2 |
由图 2和表 5可知,与对照组相比,Ⅰ组Bcl-2蛋白表达量显著降低(P < 0.05),Bax蛋白表达量提高(P < 0.05),Bcl-2/Bax显著降低(P < 0.05),说明H2O2刺激后能引起瘤胃上皮细胞中Bcl-2蛋白表达量下调和Bax蛋白表达量上调,使得Bcl-2/Bax降低。与Ⅰ组相比,Ⅱ、Ⅲ、Ⅳ组Bcl-2蛋白表达量显著提高(P < 0.05),Bax蛋白表达量显著降低(P < 0.05),Ⅲ、Ⅳ组Bcl-2/Bax显著提高(P < 0.05)。结果提示,L-茶氨酸能缓解由H2O2引起的Bcl-2和Bax蛋白表达量的变化。
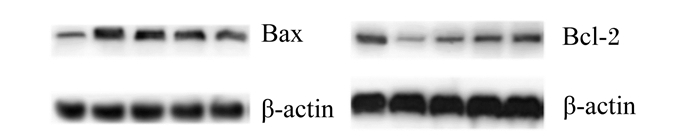
|
图 2 L-茶氨酸对H2O2诱导山羊瘤胃上皮传代细胞凋亡蛋白表达量的影响 Figure 2 Effects of L-theanine on expression levels of apoptosis proteins of ruminal epithelial cells injured by H2O2 |
|
|
表 5 L-茶氨酸对H2O2诱导山羊瘤胃上皮传代细胞凋亡蛋白表达量的影响 Table 5 Effects of L-theanine on expression levels of apoptosis proteins of ruminal epithelial cells injured by H2O2 |
高浓度氧直接损伤瘤胃上皮细胞,促使细胞凋亡或使胃部疾病恶化。大量OFR是引起细胞损伤的重要原因之一,缺血再灌注、药物代谢、金属中毒等会诱导细胞产生大量OFR[43],而H2O2作为OFR的主要成分,得到广泛的研究[44-46]。H2O2可导致细胞损伤的机制包括:损伤线粒体和耗竭ATP,氧化细胞内蛋白质和细胞脂质及引起DNA损伤,引起细胞凋亡等[47]。
减少H2O2诱导细胞凋亡比率,对减轻过氧化应激对机体损伤的影响,改善机体功能与状态具有非常重要的意义。本试验结果表明,添加L-茶氨酸可缓解H2O2引起的山羊瘤胃上皮细胞氧化应激损伤。其机制可能是由于L-茶氨酸是谷氨酰胺的衍生物,在细胞内可代谢为谷氨酸,参与到谷胱甘肽(glutathione,GSH)的合成过程。此外,L-茶氨酸可以通过维持细胞内抗氧化酶的活性,一方面减少GSH的损耗,另一方面增加GSH的生成,达到稳定细胞内GSH含量的效果,维持了细胞内的氧化还原平衡状态,从而保护机体避免氧化应激反应的损伤[48]。
3.2 L-茶氨酸对H2O2诱导山羊瘤胃上皮细胞凋亡基因和蛋白表达量的影响在线粒体凋亡调控体系中,Bcl-2家族中抗凋亡蛋白(Bcl-2、Bcl-xL)或促凋亡蛋白(Bax、Bad和Bid)主要参与调节细胞凋亡。Bcl-2蛋白是线粒体膜上的一种凋亡调控蛋白,可以与线粒体膜上的电压依赖性阳离子通道结合来调节促凋亡因子细胞色素c的释放,也可以和Bax蛋白结合,阻断其插入到线粒体膜上来维持线粒体的膜电位,而Bax是一种促凋亡蛋白,有研究发现,Bcl-2/Bax决定了线粒体通透性转换孔(MPTP)的开放程度,形成调控细胞凋亡的枢纽,因此认为调控细胞死亡的“可变电阻器(rheostat)”是Bcl-2/Bax[49]。在内外因素刺激下,Bcl-2和Bax 2种调控因子的平衡决定细胞了生命,而Bcl-2/Bax是决定细胞凋亡发生及凋亡程度的重要因素[50]。因此,Bcl-2/Bax反映了细胞损伤的程度。研究发现,H2O2能诱导Bax蛋白表达量的增加,引起Bcl-2蛋白表达量的降低,最终使Bcl-2/Bax降低,L-茶氨酸能缓解H2O2刺激后瘤胃上皮细胞中Bax和Bcl-2蛋白表达量的变化,使Bcl-2/Bax升高,说明L-茶氨酸对抗H2O2诱导的瘤胃上皮细胞凋亡是通过抑制Bcl-2/Bax的升高来实现的。
4 结论① L-茶氨酸能通过抑制细胞凋亡来有效地保护由H2O2导致的瘤胃上皮细胞损伤,促进Bcl-2蛋白表达和抑制Bax蛋白表达,抑制Bax/Bcl-2的升高是L-茶氨酸发挥抗凋亡作用的重要途径之一。
② 体外条件下,培养液中添加的L-茶氨酸浓度高于8 mm/L时能有效发挥抗凋亡作用。
| [1] |
URBAN T, HURBAIN I, URBAN M, et al. Oxidants and antioxidants.Biological effects and therapeutic perspectives[J]. Annales De Chirurgie, 1995, 49(5): 427-434. |
| [2] |
WATANABE S, TAKAGI W A, KLHDA K, et al. Helicobacter pylon-induced gastric mucosual cell injury by inducible nitrioxidesythase[J]. Gastroenterology, 1998, 114: G1340. |
| [3] |
DE LA LASTRA C A, NIETO A, MARTIN M J, et al. Gastric toxicity of racemic ketoprofen and its enantiomers in rat:oxygen radical generation and COX-expression[J]. Inflammation Research, 2002, 51(2): 51-57. |
| [4] |
KWIECIEŃ S, BRZOZOWSKI T, KONTUREK P C, et al. The role of reactive oxygen species and capsaicin-sensitive sensory nerves in the pathomechanisms of gastric ulcers induced by stress[J]. Journal of Physiology and Pharmacology, 2003, 54(3): 423-437. |
| [5] |
BANDYOPADHYAY D, BISWAS K, BHATTACHARYYA M, et al. Involvement of reactive oxygen species in gastric ulceration:protection by melatonin[J]. Indian Journal of Experimental Biology, 2002, 40(6): 693-705. |
| [6] |
HIRAISHI H, TERANO A, OTA S, et al. Role for iron in reactive oxygen species-mediated cytotoxicity to cultured rat gastric mucosal cells[J]. American Journal of Physiology, 1991, 260(4 Pt 1): G556-G563. |
| [7] |
LAZARATOS S, IRUKAYAMA-TOMOBE Y, MIYAUCHI T, et al. Oxygen radicals mediate the final exacerbation of endothelin-1-induced gastric ulcer in rat[J]. European Journal of Pharmacology, 2001, 413(1): 121-129. DOI:10.1016/S0014-2999(01)00752-X |
| [8] |
方允中, 李文杰. 自由基与酶[M]. 北京: 科学出版社, 1989: 46-48.
|
| [9] |
WISEMAN H. Damage to DNA by reactive oxygen and nitrogen species:role in inflammatory disease and progression to cancer[J]. Biochemistry, 1996, 313: 17-29. DOI:10.1042/bj3130017 |
| [10] |
HAKAHASHI K, PARK J H, AKIBA Y, et al. Effects of overfeeding of protein and energy by force feeding on hepatic microsomal mixed function oxidase system in broiler chickens[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1995, 111(3): 379-384. |
| [11] |
DANDONA P, MOHANTY P, GHANIM H, et al. The suppressive effect of dietary restriction and weight loss in the obese on the generation of reactive oxygen species by leukocytes, lipid peroxidation, and protein carbonylation[J]. Journal of Clinical Endocrinology & Metabolism, 2001, 86(1): 35-362. |
| [12] |
DJURIC Z, UHLEY V E, NAEGELI L, et al. Plasma carotenoids, tocopherols, and antioxidant capacity in a 12-week intervention study to reduce fat and/or energy intakes[J]. Nutrition, 2003, 19(3): 244-249. DOI:10.1016/S0899-9007(02)01008-0 |
| [13] |
YOUSEF M I, EL HENDY H A, EL-DEMERDASH F M, et al. Dietary zinc deficiency induced-changes in the activity of enzymes and the levels of free radicals, lipids and protein electrophoretic behavior in growing rats[J]. Toxicology, 2002, 175(1/2/3): 223-234. |
| [14] |
OTEIZA P, CLEGG M S, ZAGO M P, et al. Zinc deficiency induces oxidative stress and AP-1 activation in 3T3 cells[J]. Free Radical Biology and Medicine, 2000, 28(7): 1091-1099. DOI:10.1016/S0891-5849(00)00200-8 |
| [15] |
AMIRA A, SHAHEEN A A, EL-FATTAH A. Effect of dietary zinc on lipid peroxidation, glutathione, protein thiols levels and superoxide dismutase activity in rat tissues[J]. The International Journal of Biochemistry & Cell Biology, 1995, 27(1): 89-95. |
| [16] |
李红梅, 王一阳, 王华东, 等. 小檗碱和育亨宾对LPS诱导的小鼠肠道损伤和肠上皮细胞增殖抑制的影响[J]. 中国病理生理杂志, 2010, 26(5): 941-946. |
| [17] |
王恬. 仔猪断奶应激及营养调控措施的应用[J]. 畜牧与兽医, 2009, 41(5): 1-4. |
| [18] |
ASFAHA S. Epithelial dysffunction follow a Uout of colitis[D]. PhD Thesis. Calgary: University of Calgary, 2000.
|
| [19] |
张燕辉, 吴明春, 王庆利. 茶氨酸对大鼠局灶性脑缺血性损伤后炎性细胞因子表达的影响[J]. 中国临床神经外科杂志, 2010, 15(9): 544-546. |
| [20] |
彭彬, 刘仲华, 林勇, 等. L-茶氨酸改善慢性应激大鼠抑郁行为作用研究[J]. 茶叶科学, 2014, 34(4): 355-363. |
| [21] |
BERTOLAMI M C. Mechanisms of hepatotoxicity[J]. Arquivos Brasileiros De Cardiologia, 2005, 85(Suppl.5): 25-27. |
| [22] |
李桂兰, 抗晶晶, 殷志敏. L-茶氨酸对H2O2致LO2细胞损伤的保护作用及其机制研究[J]. 中国细胞生物学学报, 2014, 36(6): 785-790. DOI:10.11844/cjcb.2014.06.0374 |
| [23] |
AHMED M, BRZOZA K L, HILTBOLD E M. Matrix protein mutant of vesicular stomatitis virus stimulates maturation of myeloid dendritic cells[J]. Journal of Virology, 2006, 80(5): 2194-2205. |
| [24] |
CHEN L, CALOMENI E, WEN J, et al. Natural killer dendritic cells are an intermediate of developing dendritic cells[J]. Journal of Leukocyte Biology, 2007, 81(6): 1422-1433. DOI:10.1189/jlb.1106674 |
| [25] |
BALEEIRO R B, ANSELMO L B, SOARES F A, et al. High frequency of immature dendritic cells and altered in situ production of interleukin-4 and tumor necrosis factor-α in lung cancer[J]. Cancer Immunology, Immunotherapy, 2008, 57(9): 1335-1345. DOI:10.1007/s00262-008-0468-7 |
| [26] |
IKEYAMA S, KUSUMOTO K, MIYAKE H, et al. A non-toxic heat shock protein 70 inducer, geranylgeranylacetone, suppresses apoptosis of cultured rat hepatocytes caused by hydrogen peroxide and ethanol[J]. Journal of Hepatology, 2001, 35(1): 53-61. DOI:10.1016/S0168-8278(01)00053-8 |
| [27] |
YAZIHAN N, ATAOG ǦLU H, YENER B, et al. Erythropoietin attenuates hydrogen peroxide-induced damage of hepatocytes[J]. Turkish Journal of Gastroenterology, 2007, 18(4): 239-244. |
| [28] |
DI X, YAN J, ZHAO Y, et al. L-theanine protects the APP (Swedish mutation) transgenic SH-SY5Y cell against glutamate-induced excitotoxicity via inhibition of the NMDA receptor pathway[J]. Neuroscience, 2010, 168(3): 778-786. DOI:10.1016/j.neuroscience.2010.04.019 |
| [29] |
KIM T I, LEE Y K, PARK S G, et al. L-theanine, an amino acid in green tea, attenuates β-amyloid-induced cognitive dysfunction and neurotoxicity:reduction in oxidative damage and inactivation of ERK/p38 kinase and NF-κB pathways[J]. Free Radical Biology and Medicine, 2009, 47(11): 1601-1610. DOI:10.1016/j.freeradbiomed.2009.09.008 |
| [30] |
ADAMS J M, CORY S. The Bcl-2 protein family:arbiters of cell survival[J]. Science, 1998, 281(5381): 1322-1326. DOI:10.1126/science.281.5381.1322 |
| [31] |
MARZO I, BRENNER C, ZAMZAMI N, et al. Bax and adenine nucleotide translocator cooperate in the mitochondrial control of apoptosis[J]. Science, 1998, 281(5385): 2027-2031. DOI:10.1126/science.281.5385.2027 |
| [32] |
韩奇鹏, 罗玲, 揭红东, 等. 浏阳黑山羊瘤胃上皮细胞周期分布、增殖和凋亡特点[J]. 动物营养学报, 2016, 28(7): 2269-2277. |
| [33] |
刘思乐, 康劲翮, 谭支良, 等. 不同培养方法对山羊瘤胃上皮细胞生长及角蛋白18表达量的影响[J]. 动物营养学报, 2016, 28(4): 1225-1232. |
| [34] |
唐丽丽. 调节性T细胞在小鼠肥胖早期阶段的数量变化及其对内脏脂肪巨噬细胞亚型的调节作用[D]. 硕士学位论文. 长沙: 中南大学, 2014.
|
| [35] |
雷震. 药物热原检测平台-TLR4、MD2及CD14基因稳定表达细胞系的构建[D]. 硕士学位论文. 银川: 宁夏医科大学, 2014.
|
| [36] |
谢涛. 隔药饼灸对动脉粥样硬化兔易损斑块TLR2/4-IRF3信号通路调控胆固醇逆转运的影响[D]. 硕士学位论文. 长沙: 湖南中医药大学, 2015.
|
| [37] |
王尧尧, 李冉, 李运生, 等. Nesfatin-1对初情期雌性大鼠促性腺激素及其mRNA表达的影响[J]. 中国农业大学学报, 2015, 20(3): 139-145. |
| [38] |
贾宇. HL-60白血病细胞内Nucleostemin下调对PI3K/AKT/mTOR通路相关基因的影响[D]. 硕士学位论文. 郑州: 郑州大学, 2014.
|
| [39] |
YAN Q X, TANG S X, TAN Z L, et al. Proteomic analysis of isolated plasma membrane fractions from the mammary gland in lactating cows[J]. Journal of Agricultural and Food Chemistry, 2015, 63(33): 7388-7398. DOI:10.1021/acs.jafc.5b02231 |
| [40] |
KARAKI S I, TAZOE H, HAYASHI H, et al. Expression of the short-chain fatty acid receptor, GPR43, in the human colon[J]. Journal of Molecular Histology, 2008, 39(2): 135-142. DOI:10.1007/s10735-007-9145-y |
| [41] |
高树新, 许尚忠, 李金泉, 等. 利用一般线性模型分析奶牛乳房炎的影响因素[J]. 华北农学报, 2006, 21(4): 114-117. |
| [42] |
王钦秀. 一般线性回归模型-参数估计、假设检验、回归预测[J]. 数量经济技术经济研究, 1988(2): 39-44. |
| [43] |
叶煦亭, 沙继宏, 汤莹, 等. 生物细胞氧化应激模型探讨[J]. 电子显微学报, 2000, 19(3): 207-208. |
| [44] |
蔡善荣, 郑树, 张苏展, 等. 过氧化氢诱导肠上皮干细胞DNA氧化损伤模型的建立[J]. 江大学学报(医学版), 2006, 35(4): 366-369, 376. |
| [45] |
廖德荣, 刘启功, 程燕子, 等. 管内皮生长因子对过氧化氢诱导的内皮细胞凋亡的影响及其机制[J]. 中国动脉硬化杂志, 2006, 14(6): 483-486. |
| [46] |
郑延松, 李源, 张珊红, 等. 用低浓度过氧化氢建立心肌细胞氧化损伤模型[J]. 四军医大学学报, 2001, 22(20): 1849-1851, 1854. DOI:10.3321/j.issn:1000-2790.2001.20.008 |
| [47] |
张丽, 李亮, 李克忠, 等. 谷氨酰胺抑制过氧化氢诱导的A549细胞凋亡[J]. 东大学学报(医学版), 2007, 45(11): 1106-1109. DOI:10.3969/j.issn.1671-7554.2007.11.007 |
| [48] |
BHATTACHARYA S, GACHHUI R, SIL PARAMES C. Hepatoprotective properties of kombucha tea against TBHP-induced oxidative stress via suppression of mitochondria dependent apoptosis[J]. Pathophysiology, 2011, 18(3): 221-234. DOI:10.1016/j.pathophys.2011.02.001 |
| [49] |
KORSMEYER S J, SHUTTER J R, VEIS D J, et al. Bcl-2/Bax:a rheostat that regulates an anti-oxidant pathway and cell death[J]. Seminars in Cancer Biology, 1993, 4(6): 327-332. |
| [50] |
王卫东, 陈正堂. Bcl-2/Bax比率与细胞"命运"[J]. 中国肿瘤生物治疗杂志, 2007, 14(4): 393-396. DOI:10.3872/j.issn.1007-385X.2007.4.121 |




