近年来,肠道炎症尤其是结肠疾病已成为威胁人类健康的重要因素,因此肠道健康尤其是结肠健康备受关注[1]。短链脂肪酸由未被宿主消化吸收的碳水化合物如非淀粉多糖(NSP)、寡糖、抗性淀粉等在肠道中经过厌氧菌发酵形成,主要包括乙酸、丙酸、丁酸等,在结肠中浓度最高[2]。短链脂肪酸在体内发挥多种生理功能[3-4],它既可用于葡萄糖及脂质的从头合成[5],又能抑制促炎因子的产生,从而起到抗炎作用[6]。因此,短链脂肪酸在机体代谢及肠道健康中发挥着重要作用。
前人研究大多围绕着乙酸和丁酸对机体代谢的影响,而对丙酸的研究相对较少,但一些研究同样证实了丙酸对机体代谢的调节作用。丙酸是肠道内糖异生的前体物质,能够激活宿主体内与肠道糖异生有关的神经通路[7],改善机体的葡萄糖耐受性及胰岛素敏感性[8],降低脂肪的合成及血清胆固醇水平[9]。丙酸亦能通过其受体促进胃肠激素酪酪肽(PYY)的生成,进而调控宿主的食欲、胃肠蠕动等,发挥一系列代谢益处[10]。此外,丙酸还能够减少由脂多糖(LPS)引起的肿瘤坏死因子-α(TNF-α)的分泌,降低白介素-6(IL-6)等免疫相关基因的表达水平,改善机体的免疫水平[11]。本试验以生长猪为模型,向盲肠灌注丙酸,并通过转录组测序,探究丙酸对结肠黏膜基因表达的影响,以期为研究丙酸在结肠代谢中的作用提供一定的理论依据。
1 材料与方法 1.1 试验动物及试验设计选取16头60日龄、25 kg左右的杜×长×大阉公猪,单栏饲喂,自由饮水及采食。预饲3 d后,在盲肠实施T型瘘管手术。2周恢复期后,将试验猪随机分成2组,分别为对照组和试验组,每组8头。试验期内,试验组猪只通过盲肠瘘管灌注用生理盐水配制的丙酸溶液(25 mL,2 mol/L,pH 5.8),对照组猪只灌注等量的生理盐水,每天2次(07:00和18:00),共灌注28 d。在第29天将16头猪全部屠宰,采集结肠黏膜并迅速放置于液氮以供后续分析。
1.2 转录组测序 1.2.1 总RNA提取使用去RNA酶喷雾去除所需器械表面的RNA酶。总RNA提取采用TRIzol法,参照产品说明书操作。提取到的总RNA使用Nano Drop 2000测定其浓度及纯度。
1.2.2 测序将提取到的总RNA送至测序北京安诺优达基因科技有限公司进行转录组测序。用DNA酶去除DNA污染后,合成双链cDNA。接着通过PCR扩增富集片段并进行质量检测及测序。最后,去除低质量及含有超过10%未知碱基的reads以获得Clean reads[12]。
1.2.3 差异表达基因(differentially expressed genes,DEGs)的筛选将结肠黏膜中所有表达的基因以P < 0.05,FDR(false discovery rate) < 0.01且差异倍数(FC)≥2作为标准,筛选差异表达基因。
1.2.4 GO与KEGG pathway分析使用Omicsbean系统对结肠黏膜差异表达基因进行GO与KEGG pathway分析,以了解差异表达基因的生物学功能。GO是将基因进行功能分类的体系,并使用标准严格的词汇及概念对各物种的基因属性进行全方位的概括与描述。它包含3个一级功能数据库:生物学过程(biological process)、细胞组分(cell component)和分子功能(molecular function)。KEGG pathway可对差异表达基因的代谢途径及信号转导途径进行富集性分析,进一步了解差异表达基因的功能。
1.2.5 蛋白质互作(protein-protein interaction,PPI)分析PPI分析仍通过Omicsbean系统实现。该系统先基于STRING数据库建立起差异表达基因之间的相互联系,再根据差异表达基因所主要参与的生物通路构建模型,生成相应的PPI网络。
1.3 荧光定量PCR从结肠黏膜差异表达基因中挑选7个与糖代谢及免疫等相关的基因[PYY、闭锁蛋白-1(Occludin-1)、胰岛素样生长因子结合蛋白7(IGFBR7)、谷胱甘肽转移酶A1(GSTA1)、γ-谷氨酰转移酶1(GGT1)、G蛋白偶联受体5A(GPRC5A)、核糖体蛋白S28(RPS28)]进行荧光定量PCR,以验证转录组测序结果的可靠性。荧光定量PCR采用SYBR Green Mix reagents试剂盒法进行,试验步骤参照产品说明书。选用猪甘油醛-3-磷酸脱氢酶(GAPDH)基因作为内参基因,各基因引物序列如表 1所示。
|
|
表 1 荧光定量PCR基因的引物序列 Table 1 Primer sequences of genes selected for qPCR |
灌注丙酸后,在生长猪结肠黏膜中共检测出121个差异表达基因(FC≥2,P < 0.05)。其中表达上调的基因有78个,下调的基因有43个(图 1-A)。进一步利用基因功能注释发现,可功能注释的差异表达基因包括49个上调基因和30个下调基因(图 1-B)。在这些差异表达基因中,包括一些糖代谢相关基因,如IGFBP7、果糖二磷酸醛缩酶(ALDOB)、GGT1等;能量代谢相关基因,如过氧化物酶生物合成因子(LOC100624129)、烟酰胺腺嘌呤二核苷酸脱氢酶亚基4L(ND4L)、细胞色素P450(CYP39A1)等;免疫相关基因,如Occudin-1、生长抑素(SST)、GPRC5A等;此外,还包括胃肠激素PYY等(表 2)。
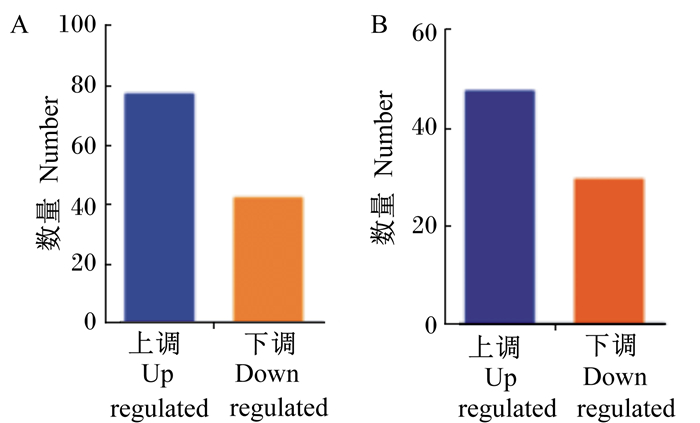
|
图 1 差异表达基因数量(A)与可功能注释的差异表达基因数量(B) Figure 1 The number of DEGs (A) and that of identifiable DEGs (B) |
|
|
表 2 部分差异表达基因功能列表 Table 2 Function list of partial DEGs |
利用GO数据库对差异表达基因进行功能分析,解析差异表达基因主要参与的生物学过程。上调表达基因的GO分析结果显示,有12个显著富集的GO term,包括糖基化合物代谢、糖类衍生物代谢、碳水化合物代谢以及前体代谢物和能量的生成等(图 2-A)。其中,富集在糖基化合物代谢途径中的差异表达基因有4个,富集在糖类衍生物代谢途径中的差异表达基因有7个,富集在碳水化合物代谢途径中的差异表达基因有5个。下调表达基因的GO分析结果显示,有8个显著富集的GO term,包括心腔发育、干细胞群维持、细胞运动负调控、细胞因子刺激反应的正调控等(图 2-B)。
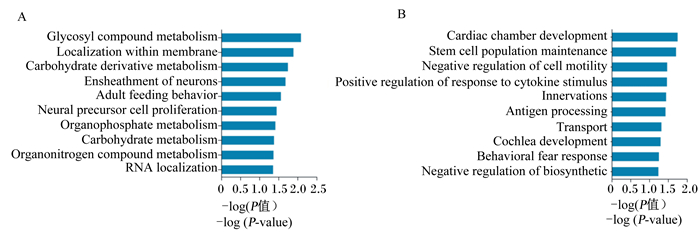
|
Glycosyl compound metabolism:糖基化合物代谢;Localization within membrane:膜内定植;Carbohydrate derivative metabolism:糖类衍生物代谢;Ensheathment of neurons:神经元髓鞘形成;Adult feeding behavior:成人摄食行为;Neural precursor cell proliferation:神经前体细胞增殖;Organophosphate metabolism:有机磷代谢;Carbohydrate metabolism:碳水化合物代谢;Organonitrogen compound metabolism:有机氮化合物代谢;RNA localization:RNA定植;Cardiac chamber development:心腔发育;Stem cell population maintenance:干细胞群维持;Negative regulation of cell motility:细胞运动负调控;Positive regulation of response to cytokine stimulus:细胞因子刺激反应正调控;Innervations:支配;Antigen processing:抗原加工;Transport:运输;Cochlea development:耳蜗发育;Behavioral fear response:恐惧行为反应;Negative regulation of biosynthetic:生物合成负调控。 图 2 GO分析(A:上调基因;B:下调基因) Figure 2 GO analysis (A: up-regulated genes; B: down-regulated genes) |
采用KEGG数据库对差异表达基因参与的主要信号通路进行分析,结果如图 3所示。差异表达基因显著富集的通路主要包括氧化磷酸化、谷胱甘肽代谢、代谢通路、叶酸生物合成、糖胺聚糖生物合成等。对上调与下调表达基因分别进行分析发现,上调表达基因有5个通路显著富集,包括氧化磷酸化、糖胺聚糖生物合成、鞘糖脂生物合成等(图 3-A);下调表达基因显著富集的通路有牛磺酸和亚牛磺酸代谢、叶酸生物合成等(图 3-B)。
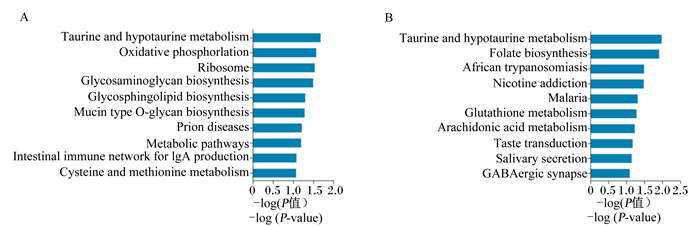
|
Taurine and hypotaurine metabolism:牛磺酸和亚牛磺酸代谢;Oxidative phosphorlation:氧化磷酸化;Ribosome:核糖体;Glycosaminoglycan biosynthesis:糖胺聚糖生物合成;Glycosphingolipid biosynthesis:鞘糖脂生物合成;Mucin type O-glycan biosynthesis:黏蛋白型O-聚糖生物合成;Prion diseases:朊病毒疾病;Metabolic pathways:代谢通路;Intestinal immune network for IgA production:免疫球蛋白A生成的肠道免疫网络;Cysteine and methionine metabolism:半胱氨酸和蛋氨酸代谢;Folate biosynthesis:叶酸生物合成;African trypanosomiasis:非洲锥虫病;Nicotine addiction:尼古丁成瘾;Malaria:疟疾;Glutathione metabolism:谷胱甘肽代谢;Arachidonic acid metabolism:花生四烯酸代谢;Taste transduction:味觉转导;Salivary secretion:唾液分泌;GABAergic synapse:GABA能突触。 图 3 KEGG pathway分析(A:上调基因;B:下调基因) Figure 3 KEGG pathway (A: up-regulated genes; B: down-regulated genes) |
采用Omicsbean系统构建PPI模型,结果如图 4所示。在该PPI网络中,代谢通路占主导地位,与其有联系的蛋白有ATP合成酶5I(ATP5I)、肠碱性磷酸酶(ALPI)、半胱氨酸双加氧酶1(CDO1)、GGT1、线粒体ND4L(MT-ND4L)、线粒体ATP合成酶8(MT-ATP8)等。通过这些蛋白,该通路又与谷胱甘肽代谢、氧化磷酸化、甘鞘糖脂生物合成、糖胺聚糖生物合成等通路相互联系,共同调节肠道代谢。
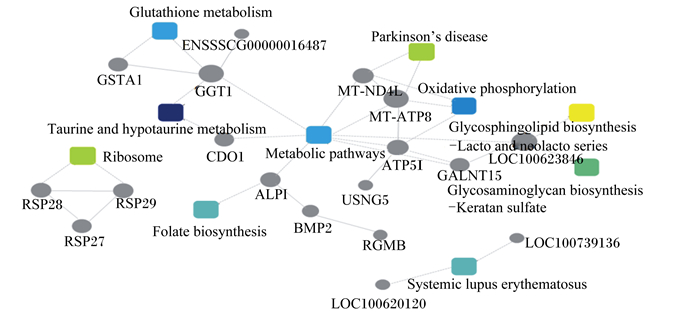
|
Glutathione metabolism:谷胱甘肽代谢;Parkinson’s disease:帕金森病;Oxidative phosphorylation:氧化磷酸化;Glycosphingolipid biosynthesis:鞘糖脂生物合成;Lacto and neolacto series:乳糖和新乳糖;Glycosaminoglycan biosynthesis:糖胺聚糖生物合成;Keratan sulfate:硫酸角质素;Systemic lupus erythematosus:系统性红斑狼疮;Folate biosynthesis:叶酸生物合成;Taurine and hypotaurine metabolism:牛磺酸和亚牛磺酸代谢;Ribosome:核糖体。 图 4 蛋白质互作分析 Figure 4 PPI analysis |
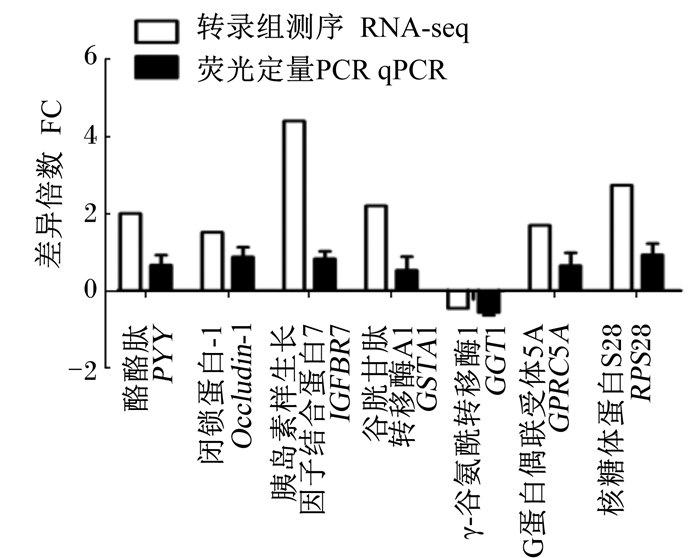
通过荧光定量PCR对结肠黏膜差异表达基因的表达水平进行测定,包括6个上调差异表达基因(PYY、Occludin-1、IGFBR7、GSTA1、GRPC5A、RPS28)和1个下调差异表达基因(GGT1),结果如图 5所示。从图中可以看出,荧光定量PCR与转录组测序中各基因表达水平的变化趋势相一致,从而证实了转录组测序结果的可靠性。
|
图 5 转录组测序与荧光定量PCR中所选基因表达水平的差异倍数比较 Figure 5 Comparison on FC of selected gene expression levels using RNA-seq and qPCR |
本研究通过转录组测序技术探究了盲肠灌注丙酸对生长猪结肠黏膜基因表达的影响。研究发现,丙酸灌注影响了一些参与糖代谢和能量代谢的基因如PYY、IGFBP7、ALDOB、LOC100624129、ND4L、CYP39A1等的表达,改变了肠道屏障功能及免疫相关基因如Occludin-1、SST、GPRC5A等的表达。对差异表达基因进行GO及KEGG pathway分析发现,丙酸使结肠黏膜在生物学过程和代谢通路上发生了显著变化,主要涉及到糖代谢、能量代谢等。此外,差异表达基因在免疫调节相关通路也有富集。结果提示,丙酸改变了结肠黏膜中糖代谢及免疫相关基因的表达水平,可能在结肠代谢及机体代谢中发挥重要的调节作用。
差异表达基因富集的糖代谢及能量代谢相关GO term主要包括糖基化合物、糖类衍生物、碳水化合物代谢、糖胺聚糖生物、鞘糖脂生物合成、氧化磷酸化等。在糖基化合物生物学过程中,PYY、IGFBP7、ALDOB等基因的表达水平在丙酸的作用下显著上调。PYY与许多消化过程有关,它能够增强胰岛素敏感性,抑制胃液分泌,降低肠胃蠕动,参与维持机体能量平衡和葡萄糖稳态[4, 14-15]。研究发现,短链脂肪酸能够通过促使结肠分泌PYY进而起到调控肠道蠕动的作用[10]。IGFBP7是胰岛素样生长因子结合蛋白家族成员,有研究发现,IGFBP7能够与IGF-1受体结合并通过胰岛素样生长因子阻断其激活[16]。ALDOB是糖异生过程中的重要酶类物质,它能催化甘油醛-3-磷酸向果糖-1, 6-二磷酸转变。这些基因表达的改变表明,丙酸促进了肠道葡萄糖生成,对肠道糖代谢及胃肠道消化吸收功能产生了影响。
此外,灌注丙酸后,结肠黏膜中氧化磷酸化过程也被显著富集。其中,ATP合成酶ATP5I及LOC100624129、ND4L、CYP39A1等基因的表达水平显著上调。氧化磷酸化是机体获得能量的重要途径。其中LOC100624129是一种过氧化物酶生物合成因子,ND4L是NADH脱氢酶亚基,CYP39A1是细胞色素P450,它们均是生物氧化过程的重要组成部分,能够将体内的糖、脂肪、蛋白质等营养物质氧化产生能量以供机体生命活动所需[17-18]。该结果提示,丙酸对结肠的能量代谢起到一定的调节作用。
除了在糖代谢及能量代谢中的影响外,本研究还发现,许多与免疫相关基因的表达发生了显著变化。前人研究显示短链脂肪酸在结肠免疫细胞稳态及肠道免疫系统发挥着调节作用[19-21]。本试验发现,丙酸显著上调了Occludin-1、SST、GPRC5A等与肠道屏障功能及免疫相关基因的表达。Occludin-1是一种重要的紧密连接蛋白,能够维持细胞的通透性,保障肠道屏障功能[22-23]。SST能抑制炎症因子的生成与释放,从而抑制炎症的发生与发展[24-25]。另有研究发现,SST会影响肠道上皮紧密连接,改善由内毒素所导致的上皮紧密连接蛋白表达水平降低的状况,有利于肠道屏障功能的维持[26]。GPRC5A是一种G蛋白偶联受体,GPRC5A基因的敲除导致小鼠上皮细胞的核因子-κB(NF-κB)被活化,促进了炎症及肿瘤的发生[27-28]。GSTA1则能够催化内源性或外源性有害物质与还原性谷胱甘肽结合,生成无毒衍生物被分解或排出体外,起到解毒作用,有利于维持机体的免疫水平[29]。因此,丙酸对这些基因表达的调节,揭示丙酸作为一种短链脂肪酸,对宿主肠道屏障及免疫功能具有调节作用。
4 结论生长猪盲肠灌注丙酸,改变了结肠糖代谢和能量代谢,以及肠道屏障与免疫功能相关基因的表达,揭示丙酸对结肠代谢及机体健康有一定的调节作用。
| [1] |
ZHANG G Y, HAMAKER B R. Cereal carbohydrates and colon health[J]. Journal of Food Science & Biotechnology, 2012, 87(4): 331-341. |
| [2] |
WONG J M W, DE SOUZA R, KENDALL C W C, et al. Colonic health:fermentation and short chain fatty acids[J]. Journal of Clinical Gastroenterology, 2006, 40(3): 235-243. DOI:10.1097/00004836-200603000-00015 |
| [3] |
DEN BESTEN G, VAN EUNEN K, GROEN A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. Journal of Lipid Research, 2013, 54(9): 2325-2340. DOI:10.1194/jlr.R036012 |
| [4] |
CHAMBERS E S, MORRISON D J, FROST G. Control of appetite and energy intake by SCFA:what are the potential underlying mechanisms?[J]. Proceedings of the Nutrition Society, 2015, 74(3): 328-336. DOI:10.1017/S0029665114001657 |
| [5] |
WOLEVER T M, BRIGHENTI F, ROYALL D, et al. Effect of rectal infusion of short chain fatty acids in human subjects[J]. American Journal of Gastroenterology, 1989, 84(9): 1027-1033. |
| [6] |
刘小华, 李舒梅, 熊跃玲. 短链脂肪酸对肠道功效及其机制的研究进展[J]. 肠外与肠内营养, 2012, 19(1): 56-58. |
| [7] |
DELAERE F, DUCHAMPT A, MOUNIEN L, et al. The role of sodium-coupled glucose co-transporter 3 in the satiety effect of portal glucose sensing[J]. Molecular Metabolism, 2012, 2(1): 47-53. |
| [8] |
DE VADDER F, KOVATCHEVA-DATCHARY P, GONCALVES D, et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J]. Cell, 2014, 156(1/2): 84-96. |
| [9] |
TODESCO T, RAO A V, BOSELLO O, et al. Propionate lowers blood glucose and alters lipid metabolism in healthy subjects[J]. The American Journal of Clinical Nutrition, 1991, 54(5): 860-865. DOI:10.1093/ajcn/54.5.860 |
| [10] |
PSICHAS A, SLEETH M L, MURPHY K G, et al. The short chain fatty acid propionate stimulates GLP-1 and PYY secretion via free fatty acid receptor 2 in rodents[J]. International Journal of Obesity, 2015, 39(3): 424-429. DOI:10.1038/ijo.2014.153 |
| [11] |
DE SILVA A, SALEM V, LONG C J, et al. The gut hormones PYY3-36 and GLP-17-36 amide reduce food intake and modulate brain activity in appetite centers in humans[J]. Cell Metabolism, 2011, 14(5): 700-706. DOI:10.1016/j.cmet.2011.09.010 |
| [12] |
TEDELIND S, WESTBERG F, KJERRULF M, et al. Anti-inflammatory properties of the short-chain fatty acids acetate and propionate:a study with relevance to inflammatory bowel disease[J]. World Journal of Gastroenterology, 2007, 13(20): 2826-2832. DOI:10.3748/wjg.v13.i20.2826 |
| [13] |
李建平, 秦贵信, 赵志辉, 等. 不同脂肪源饲粮育成猪肝脏转录组差异分析[J]. 动物营养学报, 2015, 27(7): 2128-2139. |
| [14] |
SIMPSON K, PARKER J, PLUMER J, et al. CCK, PYY and PP: the control of energy balance[M]//JOOST H G. Handbook of experimental pharmacology. Berlin: Springer, 2012209-230.
|
| [15] |
DE SILVA A, BLOOM S R. Gut hormones and appetite control:a focus on PYY and GLP-1 as therapeutic targets in obesity[J]. Gut and Liver, 2012, 6(1): 10-20. DOI:10.5009/gnl.2012.6.1.10 |
| [16] |
EVDOKIMOVA V, TOGNON C E, BENATAR T, et al. IGFBP7 binds to the IGF-1 receptor and blocks its activation by insulin-like growth factors[J]. Science Signaling, 2012, 5(255): ra92. |
| [17] |
ORTIZ DE MONTELLANO P R. Cytochrome P450:structure, mechanism, and biochemistry[M]. 3rd ed.Berlin: Springer, 2005.
|
| [18] |
BLANCO A, BLANCO G. Biological oxidations: bioenergetics[M]//BLANCO A, BLANCO G. Medical biochemistry. Amsterdam: Elsevier, 2017.
|
| [19] |
MEIJER K, DE VOS P, PRIEBE M G. Butyrate and other short-chain fatty acids as modulators of immunity:what relevance for health?[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2010, 13(6): 715-721. DOI:10.1097/MCO.0b013e32833eebe5 |
| [20] |
SMITH P M, HOWITT M R, PANIKOV N, et al. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis[J]. Science, 2013, 341(6145): 569-573. DOI:10.1126/science.1241165 |
| [21] |
ARPAIA N, CAMPBELL C, FAN X Y, et al. Metabolites produced by commensal bacteria promote peripheral regulatory Tcell generation[J]. Nature, 2013, 504(7480): 451-455. DOI:10.1038/nature12726 |
| [22] |
SUZUKI T. Regulation of intestinal epithelial permeability by tight junctions[J]. Cellular and Molecular Life Sciences, 2013, 70(4): 631-659. DOI:10.1007/s00018-012-1070-x |
| [23] |
VAN ITALLIE C M, ANDERSON J M. Architecture of tight junctions and principles of molecular composition[J]. Seminars in Cell & Developmental Biology, 2014, 36: 157-165. |
| [24] |
TEN BOKUM A M, HOFLAND L J, VAN HAGEN P M. Somatostatin and somatostatin receptors in the immune system:a review[J]. European Cytokine Network, 2000, 11(2): 161-176. |
| [25] |
CHOWERS Y, CAHALON L, LAHAV M, et al. Somatostatin through its specific receptor inhibits spontaneous and TNF-alpha-and bacteria-induced IL-8 and IL-1 beta secretion from intestinal epithelial cells[J]. Journal of Immunology, 2000, 165(6): 2955-2961. DOI:10.4049/jimmunol.165.6.2955 |
| [26] |
雷姗. 生长抑素对肠上皮细胞屏障功能的保护作用及机制研究[D]. 博士学位论文. 广州: 南方医科大学, 2014.
|
| [27] |
BARTA P, VAN PELT C, MEN T Y, et al. Enhancement of lung tumorigenesis in a gprc5a knockout mouse by chronic extrinsic airway inflammation[J]. Molecular Cancer, 2012, 11(1): 4. DOI:10.1186/1476-4598-11-4 |
| [28] |
DENG J, FUJIMOTO J, YE X F, et al. Knockout of the tumor suppressor gene Gprc5a in mice leads to NF-κB activation in airway epithelium and promotes lung inflammation and tumorigenesis[J]. Cancer Prevention Research, 2010, 3(4): 424-437. DOI:10.1158/1940-6207.CAPR-10-0032 |
| [29] |
COLEMAN J, BLAKE-KALFF M, DAVIES E. Detoxification of xenobiotics by plants:chemical modification and vacuolar compartmentation[J]. Trends in Plant Science, 1997, 2(4): 144-151. DOI:10.1016/S1360-1385(97)01019-4 |




