乳脂和乳蛋白作为牛奶的主要成分,是衡量乳制品的重要营养指标。维生素A(vitamin A)是维持动物机体正常生理代谢的必需营养素之一。维生素A能通过调控多种基因的表达来影响动物机体的生长发育、免疫及代谢,也能对多种动物的脂类代谢产生影响。王文娟等[1]发现饲粮维生素A水平的降低会提高牛肉大理石花纹的得分,而Arnett等[2]结果表明,羔羊饲粮中补饲高水平的维生素A 112 d可以提高其总肌内脂肪含量;丁明岩[3]研究发现,在石斑鱼饲料中添加2 000~4 000 IU/kg维生素A时,脂类分解代谢得到显著提高,显著高于0和2 000 IU/kg组。这些结果说明维生素A对动物的脂类代谢有显著的影响。Oldman等[4]研究表明,在分娩前60 d到产后42 d,奶牛饲喂170 000 IU/d的维生素A与饲喂50 000 IU/d的维生素A相比,产奶量显著提高,包括乳脂、乳蛋白等在内的乳成分的合成也增加。本课题组前期研究发现,饲粮中添加高剂量(220 IU/kg BW)的过瘤胃保护维生素A,奶牛产奶量、乳脂率、乳蛋白率以及日均乳脂产量和乳蛋白产量有高于低剂量(110 IU/kg BW)组的趋势[5]。然而,关于维生素A是否对奶牛的乳脂、乳蛋白合成产生影响的报道甚少。奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)是乳脂和乳蛋白合成与分泌的重要场所,其细胞的生物合成能力决定了奶牛乳腺的泌乳能力。因此,本试验选用BMECs为模型,以乳脂和乳蛋白合成相关酶活性及基因表达量为考察指标,研究维生素A对乳脂和乳蛋白合成的影响,为奶牛生产中维生素A的合理添加以及改善乳成分的组成提供依据。
1 材料与方法 1.1 主要试剂胶原酶Ⅱ(17101-015)、DMEM/F12基础培养基(12400-024)、胰岛素转铁蛋白硒钠(51500-056)、胎牛血清(FBS,10099-141)、胰蛋白酶/乙二胺四乙酸(EDTA,25300054)和双抗(15140-122)购自Gibco公司;两性霉素B(AE437)、催乳素(PRL,L6520)、视黄酸(RA,R2625)、表皮生长因子(EGF,E4127)、氢化可的松(IJ0135)购自Sigma公司;四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)购自Amresco公司;磷酸盐缓冲溶液(PBS)购自HyClone公司;PrimeScriptTM RT Master Mix(DRR036A)、SYBR Premix Ex TagTM Ⅱ(DRR820A)、RNAiso Plus(D9109B)购自宝生物工程(大连)有限公司;氯仿、无水乙醇、异丙醇购自天津市风船化学试剂科技有限公司。
1.2 试剂配制生长培养基:在每100 mL DMEM/F12基础培养基中添加FBS 10 mL,双抗2 mL,胰岛素转铁蛋白硒钠0.5 mL,PRL、两性霉素B和氢化可的松各100 μL及EGF 10 μL。
维生素A贮备液的配制:将100 mg RA(维生素A的主要活性代谢物质)溶于5 mL DMSO溶液,配制成20.00 mg/mL维生素A原液,再将其稀释成浓度分别为0、0.05、0.10、0.20、1.00和2.00 mg/mL的维生素A贮备液,0.22 μmol/L滤器过滤。
1.3 BMECs的培养BMECs培养采用胶原酶消化法。从屠宰场取健康荷斯坦奶牛乳腺组织低温保存运回实验室,剪为1 cm×1 cm×1 cm大小的组织块,用3×双抗PBS将其清洗3遍,75%酒精清洗30 s,1×双抗PBS清洗3遍,剪取腺泡丰富的部位放入5 mL无酶无菌离心管中,剪碎至糊状后加入等体积0.5%的胶原酶Ⅱ,37 ℃消化1 h,每20 min上下颠倒混匀,使其充分消化。80目滤网过滤,172×g离心5 min,PBS冲洗1次,再离心细胞3 min,之后用生长培养基悬浮接种于25 cm透气细胞瓶内,于37 ℃ 5% CO2培养箱中培养直至细胞贴壁至90%,之后用0.05%胰蛋白酶/EDTA纯化和传代细胞。
1.4 试验设计试验采用单因素完全随机试验设计,将贴壁生长的第3代BMECs随机分为6个处理,每个处理6个重复。使用无血清培养基饥饿处理24 h后,添加维生素A浓度分别为0、0.05、0.10、0.20、1.00和2.00 μg/mL的培养基,其中0 μg/mL维生素A组为对照组,继续培养24 h后按照试验要求的细胞收集方法进行细胞收集和相关指标的测定。
1.5 测定指标与方法细胞活力用MTT比色法[6]检测,以细胞相对增殖率(RGR)表示。在培养结束前4 h,每孔加入20 μL MTT,4 h后弃上清,每孔加入100 μL DMSO,振荡10 min后,用全自动酶标仪检测490 nm波长下各培养孔的吸光度(OD)值。
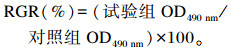
|
细胞内甘油三酯(TG)含量依照试剂盒(E1013,北京普利莱基因技术有限公司)说明书要求进行测定。细胞培养结束后弃上清,用PBS洗涤2次,每孔加入200 μL裂解液作用10 min,收集裂解液于1.5 mL离心管中,1 200×g离心5 min,取上清70 ℃加热10 min,424×g离心5 min后取上层清液进行测定。
以磷酸甘油醛脱氢酶(GAPDH)作为内参基因,采用实时荧光定量PCR仪(ABI-7500,ABI公司)测定细胞内乳脂、乳蛋白合成相关基因的表达量。测定基因主要包括乳脂合成相关基因脂肪酸合成酶(FASN)、乙酰辅酶A羧化酶(ACACA)、脂酰辅酶A去饱和酶(SCD)、脂蛋白酯酶(LPL)、脂肪酸结合蛋白3(FABP3)、固醇调节元件结合蛋白1(SREBP1)、过氧化酶体增殖物激活受体γ(PPARG),乳蛋白合成相关基因αs1-酪蛋白(CSN1S1)、β-酪蛋白(CSN2)、κ-酪蛋白(CSN3)、真核起始因子4E(eIF4E)、真核起始因子4E结合蛋白1(4EBP1)、雷帕霉素靶蛋白(mTOR)、p70核糖体蛋白S6激酶1(S6K1)、信号传导和转录激活因子5(STAT5),其引物序列及参数见表 1。反应程序为:95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸20 s,进行40个循环;72 ℃延伸7 min;熔解曲线为:70~95 ℃,每6 s升温0.5 ℃,共51个循环,基因的表达量采用2-∆∆Ct法进行计算。
|
|
表 1 引物序列及参数 Table 1 Primer sequence and parameters |
乳脂和乳蛋白合成相关酶活性和蛋白含量按照酶联免疫吸附试验(ELISA)试剂盒的操作说明书进行,主要包括BMECs内乳脂合成相关酶脂肪酸合成酶(FAS)、ACACA、LPL、SCD的活性,乳蛋白合成相关酶S6K1的活性以及mTOR的含量。
1.6 数据统计分析试验数据使用SAS 9.0软件ANOVA程序进行方差分析,并用Duncan氏法进行多重比较。P<0.05为差异显著判断标准,0.05≤P<0.10为差异趋于显著判断标准。
2 结果 2.1 RGR、TG含量和乳脂合成相关基因的表达由表 2可知,1.00、2.00 μg/mL维生素A组的RGR和TG含量显著高于对照组(P<0.05)。对于FASN基因表达量,以0.10 μg/mL维生素A组最高,显著高于对照组(P<0.05),与0.05 μg/mL维生素A组差异不显著(P>0.05);对于ACACA基因表达量,除2.00 μg/mL维生素A组外的所有维生素A组均显著高于对照组(P<0.05),且以0.10 μg/mL维生素A组最高;所有维生素A组的PPARG基因表达量显著高于对照组(P<0.05),以1.00 μg/mL维生素A组最高;对于SREBP1、SCD基因表达量,以0.05、0.10 μg/mL维生素A组显著高于对照组(P<0.05),0.20、1.00、2.00 μg/mL维生素A组与对照组无显著差异(P>0.05)。
|
|
表 2 维生素A对BMECs内RGR、TG含量和乳脂合成相关基因表达的影响 Table 2 Effects of vitamin A on intracellular RGR, TG content and mRNA expression related to milk fat synthesis in BMECs |
由表 3可知,0.05和0.10 μg/mL维生素A组的CSN1S1基因表达量较高,显著高于对照组和其他维生素A组(P<0.05),且0.20和1.00 μg/mL维生素A组显著高于对照组(P<0.05)。对于CSN3基因表达量,0.10 μg/mL维生素A组显著高于对照组及0.20、1.00、2.00 μg/mL维生素A组(P<0.05),0.20、1.00和2.00 μg/mL维生素A组与对照组无显著差异(P>0.05);对于mTOR基因表达量,0.10 μg/mL维生素A组显著高于对照组(P<0.05),其他维生素A组与对照组无显著差异(P>0.05);对于STAT5基因表达量,以0.05、0.10和0.20 μg/mL维生素A组较高,尤以0.20 μg/mL维生素A组最高,显著高于对照组(P<0.05),其他各维生素A组与对照组无显著差异(P>0.05);0.10、1.00 μg/mL维生素A组的eIF4E基因表达量相比对照组有增加的趋势(P=0.07)。
|
|
表 3 维生素A对BMECs内乳蛋白合成相关基因表达的影响 Table 3 Effects of vitamin A on mRNA expression related to milk protein synthesis in BMECs |
由表 4可知,对于ACACA活性,除2.00 μg/mL维生素A组与对照组无显著差异(P>0.05)外,其他维生素A组均显著高于对照组(P<0.05),且以0.10 μg/mL维生素A组最高;维生素A对乳脂合成相关酶FAS和LPL活性无显著的影响(P>0.05),但从数值上看,0.05和0.10 μg/mL维生素A组的FAS活性最高,且高于其他各组;SCD的活性以0.05、0.10 μg/mL维生素A组趋于显著地高于对照组(P=0.08);相比对照组,1.00 μg/mL维生素A组提高了mTOR含量,但差异不显著(P>0.05),但显著高于0.05、0.20和2.00 μg/mL维生素A组(P<0.05)。0.10和1.00 μg/mL维生素A组S6K1活性略高于其他各组,但差异不显著(P>0.05)。
|
|
表 4 维生素A对BMECs内乳脂和乳蛋白合成相关酶活性和蛋白含量的影响 Table 4 Effects of vitamin A on enzyme activity and protein content related to milk fat and protein synthesis in BMECs |
乳脂主要由TG组成,其含量约占所有乳脂成分的98%。乳腺中从头合成及从血液吸收的脂肪酸在BMECs的内质网上合成TG,随后形成大小不一的脂滴分泌至胞外[10]。本试验中,1.00、2.00 μg/mL的维生素A增加了BMECs的RGR及TG含量,说明维生素A可以促进BMECs内乳脂的合成。ACACA和FASN在BMECs内作用于乙酸和β-羟丁酸使其从头合成中短链脂肪酸,乳中约1/2的C16 : 0和几乎全部的C4 : 0~C14 : 0依赖于乳腺的从头合成。ACACA是脂肪酸合成第1阶段的限速酶,中链脂肪酸的合成则主要通过FASN,且FASN会参与其碳链延长的整个过程。本试验结果表明,添加维生素A可提高BMECs内ACACA、FASN基因的表达量,说明维生素A可能促进了BMECs内脂肪酸的从头合成,引起TG含量的上升。张娜等[11]分析了不同乳品质奶牛乳腺中乳脂合成相关基因的表达,结果表明高乳品质奶牛的乳腺中FASN基因的表达量低于低乳品质的奶牛,而二者的ACACA活性无显著差异,表明ACACA虽然是脂肪酸从头合成的重要限速酶,但酶活性却不是影响乳中脂肪含量的主要因素。在本试验中,维生素A提高了BMECs中TG含量,但其促进浓度和ACACA、FASN基因表达的不一致,说明TG含量的增加可能不是完全通过促进脂肪酸的从头合成来实现的,具体原因还有待于进一步研究。PPARG、SREBP1分别属于核转录因子家族和核激素受体家族中的配体激活受体,二者作为脂肪合成基因网络中重要的转录调控因子,都能直接调控ACACA、FASN、SCD、LPL等靶基因,进而调节脂肪酸的转运、合成及去饱和过程。脂肪合成相关基因的表达量和酶活性都是调控反刍动物乳脂分泌的重要因素[12],长链脂肪酸进入BMECs后需要去饱和[13]。SCD则是催化饱和脂肪酸形成单不饱和脂肪酸的关键限速酶,SCD的催化产物是TG合成的重要组成部分。有研究表明,激活的PPAR可以和类维生素A X受体(retinoids X recepter,RXR)形成异源二聚体,然后和靶基因PPARG相互作用来调控基因的转录和表达,而维生素A的代谢产物9-cis RA是RXR的有效配体[14]。本试验结果得出,维生素A上调了PPARG、SREBP1和SCD基因表达的同时,也促进ACACA、FASN基因的表达,且ACACA、FASN、SCD活性与其靶基因的表达量也呈现相似的变化规律,提示添加维生素A增加了BMECs内的TG含量,可能与提高了PPARG、SREBP1的基因表达量进而上调其下游靶基因FASN、ACACA、SCD等脂肪酸合成相关酶的转录水平有关,但关于具体机制的研究报道甚少,需要进一步探讨。
本试验中,维生素A对BMECs内乳脂的合成与其浓度有关,1.00、2.00 μg/mL的维生素A对细胞内TG含量促进效果较好;各浓度维生素A对FASN、ACACA、PPARG、SCD基因表达均有促进效果,FASN、SREBP1、SCD基因表达量均以0.05和0.10 μg/mL维生素A组较高;ACACA以0.10 μg/mL维生素A组增加效果最为明显;PPARG尤以1.00 μg/mL上调作用最明显。2.00 μg/mL的维生素A虽然对TG含量具有促进效果,但乳脂合成相关基因表达量与对照组相比差异不显著。综合考虑,以0.10 μg/mL的维生素A对BMECs乳脂合成的促进作用较强。
3.2 维生素A对BMECs内乳蛋白合成相关基因表达的影响乳蛋白主要由酪蛋白组成,约占80%,包括CSN1S1、CSN1S2、CSN2和CSN3,其中CSN1S1和CSN3是反映乳蛋白合成的主要蛋白质,其基因表达量可反映BMECs内乳蛋白的合成水平[15]。乳蛋白合成主要由2条信号通路来调控,分别是主要在PRL作用下从基因转录水平调控乳蛋白合成的Juns激酶(JAK)-信号转导转录激活因子(STAT)信号通路[16]和从蛋白质翻译水平起生乳调节作用的mTOR信号通路[17]。mTOR属于磷脂酰肌醇激酶相关激酶超家族,是一种丝氨酸/苏氨酸激酶。在奶牛乳腺组织中,mTOR信号通路能控制乳蛋白相关基因的翻译,S6K1是mTOR的下游调节激酶,二者的磷酸化激活可促进BMECs内乳蛋白的合成。本试验结果表明,添加一定浓度的维生素A能显著提高CSN1S1和CSN3的基因表达量,同时显著提高STAT5的基因表达量。结果也得出,0.10和1.00 μg/mL维生素A组的mTOR和eIF4E的基因表达量高于对照组,mTOR含量和S6K1活性也有相似的变化规律,提示维生素A可能是通过mTOR信号通路使mTOR和S6K1激活从而促进乳蛋白合成。这些结果说明,维生素A对CSN1S1和CSN3基因表达有提高的作用可能与mTOR和STAT5信号通路有关,但相关研究鲜有报道,需要进一步研究。胰岛素样生长因子(IGF)系统是一类与胰岛素呈高度同源的多肽生长因子,RA可以在不同的细胞系中引起IGF-Ⅰ、IGF-Ⅱ及IGF结合蛋白(IGFBP)表达的变化[18]。何伯萍等[19]通过在分离培养的BMECs中添加不同浓度的IGF-Ⅰ作用24 h后发现,IGF-Ⅰ能够显著促进CSN2和ACACA基因的表达,并且具有浓度依赖性,表明IGF-Ⅰ可作为信号分子调节乳腺的泌乳功能。王皓宇等[20]研究发现,胰岛素处理BMECs 24 h可以显著上调细胞中CSN2、CSN3、STAT5、ACACA、FASN、SREBP1基因的表达。所以本试验中维生素A对乳脂、乳蛋白合成相关基因的影响也可能是通过提高IGF及IGFBP的表达来实现的,需要进一步研究。
本试验结果也得出,维生素A对BMECs内乳蛋白合成相关基因表达量的影响与其浓度有关。低浓度的维生素A对BMECs内乳蛋白合成的促进效果更好。0.05、0.10 μg/mL维生素A能显著上调CSN1S1和mTOR基因表达,0.10、0.20 μg/mL维生素A组则对CSN3、STAT5基因表达的促进作用更好,而2.00 μg/mL维生素A组均与对照组差异不显著。综合考虑,0.10 μg/mL维生素A对BMECs内乳蛋白合成基因表达的促进作用较好。
4 结论① 维生素A可提高BMECs细胞活力和TG含量。
② 维生素A能上调BMECs内乳脂合成相关基因FASN、ACACA、PPARG、SREBP1、SCD基因和乳蛋白合成相关基因CSN1S1、CSN3、STAT5、mTOR基因的表达,但其作用效果与其浓度有关。
③ 0.10 μg/mL维生素A对乳脂、乳蛋白合成相关基因表达的促进效果较好。
| [1] |
王文娟, 汪水平, 龚月生, 等. 日粮维生素A水平对肉牛牛肉品质的影响[J]. 西北农林科技大学学报(自然科学版), 2007, 35(8): 75-81. |
| [2] |
ARNETT A M, DIKEMAN M E, SPAETH C W, et al. Effects of vitamin A supplementation in young lambs on performance, serum lipid, and longissimus muscle lipid composition[J]. Journal of Animal Science, 2007, 85(11): 3062-3071. DOI:10.2527/jas.2007-0176 |
| [3] |
丁明岩. VA、VD对两种规格斜带石斑鱼生长、饲料利用、脂肪代谢及FAS、HL mRNA表达量的影响研究[D]. 硕士学位论文. 湛江: 广东海洋大学, 2015.
|
| [4] |
OLDHAM E R, EBERHART R J, MULLER L D. Effects of supplemental vitamin A or β-carotene during the dry period and early lactation on udder health[J]. Journal of Dairy Science, 1991, 74(11): 3775-3781. DOI:10.3168/jds.S0022-0302(91)78569-X |
| [5] |
鲍宏云. 过瘤胃保护维生素A对奶牛瘤胃发酵、产奶性能及免疫功能的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2011.
|
| [6] |
郑永唐, 贲昆龙. 测定细胞存活和增殖的MTT方法的建立[J]. 免疫学杂志, 1992, 8(4): 266-269. |
| [7] |
ZHOU Y, AKERS R M, JIANG H. Growth hormone can induce expression of four major milk protein genes in transfected MAC-T cells[J]. Journal of Dairy Science, 2008, 91(1): 100-108. DOI:10.3168/jds.2007-0509 |
| [8] |
BIONAZ M, LOOR J J. Gene networks driving bovine milk fat synthesis during the lactation cycle[J]. BMC Genomics, 2008, 9: 366. DOI:10.1186/1471-2164-9-366 |
| [9] |
张养东. 脂多糖对泌乳奶牛乳脂肪和乳蛋白影响及其机理研究[D]. 博士学位论文. 哈尔滨: 东北农业大学, 2011.
|
| [10] |
BAUMAN D E, MATHER I H, WALL R J, et al. Major advances associated with the biosynthesis of milk[J]. Journal of Dairy Science, 2006, 89(4): 1235-1243. DOI:10.3168/jds.S0022-0302(06)72192-0 |
| [11] |
张娜, 王小艳, 李庆章, 等. 奶牛乳腺中调控乳脂合成关键基因表达分析[J]. 东北农业大学学报, 2014, 45(6): 84-90. |
| [12] |
AHNADI C E, BESWICK N, DELBECCHI L, et al. Addition of fish oil to diets for dairy cows.Ⅱ.Effects on milk fat and gene expression of mammary lipogenic enzymes[J]. The Journal of Dairy Research, 2002, 69(4): 521-531. |
| [13] |
CHILLIARD Y, FERLAY A, MANSBRIDGE R M, et al. Ruminant milk fat plasticity:nutritional control of saturated, polyunsaturated, trans and conjugated fatty acids[J]. Annales de Zootechnie, 2000, 49(3): 181-205. DOI:10.1051/animres:2000117 |
| [14] |
赵向利, 张英杰. 维生素A对动物基因表达的调控[J]. 饲料工业, 2014, 35(17): 83-86. |
| [15] |
常晨城. 蛋氨酸及含蛋氨酸二肽对奶牛乳腺上皮细胞内乳蛋白合成相关基因表达的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2015.
|
| [16] |
BROCKMAN J L, SCHROEDER M D, SCHULER L A. PRL activates the cyclin D1 promoter Via the Jak2/Stat pathway[J]. Molecular Endocrinology, 2002, 16(4): 774-784. DOI:10.1210/mend.16.4.0817 |
| [17] |
RIUS A G, APPUHAMY J A D R N, CYRIAC J, et al. Regulation of protein synthesis in mammary glands of lactating dairy cows by starch and amino acids[J]. Journal of Dairy Science, 2010, 93(7): 3114-3127. DOI:10.3168/jds.2009-2743 |
| [18] |
MONGAN N P, GUDAS L J. Diverse actions of retinoid receptors in cancer prevention and treatment[J]. Differentiation, 2007, 75(9): 853-870. DOI:10.1111/j.1432-0436.2007.00206.x |
| [19] |
何伯萍, 邢艳苹, 雷连成, 等. IGF-Ⅰ对奶牛乳腺上皮细胞合成乳脂、乳蛋白的影响[J]. 中国兽医学报, 2012, 32(8): 1231-1234. |
| [20] |
王皓宇, 秦彤, 郝海生, 等. 胰岛素对体外培养奶牛乳腺上皮细胞乳蛋白、乳脂肪合成相关基因mRNA表达的影响[J]. 畜牧兽医学报, 2013, 44(5): 710-718. |




