2. 天津现代晨辉科技集团有限公司, 天津 301800
2. Tianjin Chenhui Modern Technology Co., Ltd., Tianjin 301800, China
鸡血藤是一味富含黄酮类化合物的中草药,其主要分布于广东、广西及云南地区。通过现代药理学研究得出,鸡血藤具有抗氧化、抗病毒、抗肿瘤、调节脂代谢的作用[1-5]。鸡血藤醇提物成分复杂,主要包括黄酮类、木脂素类、蒽醌类等,其中黄酮类是鸡血藤醇提物中指标性成分[1]。黄酮类化合物主要分为黄酮类、异黄烷酮类等,成分包括刺芒柄花素、芒柄花甙、樱黄素等[1]。黄酮类化合物在消除自由基和抑菌抗癌等方面效果显著,且无副作用,研究前景广阔。同时,黄酮类化合物对油脂的抗氧化作用有2种途径:一是消除铁、铜等金属离子的催化作用[6];二是将氢供给脂肪的自由基,自身则转变为酚基自由基,酚基自由基的稳定性会降低自动氧化的连锁反应的传递速度,能够抑制油脂的进一步氧化[7]。
黄颡鱼(Pelteobagrus fulvidrac)属鲶形目,黄颡鱼属,广泛分布于各个水系之中,是一种经济鱼类。黄颡鱼的肉质细嫩、鲜美,无肌间刺,同时具有较高的含肉率和中等含量的脂肪,矿物质含量较丰富,肌肉系水力较好,肉质具有硬度大、弹性好等特点,广受消费者们的喜爱,已成了我国新兴的养殖鱼类之一,也是市场上的名优品种。在天津地区,黄颡鱼的销量可观,养殖资源丰富,大池塘混养经济效益高[8]。但同时,由于近年来的高密度养殖,导致黄颡鱼疾病频发,发病池塘死亡率高,经济损失惨重,制约了黄颡鱼的健康可持续发展。基于此,本试验以黄颡鱼为研究对象,探讨鸡血藤醇提物对黄颡鱼抗氧化能力、非特异性免疫力和抗病力的影响,旨在寻求提高黄颡鱼抗氧化能力和非特异性免疫力,减少疾病发生的新型添加剂,为黄颡鱼用免疫增强剂的开发提供参考。
1 材料与方法 1.1 试验材料 1.1.1 试验鱼本试验所用黄颡鱼及室内养殖场均由天津市蓝科水产有限公司提高。选取同一批次的全雄黄颡鱼,初始体重为(35.25±1.63) g,初始体长为(14.07±0.24) cm。前期暂养30 d,投喂基础饲料,以驯化黄颡鱼适应饲料和养殖环境,每日换水1次,每次换1/3的水量。最终选取720条健康的黄颡鱼进行养殖试验。
1.1.2 试验饲料本试验所用饲料原料均购自天津市天祥水产有限责任公司,将所有饲料原料进行粉碎,通过80目筛后,进行混合,使用蒸馏水混匀,达到能成团、不掉粉即可。混匀后的饲料原料,使用平模饲料颗粒机制成直径为2.5 mm的颗粒饲料,转移至烘箱中,烘30 min后,取出放置于阴凉处,风干,转至干燥处避光保存,防止饲料变质。饲料制作的过程中,分别按照0(对照)、0.04%、0.08%、0.16%、0.32%和0.64%的添加量加入鸡血藤醇提物(购自西安瑞林生物科技有限公司),并分别标记为T1~T6组。试验饲料组成及营养水平见表 1。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
将前期选取出的720尾黄颡鱼进行分箱养殖,共分成6组,每组3个重复,每个重复40尾鱼,以重复为单位养殖在天津市蓝科水产有限公司孵化车间内的直径为1.5 m、深度为0.75 m的圆形孵化桶中,孵化桶分别记作T1-1、T1-2、T1-3、T2-1……T6-2、T6-3,投喂对应饲料。试验期间,增氧机24 h运行,每日投喂2次,分别于09:00、17:00。换水则每日下午进行,先更换1/3的水量,隔天更换2/3的水量,以保证试验期间水环境的稳定,避免因水质变化而引起病害。饲养试验为期2个月,饲养前后分别记录下黄颡鱼的体长、体高、体重,用于生长指标的测定。
1.2.2 样品采集饲养试验结束后,每个重复选取15尾鱼,使用2 mL一次性无菌注射器进行尾静脉取血,并以4 500 r/min的转速离心15 min,制得血清样品,于-80 ℃冻存待测。取血后的黄颡鱼在冰浴条件下解剖,分别取出鳃、脑、头肾、中肾、肝胰脏、脾脏,用生理盐水洗去附着于器官表面的血块及脂肪组织,鳃、脑、头肾、中肾、肝胰脏、脾脏按照1 : 9的质量体积比加入生理盐水制成10%的匀浆液,肠道则按照1 : 4的质量体积比加入生理盐水制成20%的匀浆液,经过4 000 r/min、20 min的离心,静止充分沉淀后,取上清液置于-80 ℃保存备用。
1.2.3 指标测定 1.2.3.1 饲料营养成分测定水分含量采用105 ℃常压恒温烘干法(GB/T 5009.3—2010)测定,粗蛋白质(CP)含量采用杜马斯灼烧法(GB/T 24318—2009)测定,粗脂肪(EE)含量采用索氏抽提法(GB/T 5009.6—2010)测定,粗灰分(Ash)含量采用550 ℃高温灼烧法(GB/T 5009.4—2010)测定,钙(Ca)含量采用高锰酸钾滴定法(GB/T 6436—2002)测定,总磷(TP)含量采用钼钒酸比色法(GB/T 6437—2002)测定,总糖(TS)含量采用铁氰化钾法(GB/T 9695.31—1991)测定。总能(GE)利用公式计算得出,计算公式为:
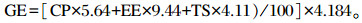
|
丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、一氧化氮(NO)、谷丙转氨酶(GTP)、谷草转氨酶(GOP)、补体3(C3)、球蛋白M(IgM)、白蛋白(ALB)测定试剂盒均购自南京建成生物工程研究所,具体测定方法参照所附说明书。
1.2.3.3 抗病力测定饲养试验结束后,使用天津水产研究所保存的嗜水气单胞菌(Aeromonas hydrophila)进行攻毒试验。将嗜水气单胞菌活化后,使用无菌磷酸盐缓冲液(PBS)将浓度调至2×108 CFU/mL,每箱取10尾体长、体重基本一致的黄颡鱼,按每100 g体重腹腔注射菌液2 mL的剂量进行攻毒注射,保持养殖条件不变,每天定时观察并记录鱼体死亡情况,试验周期为1周,统计各组鱼的累积死亡率(cumulative mortality)和免疫保护率(immune protective rate)。
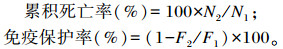
|
式中:N1为初受感染鱼尾数;N2为终死亡鱼尾数;F1为对照组死亡率;F2为试验组死亡率。
1.4 数据处理与分析试验数据用平均值±标准误表示,采用SPSS 16.0软件包中的单因素方差分析(one-way ANOVA)和LSD法多重比较进行分析,以P<0.05作为差异显著性标准。
2 结果与分析 2.1 鸡血藤醇提物对黄颡鱼体内抗氧化指标的影响 2.1.1 鸡血藤醇提物对黄颡鱼体内SOD活性的影响由表 2可知,对照组黄颡鱼体内SOD活性顺序为肝胰脏>中肾>脾脏>鳃>头肾>血清>脑;添加鸡血藤后,黄颡鱼体内SOD活性排序基本不变,仅T3、T5、T6组鳃和头肾交换了位置。与对照组相比,T2组肝胰脏、中肾、脾脏、鳃、头肾、血清、脑中SOD活性虽均有升高,但差异均未达显著水平(P>0.05);T3组中肾、脾脏和血清中SOD活性显著提高(P<0.05),分别为对照组的1.68、1.58和1.33倍;T4组肝胰脏、中肾、脾脏、鳃、头肾、血清、脑中SOD活性均显著提高(P<0.05),分别为对照组的1.51、2.37、1.92、1.81、1.73、1.48、1.70倍;T5组肝胰脏、中肾、脾脏、鳃和头肾中SOD活性显著提高(P<0.05),分别为对照组1.30、2.03、1.83、1.34和1.43倍。
|
|
表 2 鸡血藤提取物对黄颡鱼体内SOD活性的影响 Table 2 Effects of Caulis spatholobi ethanol extract on SOD activity of Pelteobagrus fulvidraco |
由表 3可知,对照组黄颡鱼体内MDA含量顺序为脾脏<中肾<鳃<头肾<肝胰脏<血清<脑,T2、T5、T6黄颡鱼体内MDA含量排序与对照组一致,T3和T4组稍有变化,为中肾<脾脏<鳃<头肾<肝胰脏<血清<脑。与对照组相比,T2组头肾和脾脏中MDA含量显著降低(P<0.05),分别比对照组降低了23.9%和17.8%;T3组头肾、血清、脾脏和中肾中MDA含量显著降低(P<0.05),分别比对照组降低了29.9%、47.9%、27.8%和38.9%;T4组头肾、血清、脑、脾脏和中肾中MDA含量显著降低(P<0.05),分别比对照组降低了60.5%、56.0%、48.8%、45.0%和59.1%;T5组肝胰脏、头肾、血清、鳃、脑、脾脏和中肾中MDA含量均显著降低(P<0.05),分别比对照组降低了60.6%、38.9%、42.1%、59.7%、54.7%、54.4%和45.3%;T6组头肾、鳃、脑、脾脏和中肾中MDA含量显著降低(P<0.05),分别比对照组降低了37.4%、54.6%、46.1%、33.9%和38.9%。
|
|
表 3 鸡血藤提取物对黄颡鱼体内MDA含量的影响 Table 3 Effects of Caulis spatholobi ethanol extract on MDA content of Pelteobagrus fulvidraco |
由表 4可知,对照组以及T2、T3组黄颡鱼体内CAT活性顺序一致,均为肝胰脏>脑>鳃>血清>中肾>脾脏>头肾;T4、T5组黄颡鱼体内CAT活性顺序一致,均为脑>肝胰脏>鳃>血清>中肾>脾脏>头肾;T6组黄颡鱼体内CAT活性顺序为脑>肝胰脏>血清>鳃>中肾>脾脏>头肾。T4组肝胰脏、头肾、鳃、脑、脾脏中CAT活性分别是对照组的1.45、1.77、1.81、2.17、1.43倍,差异显著(P<0.05);T5组头肾、脑中CAT活性分别是对照组的1.67、1.94倍,差异显著(P<0.05)。
|
|
表 4 鸡血藤提取物对黄颡鱼体内CAT活性的影响 Table 4 Effects of Caulis spatholobi ethanol extract on CAT activity of Pelteobagrus fulvidraco |
由表 5可知,对照组和T2组黄颡鱼体内GSH含量顺序一致,均为血清>肝胰脏>中肾>脑>脾脏>头肾>鳃;T3、T4、T5和T6组黄颡鱼体内GSH含量顺序一致,均为血清>肝胰脏>脑>中肾>脾脏>头肾>鳃。与对照组相比,添加鸡血藤醇提物的各试验组肝胰脏、血清中GSH含量均有显著提升,并随鸡血藤醇提物添加量的增加呈先上升后下降的趋势,其中T4组肝胰脏、脾脏和中肾中GSH含量分别是对照组的2.09、2.25和1.99倍,T5组肝胰脏、血清和脑中GSH含量分别是对照组的1.95、2.51、3.18倍。鸡血藤醇提物对黄颡鱼头肾和鳃中GSH含量无显著影响(P>0.05)。
|
|
表 5 鸡血藤提取物对黄颡鱼体内GSH含量的影响 Table 5 Effects of Caulis spatholobi ethanol extract on GSH content of Pelteobagrus fulvidraco |
由表 6可知,对照组黄颡鱼体内GSH-Px活性顺序为头肾>肝胰脏>脾脏>中肾>脑>血清>鳃;T2组黄颡鱼体内GSH-Px活性顺序为头肾>肝胰脏>脑>脾脏>血清>中肾>鳃;T3、T5和T6组黄颡鱼体内GSH-Px活性顺序一致,均为头肾>肝胰脏>脑>血清>中肾>脾脏>鳃;T4组黄颡鱼体内GSH-Px活性顺序为头肾>肝胰脏>血清>脑>中肾>脾脏>鳃。T4组血清和中肾中GSH-Px活性分别是对照组的2.53和1.72倍,差异显著(P<0.05);T5组肝胰脏、血清和脑中GSH-Px活性分别是对照组的1.79、2.47和2.83倍,差异显著(P<0.05)。鸡血藤醇提物对黄颡鱼头肾、鳃和脾脏中GSH-Px活性并无显著影响(P>0.05)。
|
|
表 6 鸡血藤提取物对黄颡鱼体内GSH-Px活性的影响 Table 6 Effects of Caulis spatholobi ethanol extract on GSH-Px activity of Pelteobagrus fulvidraco |
由表 7可知,对照组黄颡鱼体内NO含量顺序为鳃>血清>脾脏>脑>肝胰脏>中肾>头肾,T2和T3组黄颡鱼体内NO含量顺序一致,均为血清>鳃>脾脏>肝胰脏>脑>头肾>中肾;T4组黄颡鱼体内NO含量顺序为血清>鳃>脾脏>肝胰脏>头肾>脑>中肾;T5组黄颡鱼体内NO含量顺序为血清>脾脏>肝胰脏>鳃>脑>头肾>中肾;T6组黄颡鱼体内NO含量顺序为血清>脾脏>鳃>脑>肝胰脏>头肾>中肾。肝胰脏、头肾、血清中NO含量随鸡血藤醇提物添加量的增加呈先上升后下降趋势,但添加鸡血藤醇提物的各试验组与对照组相比均有上升,其中T4组肝胰脏和血清中NO含量分别是对照组的2.55和3.29倍(P<0.05),T5组肝胰脏和头肾中NO含量分别是对照组的2.68和4.00倍(P<0.05)。鳃、脑中NO含量随鸡血藤醇提物添加量的增加呈先下降后上升的趋势,添加鸡血藤醇提物的各试验组鳃、脑中NO含量均低于对照组,其中T5组鳃、T4组脑中NO含量下降最为明显,分别较对照组下降了80.1%、71.1%(P<0.05)。鸡血藤醇提物对脾脏、中肾中NO含量无显著影响(P>0.05)。
|
|
表 7 鸡血藤提取物对黄颡鱼体内NO含量的影响 Table 7 Effects of Caulis spatholobi ethanol extract on NO content of Pelteobagrus fulvidraco |
由表 8可知,黄颡鱼体内2种转氨酶活性均为肝胰脏>血清。在肝胰脏中,GOT与GPT活性随鸡血藤醇提物添加量的增加均呈先上升后下降的趋势,均在T5组达到最大值,分别为对照组的1.31和1.21倍(P<0.05)。在血清中,GOT与GPT活性随鸡血藤醇提物添加量的增加均呈现先下降后上升的趋势,分别在T4组和T5组达到最小值,比对照组分别下降了41.5%和56.3%(P<0.05)。
|
|
表 8 鸡血藤醇提物对黄颡鱼肝胰脏和血清中转氨酶活性的影响 Table 8 Effects of Caulis spatholobi ethanol extract on aminotransferase activities in hepatopancreas and serum of Pelteobagrus fulvidraco |
由表 9可知,血清中C3和ALB含量随鸡血藤醇提物添加量的增加均呈现先上升后下降的趋势,且均在T5组达到最大值,分别是对照组的3.51和1.42倍(P<0.05)。各组血清IgM含量并无显著差异(P>0.05)。
|
|
表 9 鸡血藤醇提物对黄颡鱼血清中C3、ALB和IgM含量的影响 Table 9 Effects of Caulis spatholobi ethanol extract on C3, ALB and IgM contents in serum of Pelteobagrus fulvidraco |
由表 10可知,饲养试验结束后,腹腔注射嗜水气单胞菌,7 d内黄颡鱼累积死亡率随着鸡血藤醇提物添加量的增加呈现先下降后上升的趋势,并在T4、T5组有较低值,分别比对照组下降了37.9%、34.5%(P<0.05)。通过计算免疫保护率可知,在T4组时免疫保护率达到最大值,显著高于T2和T3组(P<0.05),与T5和T6组差异不显著(P>0.05)。
|
|
表 10 鸡血藤醇提物对黄颡鱼抗病力的影响 Table 10 Effects of Caulis spatholobi ethanol extract on disease resistance of Pelteobagrus fulvidraco |
鸡血藤目前主要应用于抗氧化、抗炎症、抗肿瘤等方面,同时鸡血藤还具有镇静催眠的作用[9]。黄酮类化合物为鸡血藤醇提物的主要有效成分之一,有报道指出其是通过调控细胞周期进程进而发挥抗肿瘤作用的[10],通过清除羟自由基(·OH)、超氧阴离子氧自由基(O2-·)及过氧化氢(H2O2)发挥抗氧化作用[11]。天然黄酮类化合物有很强的抗氧化、抗衰老作用,其基本骨架上的羟基取代基是清除自由基的活性基团,羟基的取代位置和取代形式对其生物活性具有重要影响。羟基取代基清除自由基机制主要是通过电离出氢原子,中和氧自由基并且与已经电离的黄酮类化合物结合成二聚体防止逆向结合,从而清除自由基[12-13]。如于文广等[14]报道,运用4种药用植物花提取总黄酮并测定其抗氧化作用,结果4种药用植物花提取液均有一定的还原能力,在一定浓度范围内其还原能力与黄酮含量呈正相关。
本试验中,鸡血藤醇提物可以提高黄颡鱼血清及各组织中SOD、CAT及GSH-Px活性,提高GSH含量,并显著降低MDA含量,说明鸡血藤醇提物提升了黄颡鱼血清及各组织的抗氧化能力,并且降低了血清及各组织的氧化程度。SOD是体内非常重要的抗氧化酶和氧自由基清除剂,SOD活性越高,代表机体清除自由基能力越强[15]。CAT是以H2O2为底物,通过催化一对电子的转移而最终将其分解为水和氧气(O2),该酶是在生物演化过程中建立起来的生物防御系统的关键酶之一[16-17]。GSH-Px能催化GSH变为氧化型谷胱甘肽(GSSG),使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构和功能,GSH含量和GSH-Px活性越高,代表机体抗氧化损伤能力越强。MDA含量反映了机体细胞受自由基攻击的严重程度,因此其数值越低表明细胞氧化损伤程度越低。刘俊林等[11]研究发现13.6~217.0 μg/L鸡血藤醇提物中总黄酮可浓度依赖性抑制[二价铁离子(Fe2+)+抗坏血酸]诱导的大鼠心脏、肝脏、肾脏MDA的生成。此结果与本试验结果相似,因此可作为理论支持。王璐等[18]研究发现荔枝核总黄酮可降低大鼠肠组织中NO、MDA含量和一氧化氮合酶(NOS)活性,促进SOD和GSH-Px活性升高。此结果与本试验结果相类似,可作为本试验理论基础。
诱导型一氧化氮合酶(iNOS)是介导炎症反应重要的酶,iNOS催化L-精氨酸氧化成NO[19]。细胞内信号转导、凝集血小板、提升免疫防御力和舒张血管是NO在生理上的功能。强氧化性物质及过氧化亚硝酸盐在NO和O2反应时会大量生成[20]。付远妨等[21]研究发现鸡血藤黄酮乙酸乙酯部位(EFSF)能显著降低H2O2诱导的氧化应激细胞的NO分泌水平及细胞内活性氧(ROS)含量,说明EFSF对氧化应激损伤具有一定的保护作用。在本试验中,鸡血藤醇提物对黄颡鱼肝胰脏、头肾、血清中NO含量有促进作用,对鳃、脑这类氧交换密切的组织中NO含量有抑制作用。本试验结果与以上结论相类似,肝胰脏、头肾、血清中NO含量上升可起到增强抗氧化能力的作用,鳃、脑中NO含量下降可降低强氧化性物质及过氧化亚硝酸盐对机体的损伤。
目前对黄酮类物质的研究相对较丰富,但从鸡血藤提取的黄酮类物质对机体的抗氧化能力的研究较少,尤其是对于黄颡鱼的应用研究更为稀少,从本试验结果来看,鸡血藤醇提物对黄颡鱼抗氧化能力有提高作用,有待于从分子水平研究其作用机理。
3.2 鸡血藤醇提物对黄颡鱼非特异性免疫力及抗病力的影响鱼类是特异性免疫和非特异性免疫并存的低等脊椎动物,但与哺乳动物相比,鱼类特异性免疫机制并不完善,其主要依赖非特异性免疫发挥作用[22]。转氨酶有很多种类,其中GOT和GPT是氨基酸代谢过程中2个重要的氨基转移酶,在正常的鱼体内这2种转氨酶主要存在于细胞内,以肝细胞内活性最大,血清中活性极小,但当肝胰脏组织受到损害时,可能有大量的GOT和GPT从细胞内逸出进入血液,使血清中的这2种转氨酶的活性升高[23]。本试验中,肝胰脏中GOT和GPT活性随鸡血藤醇提物添加量的增加呈先上升后下降的趋势,而在血清中则呈先下降后上升的趋势,说明鸡血藤醇提物中黄酮类化合物可以降低血清中上述种转氨酶的活性,起到保护肝脏的作用。陈从显等[24]研究发现鸡血藤醇提物能抑制四氯化碳(CCl4)导致的血清GOT、GPT活性升高。亢泽春等[25]研究发现鸡血藤总黄酮能改善小鼠由乙醇所致的酒精肝,使血清中GOT、GPT活性降低。以上2个研究结果均与本试验结果相似,可作为相关依据。
C3、ALB、IgM是鱼体重要的3个非特异性免疫指标。C3是生物血清内含量最高的补体蛋白,参与多种免疫调节,如免疫防御、免疫调控、免疫病理等,只有C3被活化之后,才能带动后续补体成分的连锁反应[26]。本试验中,饲料中添加0.32%(T5组)鸡血藤醇提物能有效提高血清中C3含量,与对照组(T1组)差异最为显著。彭耀宗等[27]研究表明,草鱼血清中C3含量的增加可能是由于上调C3 mRNA的表达来实现的,其具体作用机理有待通过分子手段进行进一步研究。血清中的ALB具有结合和运输内源性与外源性物质、维持血液胶体渗透压、清除自由基、抑制血小板聚集和抗凝血等生理功能。本试验中,饲料中添加0.32%(T5组)鸡血藤醇提物时,血清中ALB含量达到最高,由此可以说明鸡血藤醇提物可以提高黄颡鱼血清中ALB含量,维持血液渗透压平衡,促进血液与各组织之间的物质交换,进而提高非特异性免疫能力,具体作用机理有待进一步研究。在鱼类的免疫球蛋白中,IgM含量最丰富,在鱼类非特异性免疫中起主要作用[28]。本试验中,鸡血藤醇提物未对血清中IgM含量产生显著影响,推测原因可能是病原体在未进入血液时已经被消除,因而IgM含量并未有显著变化,具体作用机理有待进一步研究。
本试验中,攻毒7 d后黄颡鱼的累积死亡率随着鸡血藤醇提物添加量的增加呈先下降后上升的趋势,而免疫保护率则呈先上升后下降的趋势,证明长期投喂含鸡血藤醇提物饲料可以提高黄颡鱼的非特异性免疫能力,进而提高其成活率,预防疾病。
4 结论① 鸡血藤醇提物能有效提高黄颡鱼体内SOD、CAT、GSH-Px活性及GSH含量,减少MDA含量,对NO含量具有一定的调节作用,并能有效降低血清中GOT、GPT活性,提高C3、ALB含量。其中,鸡血藤醇提物添加量为0.16%、0.32%时对抗氧化能力和非特异性免疫力的提高效果较好。
② 饲料中添加0.16%、0.32%鸡血藤醇提物可有效降低攻毒后黄颡鱼的累积死亡率,并提高免疫保护率。
③ 综合抗氧化能力、非特异性免疫力和抗病力,黄颡鱼饲料中鸡血藤醇提物的适宜添加量为0.16%~0.32%。
| [1] |
曹斌, 韦桂宁. 鸡血藤中黄酮类化合物药理作用研究进展[J]. 内科, 2017, 12(3): 341-343. |
| [2] |
刘仰斌, 张志花. 鸡血藤提取物对脑缺血再灌注损伤大鼠ATP酶活性影响的实验研究[J]. 牡丹江医学院学报, 2017, 38(1): 12-15. |
| [3] |
谭潇, 董宪喆, 郭代红, 等. 鸡血藤醇提物及其活性成分儿茶素抗辐射作用及机制研究[J]. 中国中药杂志, 2016, 41(9): 1718-1724. |
| [4] |
刘仰斌, 张志花. 鸡血藤对去卵巢豚鼠脂代谢影响的实验研究[J]. 宜春学院学报, 2014, 36(3): 65-68, 117. |
| [5] |
程悦, 符影, 王志宇, 等. 鸡血藤提取物中缩合鞣质的含量测定及其抗肿瘤活性初步研究[J]. 中山大学学报(自然科学版), 2011, 50(2): 75-80. |
| [6] |
冯淑华, 李可意, 李灵芝. 6种中药粗提物对胎鼠体外骨生长的影响[J]. 北京联合大学学报, 2009, 23(1): 11-13, 17. |
| [7] |
王宪青, 余善鸣, 刘妍妍. 油脂的氧化稳定性与抗氧化剂[J]. 肉类研究, 2003(3): 18-20, 47. |
| [8] |
沈建中. 黄颡鱼的生物学特性及其养殖技术[J]. 养殖与饲料, 2002(3): 37-40. |
| [9] |
符影, 程悦, 陈建萍, 等. 鸡血藤化学成分及药理作用研究进展[J]. 中草药, 2011, 42(6): 1229-1234. |
| [10] |
唐勇, 何薇, 王玉芝, 等. 鸡血藤黄酮类组分抗肿瘤活性研究[J]. 中国实验方剂学杂志, 2007, 13(2): 51-54. |
| [11] |
刘俊林. 鸡血藤醇提物清除氧自由基的实验研究[J]. 卫生职业教育, 2006, 24(2): 128-129. |
| [12] |
杨杰, 沙金丹, 高翔, 等. 黄酮类化合物的免疫调节作用及机制[J]. 动物营养学报, 2017, 29(12): 4295-4300. DOI:10.3969/j.issn.1006-267x.2017.12.008 |
| [13] |
陈永钧, 龙晓英, 潘素静, 等. 黄酮类化合物的药效机制及构效关系研究进展[J]. 中国实验方剂学杂志, 2013, 19(11): 337-344. |
| [14] |
于文广, 王郝, 白莹, 等. 四种药用植物花总黄酮类物质提取及抗氧化性研究[J]. 中国野生植物资源, 2010, 29(2): 44-47. |
| [15] |
BASU S. Carbon tetrachloride-induced lipid peroxidation:eicosanoid formation and their regulation by antioxidant nutrients[J]. Toxicology, 2003, 189(1/2): 113-127. |
| [16] |
SCHRADER M, FAHIMI H D. Peroxisomes and oxidative stress[J]. Biochimica et Biophysica Acta:Molecular Cell Research, 2006, 1763(12): 1755-1766. DOI:10.1016/j.bbamcr.2006.09.006 |
| [17] |
ZAMOCKY M, FURTMÜLLER P G, OBINGER C. Evolution of catalases from bacteria to humans[J]. Antioxidants & Redox Signaling, 2008, 10(9): 1527-1548. |
| [18] |
王璐, 姚兰, 张爽, 等. 荔枝核总黄酮对脓毒症大鼠肠损伤的保护作用[J]. 现代中西医结合杂志, 2017, 26(29): 3205-3207. DOI:10.3969/j.issn.1008-8849.2017.29.005 |
| [19] |
MURAKAMI A. Chemoprevention with phytochemicals targeting inducible nitric oxide synthase[J]. Forum of Nutrition, 2009, 61: 193-203. DOI:10.1159/000212751 |
| [20] |
狄建彬, 顾振纶, 赵笑东, 等. 姜黄素的抗氧化和抗炎作用研究进展[J]. 中草药, 2010, 41(5): 854-857. |
| [21] |
付远妨, 赵尉丹, 蒙西南, 等. 鸡血藤黄铜乙酸乙酯部位对H2O2诱导RAW264.7细胞氧化应激的调节作用[J]. 黑龙江畜牧兽医, 2017(12): 145-147, 296. |
| [22] |
李莉, 李春梅. 鱼类非特异性免疫研究进展[J]. 河南农业科学, 2012, 41(2): 26-32. |
| [23] |
陈晨, 黄峰, 舒秋艳, 张丽, 等. 共轭亚油酸对草鱼生长、肌肉成分、谷草转氨酶及谷丙转氨酶活性的影响[J]. 水生生物学报, 2010, 34(3): 647-651. |
| [24] |
陈从显, 徐爱钰, 许勇, 等. 鸡血藤总黄酮对小鼠急性肝损伤的保护作用[J]. 滨州医学院学报, 2012, 35(3): 189-191, 188. |
| [25] |
亢泽春, 刘少华, 高聪. 鸡血藤总黄酮对酒精性肝损伤的保护作用及机制[J]. 中国老年学杂志, 2013, 33(23): 5951-5953. |
| [26] |
昝琦, 刘欣, 逄越, 等. 补体C3结构与功能研究进展[J]. 中国免疫学志, 2014, 30(4): 549-553. |
| [27] |
彭耀宗, 周霞, 韩冰, 等. 盐酸小檗碱对草鱼补体系统及补体C3作用的研究[J]. 淡水渔业, 2016, 46(2): 50-54, 81. |
| [28] |
李春涛, 张其中, 曾伯平. 黄颡鱼IgM基因的个体发生和抗体的代间传递[J]. 水产学报, 2014, 38(5): 638-643. |




