2. 扬州大学农业科技发展研究院, 扬州 225000
2. Institutes of Agriculture Science and Technology Development, Yangzhou University, Yangzhou 225000, China
家禽在屠宰之后,由于血液循环停止,体内原有的抗氧化系统逐渐瓦解,细胞有氧代谢产物自由基不断攻击肌肉、肝脏等组织,抗氧化酶不能通过循环系统及时到达被氧化部位,清除氧自由基等有害物质,致使肌肉、肝脏等组织出现脂质氧化现象[1]。另外,脂质氧化产物在组织中得不到及时的清除而不断堆积,还会损害脂质、蛋白质、核酸等大分子并影响家禽产品的品质[2]。研究表明,脂质氧化会产生哈败味,生成的次级代谢产物如醛、酮、酸、醇等会使肉产生异味[3],自由基与人类70多种疾病有着直接或间接的联系,危害着人类的健康[4]。
我国的鹅肉产品产量占全球的93%以上,2016年我国肉鹅产值达364.12亿元[5],肉鹅在屠宰后,除了鹅肉可以带来经济价值外,鹅肝也具有很高的经济价值。鹅肝通常可以加工成一些高等特色菜肴和鹅肝酱等罐头制品,这些产品味道独特鲜美,营养价值高,还具有保健功能,因而广受消费者青睐[6]。但是,由于机体肝脏代谢活跃,耗氧量大,产生的氧自由基多,很容易发生脂质氧化[7]。研究发现,屠宰前的致晕方法对家禽肌肉的脂质氧化有显著影响[1],在屠宰前使用高浓度二氧化碳(CO2)混合气体致晕(控制气体击晕)可以推迟脂质氧化的过程,降低肌肉的脂质氧化程度[8]。但是目前对于气体致晕参数的研究参差不齐,家禽的气体致晕技术尚不成熟,国内对于气体致晕的研究更少,国内外对于家禽的气体致晕也缺乏详细的法规和标准。在鹅的屠宰方法上对于气体致晕的研究也相对较少[9]。
如上所述,致晕方法是影响鹅肝品质的因素之一,而缓解肉鹅肝脏脂质氧化的致晕方法还有待探索。本试验旨在探讨屠宰前不同二氧化碳浓度混合气体致晕对肉鹅肝脏颜色、脂质氧化和抗氧化能力的影响,以期为延缓屠宰后鹅肝脏脂质氧化的研究提供新思路,为我国肉鹅屠宰加工以及相关标准和法规的制定提供参考。
1 材料与方法 1.1 试验动物及饲养管理选取300只健康的扬州鹅公雏(套上脚号),在扬州大学试验农牧场采取网上平养方式饲养,饲养期间鹅自由采食和饮水,自然光照,试验饲粮为玉米-豆粕型基础饲粮,试验饲粮组成及营养水平见表 1。在85日龄时称重,取最接近平均体重(3.7 kg)的56只鹅分组,进行致晕屠宰试验。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the experimental diet (air-dry basis) |
本试验的气体致晕系统由储气罐和气室组成,气室高1.5 m,直径1.0 m,由2层厚塑料薄膜制成。将试验鹅左腿系上绳子后,在致晕前将致晕所需的各组气体分别混合、压缩,存入储气罐中。每次致晕处理前排出塑料薄膜袋中的气体,将储气罐中的气体解压到1个大气压(101.325 kPa)后,由塑料软管通入2层底面封闭并垫有0.5 cm厚纸板的塑料薄膜袋中。气体充满后立即收紧袋口。将系上绳子的试验鹅提起,轻轻地快速放入到气室的厚纸板上(绳子延长到气室外),迅速扎紧气室口并用秒表计时,达预设时间后立即将鹅提出并进行屠宰。致晕过程中密切观察鹅的行为反应,记录行为反应,一旦鹅在CO2刺激下产生挣扎或癫痫反应导致塑料薄膜的外膜被划破,立即用透明胶带补上防止漏气。
1.3 试验设计将56只鹅随机分为7组(1个对照组,6个试验组),每组8个重复,每个重复1只鹅。对照组不致晕直接屠宰,试验组屠宰前由不同CO2浓度的混合气体致晕。6个试验组致晕混合气体组成如下:G40组,40%CO2+21%氧气(O2)+39%氮气(N2);G50组,50%CO2+21%O2+29%N2;G60组,60%CO2+21%O2+19%N2;G70组,70%CO2+21%O2+9%N2;G79组,79%CO2+21%O2。上述5组致晕时间均为7 min。G40+G79组分2阶段致晕,40%CO2+30%O2+30N2致晕2 min,然后79%CO2+21%O2致晕5 min。
1.4 样品采集试验鹅放血后,剖开腹腔,取4份右侧肝脏,每份大约5 g,1份立即放于-20 ℃冰箱保存,另外3份放于4 ℃冰箱,分别在屠宰后24、96和168 h转移到-20 ℃冰箱保存备用,以上样品分别作为屠宰后0、1、4、7 d的样品。
1.5 检测指标和方法 1.5.1 放血率和肝脏颜色屠宰前将所有鹅分别称重并记录为m1,对照组鹅不致晕,直接割断颈动静脉、气管、食管放血屠宰,试验组鹅在致晕后割断颈动静脉、气管、食管放血屠宰,所有鹅放血时间均为5 min。放血结束后,对鹅再次称重并记录为m2。
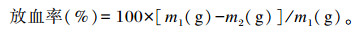
|
取屠宰后1和4 d肝脏样品,采用三点法取样检测肝脏的亮度、红度、黄度值,所用仪器为CR-400色差仪(Konica Minolta,日本),颜色的终值为3个点的平均值。
1.5.2 脂质氧化和抗氧化指标取-20 ℃保存的肝脏样品,准确称取0.5 g放入10 mL塑料离心管,在冰水浴条件下用预冷的生理盐水制成10%的匀浆,4 ℃、2 500 r/min离心10 min,吸取上清液分装成5份待测。
丙二醛(MDA)含量与谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)活性测定所用试剂盒均购自南京建成生物工程研究所,按照说明书所述方法操作。1, 1-二苯基-2-三硝基苯肼(DPPH)为东京化成工业株式会社(日本)产品,DPPH自由基清除能力的测定参考韦献雅等[10]的方法稍作修改:将2.5%的肝脏匀浆与0.1 mmol/L DPPH乙醇溶液按照1 : 10(体积比)涡旋混匀,室温避光反应30 min,3 500 r/min离心10 min,取上清液于517 nm处测定吸光度(OD)值。同时,用不同浓度的Trolox溶液与DPPH乙醇溶液按照1 : 10(体积比)涡旋混匀,重复上述步骤,绘制标准曲线(y=-0.153 3+0.670 8,R2=0.996),最后将样品OD值代入标准曲线方程中,并除以样品蛋白质浓度,得出DPPH自由基清除能力。肝脏蛋白质浓度采用考马斯亮蓝法测定,所用试剂盒购自南京建成生物工程研究所。
1.6 数据统计分析试验结果以“平均值±标准误”来表示,使用Excel 2007软件对原始数据进行处理,采用SPSS 20.0统计软件的one-way ANOVA程序进行显著性分析,并采用Duncan氏法进行组间多重比较,以P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 屠宰前不同二氧化碳浓度的混合气体致晕对肉鹅放血率和肝脏颜色的影响由表 2可知,G79组肉鹅的放血率最低,与对照、G40、G50、G70和G40+G79组比较均存在显著差异(P < 0.05)。屠宰后1 d,G79组肝脏亮度和黄度值最低,显著低于G40组(P < 0.05);G40组肝脏亮度和黄度值均较高,与G70、G79和G40+G79组均存在显著差异(P < 0.05)。屠宰后4 d,G79组肝脏亮度值最低,显著低于G40组(P < 0.05);G40组肝脏亮度值最高,与G60、G70、G79和G40+G79组均存在显著差异(P < 0.05)。无论是屠宰后1 d还是屠宰后4 d,不同二氧化碳浓度的混合气体致晕对肉鹅肝脏红度值的影响均不显著(P > 0.05)。
|
|
表 2 屠宰前不同二氧化碳浓度的混合气体致晕对肉鹅放血率以及屠宰后1和4 d肝脏颜色的影响 Table 2 Effects of pre-slaughter gas mixture stunning with different carbon dioxide concentrations on liver color at 1 and 4 days after slaughter and bleed out efficiency of meat geese |
表 3显示了屠宰前不同二氧化碳浓度的混合气体致晕对肉鹅屠宰后0、1、4和7 d肝脏脂质氧化和抗氧化能力的影响。
|
|
表 3 屠宰前不同二氧化碳浓度的混合气体致晕对肉鹅屠宰后0、1、4和7 d肝脏脂质氧化和抗氧化能力的影响 Table 3 Effects of pre-slaughter gas mixture stunning with different carbon dioxide concentrations on liver lipid oxidation and antioxidant capacity at 0, 1, 4 and 7 d after slaughter of meat geese |
屠宰后0 d,G50和G60组肝脏中MDA含量显著低于G70和G79组(P < 0.05),其他各组之间差异不显著(P > 0.05)。屠宰后1 d,G79组肝脏中MDA含量最高,其中G40+G79、对照和G40组肝脏中MDA含量显著低于G50、G70和G79组(P < 0.05)。屠宰后4、7 d时肝脏中MDA含量变化趋势相似,均以G79组最低,对照和G40组较高,G79组显著低于对照和G40组(P < 0.05)。
从储存(4 ℃)时间来看,各组屠宰后0 d肝脏中MDA含量最低,对照、G40、G50、G60和G70组肝脏中MDA含量在屠宰后0 d显著低于屠宰后4、7 d(P < 0.05);屠宰后1 d,对照和G40组肝脏中MDA含量也显著低于屠宰后4和7 d(P < 0.05);屠宰后4 d,对照、G40、G50、G60和G70组肝脏中MDA含量都是4个储存时间中最高的。
屠宰后0 d,G79组肝脏DPPH自由基清除能力最低,G40组最高,但组间差异不显著(P > 0.05);各组肝脏中CAT、T-SOD和GSH-Px活性差异均不显著(P > 0.05)。
屠宰后1 d,各组肝脏中CAT和T-SOD活性差异不显著(P > 0.05);G70、G79和G40+G79组肝脏中GSH-Px活性显著高于其他各组(P < 0.05),其他各组之间差异不显著(P > 0.05)。
屠宰后4 d,各组肝脏中CAT和T-SOD活性差异不显著(P > 0.05);G40组肝脏中GSH-Px活性显著低于其他各组(P < 0.05)。
屠宰后7 d,各组肝脏中CAT活性差异不显著(P > 0.05);G40组肝脏中GSH-Px活性显著低于G60、G79和G40+G79组(P < 0.05),同时G60、G79组与其他各组均存在显著差异(P < 0.05);G40组肝脏中T-SOD活性显著高于对照组(P < 0.05)。
从储存(4 ℃)时间对肝脏抗氧化酶活性的影响来看,屠宰后4、7 d各组肝脏中GSH-Px活性显著低于屠宰后0、1 d(P < 0.05)。屠宰后4 d,G50、G79和G40+G79组肝脏中CAT活性显著低于屠宰后0、1 d(P < 0.05)。屠宰后0、1、4、7 d,对照、G40、G60和G70组肝脏中CAT活性无显著差异(P > 0.05),G40、G50、G60和G70组肝脏中T-SOD活性无显著差异(P > 0.05)。
3 讨论 3.1 屠宰前不同二氧化碳浓度的混合气体致晕对肉鹅放血率和肝脏颜色的影响鹅肝脏的颜色是消费者选择判断鹅肝品质好坏的依据之一,目前通过食品科学领域的广泛研究,发现脂质氧化作用可以促进肉色劣变[11]。在本次试验结果中,G79组肉鹅放血率最低,可能增加肉鹅肝脏中血液的残留量。研究发现,脂质氧化产生的自由基可以使肌红蛋白中的二价铁离子(Fe2+)氧化成三价铁离子(Fe3+),形成高铁肌红蛋白,使肉色褐变导致肉色红度值增加[11-12]。Fe2+是血红蛋白的重要组成成分,在生物体内起着运输氧的作用,血红蛋白中的Fe2+是肌红蛋白中的4倍,同时Fe2+也能够促进脂质氧化[13-15]。结合G79组屠宰后0 d肝脏DPPH自由基清除能力最低,屠宰后0和1 d肝脏中MDA含量最高,可以判断屠宰后初期G79组肉鹅肝脏脂质氧化程度最高。此外,一定范围内肉色的亮度值过低[16]或者过高都表现为肉色变差,例如,鸡肉亮度值大于53则被评定为“类PSE肉”[17]。董亚维等[18]对应激模式下肉鸡的肉色进行研究后表明,脂质氧化会使肉色黄度值降低,泛黄感变弱。通过本次试验检测发现G40组肝脏亮度和黄度值都较高,而G79组肝脏亮度和黄度值都是最低的。从肝脏颜色的亮度、红度、黄度值结果可以推断,屠宰后0~4 d,G40组鹅肝脏颜色最好,易受到消费者青睐,G79组鹅肝脏颜色最差,消费者接受性比较低。
3.2 屠宰前不同二氧化碳浓度的混合气体致晕对肉鹅肝脏脂质氧化和抗氧化能力的影响家禽在屠宰的过程中,由于屠宰方式的差异,可能会使家禽体内产生大小不同的氧化应激,从而导致家禽产品出现不同程度的脂质氧化[19]。脂质氧化的中间产物MDA的含量可以间接地反映肝细胞的损伤程度,MDA含量越高,肝脏的脂质氧化程度越大[20]。但是,机体内也存在着大量抗氧化酶如GSH-Px、T-SOD、CAT等,这些酶可以增强机体清除自由基的能力,在保持动物机体抗氧化和氧化平衡上起着重要的作用[21]。
本次试验结果表明,屠宰后0和1 d,G70和G79组肉鹅肝脏中MDA含量较高,G40组肉鹅肝脏中MDA含量较低。屠宰后0 d,G79组肝脏DPPH自由基清除能力与G40组相比有降低的趋势, 表明屠宰后0 d,G40组提高了肝脏清除氧自由基的能力,所以由自由基攻击生物膜产生的脂质氧化产物MDA的含量较少[4],G79组则相反。此外,G79组肝脏中CAT活性最低,MDA含量最高,说明G79组肝脏清除氧自由基的过程中过氧化氢(H2O2)被CAT转化成水的量较少。由此说明,宰后0~1 d G40组肝脏中脂质氧化程度最小,抗氧化能力最强,G79组则与之相反。
屠宰后4和7 d的结果相似,G40组肝脏中MDA含量较高,G79组较低,G40组肝脏中T-SOD和CAT活性较高,G79组最低。通过前面的分析表明,G40组肝脏中MDA含量增加的同时可能也刺激了抗氧化系统发挥作用,提高了部分抗氧化酶的活性去抵抗自由基的攻击,然而,尽管如此,可能由于GSH-Px和其他某些未检测的抗氧化因子在G40组中较低,最终导致延长存储时间(4和7 d)的条件下G40组的肝脏MDA含量显著高于G79组。而G79组肉鹅肝脏中GSH-Px活性较高,MDA含量较低,脂质氧化程度较低,所以T-SOD和CAT抵御抗氧化的能力较弱,因此这2种酶的活性也较低。由此判断,屠宰后4~7 d,G79组肝脏中脂质氧化程度最小,抗氧化能力最强。
从储存(4 ℃)时间上看,屠宰后0~4 d,随储存时间的延长,各组肝脏中MDA含量在升高,而抗氧化酶活性在降低,说明在4 ℃条件下储存时,随储存时间的延长,抗氧化酶活性的降低导致肝脏脂质氧化程度加深。
4 结论① 在本试验条件下,40%的CO2或79%的CO2的混合气体致晕可以替代传统的直接放血屠宰方法,而对肉鹅的肝脏品质影响不大。
② 4 ℃条件下储存0~4 d时,肉鹅屠宰前采用40%CO2混合气体(40%CO2+21%O2+39%N2)致晕可以得到较好的肝脏颜色,且在0~1 d时肝脏清除自由基的能力较高,脂质氧化产物较少,有利于缓解屠宰后肉鹅的肝脏脂质氧化,得到较好品质的肝脏;而4 ℃条件下储存时间较长(4~7 d)时,采用79%CO2混合气体(79%CO2+21%O2)致晕肝脏中脂质氧化程度最低。
| [1] |
胥蕾.致晕方法影响肉仔鸡肉品质的机理及脂质过氧化调控[D].博士学位论文.北京: 中国农业科学院, 2011. http://cdmd.cnki.com.cn/Article/CDMD-82101-1011159171.htm
|
| [2] |
左玉, 马雪萍, 谢文磊, 等. 脂质的氧化及其对DNA损伤的研究进展[J]. 河南工业大学学报(自然科学版), 2006, 27(5): 73-80. DOI:10.3969/j.issn.1673-2383.2006.05.020 |
| [3] |
王兆明, 贺稚非, 李洪军. 脂质和蛋白质氧化对肉品品质影响及交互氧化机制研究进展[J]. 食品科学, 2018, 39(11): 295-301. DOI:10.7506/spkx1002-6630-201811045 |
| [4] |
刘井波, 彭双清. 脂质过氧化作用与线粒体损伤[J]. 中国预防医学杂志, 2005, 6(2): 167-170. DOI:10.3969/j.issn.1009-6639.2005.02.061 |
| [5] |
侯水生. 2016年水禽产业现状、技术研究进展及展望[J]. 中国畜牧杂志, 2017, 53(6): 143-147. |
| [6] |
陈唱, 王鹏, 张玉龙, 等. 营养鹅肝肠的研制及其营养价值分析[J]. 食品工业科技, 2018, 39(11): 232-239, 247. |
| [7] |
张自强, 刘玉梅, 邓雯, 等. 柠檬酸对小鼠肝脏组织氧化应激的影响[J]. 西北农业学报, 2011, 20(4): 16-19. DOI:10.3969/j.issn.1004-1389.2011.04.004 |
| [8] |
LINARES M B, BERRUGA M I, BÍRNEZ R, et al. Lipid oxidation in lamb meat:effect of the weight, handling previous slaughter and modified atmospheres[J]. Meat Science, 2007, 76(4): 715-720. DOI:10.1016/j.meatsci.2007.02.012 |
| [9] |
胥蕾, 张海军, 王志跃, 等. 家禽宰前致晕的进展:Ⅰ国际新标准[J]. 中国畜牧杂志, 2017, 53(3): 100-105, 111. |
| [10] |
韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J]. 食品科学, 2014, 35(9): 317-322. |
| [11] |
FAUSTMAN C, SUN Q, MANCINI R, et al. Myoglobin and lipid oxidation interactions:mechanistic bases and control[J]. Meat Science, 2010, 86(1): 86-94. DOI:10.1016/j.meatsci.2010.04.025 |
| [12] |
张克英, 陈代文, 胡祖禹. 影响猪肉品质的主要因素[J]. 四川农业大学学报, 2002, 20(1): 67-74. DOI:10.3969/j.issn.1000-2650.2002.01.016 |
| [13] |
辛馨. 动物性食品在贮藏过程中肉色的褐变[J]. 食品工业科技, 1985(1): 46-45. |
| [14] |
庄红, 张铁华, 林松毅, 等. 血红蛋白中二价铁离子保护研究进展[J]. 食品科学, 2006, 27(12): 901-903. DOI:10.3321/j.issn:1002-6630.2006.12.231 |
| [15] |
张勇.二价铁离子启动脂质过氧化的机制及几种金属离子的影响[D].硕士学位论文.北京: 中国科学院生物物理研究所, 1999. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y409749
|
| [16] |
陈骋.脂质氧化和抗氧化因子对牦牛肉肌红蛋白稳定性及高铁肌红蛋白还原能力的影响[D].博士学位论文.兰州: 甘肃农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10733-1016902420.htm
|
| [17] |
朱学伸.家禽"类PSE肉"的品质特性及其改善因素研究[D].博士学位论文.南京: 南京农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012271386.htm
|
| [18] |
董亚维, 张宏福, 卢庆萍, 等. 应激模式对不同品种肉鸡肉色的影响[J]. 安徽农业科学, 2006, 34(9): 1898-1900. DOI:10.3969/j.issn.0517-6611.2006.09.069 |
| [19] |
XU L, ZHANG H J, YUE H Y, et al. Low-current & high-frequency electrical stunning increased oxidative stress, lipid peroxidation, and gene transcription of the mitogen-activated protein kinase/nuclear factor-erythroid 2-related factor 2/antioxidant responsive element (MAPK/Nrf2/ARE) signaling pathway in breast muscle of broilers[J]. Food Chemistry, 2018, 242: 491-496. DOI:10.1016/j.foodchem.2017.09.079 |
| [20] |
王茜, 贾汉, 刘开泰, 等. 砷对小鼠肝脏脂质过氧化的影响及Vit E干预作用的研究[J]. 新疆医科大学学报, 2004, 27(4): 354-356. DOI:10.3969/j.issn.1009-5551.2004.04.014 |
| [21] |
孙启, 靳二辉, 周先建, 等. 复方中草药对AA肉鸡肌肉抗氧化能力的影响[J]. 安徽科技学院学报, 2017, 31(1): 19-24. DOI:10.3969/j.issn.1673-8772.2017.01.004 |




