2. 四川省草原科学研究院, 成都 625014
2. Sichuan Academy of Grassland Sciences, Chengdu 625014, China
牦牛主要分布在我国的青海、西藏、四川、甘肃、新疆、云南等地以及青藏高原周边国家,我国境内牦牛总数约占世界总牦牛数的92%[1]。黄牛(♂)与牦牛(♀)杂交F1代称为犏牛,犏牛具有显著的杂种优势,其产奶量和生长速度方面都优于牦牛[2]。牦牛和犏牛是世界上能适应青藏高原特殊自然环境的特有牛种,是牧民赖以生存的生产资料和生活资料,对当地的经济和文化均有重要影响[3]。牛肉肌内脂肪(IMF)含量与肉品风味的形成、多汁性及嫩度等息息相关,从而决定牛肉品质和市场价值[4-5]。IMF沉积取决于脂肪酸合成与分解的动态平衡,受到脂肪酸合成酶与分解酶等相关基因表达的调控。脂肪酸合成能力受到乙酰辅酶A羧化酶(ACC)、固醇调节元件结合蛋白-1(SREBP-1)、脂肪酸合成酶(FAS)、过氧化物酶增殖激活受体γ(PPARγ)等基因表达调控[6-7]。脂肪酸分解能力受到激素敏感脂肪酶(HSL)和肉碱转移酶-1(CPT-1)等基因表达调控[8-9]。以前的研究多集中在牦牛或犏牛肉营养品质及风味物质的研究[10-11],目前还没有比较牦牛与犏牛IMF沉积相关基因表达差异的研究。因此,本试验旨在比较牦牛与犏牛生长性能、屠宰性能、肉品质和IMF沉积相关基因表达的差异,以期对牦牛改良育种提供基础理论,同时对牦牛肉和犏牛肉资源的开发具有重要意义。
1 材料与方法 1.1 试验动物、试验设计和饲养管理选用10头体重、年龄(4岁)相近的健康麦洼公牦牛和公犏牛(藏黄牛×麦洼牦牛),按照随机区组试验设计分为牦牛组和犏牛组,每组5头牛。牦牛组和犏牛组都饲喂同一种饲粮。根据我国《肉牛饲养标准》 (NY/T 815—2004)[12]中体重200 kg、平均日增重(ADG)500 g营养需要设计配方。基础饲粮精粗比按照23 : 77的干物质(DM)基础人工配制成全混合日粮。基础饲粮组成及营养水平见表 1。预饲15 d后进行153 d的正式试验。牦牛和犏牛均为舍饲,每头牛单栏拴养饲喂,每天饲喂2次(08:00和16:00)。试验牛的饲养管理按照肉牛常规管理进行,自由采食和饮水。试验在四川省阿坝州松潘县牦牛养殖专业合作社进行。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
每15 d采集1次饲料样品,用于营养成分的测定。参照AOAC (1999)[13]方法分析饲料样品DM、粗脂肪(EE)、粗蛋白质(CP)和粗灰分(Ash)含量。中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量参照Van Soest等[14]方法检测。
1.2.2 生长性能和屠宰性能测定每天记录饲料实际饲喂量,每天收集剩余饲料存于-20 ℃冰箱,每15 d测定1次投入饲料和剩余饲料含量,用于试验期内平均日采食量(ADFI)测定。
ADG=(末重-初重)/试验天数;
料重比(F/G)=ADFI/ADG。
饲养试验结束后全部试验牛进行屠宰。胴体重为试验牛屠宰后放血,去掉头、蹄、内脏(保留肾脏和板油)和皮毛的重量。净肉重为试验牛屠宰后放血,去掉头、蹄、内脏、皮毛和骨的重量。
屠宰率(%)=(胴体重/宰前活重)×100[15];
净肉率(%)=(净肉重/宰前活重)×100。
1.2.3 肉品质分析采集试验屠宰牛背最长肌(第11~13肋骨)样品,用来测定背最长肌pH、熟肉率、剪切力以及IMF含量。用pH计(上海雷磁pHS-3D型)测定背最长肌1和24 h的pH。参照Baublits等[16]方法分析剪切力,采集3 cm厚背最长肌样品,放入塑料薄膜袋,水浴锅恒温(80 ℃)加热样品直到中心温度75 ℃,冷却后钻取肉柱(1.27 cm),用C-LM型嫩度仪测定肉柱剪切力。采用索氏脂肪抽提法分析背最长肌IMF含量。熟肉率参照Li等[17]方法测定,采集背最长肌样品(12 h内),去掉脂肪和肌膜,蒸30 min后,用熟制后肉样重量除以熟制前肉样重量。
1.2.4 酶活性分析采集试验屠宰牛背最长肌(第12~13肋骨)样品,保存在-20 ℃冰箱,用以酶活性测定。背最长肌CPT-1、ACC、FAS和HSL活性参照试剂盒(南京建成生物工程研究所)说明书进行检测。
1.2.5 基因表达分析采集试验屠宰牛背最长肌(第12~13肋骨)样品,立刻存入液氮罐中,然后保存在-80 ℃超低温冰箱,用以基因表达测定。背最长肌总RNA采用Trizol法提取,其完整性用琼脂糖凝胶电泳检测。背最长肌总RNA采用逆转录试剂盒(TaKaRa)反转录为cDNA。β-肌动蛋白、CPT-1、HSL、SREBP-1、PPARγ、FAS和ACC基因的引物序列采用Zhang等[18]的方法合成。采用实时荧光定量PCR方法测定目的基因表达量,以β-肌动蛋白为内参基因,用2-ΔΔCT法计算目的基因相对表达量。
1.3 统计分析试验采用Excel 2003处理试验数据后,用SPSS 19.0统计软件进行t检验。试验结果用平均值±标准差表示。P < 0.05表示差异显著,0.05≤P < 0.10表示有趋势。
2 结果 2.1 牦牛与犏牛生长性能和屠宰性能的比较由表 2可知,犏牛组ADG和胴体重显著高于牦牛组(P < 0.05)。犏牛组与牦牛组之间的初重、末重、ADFI、F/G、净肉重、屠宰率和净肉率差异不显著(P>0.05);但犏牛组ADFI有高于牦牛组的趋势(P=0.093),F/G有低于牦牛组的趋势(P=0.083)。
|
|
表 2 牦牛与犏牛生长性能和屠宰性能的比较 Table 2 Comparison of growth performance and slaughter performance between yak and dzo |
由表 3可知,犏牛组背最长肌熟肉率和IMF含量显著高于牦牛组(P < 0.05),犏牛组背最长肌剪切力显著低于牦牛组(P < 0.05),犏牛组与牦牛组之间的背最长肌pH1 h和pH24 h差异不显著(P>0.05)。
|
|
表 3 牦牛与犏牛肉品质的比较 Table 3 Comparison of meat quality between yak and dzo |
由表 4可知,犏牛组与牦牛组之间的背最长肌FAS和ACC活性差异不显著(P>0.05),牦牛组背最长肌HSL和CPT-1活性显著高于犏牛组(P < 0.05)。
|
|
表 4 牦牛与犏牛背最长肌酶活性的比较 Table 4 Comparison of longissimus dorsi enzyme activities between yak and dzo |
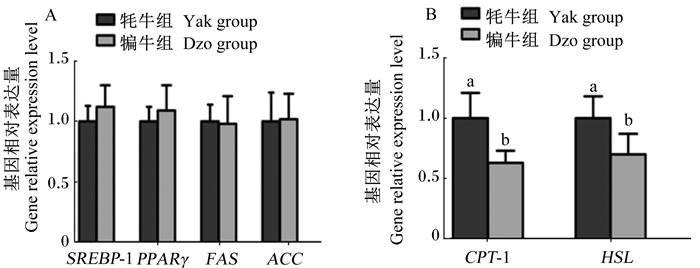
由图 1可知,犏牛组与牦牛组之间的背最长肌SREBP-1、PPARγ、FAS和ACC基因相对表达量差异不显著(P>0.05),牦牛组背最长肌HSL和CPT-1基因相对表达量显著高于犏牛组(P < 0.05)。
|
SREBP-1:固醇调节元件结合蛋白-1 sterols regulating element binding protein 1;FAS:脂肪酸合成酶fatty acid synthetase;PPARγ:过氧化物酶增殖激活受体γ peroxidase proliferation activated receptor γ;ACC:乙酰辅酶A羧化酶acetyl coenzyme A carboxylase;CPT-1:肉碱转移酶-1 carnitine transferase-1;HSL:激素敏感脂肪酶hormone sensitive lipase。 数据柱标注不同小写字母表示差异显著(P < 0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 1 牦牛与犏牛背最长肌IMF沉积相关基因表达的比较 Fig. 1 Comparison of expression of IMF deposition related genes in longissimus dorsi between yak and dzo |
本试验中,犏牛组与牦牛组之间的初重、末重、ADFI和F/G无显著差异,但犏牛组ADG高于牦牛,ADFI有高于牦牛组的趋势。犏牛组ADG显著高于牦牛组,可能是因为在相同饲养环境下犏牛组ADFI有高于牦牛组的趋势。王斌星等[19]比较舍饲条件下牦牛和犏牛生长性能的差异,研究结果表明犏牛ADG和ADFI高于牦牛,但初重、末重和F/G差异不显著。本试验供试犏牛和牦牛选自全放牧状态下,而将试验动物变成全舍饲的条件下,只有更适应环境的动物其生长性能才能够充分地发挥。犏牛ADG高于牦牛,一方面说明犏牛更加适应舍饲环境;另一方面说明犏牛在生长性能方面具有杂交优势。
胴体重是动物重要的经济性状之一,直接反映动物的产肉性能高低。本试验中,犏牛组胴体重显著高于牦牛组,说明犏牛的产肉性能优于牦牛,也说明犏牛在产肉性能方面具有杂交优势。付永等[10]研究结果表明,犏牛胴体重高于牦牛,犏牛在产肉性能方面表现出突出的杂种优势。
3.2 牦牛与犏牛肉品质的比较牛肉IMF含量是反映肉品质的重要指标之一,与肉品嫩度、多汁性及风味的形成等直接相关[4-5]。目前还没有针对舍饲条件下牦牛与犏牛IMF沉积的比较研究,本试验中,犏牛组背最长肌IMF含量显著高于牦牛组,说明犏牛更适应舍饲环境,并且在肉品质方面具有杂交优势。剪切力是评价肉嫩度的关键指标之一,剪切力越小说明肉嫩度越好。本试验中,犏组牛背最长肌剪切力显著低于牦牛组,说明犏牛肉比牦牛肉的嫩度好,也间接证明犏牛背最长肌IMF含量高于牦牛。陈晓波等[20]比较了自然放牧条件下中甸牦牛和中甸犏牛肌肉剪切力的差异,结果表明中甸牦牛背最长肌剪切力显著高于中甸犏牛。熟肉率是衡量肉质的保水力,即自由水滞留在肉里面的能力,熟肉率越高,失水率越低[21]。熟肉率越高,肉质保水力就越高,咀嚼时就会呈多汁状态,从而使肉的鲜嫩最大程度的表现出来。本试验中,犏牛组背最长肌熟肉率显著高于牦牛组,说明犏牛肉比牦牛肉的保水力高,犏牛肉的嫩度优于牦牛。陈晓波等[20]研究结果表明,中甸犏牛背最长肌熟肉率高于中甸牦牛。综上,犏牛肉与牦牛肉相比具有较高IMF含量和熟肉率,以及较低剪切力,说明犏牛在肉品质方面(嫩度)具有杂交优势,具备良好开发利用前景。
3.3 牦牛与犏牛背最长肌IMF沉积相关基因表达的比较脂肪酸合成与分解的动态平衡决定IMF沉积,受到相关酶和基因的调控。首先,脂肪酸合成酶调控IMF沉积。FAS是脂肪酸合成的关键酶之一,主要作用催化丙二酸单酰辅酶A和乙酰辅酶A生成脂肪酸,其活性的改变直接影响脂肪酸的合成[6]。ACC也是脂肪酸合成的关键酶之一,主要功能是催化乙酰辅酶A羧合成丙二酰辅酶A,进而控制长链脂肪酸的合成[7]。本研究中,犏牛与牦牛背最长肌FAS和ACC活性无显著差异,说明犏牛与牦牛在脂肪酸合成能力方面无明显差别。脂肪合成相关基因表达调控脂肪酸合成酶活性。PPARγ和SREBP-1调控FAS、ACC等脂肪合成基因表达,进而影响脂肪酸合成[6, 22]。本研究中,犏牛组与牦牛组之间的背最长肌SREBP-1、PPARγ、FAS和ACC基因相对表达量无显著差异,也再次证明牦牛背最长肌脂肪酸合成能力与犏牛相当。其次,脂肪酸分解酶可调控IMF沉积。HSL主要功能是将甘油三酯水解成甘油二酯、甘油和游离脂肪酸,是脂肪酸分解的限速酶之一[8]。CPT-1是脂肪酸氧化的限速酶之一,主要功能使脂肪酸发生β氧化[9]。本研究中,犏牛组背最长肌HSL和CPT-1活性显著低于牦牛组,说明犏牛背最长肌脂肪酸分解能力比牦牛弱,从而犏牛背最长肌IMF沉积能力强于牦牛。脂肪分解相关基因表达调控脂肪酸分解酶活性。本试验中,牦牛组背最长肌HSL和CPT-1基因相对表达量高于犏牛组,说明犏牛背最长肌脂肪酸分解相关基因表达相比于牦牛受到抑制,也再次证明牦牛背最长肌脂肪酸分解能力比犏牛强,从而使犏牛背最长肌IMF沉积能力强于牦牛。这可能是因为牦牛更加适合放牧,其脂肪酸分解加快有利于在极端环境生存,而犏牛相对于牦牛更适合舍饲环境,其脂肪酸分解减弱有利于脂肪酸沉积,从而在肉品质方面具有杂交优势。
4 结论① 与牦牛相比,犏牛在生长性能和肉质方面(嫩度和IMF含量)具有突出的杂交优势。
② 与牦牛相比,犏牛主要通过抑制脂肪分解途径(下调HSL和CPT-1基因表达及降低其活性)促进IMF沉积。
| [1] |
陆仲璘. 中国牦牛科学技术发展回顾与展望[J]. 中国牛业科学, 2007, 33(4): 3-13. DOI:10.3969/j.issn.1001-9111.2007.04.002 |
| [2] |
吴周林, 左玲, 徐弘扬, 等. 犏牛杂种优势研究进展[J]. 当代畜牧, 2018(6): 23-25. |
| [3] |
和占星, 王向东, 黄梅芬, 等. 中甸牦牛、迪庆黄牛和犏牛的乳的主要营养成分比较[J]. 食品与生物技术学报, 2015, 34(12): 1294-1301. DOI:10.3969/j.issn.1673-1689.2015.12.010 |
| [4] |
FRANK D, BALL A, HUGHES J, et al. Sensory and flavor chemistry characteristics of australian beef:influence of intramuscular fat, feed, and breed[J]. Journal of Agricultural and Food Chemistry, 2016, 64(21): 4299-4311. DOI:10.1021/acs.jafc.6b00160 |
| [5] |
PIAO M Y, YONG H I, LEE H J, et al. Comparison of fatty acid profiles and volatile compounds among quality grades and their association with carcass characteristics in longissimus dorsi and semimembranosus muscles of Korean cattle steer[J]. Livestock Science, 2017, 198: 147-156. DOI:10.1016/j.livsci.2017.02.021 |
| [6] |
MENDES K L, DE PINHO L, ANDRADE J M O, et al. Distinct metabolic effects of resveratrol on lipogenesis markers in mice adipose tissue treated with high-polyunsaturated fat and high-protein diets[J]. Life Sciences, 2016, 153: 66-73. DOI:10.1016/j.lfs.2016.04.014 |
| [7] |
MYSORE R, ZHOU Y, SÄDEVIRTA S, et al. MicroRNA-192 impairs adipocyte triglyceride storage[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2016, 1861(4): 342-351. DOI:10.1016/j.bbalip.2015.12.019 |
| [8] |
ZENG W W, PIRZGALSKA R M, PEREIRA M M A, et al. Sympathetic neuro-adipose connections mediate leptin-driven lipolysis[J]. Cell, 2015, 163(1): 84-94. DOI:10.1016/j.cell.2015.08.055 |
| [9] |
JU J, SONG J L, PARK E S, et al. Korean solar salts reduce obesity and alter its related markers in diet-induced obese mice[J]. Nutrition Research and Practice, 2016, 10(6): 629-634. DOI:10.4162/nrp.2016.10.6.629 |
| [10] |
付永, 魏雅萍, 孟茹. 牦牛、犏牛和黄牛生产性能、肉营养品质及风味物质的比较[J]. 动物营养学报, 2013, 25(11): 2734-2740. DOI:10.3969/j.issn.1006-267x.2013.11.029 |
| [11] |
刘子溱, 张玉斌, 韩玲, 等. 青海大通犊牦牛肉与成年牦牛肉品质的比较[J]. 甘肃农业大学学报, 2013, 4(2): 110-113, 118. DOI:10.3969/j.issn.1003-4315.2013.02.022 |
| [12] |
中华人民共和国农业部.NY/T 815—2004肉牛饲养标准[S].北京: 中国农业出版社, 2004.
|
| [13] |
AOAC.Official methods of analysis[S].16th ed.Washington, D.C.: Association of Official Analytical Chemists, 1999.
|
| [14] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [15] |
周光宏, 刘丽, 孙宝忠, 等. 牛肉等级评定方法和标准[J]. 肉类工业, 2001(6): 41-48. DOI:10.3969/j.issn.1008-5467.2001.06.017 |
| [16] |
BAUBLITS R T, POHLMAN F W, BROWN A H Jr, et al. Effects of sodium chloride, phosphate type and concentration, and pump rate on beef biceps femoris quality and sensory characteristics[J]. Meat Science, 2005, 70(2): 205-214. DOI:10.1016/j.meatsci.2004.12.011 |
| [17] |
LI X, EKERLJUNG M, LUNDSTRÖM K, et al. Association of polymorphisms at DGAT1, leptin, SCD1, CAPN1 and CAST genes with color, marbling and water holding capacity in meat from beef cattle populations in Sweden[J]. Meat Science, 2013, 94(2): 153-158. DOI:10.1016/j.meatsci.2013.01.010 |
| [18] |
ZHANG H B, DONG X W, WANG Z S, et al. Dietary conjugated linoleic acids increase intramuscular fat deposition and decrease subcutaneous fat deposition in yellow breed×Simmental cattle[J]. Animal Science Journal, 2016, 87(4): 517-524. DOI:10.1111/asj.2016.87.issue-4 |
| [19] |
王斌星, 许睛, 郭春华, 等. 舍饲牦牛和犏牛生产性能、屠宰性能、养分表观消化率、瘤胃发酵参数和血清生化指标的比较研究[J]. 黑龙江畜牧兽医, 2016(23): 5-9. |
| [20] |
陈晓波, 葛长荣, 田允波, 等. 云南主要地方牛种肉质特性研究[J]. 云南农业大学学报, 1999, 14(1): 49-53. |
| [21] |
刘兴余, 金邦荃. 影响肉嫩度的因素及其作用机理[J]. 食品研究与开发, 2005, 26(5): 177-180. DOI:10.3969/j.issn.1005-6521.2005.05.060 |
| [22] |
SMITH S, WITKOWSKI A, JOSHI A K. Structural and functional organization of the animal fatty acid synthase[J]. Progress in Lipid Research, 2003, 42(4): 289-317. DOI:10.1016/S0163-7827(02)00067-X |




