2. 中国农业科学院北京畜牧兽医研究所, 动物营养学国家重点实验室, 北京 100193
2. State Key Laboratory of Animal Nutrition, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
饮食调查表明,多数发达国家日常饮食中ω-3多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)的最小推荐量为650 mg/d[1],其中二十碳五烯酸(eicosapentaenoic acid,EPA)是ω-3 PUFA的一个重要组成部分。研究发现EPA能够明显地降低心血管疾病、某些自身免疫、炎症性疾病、癌症等的发生率,并且还具有一定的抗氧化作用[2-6]。EPA能够通过降低胆固醇和甘油三酯的含量,促进体内饱和脂肪酸代谢,从而起到降低血液黏稠度,增进血液循环,提高组织供氧,消除疲劳的作用;并且,EPA还可以防止脂肪在血管壁的沉积,预防动脉粥样硬化的形成和发展,预防脑血栓、脑溢血、高血压等心血管疾病,因此EPA有“血管清道夫”的美誉。有研究发现长期食用富含EPA的食物能够有效抑制肝脏中脂肪变性的风险,并降低肝胰岛素抵抗,降低患心血管疾病的风险[7-9]。多项研究表明,EPA能够调节心肌L型钙通道的活性,使胞内钙离子(Ca2+)浓度降低,从而降低心肌胞膜钠通道的活性,最终达到调节心肌细胞电生理、改善心律失常的目的[10-11]。大数据统计结果表明,食用高浓度EPA食物或者服用EPA药物的人患心梗的风险较低[12-13]。也有研究发现,EPA对炎症因子的分泌有一定的影响,进而预防动脉粥样硬化的发生[14-15],并且对于结肠癌、肝癌、胃癌等的发病率有所抑制[16-18]。
陆地上大部分动植物都不含有EPA,EPA主要存在于海洋生物体内,特别是深海动植物体内,如金枪鱼、鲭鱼、鲑鱼和微藻等。然而,近些年海洋污染愈加严重,通过鱼油补充EPA存在安全风险。目前一些研究发现牛奶中含有EPA,但是其含量相对较低,因此调控牛奶中EPA含量对于人类健康有着非常重要的价值。同时,母乳对于婴儿的生长极其重要,早有学者研究发现母乳中含有EPA和二十二碳六烯酸(docosahexaenoic acid,DHA)等必需脂肪酸[19-20]。调控牛奶中EPA含量对于婴幼儿的生长也起着至关重要的作用。
1 牛奶中EPA的含量大量研究表明,饲粮中不添加富含EPA的原料时,牛奶中EPA的平均含量约为0.05%脂肪酸(FA),并且其变异程度比较大,每升牛奶中EPA的含量在1~40 mg之间变化[21-23]。由此可见,天然牛奶中EPA的含量非常低,尽管其具有重要的生理功能,但是较低的含量无法满足机体的需求。因此,许多学者关注于影响牛奶EPA含量的因素,首先受到关注的是饲粮。研究发现鱼油EPA含量约为35%FA,在饲粮中添加一定比例的鱼油,牛奶中EPA含量有明显的提升,例如,饲粮中添加1.8%(干物质基础)鱼油时,牛奶中EPA含量能够提升到1.66%FA[24]。
2 牛奶中EPA的来源牛奶中的EPA一部分在奶牛肝脏中合成,但是EPA在奶牛体内的合成量非常少,并且其合成原料——α-亚麻酸(ALA)在机体中也无法合成[25-26]。因此,牛奶中EPA很大一部分来源于饲粮中直接添加的富含EPA饲料原料或是富含ALA饲料原料。
机体摄食脂类后,首先被瘤胃微生物酶快速水解为游离脂肪酸,这也是脂肪在体内代谢的首要条件。体内外试验研究发现,脂肪酸在体内的脂解程度比在体外大[27-28],这可能是由于动物口腔中的物理或化学作用对脂肪有一定的分解能力,瘤胃菌群在体内外也存在很大的区别,并且体内的其他器官也对瘤胃功能的正常发挥起着重要作用。瘤胃壁对不饱和脂肪酸的吸收是有限的,98%的脂肪酸在小肠中被吸收,进一步进入血液,分别被运送到身体的各个组织,其中最主要的是进入乳腺组织和肝脏中进行脂肪代谢,进入肝脏中的ALA可以进行链的加长和去饱和,最后生成EPA(图 1)[26, 29]。进入乳腺中的EPA最终以乳汁的形式排出体外。
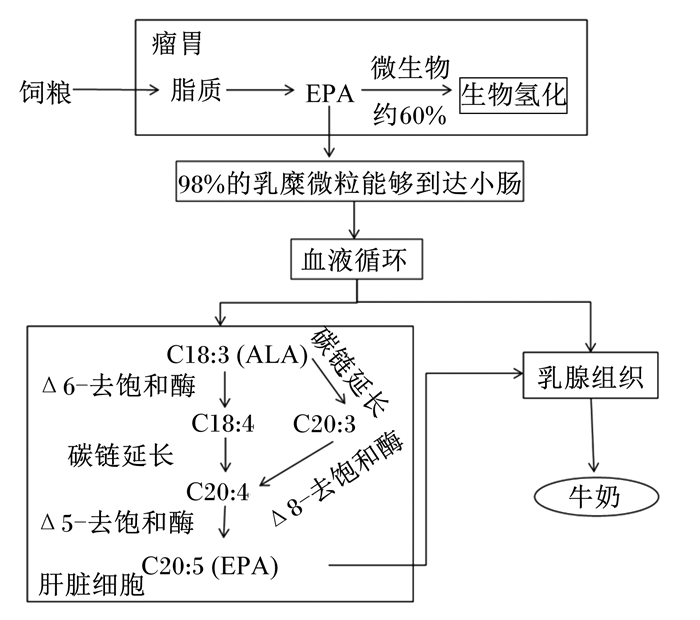
|
图 1 牛奶中EPA在体内的形成途径 Fig. 1 Forming pathway in vivo of EPA in milk |
研究发现,牛奶中EPA的转运效率比较低,只有5.4%[24],低于DHA和ALA。机体通过肝脏、乳腺等器官能够合成部分EPA。因此,调控其在体内合成的过程能够使EPA高效地转移到牛奶中。由图 1可知,在肝脏细胞中,ALA能够在一些酶的作用下合成EPA,因此有学者将目光转移到了EPA形成途径中的必需酶。以往在猪和人上的研究发现,Δ6-去饱和酶和Δ5-去饱和酶在肝脏和脂肪组织以及血液中的表达量与饲粮有非常密切的关系[30-31]。但是,在奶牛方面有关Δ6-去饱和酶和Δ5-去饱和酶在肝脏中表达量的研究还比较缺乏。通过改变限速酶来调控EPA的合成量有非常大的潜力,但是这方面的研究还很缺乏。一方面,未来应关注EPA合成过程中必需酶的活性;另一方面,体内特异性基因的改变也许会影响限速去饱和酶和延长酶的活性,进而影响机体内EPA的代谢。
早在1995年,曾经有学者试图从基因型方面来探索影响EPA转化效率的内在因素,给荷斯坦奶牛、瑞士褐牛和娟姗牛饲喂同样的饲粮,然而没有发现不同基因型的奶牛其牛奶中脂肪酸的比例有显著差异[32]。Minihane[33]发现载脂蛋白E(APOE)和脂肪酸去饱和酶(FADS)这2个基因有调节EPA代谢的潜能,但是需要更多的研究来支撑这一论点。有学者发现来自秀丽隐杆线虫(Caenorhabditis elegans)的fat-1基因是合成ω-3 PUFA的关键基因,此基因参与编码ω-3多聚不饱和脂肪酸脱氢酶[34],能够将18~20碳的ω-6 PUFA为底物合成相应的ω-3 PUFA,因此调控机体中Fat-1的表达量能够直接调控ω-3 PUFA的转化效率。这一发现在小鼠试验上多次得到了验证[35]。近些年,转基因技术的进步使得转Fat-1基因的动物越来越普遍,如转基因淡水鲤鱼可以作为一种富含EPA和DHA的新型健康鱼[36]。同样,奶牛体内也可以通过改变此基因来改变奶牛体内EPA的转化效率。
3.2 饲粮调控从目前来看,牛奶中EPA的含量主要受饲粮的影响。饲粮中添加富含EPA的饲料原料能够显著提高牛奶中EPA的含量,其中效果最佳的是在饲粮中添加鱼油[37-38, 23]。但是这与鱼油的添加量相关,研究发现,每天采食的鱼油超过428 g时,会影响到牛奶中EPA的含量,但是,在动物采食的鱼油量较低的情况下,牛奶中EPA的含量则不受影响[39]。研究还发现微藻中具有较高含量的EPA,特别是微拟球藻,其EPA含量高达3.16%[40]。近年有学者发现微藻对牛奶的产量和品质都有很大的影响,特别是对牛奶中EPA和DHA等ω-3 PUFA的含量有提升作用[41]。研究发现,在奶牛饲粮中添加微藻能够显著提高牛奶中EPA的含量[21, 23, 42-43],并且在山羊和绵羊的研究上也发现,增加饲粮中微藻的添加量对羊奶中EPA的含量有提升作用[44]。脂质复合物(以葡萄籽为试验原料)中含有丰富的ω-3 PUFA[共轭亚油酸(CLA)含量占38%,EPA和DHA含量之和占36.5%],饲粮中添加适当脂质复合物,牛奶和奶畜奶酪中脂肪酸的组成也有一定的改变[45]。综合以上试验结果可知,富含EPA的饲料原料对于提高牛奶或羊奶中EPA含量有显著效果。但是,牛奶中EPA含量虽然有所提高,其含量仍然相对较低,对于提高牛奶的功能作用还有一定的差距,因此,目前需要开发更多能够提高牛奶中EPA含量的饲料原料。
机体内的ALA能够通过一系列生化反应转化为EPA,因此在饲粮中增加富含亚麻酸的饲料原料也是一条提高乳脂中EPA含量的途径。许多亚麻籽所榨的油或者产亚麻籽的草中都含有丰富的亚麻酸。研究发现,增加饲粮中牧草含量能够显著增加奶牛血液以及牛奶中EPA的含量[46]。通过饲喂新鲜牧草或者保护性亚麻油能够增加亚麻酸的摄入量,从而增加哺乳陆生动物体内合成EPA的前体物[47]。但是也有学者发现,饲粮中富含亚麻酸的牧草含量高时(600 g/kg vs. 250 g/kg),亚麻酸的摄入量增加比较明显(84 g/d vs. 58 g/d),而牛奶中亚麻酸含量的增加幅度较小(8.0 g/d vs. 5.9 g/d),富含亚麻酸的牧草是否对牛奶中EPA的含量有所影响还未见报道。造成这种现象的原因可能是饲粮中牧草含量高时反而加速了不饱和脂肪酸的氢化,改变了瘤胃的发酵模式,研究发现,瘤胃中pH高和丙酸产量低时,更利于氢化的进行[48];另外,牧草中亚麻酸包括多种类型,而只有ALA才能有效转化为EPA。但是,摄入过多的ALA,机体对亚油酸的吸收则会受到抑制,从而打破机体内脂肪酸平衡,造成代谢紊乱[49]。因此,饲粮中亚麻酸的添加需要谨慎。总体来说,增加奶牛饲粮中EPA的含量能够直观地提升牛奶EPA含量,但是目前的效果还不太理想,因为奶牛本身的代谢机制非常复杂。虽然瘤胃壁对脂肪酸的吸收率很低,但是其瘤胃环境也可能影响饲粮中脂肪酸的组成,因为瘤胃微生物的作用还远远没有被认识清楚。
3.3 瘤胃微生态调控EPA在机体内的转化效率较低的一个重要原因是,不饱和脂肪酸在瘤胃中容易被瘤胃微生物氢化为饱和脂肪酸。造成这种现象的原因有多种且很复杂[50],其中“脱毒理论”认为不饱和脂肪酸对瘤胃微生物是有毒性的,将会抑制微生物的生长,在微生物的进化中形成了氢化这一种自我保护机制[51]。为了增加牛奶中的EPA含量,不管是在饲粮中直接添加EPA,还是通过添加亚麻酸,都会遇到同样的问题,饲粮中增加富含PUFA的原料会对瘤胃发酵产生负面影响,这主要是因为对瘤胃微生物分解纤维的活性造成了影响,并且饲粮中油脂添加较多时也可能会造成瘤胃酸中毒。因此,目前在提高牛奶中EPA含量上存在的主要问题就是,如何防止瘤胃微生物对不饱和脂肪酸的生物氢化作用。
研究发现鱼油作为奶牛的饲料添加剂,对瘤胃微生物有一定的毒性,如参与脂肪酸代谢的主要微生物之一溶纤维丁酸弧菌,并且降低了乳脂的含量[52]。Maia等[53]发现,当不饱和脂肪酸参与到溶纤维丁酸弧菌的细胞代谢时,细胞膜的渗透性增加,从而影响细胞的完整性。研究者认为,破坏细胞的完整性是PUFA发挥其毒性的机理,并且发现高度不饱和脂肪酸如EPA,对瘤胃微生物的毒性更强。对鱼油进行保护能够防止其对瘤胃功能的不利影响。研究发现,在不降低山羊干物质采食量和产奶量的基础上,饲粮中添加过瘤胃金枪鱼油显著增加了羊奶中EPA的含量,饲粮中添加3%的保护性金枪鱼油,羊奶中EPA的含量为0.3%~0.5%,EPA转运到羊奶中的效率为3.5%~7.6%[54]。
|
|
表 1 影响牛奶中EPA含量的饲粮因素 Table 1 Dietary factors influencing EPA content in milk |
脂肪酸在瘤胃中的生物氢化主要取决于甘油三酯的分解。综合以往的研究发现,利用不同的方法防止细菌脂解能够有效地阻止瘤胃中PUFA的生物氢化。用惰性物质包被鱼油能够有效地增加牛奶中EPA的含量[55]。用油料种子乳化鱼油和其他海洋生物油也能够起到保护脂肪酸的作用,比如在体外用大豆油乳化金枪鱼油,75%的脂肪酸能够得到保护[56]。然而,在体内乳化脂肪效果并不理想,油菜籽乳化时,EPA的表观转化效率能够达到29%[57]。利用脂肪酸的钙盐也可以防止瘤胃细菌发生紊乱,从而起到保护脂肪酸的效果,因为这部分脂肪酸在中性环境中很难降解,但是在酸性环境下将会被酶解[58]。将脂肪酸转化为脂肪酰胺也是一种保护脂肪酸不被生物氢化的方法,但是也有研究者持不同的态度。
瘤胃中pH较低的情况下,甘油三酯的分解将大大降低,原则上饲粮中增加谷物类饲料能够改变瘤胃发酵模式,从而使瘤胃pH降低[48],进而提高对脂肪酸的保护。然而,瘤胃中的低pH降低了微生物蛋白的产量和纤维分解的速度和程度,并且这个过程对奶牛的健康造成了一定的影响,容易造成瘤胃酸中毒,因此通过降低瘤胃pH来保护PUFA的方法在生产上不能够顺利实施。另外,加热饲料也可以适当的减少脂肪酸在瘤胃中的生物氢化,将加热到130 ℃的油菜籽添加到饲粮中能够有效地增加牛奶中的ω-3 PUFA的含量[59]。防止瘤胃中不饱和脂肪酸被氢化能够有效地提高EPA在体内的转化效率,目前研究的方法虽然比较多,但是在实践上得到应用的却很少。测序技术的发展使瘤胃微生物的研究有了突飞猛进的发展,未来应该着重探索生物氢化相关的特定微生物,并且调控其参与生物氢化的过程,减少EPA在瘤胃中的氢化率,增加其转运到小肠和血液中的量,从而提升其在牛奶中的含量。
3.4 机体对EPA吸收率的调控无论是肝脏中形成的EPA还是通过饲粮补充的EPA,机体对EPA的吸收都将直接影响牛奶中EPA的含量。对于反刍动物来说,机体对脂肪酸的吸收取决于其链的长短,对C16和C18脂肪酸的消化率最高(80%),而对C12、C14、C20和C22脂肪酸的消化率有所降低(65%~70%),并且随着脂肪酸饱和度的降低其消化率有所升高[60]。对于提高EPA在体内吸收率的研究比较困难,也缺乏这方面的数据,因此未来有必要从这方面入手,从机体调控吸收EPA的基因上来探索提升EPA吸收率的方法。就机体对EPA的吸收情况,最关键的前提是了解清楚其在小肠上皮、肝脏和乳腺中的吸收机制。
4 小结与展望富含EPA的牛奶对人类的健康具有重要的作用,因此开发此类功能性牛奶成为科研工作者的关注热点。目前学者们主要集中于提高饲粮中EPA的含量、增加EPA的过瘤胃率等方面的研究。未来不仅要继续开发富含EPA的饲料原料,还应当将重点关注在某些导致不饱和脂肪酸生物氢化的特定微生物上,从特定的物种入手,通过调控其在瘤胃中的相对丰度和活性,从而调控EPA的过瘤胃率。另外,EPA在机体内的转化效率也是导致其在牛奶中含量较低的原因之一,其中EPA在乳腺中的吸收率是值得关注的一个重要因素,未来应该集中于这方面的研究。牛奶中EPA含量的调控是非常复杂的过程,受到饲粮、机体自身消化和吸收等因素的综合影响。通过饲粮来增加牛奶中EPA含量会受到瘤胃发酵模式、微生物区系等多方面的影响,因此,必须根据实际情况采用系统集成的综合技术措施才能取得理想的结果。
| [1] |
TOKUNAGA T, WATANABE B, SATO S, et al. Synthesis and functional assessment of a novel fatty acid probe, ω-ethynyl eicosapentaenoic acid analog, to analyze the in vivo behavior of eicosapentaenoic acid[J]. Bioconjugate Chemistry, 2017, 28(8): 2077-2085. DOI:10.1021/acs.bioconjchem.7b00235 |
| [2] |
SIMOPOULOS A P. Omega-3 fatty acids in health and disease and in growth and development[J]. The American Journal of Clinical Nutrition, 1991, 54(3): 438-463. DOI:10.1093/ajcn/54.3.438 |
| [3] |
HASHIMOTO A, KATAGIRI M, TORII S, et al. Effect of dietary α-linolenate/linoleate balance on leukotriene production and histamine release in rats[J]. Prostaglandins, 1988, 36(1): 3-16. DOI:10.1016/0090-6980(88)90098-6 |
| [4] |
李冀新, 张超, 罗小玲. α-亚麻酸研究进展[J]. 粮食与油脂, 2006(2): 10-12. DOI:10.3969/j.issn.1008-9578.2006.02.003 |
| [5] |
CALDER P C. Very long chain omega-3 (n-3) fatty acids and human health[J]. European Journal of Lipid Science and Technology, 2014, 116(10): 1280-1300. DOI:10.1002/ejlt.201400025 |
| [6] |
REN H, GHEBREMESKEL K, OKPALA I, et al. Patients with sickle cell disease have reduced blood antioxidant protection[J]. International Journal for Vitamin and Nutrition Research, 2008, 78(3): 139-147. DOI:10.1024/0300-9831.78.3.139 |
| [7] |
邱雅, 曹丰. ω-3多不饱和脂肪酸对心血管的保护作用及其分子机制研究[J]. 心脏杂志, 2018, 30(5): 580-583, 617. |
| [8] |
MINIHANE A M, ARMAH C K, MILES E A, et al. Consumption of fish oil providing amounts of eicosapentaenoic acid and docosahexaenoic acid that can be obtained from the diet reduces blood pressure in adults with systolic hypertension:a retrospective analysis[J]. The Journal of Nutrition, 2016, 146(3): 516-523. DOI:10.3945/jn.115.220475 |
| [9] |
陈恒建, 夏大云, 钱玲玲, 等. 二十碳五烯酸对糖尿病大鼠冠状动脉的舒张作用及其机制[J]. 中国心脏起搏与心电生理杂志, 2017, 31(5): 443-447. |
| [10] |
HALLAQ H, SMITH T W, LEAF A. Modulation of dihydropyridine-sensitive calcium channels in heart cells by fish oil fatty acids[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(5): 1760-1764. DOI:10.1073/pnas.89.5.1760 |
| [11] |
XIAO Y F, KE Q E, WANG S Y, et al. Single point mutations affect fatty acid block of human myocardial sodium channel α subunit Na+ channels[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(6): 3606-3611. DOI:10.1073/pnas.061003798 |
| [12] |
DYERBERG J, BANG H O, STOFFERSEN E, et al. Eicosapentaenoic acid and prevention of thrombosis and atherosclerosis?[J]. The Lancet, 1978, 312(8081): 117-119. DOI:10.1016/S0140-6736(78)91505-2 |
| [13] |
YOKOYAMA M, ORIGASA H, MATSUZAKI M, et al. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS):a randomised open-label, blinded endpoint analysis[J]. The Lancet, 2007, 369(9567): 1090-1098. DOI:10.1016/S0140-6736(07)60527-3 |
| [14] |
HASHIZUME M, MIHARA M. Atherogenic effects of TNF-α and IL-6 via up-regulation of scavenger receptors[J]. Cytokine, 2012, 58(3): 424-430. DOI:10.1016/j.cyto.2012.02.010 |
| [15] |
王炎炎, 宋志秀, 杨立刚, 等. 二十碳五烯酸对THP-1巨噬细胞源性泡沫细胞形成的影响及机制[J]. 食品科学, 2016, 37(5): 162-166. |
| [16] |
黄升谋. ω-3系列多不饱和脂肪酸生理功能及其机理[J]. 襄樊学院学报, 2010, 31(5): 16-19. DOI:10.3969/j.issn.1009-2854.2010.05.004 |
| [17] |
李静静, 潘勇, 王顺合, 等.膳食补充α-亚麻酸对小鼠前列腺肿瘤的影响[J/OL].食品科学技术(2017-02-28).http://www.paper.edu.cn/releasepaper/content/201702-187.
|
| [18] |
陶国琴, 李晨. α-亚麻酸的保健功效及应用[J]. 食品科学, 2000, 21(12): 140-143. DOI:10.3321/j.issn:1002-6630.2000.12.053 |
| [19] |
ZYMON M, STRZETELSKI J, SKRZY ŃSKI G. Aspects of appropriate feeding of cows for production of milk enriched in the fatty acids, EPA and DHA.A review[J]. Journal of Animal and Feed Sciences, 2014, 23(2): 109-116. DOI:10.22358/jafs/65698/2014 |
| [20] |
SIMOPOULOS A P. The importance of the omega-6/omega-3 fatty acid ratio in cardiovascular disease and other chronic diseases[J]. Experimental Biology and Medicine, 2008, 233(6): 674-688. DOI:10.3181/0711-MR-311 |
| [21] |
MOATE P J, WILLIAMS S R O, HANNAH M C, et al. Effects of feeding algal meal high in docosahexaenoic acid on feed intake, milk production, and methane emissions in dairy cows[J]. Journal of Dairy Science, 2013, 96(5): 3177-3188. DOI:10.3168/jds.2012-6168 |
| [22] |
DONOVAN D C, SCHINGOETHE D J, BAER R J, et al. Influence of dietary fish oil on conjugated linoleic acid and other fatty acids in milk fat from lactating dairy cows[J]. Journal of Dairy Science, 2000, 83(11): 2620-2628. DOI:10.3168/jds.S0022-0302(00)75155-1 |
| [23] |
VAHMANI P, FREDEEN A H, GLOVER K E. Effect of supplementation with fish oil or microalgae on fatty acid composition of milk from cows managed in confinement or pasture systems[J]. Journal of Dairy Science, 2013, 96(10): 6660-6670. DOI:10.3168/jds.2013-6914 |
| [24] |
MATTOS R, STAPLES C R, ARTECHE A, et al. The effects of feeding fish oil on uterine secretion of PGF2α, milk composition, and metabolic status of periparturient holstein cows[J]. Journal of Dairy Science, 2004, 87(4): 921-932. DOI:10.3168/jds.S0022-0302(04)73236-1 |
| [25] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [26] |
黄国欣, 张养东, 郑楠, 等. ω-3多不饱和脂肪酸对奶牛生理功能的影响及其调控机制的研究进展[J]. 动物营养学报, 2019, 31(1): 32-41. DOI:10.3969/j.issn.1006-267x.2019.01.004 |
| [27] |
ASHES J R, GULATI S K, KITESSA S M, et al. Utilization of rumen protected n-3 fatty acids by ruminants[M]. Nottingham: Nottingham University Press, 2000: 128-140.
|
| [28] |
RYMER C, GIVENS D I, WAHLE K W J. Dietary strategies for increasing docosahexaenoic acid (DHA) and eicosapentaenoic acid (EPA) concentrations in bovine milk:a review[J]. Nutrition Abstracts and Reviews-Series B:Livestock Feeds and Feeding, 2003, 73(4): 10-22. |
| [29] |
SPRECHER H. Metabolism of highly unsaturated n-3 and n-6 fatty acids[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2000, 1486(2/3): 219-231. |
| [30] |
MISSOTTEN J, DE SMET S, RAES K, et al. Effect of supplementation of the maternal diet with fish oil or linseed oil on fatty-acid composition and expression of Δ5- and Δ6- desaturase in tissues of female piglets[J]. Animal, 2009, 3(8): 1196-1204. DOI:10.1017/S1751731109004455 |
| [31] |
XIANG M, RAHMAN M A, AI H, et al. Diet and gene expression:delta-5 and delta-6 desaturases in healthy Chinese and European subjects[J]. Annals of Nutrition & Meterbolism, 2006, 50(6): 492-498. |
| [32] |
DEPETERS E J, MEDRANO J F, REED B A. Fatty acid composition of milk fat from three breeds of dairy cattle[J]. Canadian Journal of Animal Science, 1995, 75(2): 267-269. DOI:10.4141/cjas95-040 |
| [33] |
MINIHANE A M. Impact of genotype on EPA and DHA status and responsiveness to increased intakes[J]. Nutrients, 2016, 8(3): 123. DOI:10.3390/nu8030123 |
| [34] |
SPYCHALLA J P, KINNEY A J, BROWSE J. Identification of an animal ω-3 fatty acid desaturase by heterologous expression in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(4): 1142-1147. DOI:10.1073/pnas.94.4.1142 |
| [35] |
OSTERMANN A I, WAINDOK P, SCHMIDT M J, et al. Modulation of the endogenous omega-3 fatty acid and oxylipin profile in vivo—a comparison of the fat-1 transgenic mouse with C57BL/6 wildtype mice on an omega-3 fatty acid enriched diet[J]. PLoS One, 2017, 12(9): e0184470. DOI:10.1371/journal.pone.0184470 |
| [36] |
ZHANG X F, PANG S C, LIU C J, et al. A novel dietary source of EPA and DHA:metabolic engineering of an important freshwater species-common carp by fat1-transgenesis[J]. Marine Biotechnology, 2019, 21(2): 171-185. DOI:10.1007/s10126-018-9868-7 |
| [37] |
KEADY T W J, MAYNE C S, FITZPATRICK D A. Effects of supplementation of dairy cattle with fish oil on silage intake, milk yield and milk composition[J]. Journal of Dairy Research, 2000, 67(2): 137-153. DOI:10.1017/S0022029900004180 |
| [38] |
NELSON K A S, MARTINI S. Increasing omega fatty acid content in cow's milk through diet manipulation:effect on milk flavor[J]. Journal of Dairy Science, 2009, 92(4): 1378-1386. DOI:10.3168/jds.2008-1780 |
| [39] |
OFFER N W, SPEAKE B K, DIXON J, et al. Effect of fish-oil supplementation on levels of (n-3) poly-unsaturated fatty acids in the lipoprotein fractions of bovine plasma[J]. Animal Science, 2001, 73(3): 523-531. DOI:10.1017/S1357729800058495 |
| [40] |
LOPES P A, BANDARRA N M, MARTINS S V, et al. Markers of neuroprotection of combined EPA and DHA provided by fish oil are higher than those of EPA (Nannochloropsis) and DHA (Schizochytrium) from microalgae oils in Wistar rats[J]. Nutrition & Metabolism, 2017, 14: 62. |
| [41] |
ALTOMONTE I, SALARI F, LICITRA R, et al. Use of microalgae in ruminant nutrition and implications on milk quality-a review[J]. Livestock Science, 2018, 214: 25-35. DOI:10.1016/j.livsci.2018.05.006 |
| [42] |
BICHI E, HERVÁS G, TORAL P G, et al. Milk fat depression induced by dietary marine algae in dairy ewes:persistency of milk fatty acid composition and animal performance responses[J]. Journal of Dairy Science, 2013, 96(1): 524-532. DOI:10.3168/jds.2012-5875 |
| [43] |
SINEDINO L D P, HONDA P M, SOUZA L R L, et al. Effects of supplementation with docosahexaenoic acid on reproduction of dairy cows[J]. Reproduction, 2017, 153(5): 707-723. DOI:10.1530/REP-16-0642 |
| [44] |
PÍTI P, PAJOR F, BODNÁR Á, et al. Effect of micro-alga supplementation on goat and cow milk fatty acid composition[J]. Chilean Journal of Agricultural Research, 2015, 75(2): 259-263. DOI:10.4067/S0718-58392015000200017 |
| [45] |
BODKOWSKI R, CZYŻ K, KUPCZYŃ SKI R, et al. Lipid complex effect on fatty acid profile and chemical composition of cow milk and cheese[J]. Journal of Dairy Science, 2016, 99(1): 57-67. DOI:10.3168/jds.2015-9321 |
| [46] |
LA TERRA S, MARINO V M, MANENTI M, et al. Increasing pasture intakes enhances polyunsaturated fatty acids and lipophilic antioxidants in plasma and milk of dairy cows fed total mix ration[J]. Dairy Science & Technology, 2010, 90(6): 687-698. |
| [47] |
DOREAU M, CHILLIARD Y, RELQUIN H, et al.Manipulation of milk fat in dairy cows[M]//GARNSWORTHY P C, WISEMAN J.Recent advances in animal nutrition.Nottingham: Nottingham University Press, 1998: 81-109.
|
| [48] |
秦正君, 王若勇, 时国峰, 等. 日粮精粗比对奶牛瘤胃发酵及生产性能的影响[J]. 畜牧兽医杂志, 2018, 37(1): 83-85. DOI:10.3969/j.issn.1004-6704.2018.01.033 |
| [49] |
吴永保, 李琳, 闻治国, 等. 动物体内极长链多不饱和脂肪酸代谢及其生理功能[J]. 中国畜牧杂志, 2018, 54(3): 20-26. |
| [50] |
马涛, 刁其玉. 瘤胃微生物与饲粮脂肪酸间的相互作用[J]. 动物营养学报, 2018, 30(5): 1611-1618. DOI:10.3969/j.issn.1006-267x.2018.05.001 |
| [51] |
KEMP P, LANDER D J. Hydrogenation in vitro of α-linolenic acid to stearic acid by mixed cultures of pure strains of rumen bacteria[J]. Journal of General Microbiology, 1984, 130(3): 527-533. |
| [52] |
FRANKLIN S T, MARTIN K R, BAER R J, et al. Dietary marine algae (Schizochytrium sp.) increases concentrations of conjugated linoleic, docosahexaenoic and transvaccenic acids in milk of dairy cows[J]. The Journal of Nutrition, 1999, 129(11): 2048-2052. DOI:10.1093/jn/129.11.2048 |
| [53] |
MAIA M R, CHAUDHARY L C, BESTWICK C S, et al. Toxicity of unsaturated fatty acids to the biohydrogenating ruminal bacterium, Butyrivibrio fibrisolvens[J]. BMC Microbiology, 2010, 10(1): 52. DOI:10.1186/1471-2180-10-52 |
| [54] |
KITESSA S M, GULATI S K, ASHES J R, et al. Utilisation of fish oil in ruminants:Ⅰ.Fish oil metabolism in sheep[J]. Animal Feed Science and Technology, 2001, 89(3/4): 189-199. |
| [55] |
GULATI S K, MCGRATH S, WYNN P C, et al. Preliminary results on the relative incorporation of docosahexaenoic and eicosapentaenoic acids into cows milk from two types of rumen protected fish oil[J]. International Dairy Journal, 2003, 13(5): 339-343. DOI:10.1016/S0958-6946(03)00004-9 |
| [56] |
KITESSA S M, GULATI S K, ASHES J R, et al. Effect of feeding tuna oil supplement protected against hydrogenation in the rumen on growth and n-3 fatty acid content of lamb fat and muscle[J]. Australian Journal of Agricultural Research, 2001, 52: 433-437. DOI:10.1071/AR00058 |
| [57] |
GULATI S K, KITESSA S M, ASHES J R, et al. Designing milk fat for the new millennium by dietary strategies[J]. Asian-Australasian Journal of Animal Sciences, 2000, 13(Suppl.): 538-541. |
| [58] |
BRZÍSKA F, GASIOR R, SALA K, et al. Effect of calcium salts of fatty acids on yield and milk components (in Polish)[J]. Roczniki Naukowe Zootechniki, 1999, 26: 143-157. |
| [59] |
STRZETELSKI J A, RYŚ R, STASINIEWICZ T, et al. The effect of feeding ground formaldehyde-or heat-treated rape seeds on cow performance and milk composition[J]. Journal of Animal and Feed Sciences, 1992, 1(2): 97-106. DOI:10.22358/jafs/69900/1992 |
| [60] |
DOREAU M, FERLAY A. Digestion and utilisation of fatty acids by ruminants[J]. Animal Feed Science and Technology, 1994, 45(3/4): 379-396. |




