动物肠道内的微生物数量是自身细胞数量的10倍,具有与宿主进行信息交换的功能,肠道微生物影响宿主肠道的生长、发育、营养物质吸收能力及免疫能力,对肠道健康和宿主健康有至关重要的作用[1],肠道微生物结构的紊乱将引起疾病的发生。
近年来,由于抗生素的禁止使用,药食同源中草药提取物作为绿色饲料添加剂在动物生产中的应用越来越广泛。在饲粮中添加天然中草药提取物可以有效提高育肥猪的生长性能,改善肠道形态和菌群结构[2-3]。通过开发新型中草药提取物保证畜禽健康并提高经济效益成为目前研究的热点。枸芪多糖是由枸杞子、黄芪等天然植物经干燥提炼而成,具有无耐药性、无残留、制作工艺简便等特点。枸杞子,属茄科,味甘性平,入肝、肾经,类胡萝卜素是其主要成分之一,是一种营养性抗氧化剂[4],使枸杞子具有清除氧自由基,提高机体抗氧化能力,从而缓解疲劳产生的氧化应激反应[5]。枸杞子提取物对肠道菌群失调也有调节作用[6]。黄芪,味甘,微温,入肺、脾、肝、肾经,是补中益气的传统中药,黄芪多糖是其主要的活性成分,可以激活体内的免疫细胞,增强巨噬细胞的吞噬能力,具有增强免疫力的作用[7]。有学者发现,黄芪多糖可以降低蛋鸡直肠大肠杆菌的数量和提高断奶仔猪盲肠菌群丰度[8-9],改变肠道微生物。
枸杞子的抗氧化作用和黄芪的提高免疫功能被广泛研究,但把枸杞子和黄芪提炼为枸芪多糖探究其对生猪肠道微生物的研究鲜有报道。本研究将枸芪多糖添加到育肥猪基础饲粮中,探讨其对育肥猪肠道菌群多样性及组成的影响,为枸芪多糖在育肥猪生产中的应用提供参考。
1 材料与方法 1.1 试验材料枸芪多糖是由枸杞子与黄芪(购自安国药材市场)按照1:1混合后,采用正交试验提取制成的多糖,多糖含量为1.06%。
1.2 试验动物与试验设计选用180头80~90日龄、初始体重为(50±3) kg的健康杜×长×大三元杂交育肥猪作为试验动物,随机分成2个组,每组6圈(重复),每圈15头猪。对照组饲喂基础饲粮,试验组在基础饲粮中添加1‰枸芪多糖,试验期为3个月。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验开始前对猪舍及料槽、水槽全面消毒,试验猪分栏饲养,按常规免疫程序进行免疫和驱虫,自由采食和饮水。
1.4 样品处理 1.4.1 微生物基因组DNA的抽提试验结束时,随机屠宰每圈中1头育肥猪采集盲肠内容物,装入无菌的2 mL离心管中,迅速放入液氮中保存待检,严格按照粪便基因组DNA提取试剂盒说明书对样品中微生物基因组DNA进行抽提。
1.4.2 目的基因的PCR扩增与测序根据细菌通用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对细菌16S rRNA V3~V4可变区进行PCR扩增,PCR扩增步骤为:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃复性45 s,共27个循环,最后72 ℃延伸10 min,产物4 ℃保存。用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences公司,美国)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega公司,美国)进行定量检测。根据Illumina MiSeq平台(Illumina公司,美国)标准操作规程将纯化后的扩增片段构建PE 300文库。利用Illumina公司的MiSeq PE300平台进行测序,原始数据上传至NCBI数据库中。
1.4.3 生物信息学分析Miseq PE300平台测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行操作分类单元(OTU)聚类分析和物种分类学分析。基于OTU聚类分析结果,对OTU进行多种多样性指数分析,以及对测序深度检测;基于分类学信息,在各个分类水平上进行群落结构的统计分析。
1.5 数据处理与分析数据采用SPSS 16.0统计软件处理,进行单因素方差分析并进行组间差异显著性比较,数据以平均值±标准差表示,P < 0.05表示差异显著。
2 结果与分析 2.1 试验可行性分析为了看出样本测序深度情况,本次测序选择97%相似度的OTU,利用mothur计算不同随机抽样下的α多样性指数,利用R语言工具制作稀释曲线,从该曲线可以看出测序深度是否合理,同时可以得到不同测序量下样本中物种丰富度情况。当曲线趋于平缓时,说明达到测序深度,更多的数据量只会产生少量新的OTU或不产生新的OTU,若曲线仍是上升趋势,说明继续增加测序量还会有较多新的OTU产生。从图 1可知,当测序量达到20 000时,2组样品的稀释曲线均出现转折,随后开始趋于平缓,进入平台期,说明本次测序深度充分,数据量合理。
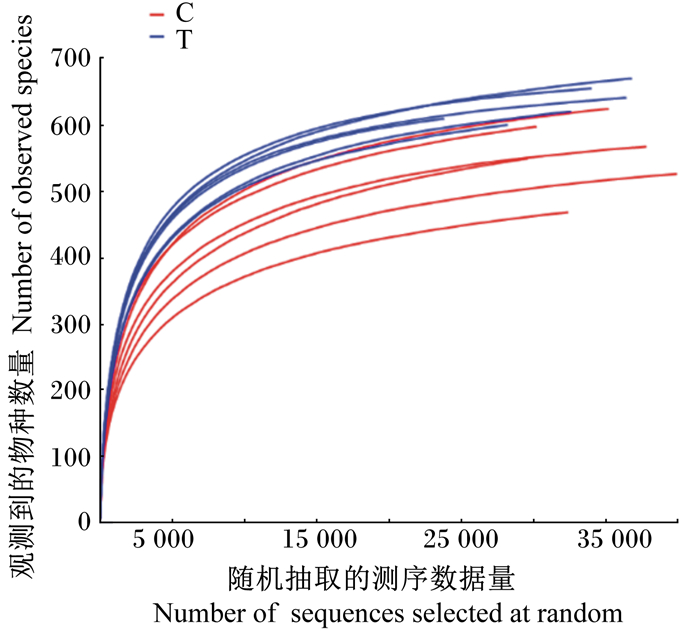
|
C:对照组control group;T:试验组trial group。下图同The same as below。 图 1 稀释曲线 Fig. 1 Rarefaction curves |
为了证实本次测序的多样性达到试验要求,绘制丰度等级曲线,该曲线可以看出物种丰度和均匀度。在水平方向,曲线的宽度反映出物种的丰度,曲线在横轴上的范围越大,物种的丰度就越高;在垂直方向,曲线下降的平滑程度反映样本中物种的均匀度,曲线下降趋势越平缓,表明物种分布均匀度较高。由图 2可知,所有样品的水平宽度较宽,下降趋势平缓,说明本次样品的物种丰度和均匀度较好。
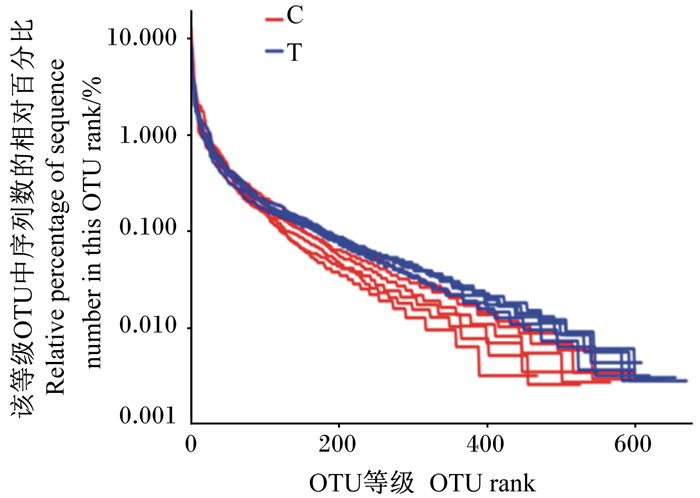
|
图 2 丰度等级曲线 Fig. 2 Rank-abundance curves |
通过相似性分析可以检验本次试验分组的组间差异是否大于组内差异,判断本试验分组是否有意义,纵坐标表示距离值。从图 3可以看出,组间的距离值大于组内的距离值,说明本次试验分组组间差异大于组内差异,分组具有科学意义。
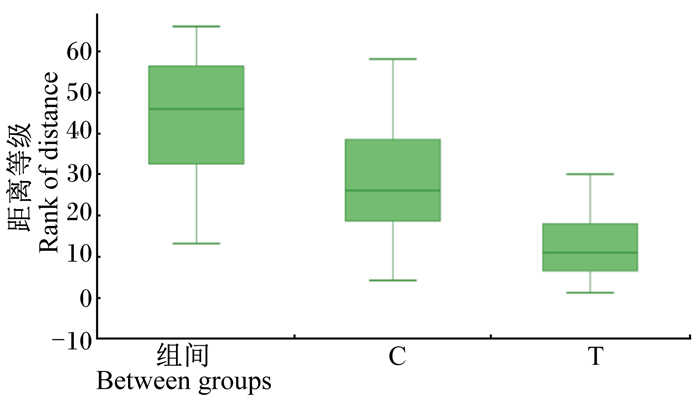
|
图 3 相似性分析 Fig. 3 Analysis of similarities |
α多样性是基于OTU聚类结果对生物多样性进行的分析,包括Ace指数、Chao指数、Shannon指数、Simpson指数,Ace指数和Chao指数反映出样本中物种的丰富度,即群落中物种的种类;而Shannon指数和Simpson指数反映物种的多样性,受样本丰富度和均匀度的影响,Simpson指数与另外3个指数不同,数值越小说明样本物种多样性越高。如表 2所示,对照组与试验组分别得到38 677和41 288条有效序列数,差异显著(P < 0.05)。试验组的Ace指数、Chao指数和Shannon指数高于对照组,且差异显著(P < 0.05);试验组的Simpson指数低于对照组,但差异不显著(P>0.05),该结果说明枸芪多糖显著增加肠道微生物的丰富度和多样性。
|
|
表 2 枸芪多糖对育肥猪肠道菌群α多样性的影响 Table 2 Effects of Gou-Qi polysaccharides on α diversity of intestinal microbiota of growing-finishing pigs |
β多样性分析是比较不同样本间微生物群落间的差异,比较的基本输出是一个距离矩阵。β多样性层级聚类树可以清楚地看出每个样本的距离远近,根据树枝的距离可以划分出不同的分组。主坐标分析(PCoA)是通过图中样本点之间的距离,得到样本间群落组成的相似程度,2个样本点越接近,表明2个样本物种组成越相似。从图 4可知,在OTU水平上可以明显将2组区分开,说明对照组与试验组的微生物群落组成有较大差异。
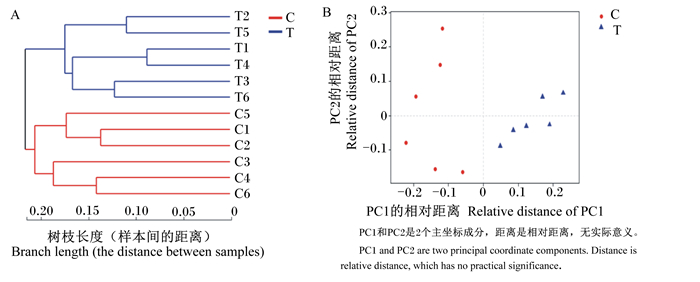
|
图 4 层级聚类树(A)和主坐标分析(B) Fig. 4 Hierarchical clustering tree (A) and PCoA (B) |
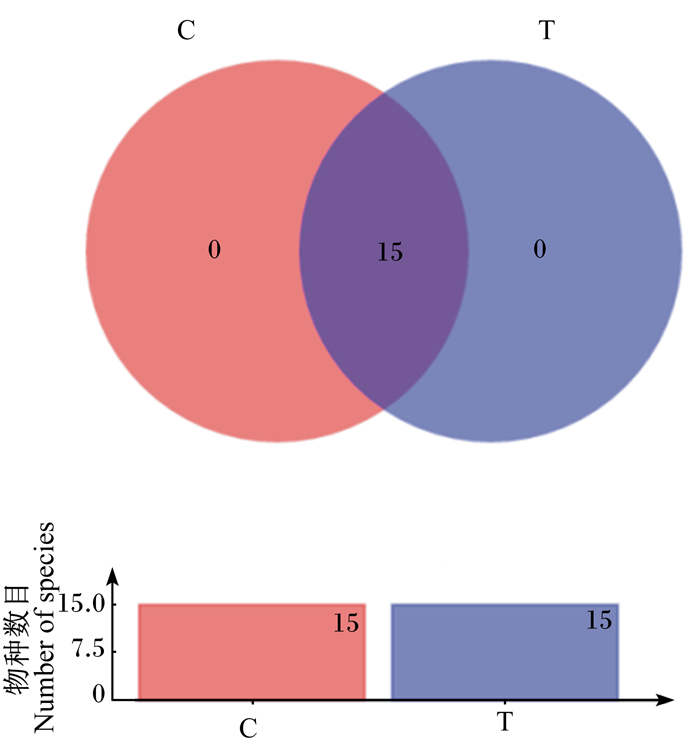
利用维恩(Venn)图可以直观地看出在不同分类学水平上不同组间物种的重叠情况。从图 5可以看出,在门水平上2组的肠道菌群构成无差异。为了进一步分析菌群构成比例的差异,进行了组间差异显著性检验分析。
|
图 5 门水平上的Venn图 Fig. 5 Venn diagram on phylum level |
从表 3可以看出,在门水平上2组的两大优势菌均为拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),2组拟杆菌门的相对丰度相差不大(P>0.05),均约为47%,试验组厚壁菌门的相对丰度较对照组升高5%,差异不显著(P>0.05),两大优势菌门的累计相对丰度在2组中均达到80%以上;随后依次是变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)和螺旋体门(Spirochaetae),与对照组相比,试验组变形菌门和螺旋体门的相对丰度分别降低2.7%和0.6%,但差异不显著(P>0.05),试验组梭杆菌门的相对丰度降低2.1%,且差异显著(P < 0.05);相对丰度低于1%且2组间差异显著的菌门包括互养菌门(Synergistetes)、疣微菌门(Verrucomicrobia)和黏胶球形菌门(Lentisphaerae),表现为试验组显著或极显著高于对照组(P < 0.05或P < 0.01);其他菌门虽有差异,但相对丰度较小且无统计学意义,未表中列出。上述试验结果说明枸芪多糖虽未改变门水平上肠道菌群组成,但改变了菌群构成比例。
|
|
表 3 门水平上的相对丰度 Table 3 Relative abundance on phylum level |
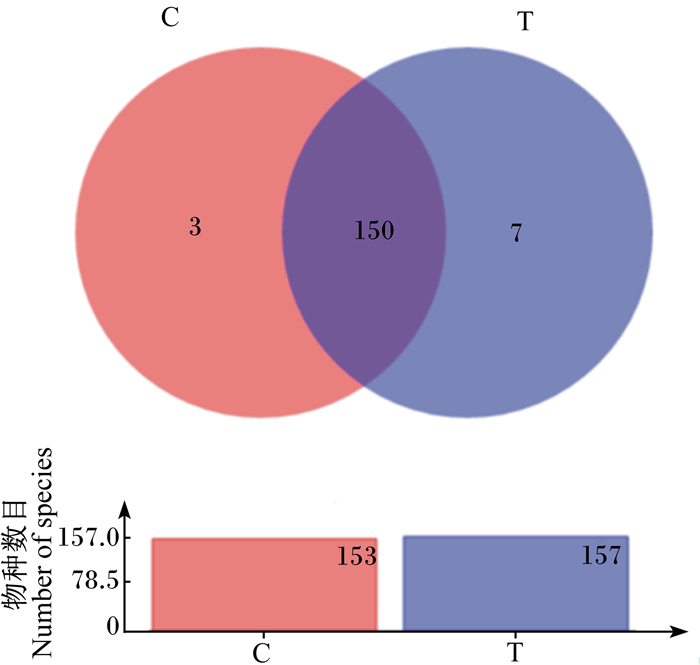
从Venn图(图 6)中可以看出,2组一共检测出160种菌属,其中150种菌属重叠,只在对照组中检测出的菌属有3种,分别是Terrisporobacter、蓝藻纲相关菌属、奇异菌属(Atopobium);只在试验组中检测出的菌属有7种,分别是厚壁菌门相关菌属Dielma、红螺菌科相关菌属、单胞菌科相关菌属、拟杆菌科相关菌属、β-变形菌纲相关菌属、毛螺菌科相关菌属、红蝽杆菌科相关菌属。
|
图 6 属水平上的Venn图 Fig. 6 Venn diagram on genus level |
从表 4可以看出,在属水平上,2组最大的优势菌均是拟杆菌属(Bacteroides),相对丰度分别达到23.410%和24.280%,试验组高于对照组,但差异不显著(P>0.05);其次是考拉杆菌属(Phascolarctobacterium)和理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group),试验组考拉杆菌属的相对丰度高于对照组,但差异不显著(P>0.05),理研菌科RC9肠道群的相对丰度在对照组和试验组中分别为4.406%和6.482%,组间差异显著(P < 0.05);梭杆菌属(Fusobacterium)、巨单胞菌属(Megamonas)、普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)、巨球型菌属(Megasphaera)、螺杆菌属(Helicobacter)、厌氧螺菌属(Anaerobiospirillum)的相对丰度,对照组均高于试验组,且差异显著或极显著(P < 0.05或P < 0.01);未明确瘤胃球菌科相关菌属(Norank_f_Ruminococcaceae)、瘤胃球菌科UCG-014 (Ruminococcaceae_UCG-014)、瘤胃球菌属扭链群([Ruminococcus]_torques_group)、副杆状菌属(Parabacteroides)、厌氧棍状菌属(Anaerotruncus)、未明确梭菌科相关菌属(Norank_f__Clostridiales_vadinBB60_group)、瘤胃球菌科UCG-005(Ruminococcaceae_UCG-005)、互养菌属(Synergistes)的相对丰度,试验组均显著高于对照组(P < 0.05)。
|
|
表 4 属水平上的相对丰度 Table 4 Relation abundance on genus level |
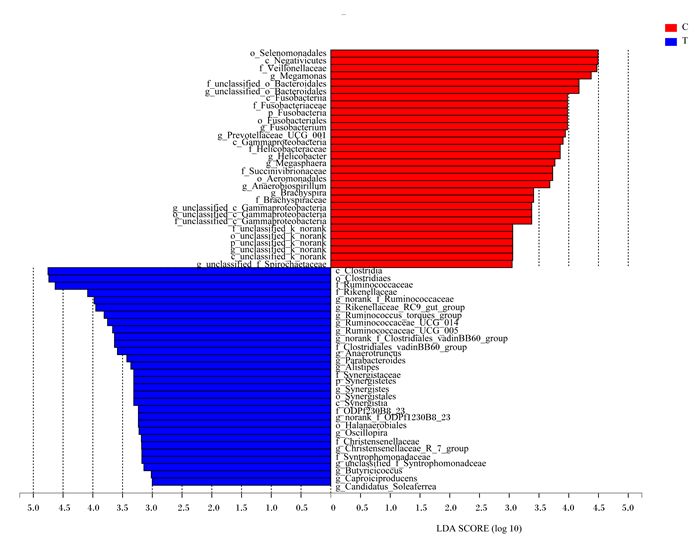
为了进一步分析出对组间菌群结构产生显著影响的菌群,对肠道菌群进行LEfSe多级物种差异判别分析,该分析用于多个组间差异比较,从而可检测出具有显著丰度差异的贡献菌。此外,可采用LEfSe线性判别分析(LDA)来估算每个物种丰度对差异效果影响的大小。从图 7可以看出,对照组中的梭杆菌门至梭杆菌属、γ-变形菌纲至厌氧螺菌属、Negativicutes至巨单胞菌属,试验组中的互养菌门至互养菌属、梭菌纲至Christensenellaceae、从瘤胃菌科至瘤胃菌属,这几个进化树在组间的菌群结构差异中发挥主要作用。除此之外,从图 8还可以看出对照组中的韦荣球菌科(Veillonellaceae)、螺杆菌纲、螺杆菌属、巨球型菌属,试验组中的厌氧棍状菌属、另枝菌属(Alistipes)、副杆状菌属同样是组成组间菌群结构显著差异的主要贡献菌。

|
Gammaproteobacteria:γ-变形菌纲;unclassified_c_Gammaproteobacteria:未分类γ-变形菌纲;Aeromonadales:气单胞菌目;Succinivibrionaceae:琥珀酸弧菌科;Anaerobiospirillum:厌氧螺菌属;Helicobacteraceae:螺杆菌科;Helicobacter:螺杆菌属;Clostridia:梭菌属;Clostridiales:梭菌目;Selenomonadales:硒单胞菌目;Ruminococcaceae:瘤胃菌科;Oscillospira:颤螺菌属;Ruminococcaceae_UCG-005:瘤胃球菌科UCG_005;norank_f_Ruminococcaceae:未明确瘤胃球菌科相关菌属;Caproiciproducens:己酸菌属;Ruminococcaceae_UCG-014:瘤胃球菌科UCG-014;Butyricicoccus丁酸球菌属;Ruminococcus_torques_group:瘤胃球菌属扭链群;Christensenellaceae:克里斯滕森菌科;Veillonellaceae:韦荣球菌科;Megamonas:巨单胞菌属;Megasphaera:巨球型菌属;Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001;Parabacteroides:副拟杆菌属;Rikenellaceae:理研菌科;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群;Alistipes:另枝菌属;unclassified_o_Bacteroidales:未分类拟杆菌目;unclassified_k_norank:未分类库;Synergistetes:互养菌门;Synergistia:互养菌纲;Synergistales:互养菌目;Synergistaceae:互养菌科;Synergistes:互养菌属。下图同The same as below。 图 7 进化分支图 Fig. 7 Cladogram |
|
图 8 线性判别分析 Fig. 8 LDA |
肠道菌群是肠道的一道生物屏障,可以与肠上皮细胞紧密结合共同抑制病原菌的生长和侵入,在维持肠道健康上发挥着重要作用。正常动物肠道内寄生10万亿个细菌,分为有益菌、条件致病菌和有害菌,它们之间存在相互竞争、相互依存的关系,正常的菌群对机体生理活动十分重要,具有保护、屏障、促进营养物质的吸收、参与代谢等作用[10],而菌群的平衡极易受饲养环境、饮食、自身免疫力等因素的影响,这种平衡一旦打破,则会导致菌群失调,增加肠道疾病发生的概率[11-12]。
3.1 试验可行性分析本试验运用稀释曲线、丰度等级曲线和相似性分析,说明本次测序深度充分,测序量合理,更多的数据量只会产生少量新的物种[13],样本的丰富度和均匀度都较好并且组间差异大于组内差异,分组具有科学意义,证明此次测序数据具有可靠性和科学性。另外,所有样本的覆盖率均达到99.7%,说明检测到的细菌数满足测序要求,未被检出的可能性较低,可以进行多样性分析。
3.2 多样性指数分析α多样性指数通常用来反映样本多样性和丰富度,其中Ace指数和Chao指数反映样本中物种的丰富度,即群落中物种的种类;Shannon指数和Simpson指数反映物种的多样性,受样本丰富度和均匀度的影响。研究发现,给小鼠饲喂复合益生菌可显著增加小鼠肠道菌群的Ace指数和Chao指数[14];在断奶仔猪饲粮中添加褐藻糖胶14 d后显著增加了肠道菌群的Chao指数和Shannon指数[15]。本次试验结果显示试验组的Ace指数和Chao指数均显著高于对照组,说明试验组肠道菌群的丰富度显著增加;试验组Shannon指数显著高于对照组,试验组Simpson指数低于对照组,而Shannon指数越低、Simpson指数越高表明群落多样性越低。α多样性指数分析结果表明在饲粮中添加枸芪多糖可显著提高育肥猪肠道菌群的丰富度,并可增加肠道菌群的多样性。β多样性的层级聚类树和PCoA可以明显看出枸芪多糖对样本的OTU数目了较大影响,2组的肠道菌群构成有较大差异。Burrough等[16]在对可溶性酒糟与猪结肠菌群关系的研究中也得到相近的结果,酒糟组的β多样性较对照组发生了显著变化,这说明植物添加剂可以改变动物肠道菌群多样性。
3.3 菌群结构分析Illumina高通量测序结果表明,2组育肥猪肠道菌群在门水平上的优势菌均是拟杆菌门(Bacteroidetes),其次是厚壁菌门(Firmicutes),二者累计相对丰度高达82%,拟杆菌属是2组最大的优势菌属,相对丰度均在23%以上,与已有研究结果[17]一致。本试验中2组厚壁菌门的相对丰度均低于拟杆菌门,且试验组高于对照组,现有研究表明肠道中的厚壁菌门数量低于拟杆菌门时,有利于对食物中热量的吸收[18],而且厚壁菌门与碳水化合物和蛋白质的吸收有关[19]。在本试验中,饲粮中添加枸芪多糖增加了育肥猪肠道菌群中厚壁菌门的相对丰度,这是否影响了育肥猪肠道营养吸收功能有待进一步研究。
试验组中的变形菌门及其γ-变形菌纲的相对丰度低于对照组,变形菌门中包含多种病原菌,尤其是γ-变形菌纲,沙门氏菌属(Salmonella)、耶尔辛氏菌属(Yersinia)、弧菌属(Vibrio)、绿脓杆菌(Pseudomonas aeruginosa)等均属于γ-变形菌纲,有研究报道,围产期暴露于变形菌门是新生儿发生气喘的诱因之一[20],在艰难梭菌相关性腹泻模型小鼠肠道菌群中发现变形菌门的相对丰度升高,同样以γ-变形菌纲的相对丰度升高为主[21]。变形菌门及相关菌属在肠道菌群中所占比例增加,会使机体内毒素含量增加,进而使炎症因子含量增加,破坏肠道菌群,引发疾病[22-23]。与对照组相比,试验组梭杆菌门和梭杆菌属的相对丰度显著降低,并且通过LEfSe多级物种差异判别分析得出γ-变形菌纲和梭杆菌门及其延伸的梭杆菌属进化树均是对使组间菌群结构发生显著差异的主要贡献菌。梭杆菌属中的具核梭杆菌和坏死梭杆菌均有较强的毒性作用,研究发现,给小鼠灌胃具核梭杆菌会造成小鼠肠道菌群紊乱[24],结肠癌患者肠道中坏死梭杆菌的数量显著升高[25],以上研究结果表明变形菌门和梭杆菌属可能是一些疾病发生的诱因之一。在饲粮中添加枸芪多糖后降低了育肥猪肠道菌群中变形菌门和梭杆菌属中有害菌的相对丰度,而使菌群结构发生改变。
互养菌属是一种新发现的菌属,广泛存在于动物肠道和土壤的厌氧环境中,在反刍动物肠道中可以抑制饲粮中毒素的作用,稳定肠道内环境[26]。本试验中,饲粮中添加枸芪多糖可显著增加肠道菌群中互养菌属的相对丰度,表明枸芪多糖可增强肠道黏膜对饲粮中可能存在的毒素作用的防御力,进而改善育肥猪肠道健康,同时互养菌属也是使肠道菌群结构在属水平发生改变的主要贡献菌之一,说明该菌属相对丰度的改变是枸芪多糖使组间群落结构发生改变的主要原因之一。
本试验研究显示,饲粮中添加枸芪多糖使肠道中的巨单胞菌属和螺杆菌属的相对丰度显著降低。有研究表明儿童过敏性紫癜患儿粪便中的巨单胞菌属的相对丰度降低[27],但也有报道得出脊髓损伤患者肠道中的巨单胞菌属数量低于健康人群[28],目前对巨单胞菌属的功能研究较少,其作用机制尚不清楚,有待进一步研究。螺杆菌属是一个新的菌属,近年来它的特性、致病性与疾病的关系被广泛的研究,据报道,螺杆菌属感染可以引起动物的肝炎、胆管炎和胃肠炎;螺杆菌属的毒力因子会导致宿主的直接损伤和影响免疫应答,激活中性粒细胞和产生炎症细胞因子引起炎症[29-30]。螺杆菌属作为致病菌,枸芪多糖可显著降低其对肠道黏膜的损伤,使肠道健康。
4 结论饲粮中添加枸芪多糖可提高育肥猪肠道菌群的丰富度和多样性,增加肠道中有益菌厚壁菌门和互养菌门的相对丰度,降低有害菌变形菌门、螺杆菌属和梭杆菌属的相对丰度,从而优化肠道菌群平衡,建立更健康的肠道菌群结构。
| [1] |
YANG Y X, DAI Z L, ZHU W Y. Important impacts of intestinal bacteria on utilization of dietary amino acids in pigs[J]. Amino Acids, 2014, 46(11): 2489-2501. DOI:10.1007/s00726-014-1807-y |
| [2] |
AHMED S T, MUN H S, ISLAM M M, et al. Effects of dietary natural and fermented herb combination on growth performance, carcass traits and meat quality in grower-finisher pigs[J]. Meat Science, 2016, 122: 7-15. DOI:10.1016/j.meatsci.2016.07.016 |
| [3] |
陈小军, 王宇, 王帅帅, 等. 钩吻提取物对生长猪生长性能、肠道形态和盲肠菌群的影响[J]. 动物营养学报, 2018, 30(9): 3626-3633. DOI:10.3969/j.issn.1006-267x.2018.09.033 |
| [4] |
罗青, 米佳, 冉林武, 等. 枸杞类胡萝卜素研究进展[J]. 食品工业科技, 2018, 39(24): 331-335, 339. |
| [5] |
杨晓磊, 耿嘉, 仇道静, 等. 藏药黑果枸杞水提物对运动疲劳所致氧化应激的影响[J]. 中国现代应用药学, 2018, 35(10): 1494-1497. |
| [6] |
刘云婷, 徐巍, 辛毅, 等. 枸杞子提取物对小鼠肠道菌群失衡的调整作用[J]. 天然产物研究与开发, 2015, 27(7): 1270-1272, 1295. |
| [7] |
刘瑞生. 黄芪多糖在猪病防治上的研究与应用概况[J]. 养猪, 2013(6): 17-20. DOI:10.3969/j.issn.1002-1957.2013.06.007 |
| [8] |
孙波, 陈静, 吴娟, 等. 黄芪多糖对免疫抑制肉鸡生长性能、肠道菌群及免疫功能的影响[J]. 中国畜牧兽医, 2014, 41(8): 101-106. |
| [9] |
甄玉国, 陈雪, 王晓磊, 等. 黄芪多糖(APS)对断奶仔猪生长性能、血液生理生化指标及菌群多样性的影响[J]. 中国兽医学报, 2016, 36(11): 1954-1958, 1968. |
| [10] |
唐立. 人类肠道微生态基础与应用研究进展[J]. 沈阳医学院学报, 2016, 18(5): 321-324. |
| [11] |
VON MARTELS J Z H, SADAGHIAN SADABAD M, BOURGONJE A R, et al. The role of gut microbiota in health and disease:in vitro modeling of host-microbe interactions at the aerobe-anaerobe interphase of the human gut[J]. Anaerobe, 2017, 44: 3-12. DOI:10.1016/j.anaerobe.2017.01.001 |
| [12] |
LOPETUSO L R, SCALDAFERRI F, BRUNO G, et al. The therapeutic management of gut barrier leaking:the emerging role for mucosal barrier protectors[J]. European Review for Medical and Pharmacological Sciences, 2015, 19(6): 1068-1076. |
| [13] |
杨俊花, 赵志辉, 郭文博, 等. 应用Illumina-MiSeq高通量测序技术分析脱氧雪腐镰刀菌烯醇对小鼠肠道菌群的影响[J]. 动物营养学报, 2017, 29(1): 158-167. DOI:10.3969/j.issn.1006-267x.2017.01.018 |
| [14] |
曲巍, 张智, 马建章, 等. 高通量测序研究益生菌对小鼠肠道菌群的影响[J]. 食品科学, 2017, 38(1): 214-219. |
| [15] |
刘萍, 赵金标, 耿正颖, 等. 日粮添加褐藻糖胶对断奶仔猪抗炎能力和肠道微生物多样性的影响[J]. 微生物学报, 2019, 59(4): 700-710. |
| [16] |
BURROUGH E R, ARRUDA B L, PATIENCE J F, et al. Alterations in the colonic microbiota of pigs associated with feeding distillers dried grains with solubles[J]. PLoS One, 2015, 10(11): e0141337. DOI:10.1371/journal.pone.0141337 |
| [17] |
SCHOKKER D, ZHANG J, ZHANG L L, et al. Early-life environmental variation affects intestinal microbiota and immune development in new-born piglets[J]. PLoS One, 2014, 9(6): e100040. DOI:10.1371/journal.pone.0100040 |
| [18] |
韩岗, 马婧, 陶士珩, 等. 厚壁菌门细菌及其祖先蛋白的氨基酸偏好性研究[J]. 安徽农业科学, 2011, 39(30): 18408-18410. DOI:10.3969/j.issn.0517-6611.2011.30.009 |
| [19] |
YATSUNENKO T, REY F E, MANARY M J, et al. Human gut microbiome viewed across age and geography[J]. Nature, 2012, 486(7402): 222-227. DOI:10.1038/nature11053 |
| [20] |
TURTURICE B A, GOLD D R, LITONJUA A A, et al. Lower perinatal exposure to proteobacteria is an independent predictor of early childhood wheezing[J]. The Journal of Allergy and Clinical Immunology, 2019, 143(1): 419-421. DOI:10.1016/j.jaci.2018.06.051 |
| [21] |
姚虹, 吕治, 徐虎峰, 等. 黄连素对艰难梭菌相关性腹泻小鼠肠道菌群的调节作用研究[J]. 中国医刊, 2018, 53(1): 77-83. DOI:10.3969/j.issn.1008-1070.2018.01.022 |
| [22] |
ZHAO L P. The gut microbiota and obesity:from correlation to causality[J]. Nature Reviews Microbiology, 2013, 11(9): 639-647. DOI:10.1038/nrmicro3089 |
| [23] |
MUSSO G, GAMBINO R, CASSADER M. Obesity, diabetes, and gut microbiota:the hygiene hypothesis expanded?[J]. Diabetes Care, 2010, 33(10): 2277-2284. DOI:10.2337/dc10-0556 |
| [24] |
宋立锦.具核梭杆菌通过非定植途径引起母婴分离大鼠肠道菌群紊乱并加剧内脏高敏感[D].硕士学位论文.济南: 山东大学, 2018.
|
| [25] |
郭世奎, 包维民, 龚昆梅, 等. 实时荧光定量PCR法研究结直肠癌患者肠道拟杆菌属、梭杆菌属和梭菌属量的变化[J]. 中国微生态学杂志, 2010, 22(1): 24-28. |
| [26] |
HALLIDAY M J, GILES H E, JAGADISH P, et al. The efficacy of a cultured Synergistes jonesii inoculum to control hydroxypyridone toxicity in Bos indicus steers fed leucaena/grass diets[J]. Animal Production Science, 2018, 59(4): 696-708. |
| [27] |
陈鹏德, 林燕, 杨洁, 等. 过敏性紫癜患儿肠道菌群结构及多样性研究[J]. 中国妇幼健康研究, 2017, 28(7): 747-752, 757. DOI:10.3969/j.issn.1673-5293.2017.07.001 |
| [28] |
GUNGOR B, ADIGUZEL E, GURSEL I, et al. Intestinal microbiota in patients with spinal cord injury[J]. PLoS One, 2016, 11(1): e0145878. DOI:10.1371/journal.pone.0145878 |
| [29] |
FOWSANTEAR W, ARGO E, PATTINSON C, et al. Comparative proteomics of Helicobacter species:the discrimination of gastric and enterohepatic Helicobacter species[J]. Journal of Proteomics, 2014, 97: 245-255. DOI:10.1016/j.jprot.2013.07.016 |
| [30] |
ABIDI M Z, WILHELM M P, NEFF J L, et al. Helicobacter canis bacteremia in a patient with fever of unknown origin[J]. Journal of Clinical Microbiology, 2013, 51(3): 1046-1048. DOI:10.1128/JCM.02548-12 |




