2. 中国农业大学食品科学与营养工程学院, 北京 100083
2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China
独特的反刍动物瘤胃发酵系统可以消化单胃动物不能或不易消化的饲粮,如纤维素、半纤维素等。然而,动物仍以氨和甲烷(CH4)的形式释放未消化完全的碳、氮营养素,从而导致营养物质的浪费,造成环境污染。因此,调控反刍动物的甲烷排放是减轻环境污染的一种有效措施。反刍动物肠道发酵产生的甲烷是组成温室气体的主要部分,约占农业活动产生的甲烷总排放量的1/4[1]。Hess等[2]研究认为,皂苷作为植物次生代谢产物可以提高瘤胃发酵效率。牛俊丽等[3]通过体外试验证明,全混合日粮中添加25和125 g/kg丝兰皂苷可以促进瘤胃发酵。尽管皂苷改变瘤胃发酵模式的机制尚未完全阐明,但大多数研究者认为这归因于皂苷的去原虫作用。原虫数量减少,对细菌的吞噬作用被抑制,产甲烷所需的氢源减少,甲烷的产量降低[4]。但也有研究报道,原虫数量减少会导致瘤胃pH下降并降低纤维素分解菌的活性,从而抑制纤维素的降解[5-6]。因此,皂苷对瘤胃发酵具有双重作用。酵母培养物(yeast cultures,YC)可有效促进厌氧菌和纤维素分解菌的生长,并能够增加乳酸菌的活力[7]。这些细菌活力的增加可以增强纤维素的降解,提高碳和氮的利用率,使微生物蛋白含量增加,甲烷产量降低[8]。Ding等[9]研究发现,啤酒酵母对干物质(DM)和中性洗涤纤维(NDF)的消化以及瘤胃发酵的稳定性具有积极作用。假设利用酵母培养物对营养物质纤维素的积极作用,可能会降低苜蓿皂苷(alfalfa saponin,AS)对纤维素的不良影响。因此,本试验旨在研究苜蓿皂苷和酵母培养物的共同作用对瘤胃的发酵特性、甲烷产量以及营养物质降解率的影响,旨在寻找并开发优良的瘤胃调控剂,为反刍动物生产提供理论依据。
1 材料与方法 1.1 试验材料苜蓿皂苷植物提取物购于西安康尔美生物技术有限公司,纯度为60%。酵母培养物购于北京英惠尔生物技术有限公司。
1.2 试验设计试验采用完全随机设计,采用3×3水平试验设计,分为9组,在发酵底物中分别添加不同水平(0、22、44 mg/g DM)的苜蓿皂苷和不同水平(0、44、88 mg/g DM)的酵母培养物。
1.3 试验动物及饲粮选取3只平均体重为(67.0±1.3) kg、安装永久性瘤胃瘘管的36月龄健康杜寒杂交羯羊为瘤胃液采集的试验动物。试验饲粮(发酵底物)以羊草和玉米为主要原料,精粗比为60 : 40,其组成及营养水平见表 1。试验羊每日饲喂2次(08:00、18:00),单槽饲养,自由饮水,试验在中国农业科学院南口中试基地进行。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the experimental diet (DM basis) |
体外发酵装置采用中国农业大学研制的“AGRS-Ⅲ”型64通路体外发酵产气自动记录装置和软件系统实时测定累积产气[10]。
试验所用的缓冲液,按照Menke等[11]的方法配制而成,配制后持续通入二氧化碳(CO2)30 min以上,直至溶液pH达到6.8,然后置于39 ℃恒温水浴锅中备用。于晨饲前1 h内进行瘤胃液采集,将采集到的瘤胃液经4层纱布过滤,装入已预热的并充满CO2的保温瓶中,迅速带回实验室处理。
称取800 mg发酵底物置于150 mL厌氧发酵瓶中,每个瓶中分别加入不同水平的苜蓿皂苷和酵母培养物,每个组5个平行。接种时迅速向每个瓶中加入预热的缓冲液60 mL、已过滤的瘤胃液15 mL以及瓶中持续通入CO2 5 s后盖上瓶塞,立即将每个发酵瓶与产气自动记录装置各气路通道相连,于39 ℃下连续培养48 h,试验重复3次。
1.5 样品收集与处理于发酵24 h收集气体,用于测定甲烷产量。发酵48 h后取出样品置于冰水中,停止发酵,记录产气量、产气速率。将培养管中的发酵液排出至已知质量的塑料离心管50 mL,立即测定并记录发酵液的pH。取1 mL发酵液加入0.3 mL 25%(质量体积比)的偏磷酸混匀,然后离心10 min(15 000×g),取上清液用于氨态氮(NH3-N)和挥发性脂肪酸(VFA)含量的测定。并将瓶中内容物全部转入经烘干称重后的尼龙袋(孔径48 μm)中过滤,收集滤液,用蒸馏水将尼龙袋连同内容物漂洗至水清后,在65 ℃下烘干不少于48 h直至恒重,用于测定干物质降解率(DMD)、中性洗涤纤维降解率(NDFD)和酸性洗涤纤维降解率(ADFD)。
1.6 测定指标及计算方法总产气量由数据分析仪采集记录。甲烷产量测定:用1 mL注射器抽取发酵气体,使用GC522气象色谱仪检测甲烷产量。色谱条件:配备火焰离子化检测器(FID),TDX-1填充不锈钢柱(柱长2.0 mm,外径3.0 mm,内径2.0 mm),测定时柱温80 ℃,检测器温度200 ℃,进样器温度120 ℃,载气流量5.3 Mpa。NH3-N含量利用靛酚比色法[12]测定。参照Cao等[13]描述的方法利用气相色谱仪测定VFA含量。饲粮中的DM、粗蛋白质(CP)、粗脂肪(EE)、钙、磷含量测定参照《饲料分析检测技术》进行分析[14],中性洗涤纤维和酸性洗涤纤维(ADF)含量根据Van Soest等[15]描述的方法测定。
1.7 计算公式根据各发酵瓶的产气时间和对应的累积产气量,参照指数函数模型对不同饲粮累积产气量数据进行非线性拟合[16],得出:
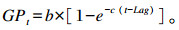
|
式中:GPt为时间t(h)的累积产气量(mL/g DM);b为渐进产气量(mL/g DM);c为产气速率(mL/h);t为产气时间(h);Lag为体外发酵产气延滞时间(h)。
根据下式计算达到最大产气量1/2时的产气速率:
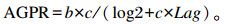
|
式中:AGPR为达到最大产气量1/2时的产气速率(mL/h);b为渐进产气量(mL/g DM);c为产气速率(mL/h);Lag为体外发酵产气延滞时间(h)。
1.8 统计分析总产气量、甲烷产量、瘤胃发酵参数分析和营养物质降解率的数据采用SAS 19.0的PROC MIX模型:
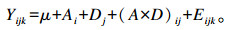
|
式中:Yijk是第i个苜蓿皂苷水平和第j个酵母培养物水平下的第k个发酵瓶的观测值;μ是总体平均值;Ai是不同苜蓿皂苷处理的固定效应(i=0、22、44);Dj是不同酵母培养物处理的固定效应(j=0、44、88);(A×D)ij是苜蓿皂苷水平和酵母培养物水平的交互效应;Eijk为随机残差值。
当处理效应P < 0.05时,进行数值间的多重比较,比较方式为LSD法。同时利用线性(linear)及二次(quadratic)的多项式分析来研究显著变化的原因。
2 结果 2.1 苜蓿皂苷和酵母培养物对体外发酵产气参数和甲烷产量的影响由表 2可知,苜蓿皂苷和酵母培养物的互作效应对累计产气量、产气动力学参数以及甲烷产量均影响显著(P < 0.05)。累计产气量、渐进产气量、产气速率和最大产气量1/2时的产气速率均随苜蓿皂苷添加水平的增加线性升高(P < 0.05),而产气速率和最大产气量1/2时的产气速率均随酵母培养物添加水平的增加线性升高(P < 0.05)。甲烷产量随苜蓿皂苷和酵母培养物添加水平的增加均呈现二次降低的变化趋势(P < 0.05)。
|
|
表 2 苜蓿皂苷和酵母培养物对体外发酵产气参数和甲烷产量的影响 Table 2 Effects of AS and YC on gas production parameters and methane production in vitro fermentation |
由表 3可知,苜蓿皂苷和酵母培养物的互作效应对瘤胃发酵液pH、NH3-N含量、总挥发性脂肪酸(TVFA)含量、VFA比例以及乙丙比均影响显著(P < 0.05)。瘤胃液pH及丙酸、丁酸含量均随苜蓿皂苷添加水平的增加线性降低(P < 0.05)。pH随酵母培养物添加水平的增加呈现出线性和二次降低的变化趋势(P < 0.05),而TVFA含量随酵母培养物添加水平的增加线性升高(P < 0.05)。
|
|
表 3 苜蓿皂苷和酵母培养物对体外瘤胃发酵液参数的影响 Table 3 Effects of AS and YC on rumen fermentation fluid parameters in vitro |
由表 4可知,苜蓿皂苷和酵母培养物及二者的互作效应对体外营养物质降解率均无显著影响(P>0.05)。
|
|
表 4 苜蓿皂苷和酵母培养物对体外营养物质降解率的影响 Table 4 Effects of AS and YC on nutrient degradation rates in vitro |
体外发酵技术主要是通过检测瘤胃微生物和发酵底物在共培养系统中的总气体产量和产气速率来评估发酵效率。Pang等[17]研究报道,体外累计产气量间接反映了发酵底物的降解或发酵程度。Hu等[18]研究证明体外累计产气量随茶皂苷添加水平的增加而升高,这与本研究结果一致。本试验中,随着苜蓿皂苷添加水平的增加,累计产气量和产气动力学参数均线性升高,这表明苜蓿皂苷可使底物的降解和发酵程度增加。由于渐近产气量可用来预测采食量[19],本试验还发现,当苜蓿皂苷添加水平为44 mg/g DM时渐进产气量最大,因此可以推测适宜添加水平的苜蓿皂苷具有刺激动物摄食的作用。随着酵母培养物添加水平的增加,产气速率线性升高,表明底物的可降解性或发酵性增强。酵母培养物对总产气量和渐进产气量均没有影响,但苜蓿皂苷和酵母培养物的互作效应对总产气量和渐进产气量却影响显著,这不仅说明苜蓿皂苷促进了瘤胃发酵,而且在发酵底物等量的条件下,酵母培养物的添加没有提供额外的能被瘤胃微生物降解和利用的营养物质。因此,本研究结果说明,苜蓿皂苷和酵母培养物共同作用可以增强瘤胃的发酵能力,这或许是通过提高瘤胃微生物活性来实现的,且以44 mg/g DM苜蓿皂苷+88 mg/g DM酵母培养物的组合效果最优。
甲烷产量降低不但可以减轻温室效应,还可以提供经济效益和社会效益。Holtshausen等[20]研究认为,丝兰皂苷和皂树皂苷均可使体外发酵甲烷产量降低的原因在于瘤胃发酵和饲粮消化率降低。根据Hu等[21]的结果可知,皂苷对甲烷的抑制作用可能与产生甲烷的瘤胃微生物(包括产甲烷菌和原虫)直接相关。Hess等[22]提出,皂苷可造成瘤胃原虫数量和生成甲烷所需的氢气(H2)含量减少,从而降低甲烷的产生。酵母对甲烷的作用机制是酵母产品通过增加营养物质消化率并且调节H2的生成,从而影响微生物的生长[23]。在本研究中,当添加44 mg/g DM苜蓿皂苷和88 mg/g DM酵母培养物时甲烷产量最低,同时苜蓿皂苷和酵母培养物均使甲烷产量二次降低。由此可知,瘤胃中产生甲烷的微生物和原生动物的数量及活性可能降低,且甲烷的产量变化还与添加剂的水平有关。但仍需在未来的研究中进一步确定苜蓿皂苷和酵母培养物对瘤胃微生物区系变化的影响。
3.2 苜蓿皂苷和酵母培养物对瘤胃发酵液参数的影响pH及NH3-N、VFA含量是反映瘤胃发酵效率和瘤胃内环境稳态的3个重要指标。pH过低或过高对于瘤胃微生物的正常生长、发育、发酵均有不利影响,本试验结果显示,苜蓿皂苷和酵母培养物均可降低瘤胃液pH,这是由于发酵底物中的碳水化合物快速降解产生的有机酸不断累积造成的。但总体来讲,本试验中的瘤胃液pH在6.6~6.9,是维持瘤胃发酵的正常水平,对瘤胃内环境没有影响。
NH3-N是反映瘤胃蛋白质代谢的一个重要指标,是瘤胃氮代谢过程中外源蛋白质和内源含氮物质降解的重要产物[4]。有研究报道,茶皂苷可降低瘤胃NH3-N浓度[18],也有研究报道丝兰提取物不能显著降低瘤胃NH3-N的浓度[24],有关酵母培养物对NH3-N浓度影响的报道也各有差异[25-26]。在本研究中,苜蓿皂苷和酵母培养物对NH3-N浓度没有出现线性或二次影响,这可能与皂苷的类型、添加剂量等有关,但具体原因有待进一步研究。
饲粮在瘤胃微生物的作用下产生大量的乙酸、丙酸及丁酸等VFA,它是反刍动物的主要能量来源,可为机体提供70%~80%的能量[27]。Dolezal等[28]在荷斯坦奶牛饲粮中添加酵母培养物(5 g/d)发现,试验组VFA含量显著高于对照组。本试验中,酵母培养物可线性增加VFA的含量,说明酵母培养物可以增加产VFA微生物(如瘤胃中的纤维素分解细菌)的数量或代谢能力[29],促使微生物发酵产生更多VFA,这有利于为动物生产提供更多能量。牛俊丽等[3]研究发现,在体外添加丝兰皂苷提高了瘤胃内乙酸和丙酸的含量。本研究结果显示,苜蓿皂苷的加入则提高了瘤胃液中丙酸和丁酸的含量,这也与Patra[30]的研究结果相一致。闫佰鹏等[31]研究发现,在育肥羊饲粮中添加酵母培养物对瘤胃内的其他有机酸含量无显著影响。与之类似,本试验条件下酵母培养物对有机酸(乙酸、丙酸、丁酸、戊酸)含量均没有显著影响,这归因于添加剂的来源、类型和浓度等。
总之,基于苜蓿皂苷和酵母培养物的互作效应对瘤胃发酵液参数的影响更加显著,并且当苜蓿皂苷添加剂水平为44 mg/g DM和酵母培养物添加水平为88 mg/g DM时,TVFA的含量最大,可以得出酵母培养物的补充可以缓解由苜蓿皂苷对瘤胃原虫所造成的伤害,并且瘤胃内微生物的活性可能增强。
3.3 苜蓿皂苷和酵母培养物对体外营养物质降解率的影响DMD反映了饲粮的消化情况,而NDFD和ADFD主要反映的是饲粮中纤维的可利用程度,影响饲粮纤维降解的因素有很多,主要包括瘤胃pH、饲粮类型、饲喂方式等[32]。Zhou等[33]研究报道,添加茶皂苷对山羊瘤胃中的DMD、NDFD和ADFD均无显著影响;而Patra[30]研究报道,皂苷可以降低饲粮纤维降解率。此外,大量研究表明,反刍动物补充酵母培养物的主要作用是在一定程度上改善瘤胃发酵和纤维素的可降解性[34-35]。本研究结果显示,苜蓿皂苷和酵母培养物均未对饲粮的体外营养物质降解率产生显著影响。因此,正如本研究中假设所言,苜蓿皂苷和酵母培养物的共同作用可使甲烷产量显著降低,而不影响饲粮的营养物质降解率。
4 结论① 在体外条件下,就底物的降解和发酵程度而言,苜蓿皂苷的效果更优于酵母培养物。
② 本试验条件下,44 mg/g DM苜蓿皂苷和88 mg/g DM酵母培养物组合添加,可以显著抑制瘤胃中甲烷的生成,并使TVFA含量以及产气量显著增加,提高瘤胃的发酵效率。
致谢:
感谢中国农业大学动物科技学院杨红建教授对试验设计给予的帮助和指导,感谢中国农业大学动物科技学院王雅春教授和张帅博士对试验统计分析所提出的宝贵意见。
| [1] |
THORPE A. Enteric fermentation and ruminant eructation:the role (and control?) of methane in the climate change debate[J]. Climatic Change, 2009, 93(3/4): 407-431. |
| [2] |
HESS H D, MONSALVE L M, LASCANO C E, et al. Supplementation of a tropical grass diet with forage legumes and Sapindus saponaria fruits:effects on in vitro ruminal nitrogen turnover and methanogenesis[J]. Crop and Pasture Science, 2003, 54(7): 703-713. DOI:10.1071/AR02241 |
| [3] |
牛俊丽, 王加启, 马露, 等. 体外法研究丝兰皂苷对瘤胃发酵参数的影响[J]. 家畜生态学报, 2016, 37(2): 34-39. |
| [4] |
周文章, 朱智, 左福元. 皂苷调控反刍动物瘤胃发酵和甲烷产量的研究进展[J]. 黑龙江畜牧兽医, 2017(2): 66-69. |
| [5] |
GUO Y Q, LIU J X, LU Y, et al. Effect of tea saponin on methanogenesis, microbial community structure and expression of mcrA gene, in cultures of rumen micro-organisms[J]. Letters in Applied Microbiology, 2008, 47(5): 421-426. DOI:10.1111/j.1472-765X.2008.02459.x |
| [6] |
PATRA A K, SAXENA J. The effect and mode of action of saponins on the microbial populations and fermentation in the rumen and ruminant production[J]. Nutrition Research Reviews, 2009, 22(2): 204-219. DOI:10.1017/S0954422409990163 |
| [7] |
孙满吉, 刘彩娟, 张永根, 等. 直接饲喂酵母培养物对奶牛瘤胃发酵的影响[J]. 动物营养学报, 2010, 22(5): 1390-1395. DOI:10.3969/j.issn.1006-267x.2010.05.039 |
| [8] |
GUEDES C M, GONCALVES D, RODRIGUES M A M, et al. Effects of a Saccharomyces cerevisiae yeast on ruminal fermentation and fibre degradation of maize silages in cows[J]. Animal Feed Science and Technology, 2008, 145(1/2/3/4): 27-40. |
| [9] |
DING G Z, CHANG Y, ZHAO L P, et al. Effect of Saccharomyces cerevisiae on alfalfa nutrient degradation characteristics and rumen microbial populations of steers fed diets with different concentrate-to-forage ratios[J]. Journal of Animal Science and Biotechnology, 2014, 5(1): 24. DOI:10.1186/2049-1891-5-24 |
| [10] |
杨红建, 宋正河, 祝仕平, 等.一种发酵微量气体产生量数据自动采集存储装置及方法: 中国, ZL200610011301.X[P].2007-12-19.
|
| [11] |
MENKE K H, RAAB L, SALEWSKI A, et al. The estimation of the digestibility and metabolizable energy contents of ruminant feedstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science, 1979, 93(1): 217-222. DOI:10.1017/S0021859600086305 |
| [12] |
王加启. 反刍动物营养学研究方法[M]. 北京: 现代教育出版社, 2011.
|
| [13] |
CAO Y C, YANG H J. Ruminal digestibility and fermentation characteristics in vitro of fenugreek and alfalfa hay combination with or without the inoculation of Neocallimastix sp. YAK11[J]. Animal Feed Science and Technology, 2011, 169(1/2): 53-60. |
| [14] |
李克广, 郭全奎. 饲料分析检测技术[M]. 北京: 中国农业大学出版社, 2015.
|
| [15] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [16] |
FRANCE J, DIJKSTRA J, DHANOA M S, et al. Estimating the extent of degradation of ruminant feeds from a description of their gas production profiles observed in vitro:derivation of models and other mathematical considerations[J]. British Journal of Nutrition, 2000, 83(2): 143-150. DOI:10.1017/S0007114500000180 |
| [17] |
PANG D G, YANG H J, CAO B B, et al. The beneficial effect of Enterococcus faecium on the in vitro ruminal fermentation rate and extent of three typical total mixed rations in northern China[J]. Livestock Science, 2014, 167: 154-160. DOI:10.1016/j.livsci.2014.06.008 |
| [18] |
HU W L, LIU J X, YE J A, et al. Effect of tea saponin on rumen fermentation in vitro[J]. Animal Feed Science and Technology, 2005, 120(3/4): 333-339. |
| [19] |
ELGHANDOUR M M Y, KHOLIF A E, SALEM A Z M, et al. Sustainable anaerobic rumen methane and carbon dioxide productions from prickly pear cactus flour by organic acid salts addition[J]. Journal of Cleaner Production, 2016, 139: 1362-1369. DOI:10.1016/j.jclepro.2016.08.075 |
| [20] |
HOLTSHAUSEN L, CHAVES A V, BEAUCHEMIN K A, et al. Feeding saponin-containing Yucca schidigera and Quillaja saponaria to decrease enteric methane production in dairy cows1[J]. Journal of Dairy Science, 2009, 92(6): 2809-2821. DOI:10.3168/jds.2008-1843 |
| [21] |
HU W L, WU Y M, LIU J X, et al. Tea saponins affect in vitro fermentation and methanogenesis in faunated and defaunated rumen fluid[J]. Journal of Zhejiang University Science B, 2005, 6(8): 787-792. |
| [22] |
HESS H D, BEURET R A, LÖTSCHER M, et al. Ruminal fermentation, methanogenesis and nitrogen utilization of sheep receiving tropical grass hay-concentrate diets offered with Sapindus saponaria fruits and Cratylia argentea foliage[J]. Animal Science, 2004, 79(1): 177-189. DOI:10.1017/S1357729800054643 |
| [23] |
NEWBOLD C J, RODE L M. Dietary additives to control methanogenesis in the rumen[J]. International Congress Series, 2006, 1293: 138-147. DOI:10.1016/j.ics.2006.03.047 |
| [24] |
BENCHAAR C, MCALLISTER T A, CHOUINARD P Y. Digestion, ruminal fermentation, ciliate protozoal populations, and milk production from dairy cows fed cinnamaldehyde, quebracho condensed tannin, or Yucca schidigera saponin extracts[J]. Journal of Dairy Science, 2008, 91(12): 4765-4777. DOI:10.3168/jds.2008-1338 |
| [25] |
ARAKAKI L C, STAHRINGER R C, GARRETT J E, et al. The effects of feeding monensin and yeast culture, alone or in combination, on the concentration and generic composition of rumen protozoa in steers fed on low-quality pasture supplemented with increasing levels of concentrate[J]. Animal Feed Science and Technology, 2000, 84(1/2): 121-127. |
| [26] |
ERASMUS L J, ROBINSON P H, AHMADI A, et al. Influence of prepartum and postpartum supplementation of a yeast culture and monensin, or both, on ruminal fermentation and performance of multiparous dairy cows[J]. Animal Feed Science and Technology, 2005, 122(3/4): 219-239. |
| [27] |
胡伟莲.皂甙对瘤胃发酵与甲烷产量及动物生产性能影响的研究[D].博士学位论文.杭州: 浙江大学, 2005. http: //cdmd.cnki.com.cn/Article/CDMD-10335-2005095419.htm
|
| [28] |
DOLEZAL P, DOLEZAL J, SZWEDZIAK K, et al. Use of yeast culture in the TMR of dairy Holstein cows[J]. Iranian Journal of Applied Animal Science, 2012, 2(1): 51-56. |
| [29] |
SNIFFEN C J, CHAUCHEYRAS-DURAND F, DE ONDARZA M B, et al.Predicting the impact of a live yeast strain on rumen kinetics and ration formulation[C]//Proceedings of the 19th southwest nutrition and management conference.Tempe, AZ: [s.n.], 2004: 53-59. http: //www.dairyweb.ca/Resources/USWebDocs/Yeast.pdf
|
| [30] |
PATRA A K. Enteric methane mitigation technologies for ruminant livestock:a synthesis of current research and future directions[J]. Environmental Monitoring and Assessment, 2012, 184(4): 1929-1952. DOI:10.1007/s10661-011-2090-y |
| [31] |
闫佰鹏, 兰贵生, 李国彰, 等. 不同淀粉来源饲粮中添加酵母培养物对育肥湖羊生长性能、养分消化率及瘤胃发酵参数的影响[J]. 动物营养学报, 2018, 30(12): 5145-5152. DOI:10.3969/j.issn.1006-267x.2018.12.043 |
| [32] |
刘培剑, 曹玉芳, 朱风华, 等. 不同厌氧碱化处理对鲜麦秸营养成分、超微结构和体外发酵参数的影响[J]. 动物营养学报, 2018, 30(8): 3229-3238. DOI:10.3969/j.issn.1006-267x.2018.08.042 |
| [33] |
ZHOU C S, XIAO W J, TAN Z L, et al. Effects of dietary supplementation of tea saponins (Ilex kudingcha C.J. Tseng) on ruminal fermentation, digestibility and plasma antioxidant parameters in goats[J]. Animal Feed Science and Technology, 2012, 176(1/2/3/4): 163-169. |
| [34] |
朴光赫, 甄玉国, 张学峰, 等. 米曲霉和酵母培养物对绵羊瘤胃发酵的影响[J]. 中国兽医学报, 2018, 38(6): 1207-1213. |
| [35] |
WELTY C M, WENNER B A, WAGNER B K, et al. Rumen microbial responses to supplemental nitrate.Ⅱ.Potential interactions with live yeast culture on the prokaryotic community and methanogenesis in continuous culture[J]. Journal of Dairy Science, 2019, 102(3): 2217-2231. DOI:10.3168/jds.2018-15826 |




