2. 腾冲市畜牧工作站, 腾冲 679100;
3. 槟榔江水牛良种繁育有限公司, 腾冲 679118;
4. 云南农业大学动物医学院, 昆明 650201
2. Tengchong Animal Husbandry Workstation, Tengchong 679100, China;
3. Binglangjiang River Buffalo Breeding Company, Tengchong 679118, China;
4. College of Veterinary Medicine, Yunnan Agricultural University, Kunming 650201, China
水牛被联合国粮农组织(FAO)认为是有重要开发潜力的家畜[1]。奶水牛的生产特性决定其适合在南方发展[2]。槟榔江水牛中心产地位于云南省腾冲县槟榔江、陇川江和大盈江等流域,民间称之为嘎啦牛(嘎啦在景颇语中意指黑色)。该水牛能适应亚热带气候,以前多为役用,现正向奶用培育[3]。2008年,槟榔江水牛被纳入中国畜禽遗传资源目录。截止2016年底,腾冲市槟榔江水牛存栏3 715头,组建核心群1个,存栏623头[4]。犊牛培育是奶水牛养殖业的关键环节,也是提高牛群质量和生产水平的基础。在1~6月龄内,犊牛的生理功能会发生巨大的变化,各组织器官也会不断地发育完善,因此该时期的营养水平直接影响到犊牛的生长性能和瘤胃发育。反刍动物瘤胃内生成的挥发性脂肪酸(VFA)是反刍动物的能量来源[5],其含量及组成比例是反映瘤胃消化代谢的重要指标。VFA经瘤胃上皮代谢,能促进瘤胃的发育,是瘤胃组织形态发育和吸收能力提高的化学刺激因素[6]。有学者对成年泌乳槟榔江水牛血清中的酶活性、三碘甲状腺原氨酸(T3)、甲状腺素(T4)等血清激素水平及牛奶成分做过测定及报道[7-10],但未见关于槟榔江犊牛瘤胃发酵和血液指标研究报道。因此,本试验研究不同培育方式对槟榔江水牛犊牛瘤胃发酵、血浆生化指标以及血清激素的影响,为槟榔江水牛犊牛饲养管理提供试验依据。
1 材料与方法 1.1 试验设计与饲养管理选取健康状况良好的新生槟榔江犊牛42头[体重为(32.67±5.28) kg],按其出生顺序依次随机分成3个组(Ⅰ、Ⅱ、Ⅲ组),每组14头犊牛,公母各占1/2。1~5日龄饲喂初乳,6~90日龄Ⅰ、Ⅱ组分别饲喂母乳3.5和4.5 kg/(天·头),Ⅲ组饲喂代乳粉0.8 kg/(天·头)(按1 : 5加水稀释)。代乳粉由全脂奶粉(昆明龙腾生物乳业有限公司)和中国宝宝代奶粉(广州市嘉仁高新科技有限公司)按1 : 1混合而成。6日龄开始诱食犊牛料[限饲2 kg/(天·头)],15日龄开始补充玉米青贮料,90日龄断奶,试验期间自由饮水和采食玉米青贮料,犊牛料组成及营养水平见表 1,全脂奶粉、代乳粉及玉米青贮料营养水平见表 2。采用单栏饲养方式,饲喂时间每天09:30、16:30,试验期180 d。
|
|
表 1 犊牛料组成及营养水平(绝干基础) Table 1 Composition and nutrient levels of the starter (dry basis) |
|
|
表 2 全脂奶粉、代乳粉及玉米青贮料营养水平(绝干基础) Table 2 Nutrient levels of whole milk powder, milk replacer and maize silage (dry basis) |
试验期间每天08:00记录犊牛料和玉米青贮料投喂量,次日08:00记录剩料量,统计实际采食量,计算犊牛料和玉米青贮料ADMI。
1.2.2 饲粮营养水平每2周采集1次玉米青贮料2 kg,置于65 ℃恒温干燥箱中烘干,粉碎制成分析样本,测定营养水平。采用索氏提取法测定粗脂肪(EE)含量(GB/T 6433—2006);凯氏定氮法测定粗蛋白质(CP)含量(GB/T 6432—2006);烘箱干燥法测定水分含量(GB/T 6435—2014);粗灰分(Ash)含量测定参照GB/T 6438—2007;钙(Ca)含量测定参照GB/T 6436—2002;磷(P)含量测定参照GB/T 6437—2002);参照Van Soest纤维分析方案,进行中性洗涤纤维(NDF)含量测定(GB/T 20806— 2006)、酸性洗涤纤维(ADF)含量测定(NY/T 1459—2007)和酸性洗涤木质素(ADL)含量测定(GB/T 20805—2006)。
1.2.3 瘤胃发酵指标在犊牛45、90和180日龄,晨饲后2 h,采用胃管式瘤胃液采样器抽取足量瘤胃液,4层纱布过滤,立即测定瘤胃液pH,剩余瘤胃液分装于10 mL离心管中,立即放在-20 ℃冰箱冷冻保存,用于测定VFA和氨态氮(NH3-N)含量。
采用气相色谱仪(Agilent 7890,美国)内标法测定VFA含量,测定方法参照李影球[11]并做改进。Agilent 7890气相色谱仪工作条件:色谱柱为HP INNOWAX 30 m×0.25 mm×0.25 μm,载气为氮气(N2);尾吹流量40 mL/min,氢气(H2)流量40 mL/min,空气流量400 mL/min;进样口温度220 ℃,分流比40 : 1,进样量1 μL,压力设为165 kpa,隔垫吹扫流量3 mL/min;FID检测器工作温度280 ℃。升温程序:120 ℃保持3 min,以10 ℃/min升至180 ℃并保持1 min,合计10 min。
NH3-N含量采用苯酚-次氯酸比色法测定[12-13],NH3-N含量标准工作曲线回归方程:
y=0.099 3x+0.047 2 (R2=0.997)。
1.2.4 血浆生化指标在犊牛5、45、90和180日龄,晨饲前,用一次性装有肝素钠的负压采血管颈静脉采血10 mL,常温下1 790×g离心15 min分离血浆用于测定血浆生化指标;另用无抗凝剂的采血管颈静脉采血10 mL,静置放置凝固后将其1 790×g离心15 min分离血清,分装于Eppendorf管,-20 ℃冻存,用于测定血清激素水平。采用双缩脲法测定血浆总蛋白(TP)含量,溴甲酚绿法测定血浆白蛋白(ALB)含量,计算法测定血浆球蛋白(GLOB)含量,速率法测定血浆碱性磷酸酶(ALP)活性,己糖激酶法测定血浆葡萄糖(GLU)含量, 酶法测定血浆甘油三酯(TG)含量,胆固醇氧化酶法测定血浆总胆固醇(TC)含量和脲酶紫外速率法测定血浆尿素氮(UN)含量;采用电化学发光法测定血清T3、T4和胰岛素(INS)含量。
1.3 数据统计及分析试验数据用“平均值±标准差”表示,采用SPSS 17.0统计软件做单因素方差分析(one-way ANOVA)和Duncan氏法多重比较,P < 0.05判为差异显著。
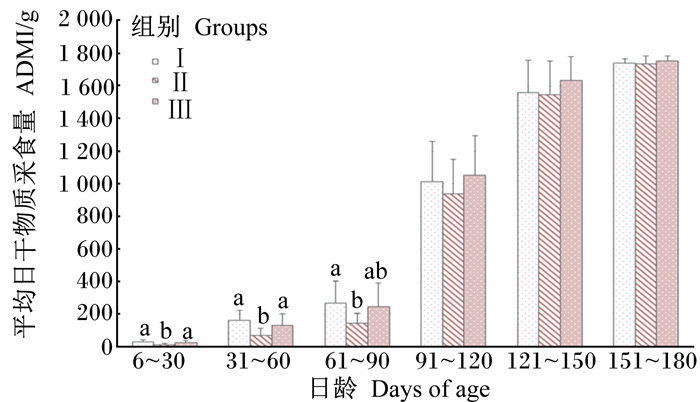
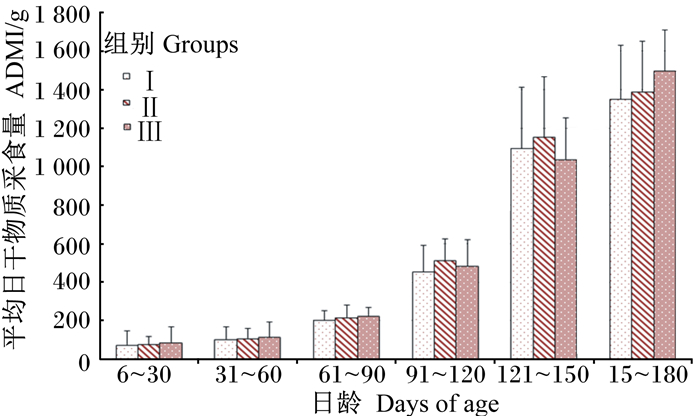
2 结果 2.1 不同培育方式对槟榔江水牛犊牛ADMI的影响由图 1和图 2可知,在60日龄前,犊牛料ADMI Ⅰ、Ⅲ组显著高于Ⅱ组(P < 0.05),在61~90日龄,Ⅰ组显著高于Ⅱ组(P < 0.05),但与Ⅲ组差异不显著(P>0.05),在91~180日龄,各组间均无显著差异(P>0.05);玉米青贮料ADMI整个试验期各组间均无显著差异(P>0.05)。
|
数据柱形图标注无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05)。下图同。 Values columns with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P < 0.05). The same as below. 图 1 不同培育方式的槟榔江水牛犊牛料ADMI的比较 Fig. 1 Comparison of average daily dry matter intake of starters of Binglangjiang buffalo calves with different rearing methods |
|
图 2 不同培育方式的槟榔江水牛犊牛玉米青贮料ADMI的比较 Fig. 2 Comparison of average daily dry matter intake of maize silage of Binglangjiang buffalo calves with different rearing methods |
由表 3可知,瘤胃液pH和NH3-N含量各组间无显著影响(P>0.05)。在90日龄,瘤胃液VFA含量Ⅰ、Ⅲ组显著高于Ⅱ组(P < 0.05),Ⅰ、Ⅲ组间差异不显著(P>0.05)。在90日龄,乙酸含量Ⅱ组显著高于Ⅰ组(P < 0.05),而丙酸含量Ⅰ组显著高于Ⅱ组(P < 0.05),其余2个组间均差异不显著(P>0.05)。在45和180日龄,瘤胃液TVFA、乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸含量及乙酸/丙酸各组间均无显著差异(P>0.05)。
|
|
表 3 不同培育方式对槟榔江水牛犊牛瘤胃发酵的影响 Table 3 Effects of different rearing methods on rumen fermentation of Binglangjiang buffalo calves |
由表 4可知,在90日龄,血浆白蛋白含量Ⅰ、Ⅱ组显著高于Ⅲ组(P < 0.05),但Ⅰ、Ⅱ组间差异不显著(P>0.05);在5、45和180日龄,各组间差异均不显著(P>0.05);在5和180日龄,血浆甘油三酯含量各组间差异均不显著(P>0.05);在45龄,Ⅰ、Ⅱ组显著高于Ⅲ组(P < 0.05),在90日龄,Ⅱ组显著高于Ⅲ组(P < 0.05),但Ⅰ、Ⅱ组间差异不显著(P>0.05);在5、45和180日龄,血浆总胆固醇含量各组间差异均不显著(P>0.05);在90日龄,Ⅱ组显著高于Ⅲ组(P < 0.05),但Ⅰ、Ⅱ组间差异不显著(P>0.05);在5、45、90和180日龄,血浆总蛋白、球蛋白、葡萄糖和尿素氮含量,白球比及碱性磷酸酶活性各组间均无显著差异(P>0.05)。
|
|
表 4 不同培育方式对槟榔江水牛犊牛血浆生化指标的影响 Table 4 Effects of different rearing methods on plasma biochemical parameters of Binglangjiang buffalo calves |
由表 5可知,在5和180日龄,血清T3含量各组间均无显著差异(P>0.05);在45和90日龄,Ⅱ组显著高于Ⅲ组(P < 0.05),但Ⅰ、Ⅱ组间差异不显著(P>0.05);在5、45、90和180日龄,血清T4含量各组间均无显著差异(P>0.05)。在5、45和180日龄,血清INS含量各组间均无显著差异(P>0.05);在90日龄,Ⅱ组显著高于Ⅲ组(P < 0.05),其他2组间差异不显著(P>0.05)。
|
|
表 5 不同培育方式对槟榔江水牛犊牛血清激素水平的影响 Table 5 Effects of different rearing methods on serum hormone levels of Binglangjiang buffalo calves |
90日龄前,犊牛料ADMI Ⅰ、Ⅲ组显著高于Ⅱ组,而玉米青贮料3组间差异不显著,表明低奶量和代乳粉能够提高犊牛料ADMI,但不影响玉米青贮ADMI。仁瑞清等[14]研究发现,在传统饲喂模式下,犊牛固体饲料ADMI显著高于现代饲喂模式,也表明饲养模式会影响采食量。
3.2 不同培育方式对槟榔江水牛犊牛瘤胃发酵的影响 3.2.1 瘤胃液NH3-N含量NH3-N是瘤胃主要的代谢物,可作为瘤胃功能发育的标志。NH3-N含量反映蛋白质降解与合成之间所达到的平衡状况[15]。瘤胃微生物生长需要有适宜的NH3-N含量,其最佳含量为6.30~27.50 mg/dL[16]。本试验不同培育方式槟榔江犊牛瘤胃液NH3-N含量在9.19~13.33 mg/dL之间,属正常含量范围。另外,在犊牛开食料中补充适宜的中性洗涤纤维会具有适宜的NH3-N含量,利于提高瘤胃代谢活动,促进动物生长性能[17],本试验犊牛料中也含有8.32%的中性洗涤纤维。陈宁[18]研究发现,NH3-N含量一般在饲喂后2~3 h达到峰值,而本试验对犊牛饲喂后2 h测定,提示此时瘤胃液NH3-N含量可能为槟榔江犊牛峰值。
3.2.2 瘤胃液pHpH是反映瘤胃发酵水平的综合指标。适宜的pH是瘤胃正常发酵的前提,反刍动物能够通过瘤胃稳态的自身调节,使pH变化维持在6~7之间。适宜的瘤胃液pH对幼龄反刍动物瘤胃发育、微生物发酵和机体健康具有重要意义[19-21]。本试验不同培育方式瘤胃液pH为6.68~7.08,除180日龄Ⅲ组pH高于7,其余均低于7。
3.2.3 瘤胃液VFA含量碳水化合物在反刍动物瘤胃中被微生物降解,产生的VFA,提供机体可消化能的70%~80%[22]。乙酸、丙酸和丁酸约占瘤胃发酵TVFA的95%,在机体代谢中最为重要。本试验发现在90日龄,TVFA含量Ⅰ、Ⅲ组显著高于Ⅱ组,Ⅰ组丙酸含量显著高于Ⅱ组,表明母乳饲喂量高会降低瘤胃液TVFA和丙酸的含量。马俊南等[23]研究发现,适量增加固体饲料饲喂比例利于改善断奶前后犊牛瘤胃发酵环境,采用高固体饲料饲喂模式对实施提前断奶具有一定优势。本试验在90日龄前,Ⅰ、Ⅲ组犊牛料ADMI显著高于Ⅱ组,与该研究结果一致。其他研究发现,2周龄犊牛瘤胃中可检测到VFA[24],8周龄VFA含量就可达到成年动物水平[25],本试验中,45日龄TVFA含量显著低于90和180日龄,尚未达到成年水平,可能是水牛生长发育缓慢所致,具体原因有待进一步研究。
反刍动物瘤胃对丁酸吸收最快,丙酸次之,乙酸最慢,且瘤胃内乙酸摩尔浓度通常最高[26],但本试验槟榔江犊牛在90日龄时丙酸含量最高。另外,乙酸/丙酸影响瘤胃液的pH和瘤胃内饲料的转化率,进而影响动物的生产性能,乙酸/丙酸过高或过低对瘤胃发酵、饲料消化及生产性能发挥都不利[27]。乙酸/丙酸变化范围为1.05~5.15,最适范围是2.0~3.6[28],而本试验测得值是0.88~1.29,其中90日龄有2个组低于1.05,其原因可能是犊牛在大量采食犊牛料之后2 h采集瘤胃液有关,因为饲喂精料可增加瘤胃液丙酸含量[29]。
3.3 不同培育方式对槟榔江水牛犊牛血浆生化指标的影响血液中各种生化成分是动物体生命活动的物质基础,其含量及变化规律是动物机体重要的生物学特征[30]。白蛋白有增加血容量和维持血浆胶体渗透压的作用,组织蛋白和血浆蛋白可互相转化,免疫球蛋白含量在一定程度上能反映犊牛的免疫力[31]。本试验在犊牛90日龄时,饲喂母乳的试验组(Ⅰ、Ⅱ组)血浆白蛋白含量显著高于饲喂代乳粉组(Ⅲ组),表明饲喂母乳犊牛免疫力可能高于饲喂代乳粉的犊牛。血浆总蛋白是机体蛋白质合成代谢的一个重要指标,其含量高低可反映蛋白质的代谢情况,血浆总蛋白含量升高,表明动物的新陈代谢加强,利于动物生长[32-33]。本试验发现不同培育方式不影响血浆总蛋白含量。血液葡萄糖含量对犊牛各组织器官的生理功能极其重要,是各组织细胞活动的主要能量来源[34],其含量变化反映机体所处的生理状态,并在一定程度上和生长速度呈正相关[35]。血浆葡萄糖含量不宜超过6.1 mmol/L[36],本试验血浆葡萄糖含量为4.70~5.97 mmol/L,但未见不同培育方式对犊牛血浆葡萄糖含量有影响。血浆尿素氮含量可较准确地反映体内蛋白质的代谢状况和饲粮氨基酸的平衡情况[37-38],本试验未发现不同培育方式对血浆尿素氮含量有影响。
脂肪组织发育和脂肪沉积取决于血清甘油三酯含量[39],一般情况下会成为脂肪酸的贮藏库,根据身体所需被分解。甘油三酯是脂肪酸代谢的产物,是反映脂肪消化吸收状态的直接指标[35, 40]。本试验饲喂母乳组(Ⅰ、Ⅱ组)血浆甘油三酯含量显著高于饲喂代乳粉组(Ⅲ组),表明母乳乳脂含量高于代乳粉,这与张永云等[10]报道槟榔江水牛奶乳蛋白、乳脂和乳糖含量显著高于荷斯坦牛奶的结果一致。
3.4 不同培育方式对槟榔江水牛犊牛血清激素水平的影响T4由甲状腺合成、储藏和释放,合成T4的原料是体内的碘和酪氨酸,而血清中几乎全部的T3均由T4内环脱碘转变而成。T3和T4具有基本相同的生理活动,但T3的作用比T4要强。T3和T4在动物机体物质能量代谢、生长发育过程中起着重要的作用,一方面可促进小肠黏膜对糖的吸收,增强肝糖原分解,抑制糖原合成,同时可促进脂肪和蛋白质的分解;另一方面,可加强外周组织对糖的利用,促进蛋白质和胆固醇的合成,降低血糖[41]。研究表明,不同饲养方式对牛血清生长素(GH)、T3、T4含量等有显著影响,散栏饲养方式显著提高血清GH、T3、T4的含量,并对其增重有显著影响[42],本试验不同培育方式在45和90日龄,饲喂母乳组(Ⅰ、Ⅱ组)血清T3含量高于饲喂代乳粉组(Ⅲ组),证实这个观点。
INS的主要作用是促进全身组织对葡萄糖的利用,抑制糖原分解和糖异生,从而使血糖含量降低,同时促进脂肪和蛋白质的合成。有研究表明,INS可增强肝细胞脂肪合成,从而增加肝脏脂肪沉积,而胰高血糖素的作用与其相反,可降低肝脏脂肪沉积[43]。本试验犊牛在90日龄,血清INS含量Ⅱ组>Ⅰ组>Ⅲ组,且断奶前Ⅰ组和Ⅱ组INS含量均高于Ⅲ组。
4 结论① 不同培育方式仅对90日龄犊牛瘤胃液TVFA、乙酸和丙酸含量有影响,且高母乳饲喂量会降低TVFA和丙酸的产量,但提高乙酸的产量。
② 不同培育方式仅对45日龄犊牛血浆甘油三酯和血清T3含量及90日龄血浆白蛋白、甘油三酯、总胆固醇含量及血清T3、INS含量有影响,且饲喂母乳组的含量均高于代乳粉组。
| [1] |
杨炳壮. 全球水牛业发展现状与我国奶水牛业的发展趋势[J]. 广西农学报, 2011, 26(1): 40-48. DOI:10.3969/j.issn.1003-4374.2011.01.013 |
| [2] |
毛华明, 李永强, 王鹏武. 云南奶水牛业发展概况[J]. 中国奶牛, 2012(13): 58-61. DOI:10.3969/j.issn.1004-4264.2012.13.015 |
| [3] |
霍金龙. 我国唯一的河流型奶水牛——槟榔江水牛的开发利用思考[J]. 中国牛业科学, 2010, 36(5): 59-61. DOI:10.3969/j.issn.1001-9111.2010.05.017 |
| [4] |
余选富, 王友文, 邵思远, 等. 槟榔江水牛生产性能测定及其种质评价[J]. 中国奶牛, 2018(3): 27-31. |
| [5] |
AGARWAL N, SHEKHAR C, KUMAR R, et al. Effect of peppermint (Mentha piperita) oil on in vitro methanogenesis and fermentation of feed with buffalo rumen liquor[J]. Animal Feed Science and Technology, 2009, 148(2/3/4): 321-327. |
| [6] |
张海涛, 王加启, 卜登攀, 等. 影响犊牛瘤胃发育的因素研究[J]. 乳业科学与技术, 2008, 31(2): 86-89. DOI:10.3969/j.issn.1671-5187.2008.02.013 |
| [7] |
彭洁, 贺珠婷, 李卫真, 等. 槟榔江水牛、摩拉水牛和荷斯坦奶牛血清中酶活性的测定[J]. 黑龙江畜牧兽医, 2016(5): 212-214. |
| [8] |
刘超英, 贺珠婷, 张永云, 等. 槟榔江水牛、摩拉水牛和荷斯坦奶牛血清中3种激素含量的测定[J]. 安徽农业科学, 2016, 44(2): 76-78. DOI:10.3969/j.issn.0517-6611.2016.02.027 |
| [9] |
刘超英, 贺珠婷, 张永云, 等. 槟榔江水牛、摩拉水牛和荷斯坦奶牛血清中T3、T4含量测定[J]. 上海畜牧兽医通讯, 2016(1): 44-45. DOI:10.3969/j.issn.1000-7725.2016.01.016 |
| [10] |
张永云, 张颖, 王绍卿, 等. 槟榔江水牛、摩拉水牛和荷斯坦牛乳成分比较分析[J]. 中国奶牛, 2012(7): 24-26. DOI:10.3969/j.issn.1004-4264.2012.07.010 |
| [11] |
李影球.犊牛代乳料中用大豆蛋白替代部分乳蛋白的试验研究[D].硕士学位论文.南宁: 广西大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10593-2005088784.htm
|
| [12] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [13] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(6/7): 37. |
| [14] |
仁瑞清, 曹玉凤, 高艳霞, 等. 不同饲喂模式对断奶前犊牛消化代谢及生长性能的影响[J]. 中国奶牛, 2012(13): 29-33. DOI:10.3969/j.issn.1004-4264.2012.13.006 |
| [15] |
栗明月, 方洛云, 苏汉书, 等. 竹叶提取物对奶牛瘤胃体外发酵参数及产气量的影响[J]. 动物营养学报, 2019, 31(04): 1816-1822. |
| [16] |
MURPHY J J, KENNELLY J J. Effect of protein concentration and protein source on the degradability of dry matter and protein in situ[J]. Journal of Dairy Science, 1987, 70(9): 1841-1849. DOI:10.3168/jds.S0022-0302(87)80223-0 |
| [17] |
任春燕, 毕研亮, 杜汉昌, 等. 开食料中不同NDF水平对犊牛生长性能、瘤胃内环境及血清生化指标的影响[J]. 草业学报, 2018, 27(5): 210-218. |
| [18] |
陈宁.日粮精粗比对断奶初期犊牛瘤胃内环境及粗饲料降解的影响[D].硕士学位论文.重庆: 西南大学, 2006. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y937557
|
| [19] |
BEIRAN V AND H, GHORBANI G R, KHORVASH M, et al. Interactions of alfalfa hay and sodium propionate on dairy calf performance and rumen development[J]. Journal of Dairy Science, 2014, 97(4): 2270-2280. DOI:10.3168/jds.2012-6332 |
| [20] |
CALSAMIGLIA S, CARDOZO P W, FERRET A, et al. Changes in rumen microbial fermentation are due to a combined effect of type of diet and pH[J]. Journal of Animal Science, 2008, 86(3): 702-711. DOI:10.2527/jas.2007-0146 |
| [21] |
LAARMAN A H, OBA M. Short communication:effect of calf starter on rumen pH of Holstein dairy calves at weaning[J]. Journal of Dairy Science, 2011, 94(11): 5661-5664. DOI:10.3168/jds.2011-4273 |
| [22] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [23] |
马俊南, 刁其玉, 齐志国, 等. 不同固液比例饲喂模式对断奶前后犊牛营养物质代谢及瘤胃发酵的影响[J]. 动物营养学报, 2017, 29(6): 1930-1939. DOI:10.3969/j.issn.1006-267x.2017.06.014 |
| [24] |
BEHARKA A A, NAGARAJA T G, MORRILL J L, et al. Effects of form of the diet on anatomical, microbial, and fermentative development of the rumen of neonatal calves[J]. Journal of Dairy Science, 1998, 81(7): 1946-1955. DOI:10.3168/jds.S0022-0302(98)75768-6 |
| [25] |
NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington, D.C.: National Academies Press, 2001.
|
| [26] |
卢德勋. 发展反刍动物绿色营养技术[J]. 动物营养学报, 1999, 11(增刊): 1-16. |
| [27] |
GADO H M, SALEM A Z M, ROBINSON P H, et al. Influence of exogenous enzymes on nutrient digestibility, extent of ruminal fermentation as well as milk production and composition in dairy cows[J]. Animal Feed Science & Technology, 2009, 154(1/2): 36-46. |
| [28] |
孙国强, 吕永艳, 刘建雷. 脂肪酸钙对瘤胃发酵及羧甲基纤维素酶活性的影响[J]. 中国饲料, 2010(24): 31-33. DOI:10.3969/j.issn.1004-3314.2010.24.008 |
| [29] |
SUTTON J D, MORANT S V, BINES J A, et al. Effect of altering the starch:fibre ratio in the concentrates on hay intake and milk production by Friesian cows[J]. The Journal of Agricultural Science, 1993, 120(3): 379-390. DOI:10.1017/S0021859600076541 |
| [30] |
汪张贵.日粮核黄素添加水平对新扬州仔鸡免疫机能和血液生化指标的影响[D].硕士学位论文.扬州: 扬州大学, 2005.
|
| [31] |
VICARI T, VAN DEN BORNE J J G C, GERRITS W J J, et al. Postprandial blood hormone and metabolite concentrations influenced by feeding frequency and feeding level in veal calves[J]. Domestic Animal Endocrinology, 2008, 34(1): 74-88. DOI:10.1016/j.domaniend.2006.11.002 |
| [32] |
吕小康, 王杰, 王世琴, 等. 饲粮添加木薯渣对羔羊生长性能、血清指标及瘤胃发酵指标的影响[J]. 动物营养学报, 2017, 29(10): 3666-3675. DOI:10.3969/j.issn.1006-267X.2017.10.029 |
| [33] |
王彦华, 王成章, 高永革, 等. 苜蓿皂苷对断奶仔猪生产性能、消化率及血液生化指标的影响[J]. 草业学报, 2009, 18(5): 115-122. DOI:10.3321/j.issn:1004-5759.2009.05.017 |
| [34] |
周怿, 刁其玉, 屠焰, 等. 酵母β-葡聚糖对早期断奶犊牛生产性能和血液生理生化指标的影响[J]. 中国畜牧杂志, 2010, 46(13): 47-51. |
| [35] |
叶纪梅.不同处理大豆粉在犊牛代乳粉中的应用研究[D].硕士学位论文.扬州: 扬州大学, 2006: 18-21. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y927802
|
| [36] |
岳喜新, 刁其玉, 马春晖, 等. 饲喂代乳粉对羔羊生长性能和血清生化指标的影响[J]. 饲料工业, 2011, 32(1): 20-30. |
| [37] |
STANLEY C C, WILLIAMS C C, JENNY B F, et al. Effects of feeding milk replacer once versus twice daily on glucose metabolism in Holstein and Jersey calves[J]. Journal of Dairy Science, 2002, 85(9): 2335-2343. DOI:10.3168/jds.S0022-0302(02)74313-0 |
| [38] |
汪水平, 王文娟, 左福元, 等. 中药复方对夏季肉牛的影响:Ⅱ.血气指标、血清代谢产物浓度及免疫和抗氧化功能参数[J]. 畜牧兽医学报, 2011, 42(5): 734-741. |
| [39] |
VTTURRO E, 胡菡. 泌乳奶牛甘油三酯合成过程中潜在基因的诱导表达[J]. 中国畜牧兽医, 2009, 36(8): 180. |
| [40] |
张祥.不同乳铁蛋白含量的代乳粉对犊牛生长发育的影响[D].硕士学位论文.扬州: 扬州大学, 2007: 22.
|
| [41] |
张兴隆.育成期营养对皖南牛生长发育、血液激素、消化规律和育肥效果影响的研究[D].博士学位论文.北京: 中国农业大学, 2015.
|
| [42] |
居来提·阿不都外力, 张浩, 任万平, 等. 不同饲养方式条件对青年新疆褐牛体重与血清激素水平的影响[J]. 新疆农业科学, 2014, 51(12): 2321-2327. |
| [43] |
GRUMMER R R. Etiology of lipid-related metabolic disorders in periparturient dairy cows[J]. Journal of Dairy Science, 1993, 76(12): 3882-3896. DOI:10.3168/jds.S0022-0302(93)77729-2 |




