2. 中国动物疫病预防控制中心, 北京 100125
2. China Animal Disease Control Center, Beijing 100125, China
在畜牧养殖生产过程中,反刍动物瘤胃发酵生成的甲烷(CH4)和部分氨态氮(NH3-N)会以间接或直接的方式排出体外,不仅导致反刍动物饲料能量的严重浪费,同时也对生态环境造成严重影响[1]。因此,我们研究降低瘤胃CH4的生成对提高反刍动物生产效率和环境保护具有双重意义。而植物精油以其高效、绿色、无残留的特点作为畜禽饲料添加剂逐渐引起人们的关注。最早发现的大部分植物精油具有广谱的抗菌性和良好的抑菌效果[2-3],在反刍动物生产中,其主要通过影响瘤胃微生物的活性,从而影响瘤胃发酵[4]。有研究发现,植物精油可以改变挥发性脂肪酸(VFA)含量及比例并影响瘤胃发酵模式,促进氨基酸的累积,降低NH3-N含量,同时抑制CH4产生[5-7],进而影响饲粮营养物质的消化率和动物生长性能[8-9]。
目前,对于植物精油的大部分研究集中在其对反刍动物瘤胃发酵和CH4产量的影响,而对营养物质消化影响的研究较少。在实际应用中,如果植物精油的添加不显著影响VFA的含量,同时还可以降低CH4产量和氮的排放,那么可以认为是对生产比较有利的,而如果植物精油的添加在抑制CH4生成的同时造成了营养物质消化率的显著下降,那么总体上认为其对动物的生产并不是有利的[10]。因此,对于植物精油的添加,我们需要研究其降低CH4以及影响营养物质消化率的平衡点。已有研究发现,香芹酚、丁子香酚、茴香油均可在一定程度降低体外瘤胃CH4的产生[11-12],且丁子香酚对体外瘤胃发酵无显著影响[13]。本课题组前期的研究也发现,香芹酚和茴香油的添加可有效降低体外24 h CH4产量,而丁子香酚和桉叶油的添加对体外瘤胃发酵无显著影响[14-15]。由此,我们在前期研究的基础上,选择丁子香酚、香芹酚、桉叶油和茴香油这4种植物精油,在研究其添加对瘤胃发酵和CH4产量影响的基础上,同时还研究其对发酵底物干物质(DM)降解率的影响,并探讨它们之间的关系,为植物精油在动物生产上的应用提供更多的理论支持。
1 材料与方法 1.1 供试植物精油选择4种植物精油开展本试验,分别是丁子香酚(纯度99%)、香芹酚(纯度99%)、茴香油(纯度89%)、桉叶油(纯度80%),以上4种植物精油均购自中国南京文森宝国际贸易有限公司。
1.2 试验设计体外培养试验底物参考《肉羊饲养标准》(NY/T 816—2004)推荐的营养水平,以玉米、豆粕和羊草等作为原料,粉碎过0.5 mm筛后按一定比例进行混合配制,其底物组成及营养水平见表 1,底物精粗比为6 : 4。采用4×5的双因子试验设计,其中,因子1为不同种类的植物精油(丁子香酚、香芹酚、桉叶油和茴香油),因子2为植物精油的不同浓度(0、50、100、200和400 mg/L)。每种植物精油的每个浓度设3个重复。另设空白对照组(用于校正产气量值),不加底物,只添加发酵液进行体外培养,设3个重复。进行2批试验,其中一批试验在体外发酵培养24 h终止发酵,记录不同时间点的产气量,测定体外瘤胃发酵参数、底物DM降解率及体外瘤胃发酵CH4含量;另一批试验体外发酵培养至96 h终止发酵,记录不同时间点的产气量,并计算各项产气参数。
|
|
表 1 体外发酵底物组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the substrate in vitro fermentation (DM basis) |
瘤胃体外产气试验采用Menke等[17]的体外产气法,选用4只体重为(67.0±1.2) kg、健康且装有永久瘤胃瘘管的杜×寒F1代杂交成年羊作为瘤胃液供体羊,其饲粮组成同体外试验的底物组成。瘤胃液与缓冲液以1 : 2的比例依据Menke等[17]混合配制人工瘤胃发酵液缓冲液。称取200 mg(DM基础)底物至100 mL培养管(注射器)的顶部,从培养管的前端注入0.5 mL植物精油混合物(植物精油与乙醇不同浓度梯度的混合物),然后加入30 mL人工瘤胃发酵液。按照试验设计,使得加入发酵液后不同种类植物精油浓度分别达到0、50、100、200和400 mg/L。另外,空白对照组的培养管中不加底物,直接加入30 mL人工瘤胃发酵液。一批培养管放置在39 ℃的恒温水浴培养箱中发酵培养24 h终止培养,另一批培养管发酵培养至96 h终止培养。
1.4 测定指标与方法 1.4.1 底物营养成分含量底物营养成分含量的测定设3个平行,控制平行样品测定结果的变异系数在5%以内。用100减去550 ℃马弗炉燃烧5 h后的粗灰分含量即为有机物含量;采用105 ℃烘箱烘干5 h测定DM含量;根据AOAC(1995)[18]方法测定酸性洗涤纤维(ADF)含量,采用Van Soest等[19]方法测定中性洗涤纤维(NDF)含量;采用凯氏定氮法[19]测定粗蛋白质(CP,N×6.25)含量;钙和磷含量的测定分别采用高锰酸钾滴定法和钼黄比色法[20]。
1.4.2 产气量一批试验体外培养24 h,分别读取0、1、2、4、6、8、10、12、16、20和24 h的培养管刻度值,计算不同时间点的体外产气量和24 h的累积净产气量。
另一批试验体外培养96 h,分别读取0、1、2、4、6、8、10、12、16、20、24、48、54、60、66、72、78、84、90和96 h培养管刻度值,计算不同时间点的体外产气量和96 h的累积净产气量,并绘制产气曲线。
参照指数模型对不同底物96 h累积产气量进行非线性拟合。
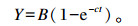
|
式中:Y为t时间点的累积产气量(mL);B为理论最大产气量(mL);c为产气速度(h-1);t为培养时间(h)。
1.4.3 24 h体外瘤胃发酵CH4含量和产量在体外培养24 h后,将培养管取出,迅速放入冰水中终止发酵。用5 mL一次性注射器抽取发酵管中的气体,立即用TP-2060T气相色谱仪(北京分析仪器厂)测定气体中的CH4含量,色谱条件:TCD检测器,TDX-01填充柱,1 mm×3 mm×2 mm,进样口温度150 ℃,柱温120 ℃,检测器温度150 ℃,载气为氦气(He),流速50 mL/min,进样量0.1 mL。并根据CH4含量和产气量计算CH4产量。
1.4.4 体外瘤胃发酵参数将采集气体后培养管中的发酵液离心(800×g,15 min),取1 mL上清液加入预先加入200 μL 25%偏磷酸冷冻保存的1.5 mL离心管中,采用气相色谱法[21]测定VFA含量。
1.4.5 24 h体外瘤胃发酵DM降解率体外培养24 h终止发酵后,将培养管(注射器)中的残渣转移至50 mL离心管中离心,取沉淀用蒸馏水悬浮,再离心,重复2次后将残渣在105 ℃烘干24 h,称重并计算样品DM降解率。
1.5 数据统计与分析试验数据采用SAS 9.4的混合模型(MIX)进行统计分析,按双因子试验设计进行方差分析和多重比较,包括因子1不同种类的植物精油、因子2植物精油的不同浓度以及植物精油种类与浓度的互作(种类×浓度)。另外,不同浓度植物精油对各项测定指标的影响采用线性(L)和二次曲线(Q)比较。显著性水平定为P < 0.05,变化趋势范围定在0.05≤P≤0.10。
2 结果与分析 2.1 植物精油对体外瘤胃发酵24 h发酵液VFA含量的影响植物精油对体外瘤胃发酵24 h发酵液VFA含量的影响见表 2。植物精油种类及其浓度均显著影响体外瘤胃发酵液总VFA含量(P < 0.05),且二者的互作对总VFA含量也有显著影响(P < 0.05)。随浓度的增加,香芹酚的体外瘤胃发酵液总VFA含量呈显著二次曲线下降(P < 0.05)。在200 mg/L浓度下,香芹酚的体外瘤胃发酵液总VFA含量显著低于桉叶油和茴香油(P < 0.05);在400 mg/L浓度下,香芹酚的体外瘤胃发酵液总VFA含量显著低于其他3种植物精油(P < 0.05)。
|
|
表 2 不同植物精油对体外瘤胃发酵24 h发酵液VFA含量的影响 Table 2 Effects of different essential oils on ruminal VFA content in vitro rumen fermentation for 24 h |
植物精油及其浓度对体外瘤胃发酵液乙酸含量均无显著影响(P>0.05),但均显著影响体外瘤胃发酵液丙酸含量(P < 0.05),且二者的互作对乙酸和丙酸含量均有显著影响(P < 0.05)。随浓度的增加,丁子香酚和茴香油的体外瘤胃发酵液丙酸含量呈显著线性下降(P < 0.05)。在100 mg/L浓度下,丁子香酚和桉叶油的体外瘤胃发酵液丙酸含量显著高于香芹酚和茴香油(P < 0.05);在200 mg/L浓度下,4种植物精油间丙酸含量有显著差异(P < 0.05),其中由高到低依次是:桉叶油、丁子香酚、茴香油和香芹酚;在400 mg/L浓度下,桉叶油、丁子香酚和香芹酚的体外瘤胃发酵液丙酸含量均显著高于茴香油(P < 0.05)。
植物精油及其浓度均显著影响体外瘤胃发酵液乙丙比(P < 0.05),且二者互作对乙丙比也有显著影响(P < 0.05)。随浓度的增加,香芹酚和茴香油的体外瘤胃发酵液乙丙比呈显著二次曲线变化(P < 0.05)。在100 mg/L浓度下,香芹酚和茴香油的体外瘤胃发酵液乙丙比显著高于丁子香酚和桉叶油(P < 0.05);在200 mg/L浓度下,香芹酚的体外瘤胃发酵液乙丙比显著高于其他3种植物精油(P < 0.05);在400 mg/L浓度下,茴香油的体外瘤胃发酵液乙丙比显著高于其他3种植物精油(P < 0.05)。
2.2 植物精油对体外瘤胃发酵24 h产气量和CH4产量的影响不同植物精油对体外瘤胃发酵24 h产气量和CH4产量的影响见表 3。植物精油及其浓度均显著影响体外瘤胃发酵24 h产气量、24 h CH4含量及CH4产量(P < 0.05),且二者的互作对上述指标均有显著影响(P < 0.05)。随浓度的增加,香芹酚的体外瘤胃发酵24 h产气量、24 h CH4含量及CH4产量均呈显著二次曲线下降(P < 0.05)。在200、400 mg/L浓度下,香芹酚的体外瘤胃发酵24 h产气量显著低于其他3种植物精油(P < 0.05);在50、100 mg/L浓度下,丁子香酚的体外瘤胃发酵24 h CH4含量显著低于桉叶油(P < 0.05),桉叶油显著低于茴香油(P < 0.05);在400 mg/L浓度下,香芹酚的体外瘤胃发酵24 h CH4含量及产量均显著低于其他3种植物精油(P < 0.05)。
|
|
表 3 不同植物精油对体外瘤胃发酵24 h产气量和CH4产量的影响 Table 3 Effects of different plant essential oils on gas production and methane production in vitro rumen fermentation for 24 h |
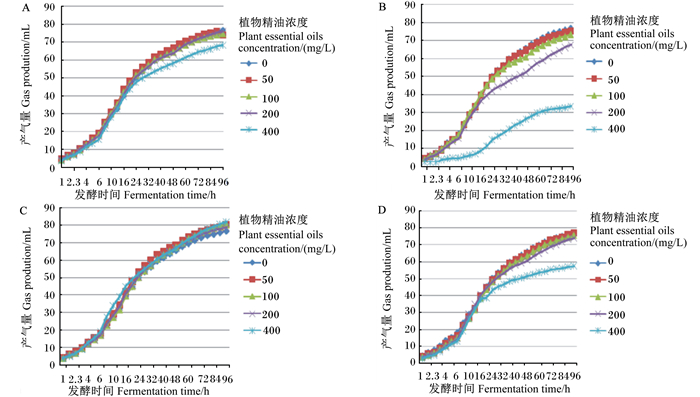
不同植物精油随浓度变化对体外瘤胃发酵96 h产气量的影响见图 1。50、100和200 mg/L丁子香酚、香芹酚和茴香油对体外瘤胃发酵产气趋势无明显影响,但添加高浓度茴香油和丁子香酚在体外培养16或24 h后产气曲线下降,高浓度的香芹酚从发酵一开始产气曲线就明显下降;而不同浓度的桉叶油的96 h产气曲线均无明显变化。
|
A:丁子香酚eugenol;B香芹酚carvacrol;C:桉叶油eucalyptus; D:茴香油anise oil。 图 1 不同植物精油的96 h体外瘤胃发酵动态产气量变化图 Fig. 1 Dynamic gas production of different plant essential oils in vitro rumen fermentation for 96 h |
不同植物精油对体外瘤胃发酵96 h的产气量和产气参数的影响见表 4。植物精油及其浓度均显著影响体外瘤胃发酵96 h产气量和理论最大产气量(P < 0.05),且二者的互作对以上指标均有显著影响(P < 0.05)。随浓度的增加,丁子香酚的体外瘤胃发酵96 h产气量和理论最大产气量均呈显著线性下降(P < 0.05),而香芹酚和茴香油的体外瘤胃发酵96 h产气量和理论最大产气量均呈显著二次曲线下降(P < 0.05)。在50 mg/mL浓度下,丁子香酚和香芹酚的体外瘤胃发酵96 h理论最大产气量显著低于桉叶油(P < 0.05);100 mg/mL浓度下,3种植物精油的体外瘤胃发酵96 h理论最大产气量均显著低于桉叶油(P < 0.05);在200、400 mg/mL浓度下,4种植物精油间96 h理论最大产气量差异显著(P < 0.05),由高到低依次是:桉叶油、丁子香酚、茴香油、香芹酚。
|
|
表 4 不同植物精油对体外瘤胃发酵96 h产气参数的影响 Table 4 Effects of different plant essential oils on gas production parameters in vitro rumen fermentation for 96 h |
植物精油显著影响体外瘤胃发酵96 h产气速率(P < 0.05),而其浓度对体外瘤胃发酵96 h产气速率影响不显著(P>0.05),但二者互作对其有显著影响(P < 0.05)。随浓度的增加,香芹酚和茴香油的体外发酵产气速率呈显著二次曲线变化(P < 0.05)。其中,在100 mg/mL浓度下,丁子香酚的体外瘤胃发酵产气速率显著高于茴香油和桉叶油(P < 0.05);在400 mg/mL浓度下,4种植物精油间体外瘤胃发酵产气速率差异显著(P < 0.05),由高到低依次是:茴香油、丁子香酚、桉叶油、香芹酚。
2.4 植物精油对体外瘤胃发酵24 h底物DM降解率的影响不同植物精油对体外瘤胃发酵24 h底物DM降解率的影响见表 5。植物精油及其浓度均显著影响体外瘤胃发酵24 h底物DM降解率(P < 0.05),且二者的互作对其也有显著影响(P < 0.05)。随浓度的增加,丁子香酚、香芹酚和茴香油的体外瘤胃发酵24 h底物DM降解率均呈显著二次曲线下降(P < 0.05)。在100 mg/mL浓度下,香芹酚和桉叶油的体外瘤胃发酵24 h底物DM降解率显著低于丁子香酚(P < 0.05);在200 mg/mL浓度下,香芹酚的体外瘤胃发酵24 h底物DM降解率显著低于茴香油(P < 0.05),茴香油显著低于丁子香酚和桉叶油(P < 0.05);在400 mg/mL浓度下,香芹酚的体外瘤胃发酵24 h底物DM降解率显著低于其他3种植物精油(P < 0.05)。
|
|
表 5 不同植物精油对体外瘤胃发酵24 h底物DM降解率的影响 Table 5 Effects of different plant essential oils on degradation rate of substrate DM in vitro rumen fermentation for 24 h |
本试验中,不同浓度的桉叶油和茴香油对体外瘤胃发酵总VFA含量均无显著影响,而200、400 mg/L香芹酚的总VFA含量分别降低了15.6%和61.7%。张然等[22]研究发现,在体外瘤胃发酵试验中添加0.015%牛至油对总VFA含量影响不显著,而添加0.030%、0.045%牛至油均可显著降低总VFA含量,表明植物精油影响瘤胃发酵存在着一定的浓度效应。且通过添加百里香酚、樟脑、5-萜烯等植物精油活性物质均在不同程度上对总VFA含量有一定的影响[7, 23]。此外,在本试验中,随着香芹酚浓度的增加,乙丙比呈先升高后降低的趋势;而中、高浓度茴香油显著增加了乙丙比,表明随植物精油浓度的变化,瘤胃发酵模式发生改变。有报道称,瘤胃微生物的细胞膜会因受到植物精油中一些有效基团的作用,使细胞膜失去稳定性,造成渗透压改变,导致瘤胃微生物生长受到抑制,从而也改变了瘤胃发酵模式[24]。所以推测植物精油的添加可能会导致瘤胃的发酵模式改变。林波等[25]研究发现,添加不同浓度的苍术精油显著增加总VFA含量,同时也显著增加乙酸、丙酸、丁酸的含量,而乙丙比随添加浓度的增加呈先升高后降低的趋势[26]。而添加无患子皂苷可增加丙酸含量,降低乙丙比,进而改变瘤胃发酵模式[27]。因此,植物精油的添加可以通过改变瘤胃发酵产生的VFA组成来进一步调控瘤胃的发酵模式,并且其受植物精油的种类和浓度的影响。
3.2 不同植物精油对体外瘤胃产气和CH4产量及DM降解率的影响 3.2.1 不同植物精油对体外瘤胃产气的影响体外发酵的产气量可以反映底物被瘤胃微生物利用的程度,是评价反刍动物瘤胃发酵的一个重要指标,与饲料碳水化合物的消化率[28]、饲料中可发酵成分和瘤胃微生物活性存在着密切的相关性[17]。在本试验中,低、中浓度香芹酚及各浓度的丁子香酚、桉叶油与茴香油对24 h产气量均无显著影响,而在200、400 mg/L浓度下,香芹酚的24 h产气量分别显著降低了13.7%和56.7%,这与本试验不同植物精油对体外发酵总VFA含量影响的结果相一致,表明体外产气量与其总VFA含量存在一定的相关性。另外,添加低浓度的各植物精油对96 h产气量、理论最大产气量均无显著影响,而添加中、高浓度的丁子香酚、香芹酚与茴香油可在一定程度上降低96 h产气量和理论最大产气量。这表明低浓度的植物精油对体外产气没有影响,但随浓度的增加,逐渐影响瘤胃发酵从而抑制产气。并且,通过添加不同植物精油在不同浓度下对96 h体外瘤胃发酵动态产气变化的研究发现,不同浓度的桉叶油对体外瘤胃发酵96 h产气量均没有影响,而添加中、高浓度的其他几种植物精油后,均降低96 h产气量,并且随发酵时间的延长,对产气的抑制效果更加明显。金恩望等[29]研究发现,1 000 mg/kg高浓度茶树油和丁香油的72 h产气量和理论最大产气量均分别降低了22.3%和15.8%、18.9%和9.0%。由此,不同植物精油种类和浓度影响体外瘤胃发酵产气量,且高浓度的植物精油会对瘤胃发酵产生抑制从而降低产气量。
3.2.2 不同植物精油对体外瘤胃CH4产量的影响据报道,在瘤胃内82%的CH4是通过甲烷短杆菌利用代谢氢还原二氧化碳生成,其次是瘤胃发酵产生乙酸与丁酸过程中释放出的氢气为甲烷菌的生长及CH4的生成提供了底物,进而导致瘤胃CH4产量增加[30]。本试验中,除200、400 mg/L香芹酚外,其余各组均对CH4含量和产量无显著影响,而400 mg/L香芹酚的CH4含量降低了30%。张然等[31]研究发现,在体外添加300、400 mg/L的牛至油可显著降低30%~40%的CH4产生,与本试验研究结果一致。此外,研究发现,添加大蒜油、丁子香酚和茴香油等不同植物精油可降低瘤胃微生物区系中甲烷菌与原虫的数量[12]。由此,植物精油对CH4产量的抑制主要是通过影响瘤胃微生物的代谢和抑制产甲烷菌的增殖来实现的[23]。本试验中,高浓度香芹酚的添加虽可有效降低CH4含量与产量,但同时也抑制了瘤胃底物的发酵,而低、中浓度的丁子香酚和低浓度的香芹酚、茴香油以及各浓度的桉叶油对体外瘤胃总VFA含量及产气参数均无显著影响,表明对瘤胃发酵没有抑制作用。
3.2.3 不同植物精油对体外瘤胃DM降解率的影响研究发现,添加5、50 mg/L的丁子香酚均未显著影响体外DM降解率[32],而添加500 mg/L的留兰香精油和肉桂油分别使体外DM降解率降低了10.8%和20.7%[33],本试验结中,添加低浓度的丁子香酚和香芹酚对24 h DM降解率没有显著影响,而添加400 mg/L各种植物精油均显著降低底物24 h DM降解率。这表明植物精油对DM降解率的影响与其种类和浓度有关。本试验中高浓度香芹酚对底物DM降解率影响最显著,而桉叶油的影响最小,这与瘤胃发酵和产气的结果相一致,高浓度的香芹酚显著影响瘤胃发酵和产气,而不同浓度桉叶油对瘤胃发酵和产气均无显著影响。据报道,高浓度植物精油与细胞膜相互作用,消散H+和K+的浓度梯度,进而使细胞质外泄,导致微生物细胞裂解[34-35],然后通过抑制瘤胃微生物的生长、繁殖,从而影响瘤胃对饲粮中营养成分的降解。Duval等[36]研究还发现,植物精油进入瘤胃后会影响瘤胃微生物对富含淀粉或蛋白质的饲粮附着和定植能力,从而影响饲粮中可溶组分的裂解,也可能导致瘤胃DM降解率的降低。
综上所述,植物精油对体外瘤胃发酵、CH4产量及底物DM降解的影响受其种类、浓度的影响,在生产中的应用需综合考虑。
4 结论在本试验条件下,不同浓度的桉叶油对体外瘤胃发酵没有显著影响,而添加丁子香酚、香芹酚和茴香油均不同程度影响体外瘤胃发酵。低浓度的丁子香酚和香芹酚对24 h体外瘤胃DM降解率没有显著影响,高浓度香芹酚可显著降低24 h体外瘤胃发酵产气量和CH4产量,并降低底物DM降解率。
| [1] |
周文章, 徐龙鑫, 符世雄, 等. 植物精油调控反刍动物瘤胃发酵的研究进展[J]. 贵州畜牧兽医, 2017, 41(4): 15-18. DOI:10.3969/j.issn.1007-1474.2017.04.005 |
| [2] |
ŠKRINJAR M M, NEMET N T. Antimicrobial effects of spices and herbs essential oils[J]. Acta Periodica Technologica, 2009(40): 195-209. DOI:10.2298/APT0940195S |
| [3] |
陈百万, 袁永红, 王礼柏, 等. 丁香精油抗奶牛乳腺炎病原微生物活性研究[J]. 绵阳师范学院学报, 2015, 34(2): 51-56. DOI:10.3969/j.issn.1672-612X.2015.02.011 |
| [4] |
PARASKEVAKIS N. Effects of dietary Greek oregano (Origanum vulgare ssp.hirtum) supplementation on rumen fermentation, enzyme profile and microbial communities in goats[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(3): 701-705. DOI:10.1111/jpn.12812 |
| [5] |
史浩亭, 王加启, 卜登攀, 等.香精油对瘤胃微生物氮代谢、挥发性脂肪酸生成影响的研究进展[C]//第四届中国奶业大会论文集.南昌: 中国奶业协会, 2013: 3.
|
| [6] |
WANG S P, KREUZER M, BRAUN U, et al. Effect of unconventional oilseeds (safflower, poppy, hemp, camelina) on in vitro ruminal methane production and fermentation[J]. Journal of the Science of Food and Agriculture, 2017, 97(11): 3864-3870. DOI:10.1002/jsfa.8260 |
| [7] |
JOCH M, MRÁZEK J, SKŘIVANOVÁ E, et al. Effects of pure plant secondary metabolites on methane production, rumen fermentation and rumen bacteria populations in vitro[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(4): 869-881. DOI:10.1111/jpn.12910 |
| [8] |
YANG W Z, AMETAJ B N, BENCHAAR C, et al. Cinnamaldehyde in feedlot cattle diets:intake, growth performance, carcass characteristics, and blood metabolites[J]. Journal of Animal Science, 2010, 88(3): 1082-1092. DOI:10.2527/jas.2008-1608 |
| [9] |
SILVA G G, TAKIYA C S, DEL VALLE T A, et al. Nutrient digestibility, ruminal fermentation, and milk yield in dairy cows fed a blend of essential oils and amylase[J]. Journal of Dairy Science, 2018, 101(11): 9815-9826. DOI:10.3168/jds.2018-14789 |
| [10] |
陶蕾, 赵凤舞, 周玉岩, 等. 植物精油对反刍动物瘤胃发酵影响的研究进展[J]. 中国草食动物科学, 2017, 37(2): 52-54. DOI:10.3969/j.issn.2095-3887.2017.02.017 |
| [11] |
林波.挥发油及其活性成分组合与富马酸钠共同添加对体外瘤胃发酵和湖羊养分消化的影响[D].博士学位论文.杭州: 浙江大学, 2011.
|
| [12] |
陆燕.植物精油对瘤胃甲烷产量生成和微生态的影响[D].硕士学位论文.南京: 南京农业大学, 2009.
|
| [13] |
田梅, 桂蕴, 齐艳梅, 等. 不同营养水平日粮添加丁香酚对奶牛消化性能、瘤胃发酵及奶品质的影响[J]. 中国饲料, 2019(6): 46-50. |
| [14] |
李艳玲, 贾淼, 鲁琳. 不同植物精油对体外瘤胃发酵及甲烷产量影响的比较研究[J]. 动物营养学报, 2017, 29(7): 2448-2459. DOI:10.3969/j.issn.1006-267x.2017.07.029 |
| [15] |
石宁, 贾淼, 李艳玲. 体外产气法研究植物精油对肉羊体外瘤胃发酵参数及甲烷产量的影响[J]. 动物营养学报, 2019, 31(1): 274-284. DOI:10.3969/j.issn.1006-267x.2019.01.034 |
| [16] |
National Research Council.Nutrient requirements of small ruminants[S]. Washington, D.C.: The National Academy Press, 2007.
|
| [17] |
MENKE K H, RAAB L, SALEWSKI A, et al. The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science, 1979, 93(1): 217-222. DOI:10.1017/S0021859600086305 |
| [18] |
AOAC.Official methods of analysis[S]. 16th ed.Arlington, VA: Association of Official Analytical Chemists, 1995.
|
| [19] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [20] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版.北京: 中国农业大学出版社, 2007: 140-147.
|
| [21] |
CAO Y C, YANG H J. Ruminal digestibility and fermentation characteristics in vitro of fenugreek and alfalfa hay combination with or without the inoculation of Neocallimastix sp. YAK11[J]. Animal Feed Science and Technology, 2011, 169(1/2): 53-60. |
| [22] |
张然, 郑琛, 闫晓刚, 等. 牛至油对绵羊瘤胃发酵特性及饲粮营养物质瘤胃降解率的影响[J]. 动物营养学报, 2018, 30(10): 4181-4189. DOI:10.3969/j.issn.1006-267x.2018.10.044 |
| [23] |
BODAS R, PRIETO N, GARCÍA-GONZÁLEZ R, et al. Manipulation of rumen fermentation and methane production with plant secondary metabolites[J]. Animal Feed Science and Technology, 2012, 176(1/2/3/4): 78-93. |
| [24] |
李典典, 丛玉艳. 植物添加剂对反刍动物甲烷气体产生调控作用的研究[J]. 当代畜牧, 2014(15): 30-32. |
| [25] |
林波, 陆燕. 植物提取物调控反刍动物瘤胃发酵的研究进展[J]. 饲料工业, 2009, 30(19): 27-31. DOI:10.3969/j.issn.1001-991X.2009.19.010 |
| [26] |
徐振松, 瞿明仁, 宋小珍, 等. 苍术精油对锦江黄牛瘤胃体外发酵及养分降解率的影响[J]. 动物营养学报, 2014, 26(8): 2373-2378. DOI:10.3969/j.issn.1006-267x.2014.08.044 |
| [27] |
王晓霞, 王侃, 吴晨晖, 等. 无患子皂甙对瘤胃发酵及甲烷产量的影响[J]. 中国畜牧杂志, 2012, 48(17): 55-58. DOI:10.3969/j.issn.0258-7033.2012.17.015 |
| [28] |
徐振松, 瞿明仁, 宋小珍, 等. 体外法研究不同水平苍术精油对肉牛瘤胃发酵和养分降解率的影响[J]. 中国饲料, 2013(15): 10-13. DOI:10.3969/j.issn.1004-3314.2013.15.004 |
| [29] |
金恩望, 王加启, 卜登攀, 等. 利用体外产气法研究植物精油对瘤胃体外发酵和甲烷生成的影响[J]. 中国农业大学学报, 2013, 18(3): 120-127. |
| [30] |
李春华, 高艳霞, 曹玉凤, 等. 影响反刍动物瘤胃甲烷产生的因素及调控措施[J]. 黑龙江畜牧兽医, 2010(15): 33-34. |
| [31] |
张然, 郑琛, 闫晓刚, 等. 体外产气法研究牛至油对绵羊瘤胃发酵特性和甲烷产量的影响[J]. 动物营养学报, 2018, 30(8): 3168-3175. DOI:10.3969/j.issn.1006-267x.2018.08.035 |
| [32] |
CASTILLEJOS L, CALSAMIGLIA S, FERRET A. Effect of essential oil active compounds on rumen microbial fermentation and nutrient flow in in vitro systems[J]. Journal of Dairy Science, 2006, 89(7): 2649-2658. DOI:10.3168/jds.S0022-0302(06)72341-4 |
| [33] |
金恩望, 卜登攀, 王加启, 等. 利用批次培养法研究植物精油对瘤胃体外发酵的影响[J]. 甘肃农业大学学报, 2014, 49(2): 5-12, 20. DOI:10.3969/j.issn.1003-4315.2014.02.002 |
| [34] |
BAJPAI V K, BAEK K H, KANG S C. Control of Salmonella in foods by using essential oils:a review[J]. Food Research International, 2012, 45(2): 722-734. DOI:10.1016/j.foodres.2011.04.052 |
| [35] |
DENYER S P, HUGO W B.Mechanisms of action of chemical biocides: their study and exploitation[M]. London: Blackwell Scientific, 1991.
|
| [36] |
DUVAL S M, MCEWAN N R, GRAHAM R C, et al. Effect of a blend of essential oil compounds on the colonization of starch-rich substrates by bacteria in the rumen[J]. Journal of Applied Microbiology, 2007, 103(6): 2132-2141. DOI:10.1111/j.1365-2672.2007.03455.x |




