2. 湖南农业大学动物医学院, 长沙 410128
2. College of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China
在现代集约化养殖中,畜禽由于易受到环境、饲粮等各种不良因素的影响,从而引发起机体的应激反应,造成机体代谢紊乱、生长发育受阻和抗病能力减弱,最终导致生长缓慢、发病、甚至死亡。畜禽养殖中广泛使用添加抗生素的方式来解决这些问题,但长期大规模的使用抗生素会严重影响人类的自身健康和环境安全。因此,开发寻求天然、生理活性强、无毒副作用和环境污染小的新型饲料添加剂产品已成为研究热点。
1 原儿茶酸(protocatechuic acid,PCA)原儿茶酸分子式为3, 4-二羟基苯甲酸,相对分子质量为154.12,是一种在植物界中分布广泛的天然酚酸[1],常见的水果如覆盆子、蓝莓、桑椹[1],传统的中草药如刺五加、五味子、杜仲[2-4],以及植物果实和叶子如松针、松塔等[5-6]均含量丰富。近期研究表明,原儿茶酸是花青素在体内的主要酚类代谢产物[7]。花青素具有抗炎、抗氧化等生理功能,应用于畜禽生产中具有促进生长性能、提高畜禽免疫力的特点[8],但其进入体内可被快速代谢生成一系列次级代谢产物,而原儿茶酸被认为是花青素在体内发挥生理功能的主要活性代谢产物之一[9]。原儿茶酸因具有抗氧化、抗炎、抑菌等生理功能已被应用于医药、保健等领域[10]。本文就原儿茶酸的国内外研究现状,总结其生理功能及潜在作用机理,探讨其在畜禽生产中的应用价值及潜力。
1.1 原儿茶酸来源我国蕴含着巨大的原儿茶酸资源,为原儿茶酸的开发利用提供了有力保障。富含原儿茶酸的刺五加和五味子广泛分布于我国东北、华北地区,如黑龙江、辽宁等省[11-12];而杜仲产于我国中部及西南部,湖南省是杜仲的主要产区,张家界市慈利县作为全国最大的杜仲生产基地,杜仲种植面积达15万亩(1亩≈666.67 m2)以上[13]。此外,松树在我国资源极为丰富,松针、松塔等属于可持续利用的再生资源,极易获取,而目前松针、松塔大多作为燃料使用[5-6]。
1.2 原儿茶酸的生物合成原儿茶酸能以微生物中的莽草酸途径以葡萄糖为底物进行生物合成。莽草酸途径是微生物合成芳香族化合物为机体提供芳香族氨基酸的主要途径[16]。原儿茶酸的生物合成途径如图 1所示:葡萄糖糖酵解途径(embden-meyerhof-parnas pathway,EMP)和磷酸戊糖途径(pentose phosphate pathway,PPP)分别生成磷酸烯醇式丙酮酸(phosphoenolpyruvic acid,PEP)和赤藓糖-4-磷酸(erythrose-4-phosphate,E4P)[16]。PEP和E4P是莽草酸途径的起始底物,首先在2-酮-3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸合酶(3-deoxy-D-arabino-heptulosonate-7-phosphate synthase)作用下生成2-酮-3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸(3-deoxy-D-arabino-heptulosonate-7-phosphate,DAHP),之后DAHP在3-脱氧奎尼酸合酶(3-dehydroquinate synthase)催化下生成3-脱氧奎尼酸(3-dehydroquinate,DHQ),而后DHQ在3-脱氢奎尼酸脱水酶(3-dehydroquinate dehydratase)作用下脱水生成3-脱氢莽草酸(3-dehydroshikimate,DHS),通过基因工程方法在大肠杆菌内引入3-脱氢莽草酸脱羟酶和原儿茶酸脱羧酶的肺炎克雷伯菌基因,则大肠杆菌可以将DHS转化为原儿茶酸[14-16]。目前使用大肠杆菌工程菌以葡萄糖合成DHS的摩尔转化率在30%以上,而DHS合成原儿茶酸摩尔转换率超过95%[17]。相对于天然提取法和以香草酸为底物的化学合成法,利用大肠杆菌工程菌以葡萄糖为底物合成原儿茶酸具有成本低、绿色、环保等优势,可规模化生产以满足畜禽养殖的需求。
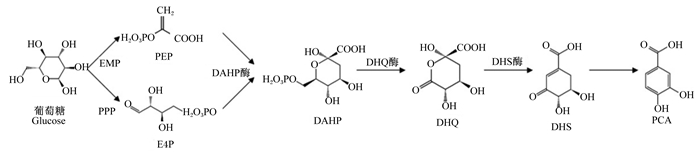
|
EMP:葡萄糖糖酵解途径embden-meyerhof-parnas pathway;PPP:磷酸戊糖途径pentose phosphate pathway;PEP:磷酸烯醇式丙酮酸phosphoenolpyruvic acid;E4P:赤藓糖-4-磷酸erythrose-4-phosphate;DAHP:2-酮-3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸3-deoxy-D-arabino-heptulosonate-7-phosphate,DHQ:3-脱氣奎尼酸合3-dehydroquinate;DHS:3-脱氢莽草酸3-dehydroshikimate;PCA:原儿茶酸protocatechuic acid。 图 1 原儿茶酸的生物合成 Fig. 1 Biosynthesis of protocatechuic acid[14-16] |
植物多酚特有的羟基结构使其具有较强的抗氧化能力,多酚的抗氧化能力与其羟基数目以及位置有关:原儿茶酸具有邻苯二酚,邻位羟基极易发生自氧化作用,缩合形成醌类结构,羟基给出的氢离子能与活性氧自由基(reactive oxygen species,ROS)结合使其淬灭[18]。在由过氧化氢(H2O2)诱导的细胞氧化应激模型中,原儿茶酸能显著降低细胞内ROS含量,减轻ROS造成的细胞结构损伤,缓解氧化应激引起的细胞凋亡[19-20]。在1, 2-二苦基-2-三硝基苯亚肼(1, 1-diphenyl-2-picrylhydrazyl,DPPH)自由基和H2O2清除率试验以及氧化应激细胞模型中,原儿茶酸的抗氧化能力强于维生素C、维生素E以及二丁基羟基甲苯等抗氧化剂[20-21]。
原儿茶酸能通过上调机体抗氧化酶的表达来提高机体抗氧化能力。机体的ROS反应是一种连锁反应,由于电子传递、药物、外界刺激等因素使氧气(O2)获得1个电子,转换为超氧化物阴离子(O2-·),O2-·在超氧化物歧化酶(superoxide dismutase,SOD)作用下生成过氧化氢H2O2,而H2O2在过氧化氢酶(catalase,CAT)或谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)作用下清除[21]。原儿茶酸能上调机体SOD、CAT、GSH-Px活性,增强机体抗氧化能力。Zhang等[22]研究发现,灌服10 mg/kg BW的原儿茶酸能显著提高老年大鼠(22月龄)肝脏SOD、CAT、GSH-Px活性,显著降低丙二醛(malondialdehyde,MDA)含量。王一冰[23]研究报道,在饲粮中添加300 mg/kg的原儿茶酸,能显著降低肉鸡肝脏中MDA含量,并能提高肝脏中总抗氧化能力(total antioxidant capacity,T-AOC)和GSH-Px活性。此外,原儿茶酸能与过渡金属离子螯合[21],当体内抗氧化酶系统无法有效清除H2O2和O2-·时,那么在过渡金属离子作用下H2O2和O2-·会产生芬顿反应生成氧化性更强的羟自由基(·OH),而原儿茶酸能与过渡金属离子结合减少·OH生成[24]。原儿茶酸还能通过调控核因子E2相关因子2(nuclear factor-E2-related factor 2,Nrf2)信号通路来上调抗氧化酶的表达。抗氧化反应元件(antioxidant responsive element,ARE)是一个特异的DNA启动子结合序列,是机体抗氧化应激的保护性顺式应答元件,调控着抗氧化酶的表达,而ARE启动子受到Nrf2信号通路的调控,在正常状态下Nrf2与Kelch样环氧氯丙烷相关蛋白1(Kelch sample related protein 1,Keap1)结合被“锚定”在细胞质中,当机体受到外界刺激时,上游蛋白激酶被活化诱导Nrf2的磷酸化使Nrf2的构象改变, 促使其与Keap1分离,Nrf2识别ARE启动子并与之结合,进而促进目标基因转录[10]。Vari等[25]研究发现,原儿茶酸是通过上调c-Jun N-末端激酶(c-Jun N-terminal kinase,JNK)的磷酸化,激活Nrf2-ARE信号通路上调机体抗氧化酶系统表达。
2.2 抑菌作用原儿茶酸是刺五加、丹参等传统中草药的主要抑菌成分[2-4]。原儿茶酸能够抑制革兰氏阳性菌、革兰氏阴性菌等致病菌以及真菌的生长,表 1总结了原儿茶酸对于不同细菌和真菌的最小抑菌浓度。原儿茶酸的抑菌活性不受温度的影响,经过100 ℃加热后原儿茶酸还可具有灭菌活性[26]。在与不同抗菌药(黏菌素、克林沙星、阿米卡星、磷霉素)联用时,原儿茶酸还具有协同相加效应[27]。原儿茶酸可以选择性地抑制致病菌的生长而不影响益生菌的生长。Pacheco等[28]研究发现,在20 mmol/mL浓度时,原儿茶酸能抑制肠杆菌和鼠伤寒沙门氏菌的生长,但并不影响鼠李糖乳杆菌和嗜酸乳杆菌的生长。
|
|
表 1 原儿茶酸对不同细菌和真菌的最小抑菌浓度 Table 1 Minimum inhibitory concentration of protocatechuic acid on different bacteria and fungi |
目前,原儿茶酸的抗菌机理尚不明确,根据已有的文献,原儿茶酸的抗菌机理可能与以下几点有关:1)原儿茶酸具有邻羟基,羟基是疏水性基团可以和细胞膜的脂质双分子层结合,影响细胞膜磷脂与蛋白质的相互作用,改变细胞膜结构、功能和通透性[32-34]。贾振宇等[32]研究发现,在经过原儿茶酸处理后,阪崎克罗诺肠杆菌胞内pH降低,细胞膜电位发生超极化/去极化,细菌细胞膜完整性降低,电镜下细菌表面出现皱缩和塌陷。2)原儿茶酸能与铁形成稳定的配合物,而铁的缺乏会使金属酶如血红素酶和核糖苷酸还原酶的活性下降,双歧杆菌和乳酸杆菌等有益菌不含有血红素酶,且双歧杆菌和乳酸杆菌的核糖苷酸酶还原酶等含铁酶被使用腺苷钴胺的酶取代因此不受影响,而大肠杆菌等致病菌则会在原儿茶酸作用下抑制生长[28, 35]。3)多酚在高剂量下会发生促氧化作用[36]。原儿茶酸的邻苯二酚结构决定其羟基极易发生断裂,高剂量下断裂的羟基能给出的电子能使O2活化成O2-·,O2-·从而引起细菌细胞膜脂质过氧化,而O2-·在SOD作用下生成H2O2[36]。大肠杆菌、金黄色葡萄球菌等致病菌中二价铁离子(Fe2+)含量高于嗜酸乳杆菌、鼠李糖乳杆菌等益生菌,其更易发生芬顿反应生成更多的·OH,过量的·OH直接作用于DNA导致断裂,引起细菌凋亡[31]。
2.3 抗炎当机体受到细菌、病毒等有害物质的入侵,会通过一系列的信号途径,引起机体的炎症反应[37]。炎症反应本是一种机体自身保护性反应,但炎症因子的长期或者过度激活会导致组织器官损伤[37]。前文中已经概述原儿茶酸能减少机体ROS和具有抑菌作用,而ROS和革兰氏阴性菌的细胞壁产生脂多糖(lipopolysaccharides,LPS)均能刺激机体产生炎症反应,而原儿茶酸能减少ROS和LPS的产生从而缓解机体炎症反应。
大量研究表明原儿茶酸能降低促炎因子水平。Zhang等[38]研究表明,在LPS诱导的小鼠急性肺损伤模型中,原儿茶酸能降低肿瘤坏死因子-α(tumor necrosis factor,TNF-α)和白细胞介素-1β(interleukin-1β,IL-1β)的含量。Farombi等[39]研究报道,在由葡聚糖硫酸钠诱导的溃疡性结肠炎大鼠模型中,原儿茶酸能抑制环氧合酶-2(cyclooxygenase-2,COX-2)和诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS)蛋白质表达,降低肝脏中IL-1β、白细胞介素-2(interleukin-2,IL-2)、TNF-α含量。促炎因子如TNF-α能诱导淋巴细胞和上皮细胞产生多种黏附分子,诱导趋化因子产生,促使炎症细胞向炎症局部聚集,进一步造成组织损伤[38]。此外,TNF-α能活化巨噬细胞和单核细胞,产生IL-1β、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)等促炎细胞因子,使炎性反应进一步扩大[37]。综上,原儿茶酸可减少促炎因子的生成,缓解炎症反应,防止炎症反应的扩大化。
原儿茶酸主要通过介导核转录因子-κB(nuclearfactor-κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路发挥其抗炎症功能[38, 40]。NF-κB是一种由p50亚基和p65亚基组合的二聚体,在正常状态时,NF-κB与NF-κB抑制蛋白(inhibitor of NF-κB,IκB)结合,无法进入细胞核转录。当受到外界刺激时,IκB发生磷酸化,NF-κB解离进入细胞核内,与特定DNA位点结合诱导多种炎症因子如TNF-α、IL-1、IL-6等的表达[41]。NF-κB信号通路受到多种蛋白激酶调控,如p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)、细胞外信号调激酶(extracellular regulated protein kinases,ERK)、JNK、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPAR)。Wang等[42]研究报道,原儿茶酸能通过作用于过氧化物酶体增殖物激活受体-γ(peroxisome proliferators-activated receptors-γ,PPAR-γ),通过上调PPAR-γ的表达来抑制NF-κB的活化。Zhang等[38]研究报道,原儿茶酸能够阻断LPS诱导的p38 MAPK蛋白激酶和NF-κB的活化,即通过抑制p38MAPK-NF-κB信号通路来缓解炎症反应。此外,原儿茶酸能抑制由LPS引起磷脂酰肌醇-3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin,PI3K/Akt/mTOR)信号通路、JNK信号通路、Toll样受体信号通路的激活,抑制NF-κB的活化,缓解炎症反应[40]。
2.4 抗病毒体外细胞试验和动物试验均有报道原儿茶酸还具有抗病毒作用,原儿茶酸对乙型肝炎病毒(hepatitis B virus,HBV)[43]、传染性法氏囊病毒(infectious bursal disease virus,IBDV)[44]、禽流感病毒(avian influenza virus type A,H9N2)[45]、新城疫病毒(newcastle disease virus,NDV)[46]有明显的抑制作用。目前有关原儿茶酸抗病毒机理的研究相对较少,根据已有的文献,原儿茶酸的抗病毒机理可能与以下几点有关:1)原儿茶酸能提高机体免疫力,增强对病毒抵抗力。环磷酰胺是一种免疫抑制剂,能抑制动物的体液免疫应答和细胞免疫应答[47]。在环磷酰胺诱导的肉鸡免疫抑制模型中,原儿茶酸能阻断由环磷酰胺引起的法氏囊、胸腺和脾脏指数降低,提高新城疫-传染性支气管炎二联活疫苗的抗体产生水平,提高机体细胞和体液免疫水平[48]。Guo等[46]研究表明,在接种新城疫病毒NDV弱毒鸡模型中,与口服125 mg/kg黄芪多糖组相比,口服40 mg/kg的原儿茶酸组对比对照组能显著提高了新城疫病毒NDV抗体和促进淋巴细胞增殖,提高机体体液免疫和细胞免疫能力,并且鸡的存活率(70%)高于黄芪多糖组(50%)。2)原儿茶酸能通过调控细胞凋亡,加快感染病毒细胞凋亡过程,防止病毒感染。Ou等[44]研究表明,经过原儿茶酸处理后,感染传染性法氏囊病毒IBDV鸡的法氏囊中IBDV病毒量显著低于对照组,口服20 mg/kg原儿茶酸组的存活率达到90%。原儿茶酸可以在感染病毒早期通过下调抗凋亡蛋白B淋巴细胞瘤-2蛋白(B-cell lymphoma-2 protein,Bcl-2)和上调促凋亡蛋白Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的表达,加速法氏囊内感染病毒的淋巴细胞凋亡速率,减少了病毒的复制达到抗病毒的作用[49]。3)原儿茶酸能够通过调控MAPK信号通路,诱导细胞外信号相关激酶ERK1/2的磷酸化,抑制HepG2.2.15细胞中的HNF4a和HNFla启动子基因表达,从而抑制HBV病毒的复制[50]。
综上所述,原儿茶酸具有抗氧化、抑菌、抗炎、抗病毒等多种生物学活性,其潜在作用机理如图 2所示。
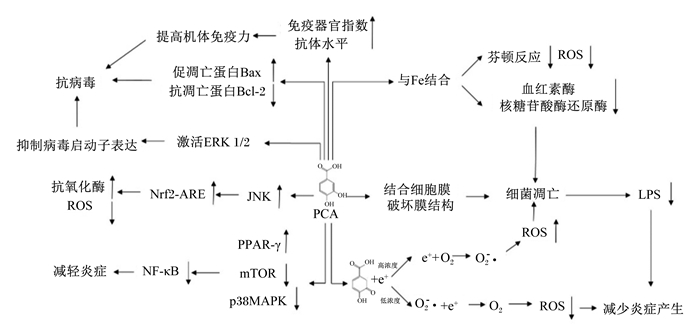
|
Bax:Bcl-2相关X蛋白Bcl-2 associated x protein;Bcl-2:B淋巴细胞瘤-2蛋白B-cell lymphoma-2 protein;ROS:活性氧自由基reactive oxygen species;ERK1/2:细胞外信号调激酶1/2 extracellular regulated protein kinases 1/2;Nrf2-ARE:核因子E2相关因子2-抗氧化反应元件nuclear factor-E2-related factor 2-antioxidant responsive element;JNK:c-Jun N-末端激酶c-Jun N-terminal kinase;LPS:脂多糖lipopolysaccharides;PPAR-γ:过氧化物酶体增殖物激活受体-γ peroxisome proliferators-activated receptors-γ;PCA:原儿茶酸protocatechuic acid;mTOR:哺乳动物类雷帕霉素靶蛋白mammalian target of rapamycin;p38MAPK:p38丝裂原活化蛋白激酶p38 mitogen-activated protein kinase;O2-·:超氧化物阴离子superoxide anion。 图 2 原儿茶酸的潜在作用机理 Fig. 2 Potential function mechanisms of protocatechuic acid[21, 24-25, 30-33, 35, 38-39, 45, 47-48] |
规模化养猪生产中,早期断奶会诱发氧化应激与炎症反应,造成仔猪肠道损伤,易受到致病菌侵染[51]。原儿茶酸能减轻早期断奶仔猪氧化应激与炎症反应。陈鹏等[52]在断奶仔猪饲粮中添加杜仲叶提取物,与基础饲粮相比,250 mg/kg的杜仲叶提取物能显著提高断奶仔猪的平均日增重,与添加50 mg/kg金霉素的抗生素组无显著差异。本课题组通过内毒素诱导的断奶仔猪肠黏膜损伤试验发现,原儿茶酸能有效提高仔猪抗氧化能力并降低炎症反应,减少肠黏膜损伤,从而提高断奶仔猪的生长性能。此外,原儿茶酸还能减少肠道中致病菌的丰度,改善肠道菌群结构,从而缓解断奶造成的肠道损伤。Fang等[53]研究发现,与添加400 mg/kg杆菌肽锌和300 mg/kg卡巴多的抗生素对照组相比,刺五加提取物能显著提高断奶仔猪十二指肠、空肠和回肠的绒毛高度,降低隐窝深度,并能增加乳酸乳杆菌、唾液乳杆菌、枯草芽孢杆菌等益生菌丰度,降低金黄色葡萄球菌、鼠伤寒沙门氏菌、大肠杆菌丰度,减少断奶应激导致的腹泻。王一冰[23]在黄羽肉鸡饲粮中添加原儿茶酸,与添加200 mg/kg恩拉霉素的抗生素对照组相比,添加原儿茶酸能增加盲肠菌群的α多样性,显著提高厚壁菌门的相对丰度,降低拟杆菌门和变形菌门的相对丰度,300 mg/kg的原儿茶酸能显著提高黄羽肉鸡末重,降低料重比。原儿茶酸还能缓解热应激诱导的氧化应激,减轻家禽氧化损伤,提高家禽生产性能[54]。
4 小结综上,原儿茶酸具有多种生物学功能,应用于畜禽生产中可潜在提高畜禽生产性能和免疫能力,且其来源广泛,生物合成成本低,因此在畜禽生产中具有很好的应用前景。然而,一些问题的存在限制了其合理有效利用,如:1)原儿茶酸的作用机理尚不清楚,需要找到其在体内的关键作用靶点;2)原儿茶酸的代谢途径,生物利用率尚不清楚,在畜禽饲粮中的适宜添加比例还有待研究;3)原儿茶酸在畜禽生产中应用较少,如何将原儿茶酸更好应用于畜禽生产中还需深入研究。因此,系统地研究原儿茶酸的生物功能,探究其分子作用机理及生物利用率,可为其作为一种新型绿色饲料添加剂合理应用于畜禽生产提供有效参考与理论依据。
| [1] |
PACHECO-PALENCIA L A, MERTENS-TALCOTT S, TALCOTT S T. Chemical composition, antioxidant properties, and thermal stability of a phytochemical enriched oil from açai (Euterpe oleracea Mart.)[J]. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4631-4636. DOI:10.1021/jf800161u |
| [2] |
尚海花, 王淼, 刘颖, 等. HPLC法测定不同产地刺五加中原儿茶酸、紫丁香苷、绿原酸、刺五加苷E和异嗪皮啶[J]. 现代药物与临床, 2018, 33(6): 1324-1328. |
| [3] |
SZOPA A, KOKOTKIEWICZ A, BEDNARZ M, et al. Studies on the accumulation of phenolic acids and flavonoids in different in vitro culture systems of Schisandra chinensis (Turcz.) Baill.Using a DAD-HPLC method[J]. Phytochemistry Letters, 2017, 20: 462-469. DOI:10.1016/j.phytol.2016.10.016 |
| [4] |
YIN M C, LIN C C, WU H C, et al. Apoptotic effects of protocatechuic acid in human breast, lung, liver, cervix, and prostate cancer cells:potential mechanisms of action[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 6468-6473. DOI:10.1021/jf9004466 |
| [5] |
吴道勋, 刘璐, 王莹, 等. 云南松松塔中原儿茶酸提取工艺的研究[J]. 大理学院学报, 2014, 13(4): 4-6, 7. |
| [6] |
邓毅, 宁红霞, 沈薇, 等. HPLC同时测定雪松松针中没食子酸、原儿茶酸和儿茶素的含量[J]. 中国现代应用药学, 2014, 31(9): 1104-1107. |
| [7] |
DE FERRARS R M, CZANK C, ZHANG Q, et al. The pharmacokinetics of anthocyanins and their metabolites in humans[J]. British Journal of Pharmacology, 2014, 171(13): 3268-3282. DOI:10.1111/bph.12676 |
| [8] |
胡睿智, 贺宇佳, 何子煜, 等. 矢车菊素-3-葡萄糖苷的吸收、代谢及生理功能研究进展[J]. 动物营养学报, 2019, 31(05): 2052-2062. |
| [9] |
KAY C D, KROON P A, CASSIDY A. The bioactivity of dietary anthocyanins is likely to be mediated by their degradation products[J]. Molecular Nutrition & Food Research, 2009, 53(Suppl.1): S92-S101. |
| [10] |
KAKKAR S, BAIS S. A review on protocatechuic acid and its pharmacological potential[J]. ISRN Pharmacology, 2014, 2014: 952943. |
| [11] |
胡理乐, 张海英, 秦岭, 等. 中国五味子分布范围及气候变化影响预测[J]. 应用生态学报, 2012, 23(9): 2445-2450. |
| [12] |
程海涛, 刘德江, 罗志文, 等. 药用植物刺五加资源分布与环境因子的相关性[J]. 黑龙江医药科学, 2012, 35(4): 8-9. DOI:10.3969/j.issn.1008-0104.2012.04.004 |
| [13] |
王效宇, 陈毅烽, 伍江波, 等. 湖南省杜仲产业现状调查[J]. 经济林研究, 2016, 34(4): 158-162. |
| [14] |
REIS F S, ĆIRIĆ A, STOJKOVIĆ D, et al. Effects of different culture conditions on biological potential and metabolites production in three Penicillium isolates[J]. Drug Development and Industrial Pharmacy, 2015, 41(2): 253-262. DOI:10.3109/03639045.2013.858738 |
| [15] |
LI W S, XIE D M, FROST J W. Benzene-free synthesis of catechol: interfacing microbial and chemical catalysis[J]. Journal of the American Chemical Society, 2005, 127(9): 2874-2882. DOI:10.1021/ja045148n |
| [16] |
王佳.改造木糖非磷酸化代谢途径及莽草酸途径生物合成高附加值产物[D].博士学位论文.北京: 北京化工大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10010-1018315798.htm
|
| [17] |
WU F L, CAO P, SONG G T, et al. Expanding the repertoire of aromatic chemicals by microbial production[J]. Journal of Chemical Technology and Biotechnology, 2018, 93(10): 2804-2816. DOI:10.1002/jctb.5690 |
| [18] |
SROKA Z, CISOWSKI W. Hydrogen peroxide scavenging, antioxidant and anti-radical activity of some phenolic acids[J]. Food and Chemical Toxicology, 2003, 41(6): 753-758. DOI:10.1016/S0278-6915(02)00329-0 |
| [19] |
SHI G F, AN L J, JIANG B, et al. Alpinia protocatechuic acid protects against oxidative damage in vitro and reduces oxidative stress in vivo[J]. Neuroscience Letters, 2006, 403(3): 206-210. DOI:10.1016/j.neulet.2006.02.057 |
| [20] |
CHOU T H, DING H Y, LIN R J, et al. Inhibition of melanogenesis and oxidation by protocatechuic acid from Origanum vulgare (oregano)[J]. Journal of Natural Products, 2010, 73(11): 1767-1774. DOI:10.1021/np100281g |
| [21] |
LI X C, WANG X Z, CHEN D F, et al. Antioxidant activity and mechanism of protocatechuic acid in vitro[J]. Functional Foods in Health & Disease, 2011, 1(7): 232-244. |
| [22] |
ZHANG X L, SHI G F, LIU X Z, et al. Anti-ageing effects of protocatechuic acid from Alpinia on spleen and liver antioxidative system of senescent mice[J]. Cell Biochemistry & Function, 2011, 29(4): 342-347. |
| [23] |
王一冰.原儿茶酸影响动物肠道屏障功能的研究[D].博士学位论文.杭州: 浙江大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10335-1017275790.htm
|
| [24] |
刘时中. 自由基与衰老[J]. 生理科学进展, 1983, 14(2): 147-152. |
| [25] |
VARI R, D'ARCHIVIO M, FILESI C, et al. Protocatechuic acid induces antioxidant/detoxifying enzyme expression through JNK-mediated Nrf2 activation in murine macrophages[J]. The Journal of Nutritional Biochemistry, 2011, 22(5): 409-417. DOI:10.1016/j.jnutbio.2010.03.008 |
| [26] |
CHAO C Y, YIN M C. Antibacterial effects of roselle calyx extracts and protocatechuic acid in ground beef and apple juice[J]. Foodborne Pathogens and Disease, 2009, 6(2): 201-206. DOI:10.1089/fpd.2008.0187 |
| [27] |
柴贝贝, 姜维佳, 王莉贞, 等. 原儿茶酸或绿原酸与抗菌药联用对鱼源链球菌的抑菌效果[J]. 南方农业学报, 2018, 49(3): 580-585. DOI:10.3969/j.issn.2095-1191.2018.03.25 |
| [28] |
PACHECO O R, WALL-MEDRANO A, GOÑI M G, et al. Effect of phenolic compounds on the growth of selected probiotic and pathogenic bacteria[J]. Letters in Applied Microbiology, 2018, 66(1): 25-31. DOI:10.1111/lam.12814 |
| [29] |
GUTIERREZ L M, RUA J, CARO I, et al. Evaluation of antimicrobial and antioxidant activities of natural phenolic compounds against foodborne pathogens and spoilage bacteria[J]. Food Control, 2012, 26(2): 555-563. DOI:10.1016/j.foodcont.2012.02.025 |
| [30] |
袁胜浩, 卞金辉, 谢珍, 等. 大半边莲中酚酸类成分与抑菌活性研究[J]. 中成药, 2013, 35(01): 170-172. |
| [31] |
AJIBOYE T O, HABIBU R S, SAIDU K, et al. Involvement of oxidative stress in protocatechuic acid-medi ated bacterial lethality[J]. Microbiologyopen, 2017, 6(4): 10. |
| [32] |
贾振宇, 孙怡, 陈怡飞, 等. 原儿茶酸对阪崎克罗诺肠杆菌的抑制作用[J]. 微生物学通报, 2018, 45(04): 788-796. |
| [33] |
LIU W H, HSU C C, YIN M C. In vitro anti-helicobacter pylori activity of diallyl sulphides and protocatechuic acid[J]. Phytotherapy Research, 2008, 22(1): 53-57. DOI:10.1002/ptr.2259 |
| [34] |
KEMPERMAN R A, BOLCA S, ROGER L C, et al. Novel approaches for analysing gut microbes and dietary polyphenols:challenges and opportunities[J]. Microbiology, 2010, 156(11): 3224-3231. DOI:10.1099/mic.0.042127-0 |
| [35] |
SMITH A H, ZOETENDAL E, MACKIE R I. Bacterial mechanisms to overcome inhibitory effects of dietary tannins[J]. Microbial Ecology, 2005, 50(2): 197-205. DOI:10.1007/s00248-004-0180-x |
| [36] |
BABICH H, SCHUCK A G, WEISBURG J H, et al. Research strategies in the study of the pro-oxidant nature of polyphenol nutraceuticals[J]. Journal of Toxicology, 2011, 2011: 467305. |
| [37] |
SEMAMING Y, PANNENGPETCH P, CHATTIPAKORN S C, et al. Pharmacological properties of protocatechuic acid and its potential roles as complementary medicine[J]. Evidence-Based Complementary and Alternative Medicine, 2015, 2015: 593902. |
| [38] |
ZHANG X L, LI C L, LI J, et al. Protective effects of protocatechuic acid on acute lung injury induced by lipopolysaccharide in mice via p38MAPK and NF-κB signal pathways[J]. International Immunopharmacology, 2015, 26(1): 229-236. DOI:10.1016/j.intimp.2015.03.031 |
| [39] |
FAROMBI E O, ADEDARA I A, AWOYEMI O V, et al. Dietary protocatechuic acid ameliorates dextran sulphate sodium-induced ulcerative colitis and hepatotoxicity in rats[J]. Food & Function, 2016, 7(2): 913-921. |
| [40] |
NAM Y J, LEE C S. Protocatechuic acid inhibits Toll-like receptor-4-dependent activation of NF-κB by suppressing activation of the Akt, mTOR, JNK and p38-MAPK[J]. International Immunopharmacology, 2018, 55: 272-281. DOI:10.1016/j.intimp.2017.12.024 |
| [41] |
MASELLA R, SANTANGELO C, M.D'ARCHIVIO M, et al. Protocatechuic acid and human disease prevention:biological activities and molecular mechanisms[J]. Current Medicinal Chemistry, 2012, 19(18): 2901-2917. DOI:10.2174/092986712800672102 |
| [42] |
WANG Y M, ZHOU J, FU S, et al. Preventive effects of protocatechuic acid on LPS-induced inflammatory response in human gingival fibroblasts via activating PPAR-γ[J]. Inflammation, 2015, 38(3): 1080-1084. DOI:10.1007/s10753-014-0073-1 |
| [43] |
刘厚佳, 胡晋红, 孙莲娜, 等. 原儿茶酸等化合物对HBV DNA转染人肝癌细胞株的作用[J]. 第二军医大学学报, 2001, 22(7): 661-663. DOI:10.3321/j.issn:0258-879X.2001.07.020 |
| [44] |
OU C B, PANG Q, CHEN X, et al. Protocatechuic acid, a new active substance against the challenge of avian infectious bursal disease virus[J]. Poultry Science, 2012, 91(7): 1604-1609. DOI:10.3382/ps.2011-02069 |
| [45] |
OU C B, SHI N N, YANG Q H, et al. Protocatechuic acid, a novel active substance against avian influenza virus H9N2 infection[J]. PLoS One, 2014, 9(10): e111004. DOI:10.1371/journal.pone.0111004 |
| [46] |
GUO Y X, ZHANG Q, ZUO Z H, et al. Protocatechuic acid (PCA) induced a better antiviral effect by immune enhancement in SPF chickens[J]. Microbial Pathogenesis, 2018, 114: 233-238. DOI:10.1016/j.micpath.2017.11.068 |
| [47] |
宋雁, 贾旭东, 崔文明, 等. 不同途径和剂量环磷酰胺建立小鼠免疫抑制模型的对比研究[J]. 中国食品卫生杂志, 2013, 25(3): 218-225. |
| [48] |
欧长波, 何诚. 原儿茶酸对环磷酰胺诱导的肉鸡免疫抑制影响的研究[J]. 中国家禽, 2017, 39(2): 28-32. |
| [49] |
OU C B, WANG Q X, WEI X B, et al. Pro-apoptosis effects of protocatechuic acid in the early stage of infectious bursal disease virus infection[J]. Microbial Pathogenesis, 2018, 124: 216-222. DOI:10.1016/j.micpath.2018.08.030 |
| [50] |
DAI X Q, CAI W T, WU X, et al. Protocatechuic acid inhibits hepatitis B virus replication by activating ERK1/2 pathway and down-regulating HNF4α and HNF1α in vitro[J]. Life Sciences, 2017, 180: 68-74. DOI:10.1016/j.lfs.2017.05.015 |
| [51] |
石海仁, 滚双宝, 张生伟, 等. 杜仲叶对育肥猪生长性能、胴体性状、抗氧化能力及肠道菌群的影响[J]. 动物营养学报, 2018, 30(1): 350-359. DOI:10.3969/j.issn.1006-267x.2018.01.042 |
| [52] |
陈鹏, 杨在宾, 黄丽波, 等. 八角和杜仲叶提取物对断奶仔猪生长性能、血清酶活性及肝脏肿瘤坏死因子-α分布和表达的影响[J]. 动物营养学报, 2017, 29(3): 874-881. DOI:10.3969/j.issn.1006-267x.2017.03.018 |
| [53] |
FANG J, YAN F Y, KONG X F, et al. Dietary supplementation with Acanthopanax senticosus extract enhances gut health in weanling piglets[J]. Livestock Science, 2009, 123(2/3): 268-275. |
| [54] |
HU R Z, HE Y J, AROWOLO M A, et al. Polyphenols as potential attenuators of heat stress in poultry production[J]. Antioxidants, 2019, 8(3): 67. DOI:10.3390/antiox8030067 |




