2. 河南省草地资源创新与利用重点实验室, 郑州 450002;
3. 河南省牧草工程技术研究中心, 郑州 450002
2. Henan Key Laboratory of Innovation and Utilization of Grassland Resources, Zhengzhou 450002, China;
3. Henan Engineering Research Center for Forage, Zhengzhou 450002, China
仔猪断奶时由于饲粮、免疫、生理等的变化,容易遭受环境中各种病原体和非病原体感染,从而产生应激,导致采食量和体重下降、腹泻率增加,影响仔猪的正常生长[1]。在免疫应激状态下,免疫系统的炎性细胞因子[如白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)]过量分泌,导致组织(如肝脏和肠道)损伤,从而降低生产性能[2]。已有研究表明脂多糖(LPS)刺激可以引起免疫细胞释放大量的炎性细胞因子,如IL-1β、IL-6、TNF-α等[3],炎性细胞因子含量升高促使下丘脑-垂体-肾上腺轴活化,引起免疫应激[4-5]。借助于营养调控手段来调节炎性细胞因子的分泌,缓解免疫应激具有重要意义。目前,通过脂肪酸、氨基酸、糖类及植物精油、植物多酚等营养素调控仔猪免疫应激的研究较多[6-7]。近年来,随着对饲粮纤维理化特性和营养生理作用研究的深入,发现饲粮纤维可以在肠道微生物发酵作用下,调节肠道微生态平衡并影响动物健康,饲粮纤维在后肠段的发酵产物——短链脂肪酸可以维持肠道健康[8]。因此,本试验通过给仔猪注射LPS以模拟仔猪免疫应激状态[9-10],研究饲粮纤维对LPS刺激仔猪生长性能、器官相对重量及炎性细胞因子mRNA表达量的影响,旨在为饲粮纤维缓解仔猪免疫应激的研究提供理论依据。
1 材料与方法 1.1 试验动物与设计采用2×2双因子试验设计,2个因子分别为饲粮纤维(基础饲粮或添加2%纤维饲粮)(试验所用纤维购买于奥地利Agromed公司,含有85%的总膳食纤维及59%的粗纤维[11-12])和LPS刺激(注射LPS或生理盐水,LPS购买于Sigma公司,大肠杆菌血清型O55 : B5)。选取96头健康状况良好、体况相近[(7.93±0.03) kg]的34日龄杜洛克×长白×大白仔猪,按体重相近原则随机分为4个处理,每个处理3个重复,每个重复8头仔猪。其中处理1和3饲喂基础饲粮,处理2和4饲喂添加2%纤维饲粮,试验期28 d。在试验第16天和第28天,处理3和4的仔猪腹膜注射LPS(LPS溶解于生理盐水中,注射液中LPS含量为500 μg/kg,按0.2 mL/kg BW即100 μg/kg BW注射),处理1和2的仔猪腹膜注射等剂量生理盐水。试验第28天注射LPS或生理盐水12 h后屠宰仔猪取样。
试验前对猪舍进行严格消毒,待猪舍干燥后,将试验猪称重和分组。采用粉料饲喂,自由采食和饮水,按常规程序进行免疫和驱虫。基础饲粮参照NRC(2012)断奶仔猪的营养需要配制,在基础饲粮配方的基础添加2%的纤维,配制添加纤维饲粮。饲粮组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
于试验开始(第1天)、第16天、第23天、第28天,以重复为单位对仔猪称重并记录采食量。生长性能指标包括平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.2.2 器官相对重量试验第28天注射LPS或生理盐水12 h后,从每个处理的各重复随机选择1头仔猪屠宰,分离心脏、肝脏、脾脏、肺脏、肾脏和胸腺,吸掉血液并剔除脂肪后分别称重,计算器官相对重量。
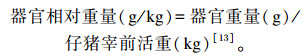
|
心脏、胸腺、脾脏和肝脏称重后取样用于提取总RNA。总RNA提取按照试剂盒[生工生物工程(上海)股份有限公司]说明书进行。RNA浓度通过Nanodrop 2000超微量分光光度计(Thermo公司)检测,纯度以OD260/280表示。cDNA合成按照反转录试剂盒(Toyobo公司)说明书进行,反转录后的cDNA于-20 ℃保存备用。采用实时荧光定量PCR法检测各组织中IL-1β、IL-6和TNF-α的mRNA表达量,用Lightcycle 96 Real-time PCR仪(Roche公司)进行测定,反应荧光染料为SYBR Green Ⅰ(Biosharp公司)。反应体系为10 μL,由5 μL qPCR MasterMix、0.2 μL上游引物、0.2 μL下游引物、4.1 μL RNase-free water、0.5 μL cDNA组成。根据甘油醛-3-磷酸脱氢酶(GAPDH)、IL-1β、IL-6和TNF-α的基因序列,用Primer premier 5.0设计引物,送交尚亚生物技术有限公司合成,基因的引物序列及参数见表 2。循环参数:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。目的基因mRNA表达量采用Livak等[14]的2-ΔΔCt法计算,以GAPDH为内参基因。
|
|
表 2 基因的引物序列及参数 Table 2 Primer sequences and parameters of genes |
采用SPSS 24.0的一般线性模型(GLM)进行双因素方差分析。模型主效应包括饲粮纤维、LPS刺激及二者的交互作用。结果以平均值±标准差表示,以P < 0.05表示差异显著,以0.05 < P≤0.10表示差异具有显著性趋势。采用GraphPad Prism 7.0软件作图。
2 结果与分析 2.1 饲粮纤维对LPS刺激仔猪生长性能的影响由表 3可知,在整个试验期内,饲粮纤维与LPS刺激对仔猪生长性能的影响不存在显著的交互作用(P>0.05)。在第1~15天,饲粮中添加纤维显著提高了仔猪的平均日采食量(P < 0.05);在第16~22天,LPS刺激具有降低仔猪的平均日采食量的趋势(P=0.093),并显著降低了平均日增重(P < 0.05),显著提高了料重比(P < 0.05);在第23~28天,LPS刺激显著降低了仔猪的平均日采食量(P < 0.05),饲粮中添加纤维具有提高仔猪的平均日增重和降低料重比的趋势(P=0.058、P=0.080)。在整个试验期(第1~28天),LPS刺激显著降低了仔猪的平均日采食量和日增重(P < 0.05),而饲粮中添加纤维具有提高仔猪平均日增重的趋势(P=0.076);LPS刺激具有提高仔猪料重比的趋势(P=0.100),而饲粮中添加纤维显著降低了仔猪的料重比(P < 0.05)。
|
|
表 3 饲粮纤维和LPS刺激对仔猪生长性能的影响 Table 3 Effects of dietary fiber and LPS challenge on growth performance of piglets |
由表 4可知,饲粮添加纤维与LPS刺激对仔猪各器官的相对重量均无显著的交互作用(P>0.05);LPS刺激降低了仔猪心脏、脾脏和胸腺的相对重量,但差异未达显著水平(P>0.05);饲粮中添加纤维后,仔猪肝脏、脾脏和肺脏的相对重量有所增加,差异未达显著水平(P>0.05);饲粮中添加纤维有增加仔猪心脏相对重量的趋势(P=0.054),并显著增加了胸腺的相对重量(P < 0.05)。
|
|
表 4 饲粮纤维和LPS刺激对仔猪器官相对重量的影响 Table 4 Effects of dietary fiber and LPS challenge on organ relative weight of piglets |
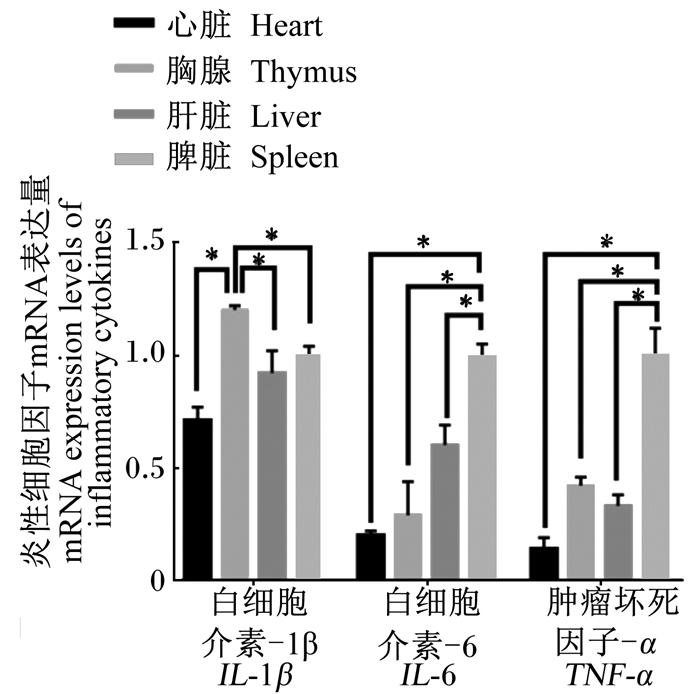
由图 1可知,IL-1β mRNA在仔猪胸腺中的表达量最高,显著高于在心脏、肝脏和脾脏中的表达量(P < 0.05);IL-6和TNF-α mRNA在仔猪脾脏中的表达量最高,显著高于在心脏、胸腺和肝脏中的表达量(P < 0.05)。炎性细胞因子mRNA在仔猪胸腺、脾脏和肝脏中的表达量较高,因此进一步研究其在不同处理中的表达量。
|
“*”表示差异显著(P < 0.05)。 “*” indicated significant difference (P < 0.05). 图 1 仔猪不同组织中炎性细胞因子mRNA表达量 Fig. 1 mRNA expression levels of inflammatory cytokines in different tissues of piglets |
由表 5可知,饲粮纤维与LPS刺激对仔猪胸腺中IL-6和TNF-α mRNA表达量以及脾脏的IL-6 mRNA表达量存在显著的交互作用(P < 0.05)。LPS刺激后,仔猪肝脏中IL-1β和TNF-α mRNA表达量升高(P>0.05),胸腺中IL-6 mRNA表达量升高(P>0.05);饲粮中添加纤维降低了仔猪脾脏中TNF-α mRNA表达量(P>0.05),显著降低了胸腺中IL-1β、IL-6和TNF-α mRNA表达量(P < 0.05)。
|
|
表 5 饲粮纤维和LPS刺激对仔猪不同组织中炎性细胞因子mRNA表达量的影响 Table 5 Effects of dietary fiber and LPS challenge on mRNA expression levels of inflammatory cytokines in in different tissues of piglets |
LPS是革兰氏阴性菌的菌膜结构物质,能诱导仔猪产生细菌感染症状,如厌食、嗜睡和发热等[15]。朱惠玲等[16]报道,LPS刺激降低了仔猪的平均日采食量和平均日增重。Mao等[17]报道,LPS刺激显著降低了仔猪的平均日增重。本研究中,LPS刺激显著降低了仔猪的平均日采食量和平均日增重,具有提高料重比的趋势,这与上述前人的研究结果相似。LPS刺激后,炎性细胞因子分泌增加,将用于生长发育的能量转向于维持高度激活的免疫系统,从而降低了生产性能[18]。这些炎性细胞因子也可以直接作用于靶组织或通过作用于神经内分泌系统,引起动物发生一系列行为和代谢上的改变,导致动物生长迟缓以及胴体品质下降[19]。近年来,通过营养调控缓解免疫应激已成为动物营养学的重要研究方向。Gerritsen等[20]发现,在饲粮中添加15%的水不溶性非淀粉多糖显著增加了断奶仔猪的平均日采食量和平均日增重。王莲香[21]发现在饲粮中添加1.5%~8.0%的水不溶性饲粮纤维能够提高断奶仔猪的平均日采食量和平均日增重。Hermes等[22]研究表明,仔猪饲喂高纤维水平饲粮后全期日增重和试验末重有了极显著提高。本研究发现,饲粮中添加纤维后,提高了仔猪的平均日采食量和平均日增重,显著降低了料重比,与上述研究所得结果相似。肠道健康的维持是复杂的,依赖于饮食、共生微生物区系和黏膜之间的微妙平衡,包括消化道上皮和覆盖在上皮上的黏液[23]。而饲粮纤维可以促进肠道健康,其作用可能与促进胃肠道成熟、饲粮纤维对肠道微生物区系生长的物理效应以及阻断致病菌与胃肠道黏膜的黏附有关[24]。此外,饲粮纤维在后肠段发酵生成的短链脂肪酸具有多种有益的作用,例如为肠上皮细胞提供能量、维持上皮屏障功能、调节细胞增殖、消除炎症和调节免疫反应[25]。Liu等[26]的研究也表明,饲粮中添加纤维后,仔猪盲肠段乙酸和丁酸的含量升高。本研究中,饲粮中添加纤维可以改善仔猪的生长性能,其作用也可能与饲粮纤维在后肠段发酵生成的短链脂肪酸有关。
3.2 饲粮纤维对LPS刺激仔猪器官相对重量的影响动物内脏器官是动物生理功能正常进行的物质基础,其相对重量近似反映该脏器的生理功能[27]。心脏的功能是推动血液流向各组织、器官,以供应氧和营养物质,并带走代谢的终产物(二氧化碳、尿素和尿酸等),维持细胞正常代谢。肝脏是机体新陈代谢的重要器官,具有还原与储存肝糖原、合成分泌性蛋白质等作用。脾脏是最大的免疫器官,其含有的巨噬细胞、淋巴细胞等能够消除病原微生物,产生免疫球蛋白、补体等免疫物质,进而发挥免疫作用。肺脏是与大气接触的第一重要器官,担负着氧气的输入和二氧化碳的输出,通过心脏有节律的收缩与舒张输送到各个组织器官[28]。胸腺是动物机体的中枢免疫器官,可以诱导淋巴干细胞成熟为T细胞,T细胞随淋巴和血流迁移到外周免疫器官,参与细胞免疫应答,也辅助和调节体液免疫应答[29],其相对重量一定程度上能够反映动物的免疫功能[30-32]。已有研究发现饲粮添加纤维可以提高家兔淋巴组织中淋巴滤泡的生长[33],并提高肠道中分泌型免疫球蛋白A(sIgA)抗体的含量[34]。张南斌等[35]研究表明,饲粮中粗纤维水平为14.32%时生长肉兔的胸腺指数和肝脏指数最高,机体免疫状态达到最佳。陶志勇[36]研究发现,提高饲粮中粗纤维水平可以提高家兔的免疫水平,包括提高胸腺指数和脾脏指数。在Abdollahi等[37]的研究中,饲粮中添加纤维提高了肉仔鸡脾脏的相对重量。本研究中,LPS刺激降低了仔猪心脏、脾脏和胸腺的相对重量;饲粮中添加纤维后,仔猪的胸腺指数显著提高,说明饲粮纤维可以促进胸腺的发育,进而提高仔猪的免疫功能。
3.3 仔猪不同组织中炎性细胞因子mRNA的表达量炎性细胞因子参与机体的免疫应答和调节,IL-1β、IL-6、TNF-α是较典型的炎性细胞因子,但有关其在不同组织间的表达分布情况的研究较少。陈逢等[38]研究表明TNF-α mRNA在脾脏中表达量较高。与其研究相似,本研究发现,IL-6、TNF-α mRNA的表达量在脾脏中较高,IL-1β的mRNA表达量在胸腺中较高。炎性细胞因子mRNA的表达量在仔猪不同组织中差异较大,可能与各组织对抗原的识别和抵抗能力相关。脾脏和胸腺作为机体重要的免疫器官,是免疫应答的主要场所,其含有的巨噬细胞可以产生炎性细胞因子,引起细胞免疫应答和体液免疫应答。
3.4 饲粮纤维对LPS刺激仔猪不同组织中炎性细胞因子mRNA表达量的影响目前通过给动物腹膜或静脉注射LPS以其刺激所导致的感染和炎症反应模型是研究动物免疫应激反应较为经典的模式[15]。LPS刺激引起巨噬细胞合成和分泌IL-1β、IL-6、TNF-α等炎性细胞因子,使机体发生一系列代谢变化。Chen等[2]研究表明,在免疫应激状态下,免疫系统产生的炎性细胞因子(IL-1β、IL-6、TNF-α)会导致组织(如肝脏和肠道)损伤。Zhang等[39]研究发现,LPS刺激后,仔猪肝脏中IL-1β、IL-6、TNF-α mRNA的表达量显著升高。本研究中,LPS刺激提高了仔猪肝脏和胸腺中IL-1β、IL-6、TNF-α mRNA的表达量,这与Zhang等[39]的研究结果相似。皮定安[40]发现天冬酰胺(Asn)通过Toll样受体4(TLR4)和核苷酸结合寡聚域受体(NOD)信号通路缓解了LPS刺激引起的肝脏的TNF-α mRNA表达量的升高。Chen等[41]研究发现,TLR4和NOD信号通路激活启动了仔猪的免疫应激,负调控该通路可成为控制仔猪免疫应激的新途径。Zeitz等[42]研究表明,在饲粮中添加木质纤维OptiCell显著降低了空肠中IL-1β、白细胞介素-17(IL-17)mRNA的表达量。本研究结果也发现,饲粮中添加纤维后,仔猪胸腺中IL-6、TNF-α mRNA的表达量显著降低。目前关于饲粮纤维对免疫应激仔猪炎性细胞因子mRNA表达量影响的研究较少,因此本试验推测饲粮纤维也可能通过TLR4和NOD信号通路调控下游基因的表达,降低炎性细胞因子的表达量,但有待进一步验证。
4 结论① LPS刺激降低了仔猪的生长性能,导致心脏、脾脏和胸腺的相对重量降低,肝脏和胸腺中炎性细胞因子mRNA的表达量升高。
② 在饲粮中添加纤维后,提高了仔猪的平均日采食量和平均日增重,降低了料重比,并且可以增加心脏和胸腺的相对重量,降低脾脏和胸腺中炎性细胞因子mRNA的表达量。
③ 综上可知,饲粮纤维具有改善仔猪生长性能、降低炎症反应的作用,从而说明饲粮纤维具有缓解仔猪免疫应激的潜力。
| [1] |
LALLÈS J P, BOSI P, SMIDT H, et al. Weaning—a challenge to gut physiologists[J]. Livestock Science, 2007, 108(1/2/3): 82-93. |
| [2] |
CHEN F, LIU Y L, ZHU H L, et al. Fish oil attenuates liver injury caused by LPS in weaned pigs associated with inhibition of TLR4 and nucleotide-binding oligomerization domain protein signaling pathways[J]. Innate Immunity, 2013, 19(5): 504-515. DOI:10.1177/1753425912472003 |
| [3] |
JACOBI S K, GABLER N K, AJUWON K M, et al. Adipocytes, myofibers, and cytokine biology:new horizons in the regulation of growth and body composition[J]. Journal of Animal Science, 2006, 84(Suppl.13): E140-E149. |
| [4] |
CHESNOKOVA V, MELMED S. Minireview:neuro-immuno-endocrine modulation of the hypothalamic-pituitary-adrenal (HPA) axis by gp130 signaling molecules[J]. Endocrinology, 2002, 143(5): 1571-1574. DOI:10.1210/endo.143.5.8861 |
| [5] |
LEONARD B E. The HPA and immune axes in stress:the involvement of the serotonergic system[J]. European Psychiatry, 2005, 20(Suppl.3): S302-S306. |
| [6] |
陈渝.精氨酸对免疫应激断奶仔猪细胞膜表面TLRs基因表达的影响及作用途径研究[D].硕士学位论文.雅安: 四川农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10626-1013157496.htm
|
| [7] |
LIU Y L, CHEN F, ODLE J, et al. Fish oil enhances intestinal integrity and inhibits TLR4 and NOD2 signaling pathways in weaned pigs after LPS challenge[J]. The Journal of Nutrition, 2012, 142(11): 2017-2024. DOI:10.3945/jn.112.164947 |
| [8] |
KASUBUCHI M, HASEGAWA S, HIRAMATSU T, et al. Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation[J]. Nutrients, 2015, 7(4): 2839-2849. DOI:10.3390/nu7042839 |
| [9] |
LIU Y L, LI D F, GONG L M, et al. Effects of fish oil supplementation on the performance and the immunological, adrenal, and somatotropic responses of weaned pigs after an Escherichia coli lipopolysaccharide challenge[J]. Journal of Animal Science, 2003, 81(11): 2758-2765. DOI:10.2527/2003.81112758x |
| [10] |
LIU Y L, GONG L M, LI D F, et al. Effects of fish oil on lymphocyte proliferation, cytokine production and intracellular signalling in weanling pigs[J]. Archives of Animal Nutrition, 2003, 57(3): 151-165. DOI:10.1080/0003942031000136594 |
| [11] |
徐立蛟, 贺喜, 成廷水. 膳食纤维在母猪营养中的应用[J]. 饲料工业, 2012, 33(23): 12-15. |
| [12] |
KHERAVⅡ S K, SWICK R A, CHOCT M, et al. Coarse particle inclusion and lignocellulose-rich fiber addition in feed benefit performance and health of broiler chickens[J]. Poultry Science, 2017, 96(9): 3272-3281. DOI:10.3382/ps/pex123 |
| [13] |
BAREA R, NIETO R, LARA L, et al. Effects of dietary protein content and feeding level on carcass characteristics and organ weights of Iberian pigs growing between 50 and 100 kg live weight[J]. Animal Science, 2006, 82(3): 405-413. DOI:10.1079/ASC200645 |
| [14] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [15] |
JOHNSON R W. Inhibition of growth by pro-inflammatory cytokines:an integrated view[J]. Journal of Animal Science, 1997, 75(5): 1244-1255. DOI:10.2527/1997.7551244x |
| [16] |
朱惠玲, 刘玉兰, 郭广伦, 等. 牛膝多糖对免疫应激仔猪生长性能、炎性介质和内分泌激素的影响[J]. 中国畜牧杂志, 2011, 47(5): 48-51. |
| [17] |
MAO X F, PIAO X S, LAI C H, et al. Effects of β-glucan obtained from the Chinese herb Astragalus membranaceus and lipopolysaccharide challenge on performance, immunological, adrenal, and somatotropic responses of weanling pigs[J]. Journal of Animal Science, 2005, 83(12): 2775-2782. DOI:10.2527/2005.83122775x |
| [18] |
COOK M E, MILLER C C, PARK Y, et al. Immune modulation by altered nutrient metabolism:nutritional control of immune-induced growth depression[J]. Poultry Science, 1993, 72(7): 1301-1305. DOI:10.3382/ps.0721301 |
| [19] |
GABLER N K, SPURLOCK M E. Integrating the immune system with the regulation of growth and efficiency[J]. Journal of Animal Science, 2008, 86(Suppl.14): E64-E74. |
| [20] |
GERRITSEN R, VAN DER AAR P, MOLIST F. Insoluble nonstarch polysaccharides in diets for weaned piglets[J]. Journal of Animal Science, 2012, 90(Suppl.4): 318-320. |
| [21] |
王莲香. 日粮纤维对断奶仔猪肠道健康和生产性能的影响[J]. 养殖与饲料, 2018(9): 59-60. DOI:10.3969/j.issn.1671-427X.2018.09.024 |
| [22] |
HERMES R G, MOLIST F, YWAZAKI M, et al. Effect of dietary level of protein and fiber on the productive performance and health status of piglets[J]. Journal of Animal Science, 2009, 87(11): 3569-3577. DOI:10.2527/jas.2008-1241 |
| [23] |
MONTAGNE L, PLUSKE J R, HAMPSON D J. A review of interactions between dietary fibre and the intestinal mucosa, and their consequences on digestive health in young non-ruminant animals[J]. Animal Feed Science and Technology, 2003, 108(1/2/3/4): 95-117. |
| [24] |
MOLIST F, VAN OOSTRUM M, PÉREZ J F, et al. Relevance of functional properties of dietary fibre in diets for weanling pigs[J]. Animal Feed Science and Technology, 2014, 189: 1-10. DOI:10.1016/j.anifeedsci.2013.12.013 |
| [25] |
MASLOWSKI K M, MACKAY C R. Diet, gut microbiota and immune responses[J]. Nature Immunology, 2011, 12(1): 5-9. DOI:10.1038/ni0111-5 |
| [26] |
LIU B S, WANG W J, ZHU X Y, et al. Response of gut microbiota to dietary fiber and metabolic interaction with SCFAs in piglets[J]. Frontiers in Microbiology, 2018, 9: 2344. DOI:10.3389/fmicb.2018.02344 |
| [27] |
张世炎, 麦海, 胡杰, 等. 板齿鼠内脏器官的重量和含水量的季节变化[J]. 四川动物, 2005, 24(4): 481-484. DOI:10.3969/j.issn.1000-7083.2005.04.010 |
| [28] |
JUNQUEIRA L C U, CARNEIRO J. Basic histology:text & atlas[M]. New York: McGraw-Hill Companies Inc., 2010.
|
| [29] |
MOESER A J, POHL C S, RAJPUT M. Weaning stress and gastrointestinal barrier development:implications for lifelong gut health in pigs[J]. Animal Nutrition, 2017, 3(4): 313-321. DOI:10.1016/j.aninu.2017.06.003 |
| [30] |
李素芬, 冯敏山, 阎国红. 生化黄腐酸对肉用仔鸡生产性能及免疫器官的影响[J]. 中国饲料, 2000(14): 14-15. |
| [31] |
VIDER J, LEHTMAA J, KULLISAAR T, et al. Acute immune response in respect to exercise-induced oxidative stress[J]. Pathophysiology, 2001, 7(4): 263-270. DOI:10.1016/S0928-4680(00)00057-2 |
| [32] |
黄思琪, 曲红焱, 黄大鹏, 等. L-精氨酸对冷应激仔猪生长性能、免疫功能及肝脏、肾脏中肿瘤坏死因子-α、干扰素-γ基因表达量的影响[J]. 动物营养学报, 2019, 31(1): 131-139. DOI:10.3969/j.issn.1006-267x.2019.01.018 |
| [33] |
CARABAÑO R, BADIOLA I, CHAMORRO S, et al. Review.New trends in rabbit feeding:influence of nutrition on intestinal health[J]. Spanish Journal of Agricultural Research, 2008, 6(Special issue): 15-25. |
| [34] |
CHEN H, MAO X B, HE J, et al. Dietary fibre affects intestinal mucosal barrier function and regulates intestinal bacteria in weaning piglets[J]. British Journal of Nutrition, 2013, 110(10): 1837-1848. DOI:10.1017/S0007114513001293 |
| [35] |
张南斌, 孙瑛超, 赵晓宇, 等. 饲粮不同粗纤维水平对生长肉兔生长性能、屠宰性能、肌肉品质及胃肠道和免疫器官发育的影响[J]. 动物营养学报, 2018, 30(5): 1789-1797. DOI:10.3969/j.issn.1006-267x.2018.05.021 |
| [36] |
陶志勇.日粮NDF水平对生长肉兔生产性能、营养物质利用、免疫及盲肠发酵的影响[D].硕士学位论文.泰安: 山东农业大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10434-2004120954.htm
|
| [37] |
ABDOLLAHI M R, ZAEFARIAN F, HUNT H, et al. Wheat particle size, insoluble fibre sources and whole wheat feeding influence gizzard musculature and nutrient utilisation to different extents in broiler chickens[J]. Journal of Animal Physiology and Animal Nutrition, 2019, 103(1): 146-161. DOI:10.1111/jpn.13019 |
| [38] |
陈逢, 刘玉兰, 李权, 等. TLR4信号通路关键基因在断奶仔猪不同组织中的mRNA表达[J]. 中国畜牧杂志, 2013, 49(17): 53-57. DOI:10.3969/j.issn.0258-7033.2013.17.013 |
| [39] |
ZHANG L, WANG X Y, CHEN S K, et al. Medium-chain triglycerides attenuate liver injury in lipopolysaccharide-challenged pigs by inhibiting necroptotic and inflammatory signaling pathways[J]. International Journal of Molecular Sciences, 2018, 19(11): 3697. DOI:10.3390/ijms19113697 |
| [40] |
皮定安.天冬酰胺对脂多糖诱导的仔猪肝脏损伤和肌肉蛋白质降解的调控作用[D].硕士学位论文.武汉: 武汉轻工大学, 2014.
|
| [41] |
CHEN S K, LIU Y L, WANG X Y, et al. Asparagine improves intestinal integrity, inhibits TLR4 and NOD signaling, and differently regulates p38 and ERK1/2 signaling in weanling piglets after LPS challenge[J]. Innate Immunity, 2016, 22(8): 577-587. DOI:10.1177/1753425916664124 |
| [42] |
ZEITZ J O, NEUFELD K, POTTHAST C, et al. Effects of dietary supplementation of the lignocelluloses FibreCell and OptiCell on performance, expression of inflammation-related genes and the gut microbiome of broilers[J]. Poultry Science, 2019, 98(1): 287-297. DOI:10.3382/ps/pey345 |




